- Artigo
- Fonte: Campus Sanofi
- 17 de jun. de 2024
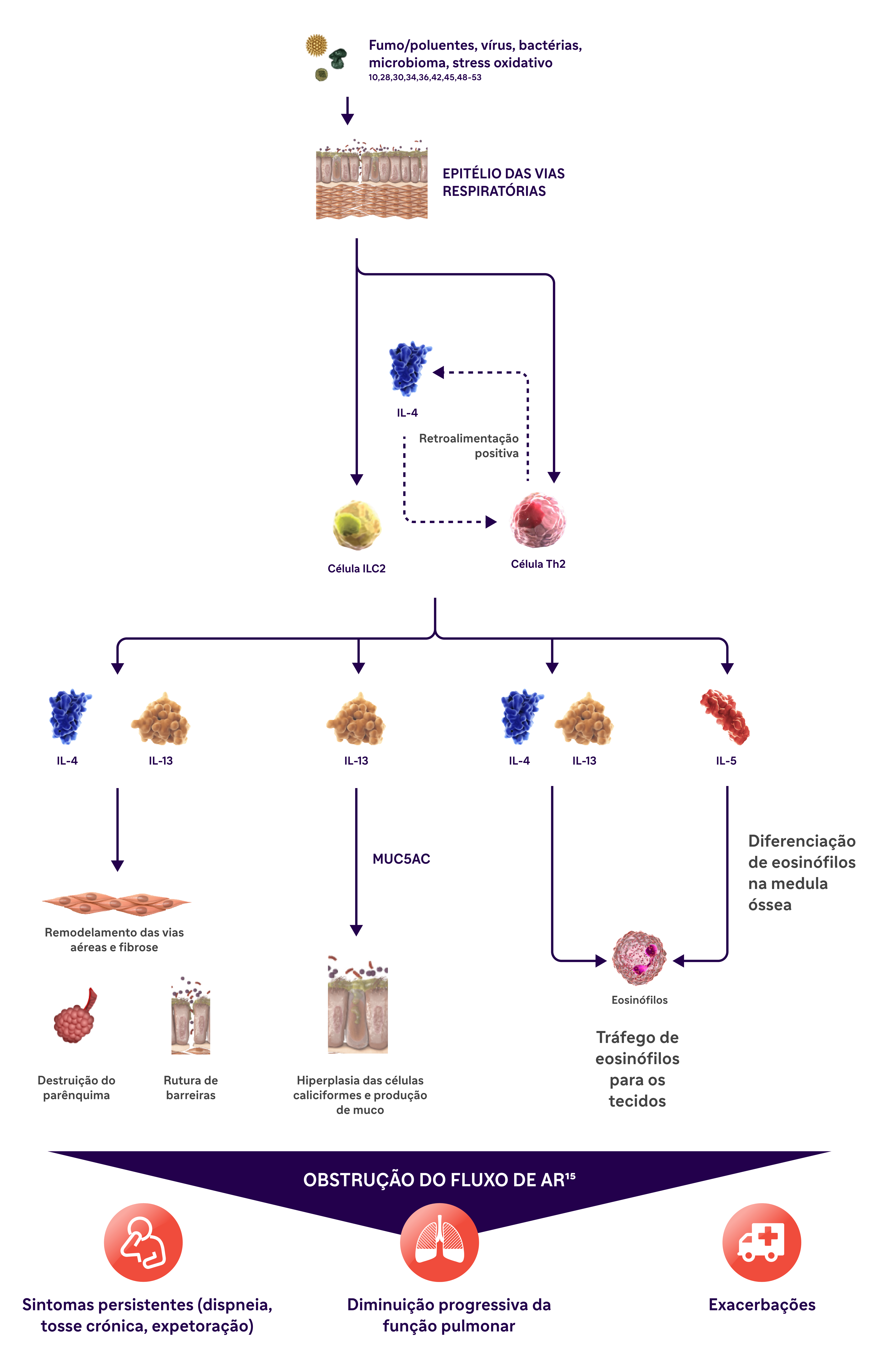
Papel da inflamação tipo 2


A inflamação tipo 2 pode aumentar o risco de exacerbações e comprometimento da função pulmonar na DPOC 23,24
A DPOC é caracterizada pela produção de muco, obstrução das vias aéreas e tosse crônica. 13
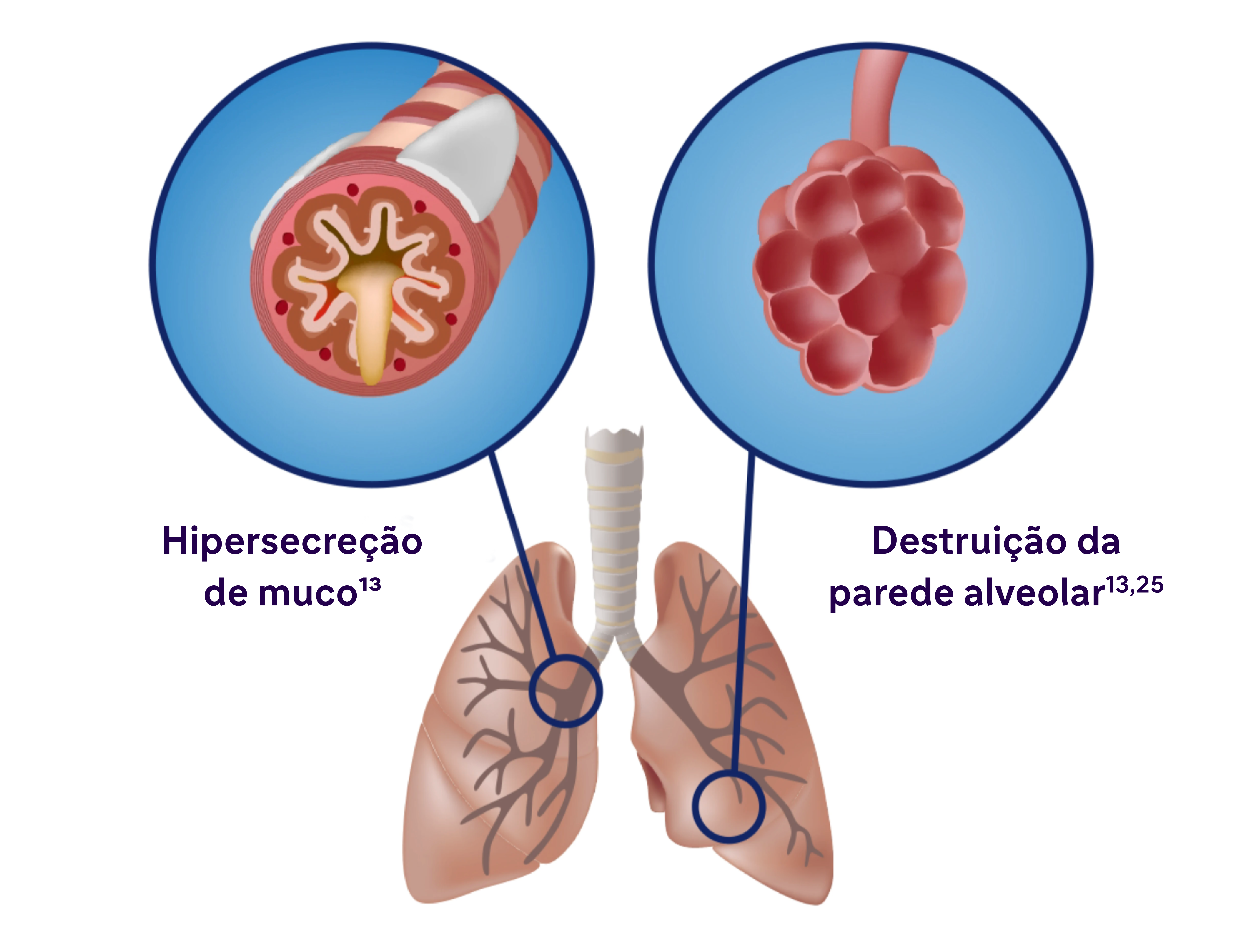
A inflamação se manifesta sistêmica e localmente

- A inflamação crônica causa alterações estruturais, incluindo estreitamento das vias aéreas e diminuição da elasticidade pulmonar 13
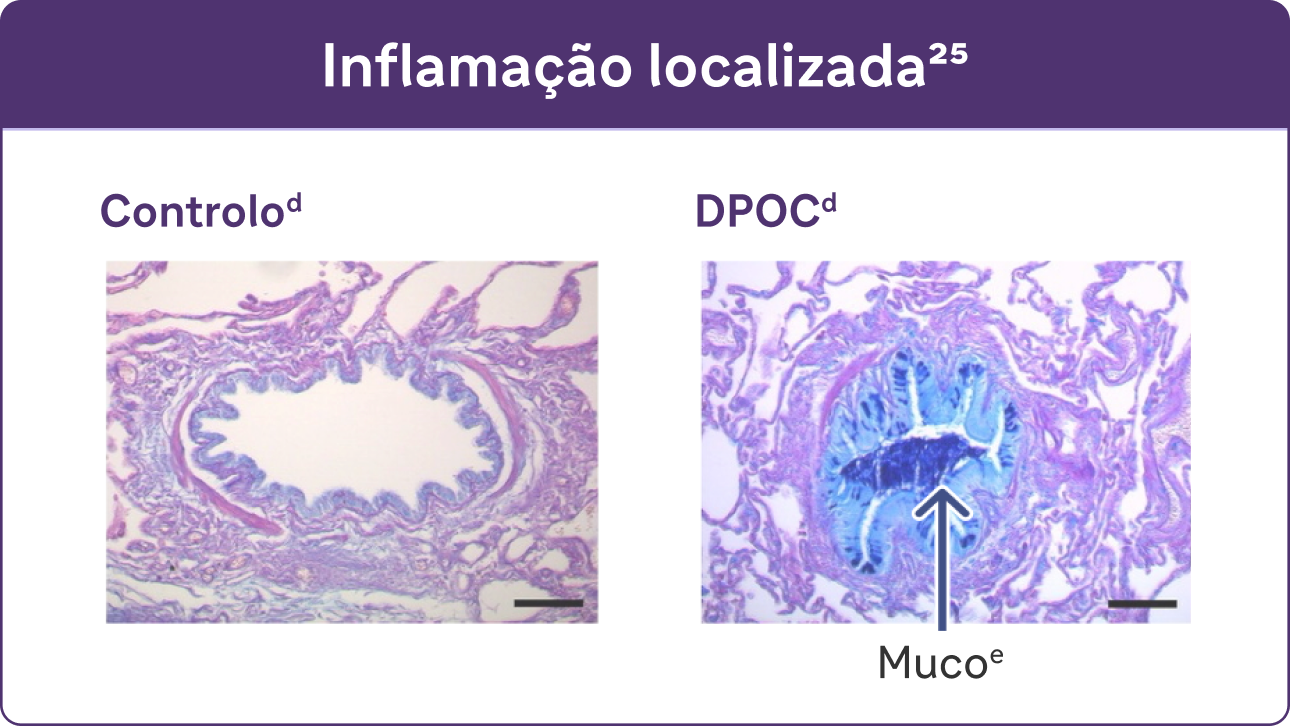
- Estudos identificaram uma relação entre inflamação e hipersecreção de muco em condições respiratórias como a DPOC 25

Ouça o Prof. Nicola Hanania: "Não vemos mais isso como uma doença que serve para todos"
1:36 minutos
Nicola Hanania é professor de medicina, chefe da seção de cuidados intensivos pulmonares e medicina do sono no Hospital Ben Taub em Houston, Texas, e diretor do Airways Clinical Research Center, ACRC, no Bear College of Medicine.
.webp)
Ouça oepisódio completo do podcast no site da EMJ.
Patrocinado pela Sanofi eRegeneron, em parceria com aEMJ.
Acho que a nossa abordagem a essa doença mudou. Sabemos que há múltiplos, ao que chamamos, fenótipos, mas, não apenas isso, identificamos m[ultiplos mecanismos da doença, por isso já não olhamos a DPOC como uma doença de abordagem única. Por isso, é muito importante que os clínicos se aprofundem na história clínica do paciente para identificar esses fenótipos. Se é um exacerbador frequente, ou um fenótipo brônquico crônico, ou um fenótpo principalmente de enfisema. Mas, agora, usamos biomarcadores, como os eosinófilos no sangue e, talvez mais no futuro, biomarcadores radiológicos, podem nos ajudar a subdividir esse grupo de pacientes para que possamos fazer uma abordagem mais personalizada. Eu acho que é um momento positivo para a DPOC. Evoluímos de uma abordagem generalizada para, agora, termos, como mencionei, múltiplos subtipos ou fenótipos, e incluindo a identificação de mais mecanismos para que tenhamos uma abordagem mais direcionada para esta doença. Espero que isso nos ajude a ter melhores resultados no futuro. Esse é o principal objetivo: diminuir o risco de mortalidade que temos visto na DPOC, enquanto temos visto tantas conquistas noutras doenças. Na DPOC, infelizmente, ainda não mudamos muito esse fardo, então esperamos que, com novas abordagens, possamos melhorar os resultados.
Eosinófilos elevados no sangue (>300 células/uL) é um biomarcador de inflamação tipo 2 na DPOC 13
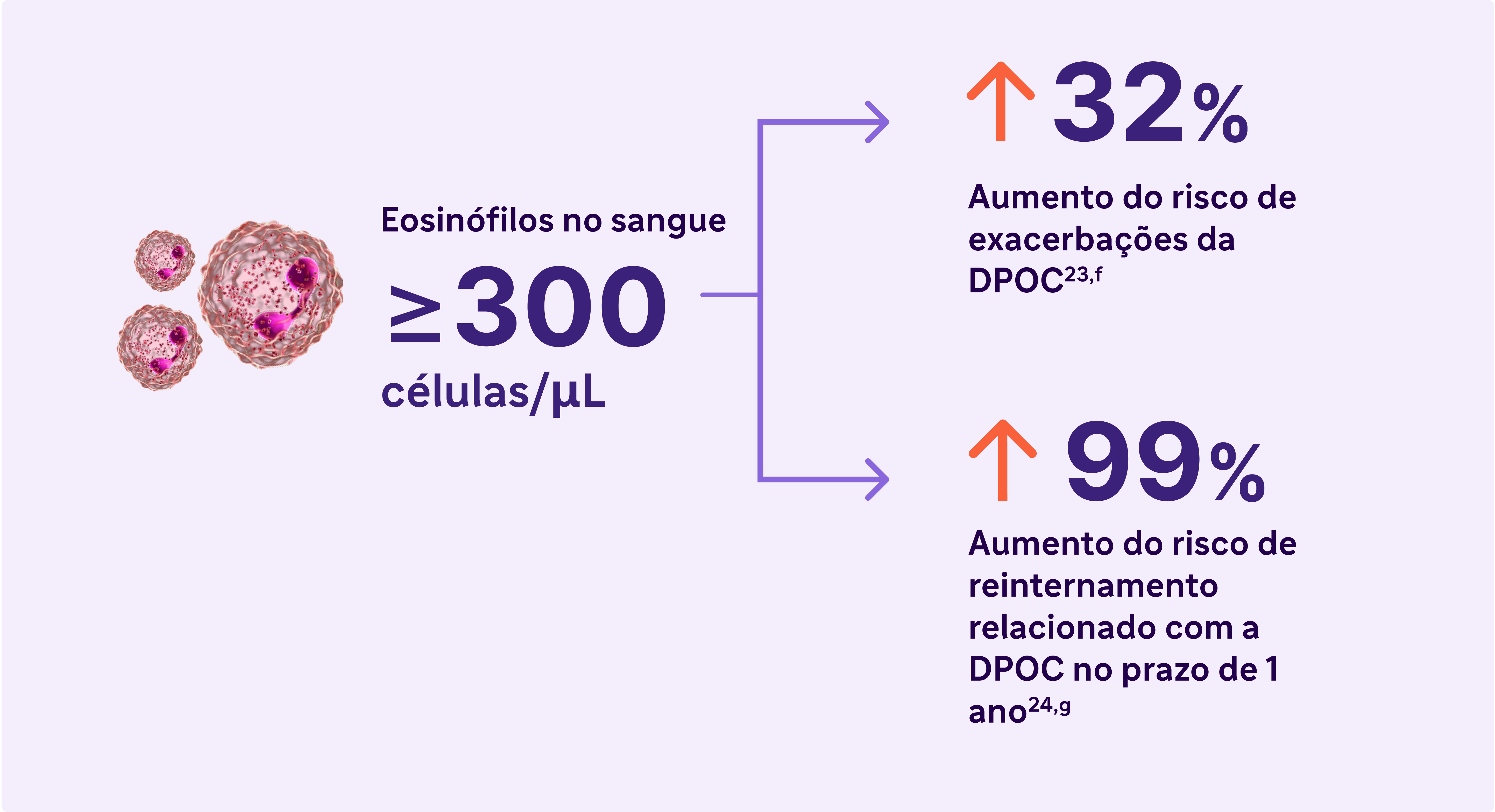
Eosinófilos elevados na DPOC são uma característica tratável e um biomarcador de inflamação tipo 2 13
O Relatório GOLD de 2024 reconhece EOS elevado no sangue como um biomarcador clinicamente utilizado na identificação de DPOC com inflamação tipo 2.
A inflamação tipo 2 na DPOC pode envolver múltiplas vias, citocinas e células inflamatórias 28-33
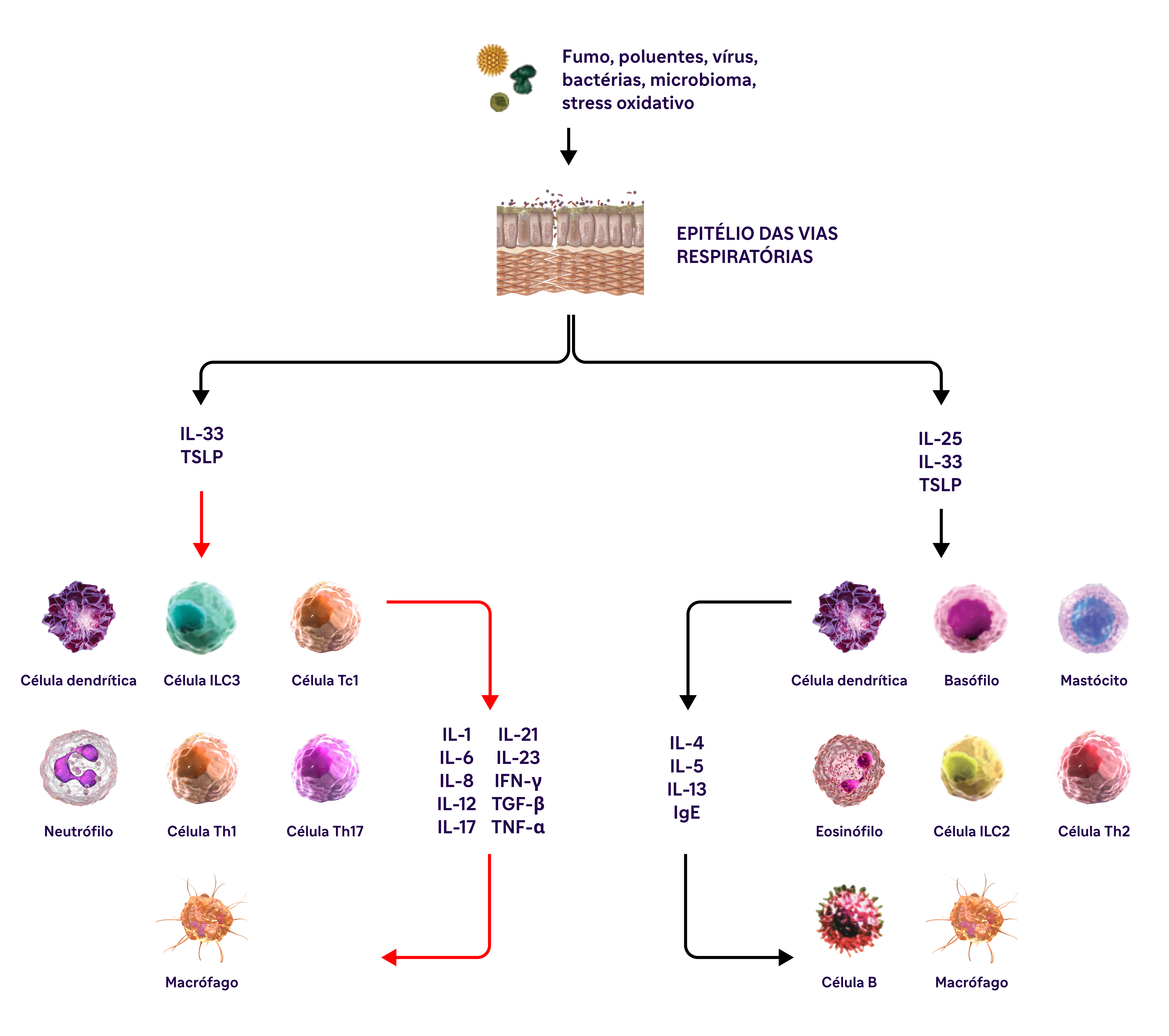
IL-4, IL-13 e IL-5 são citocinas do tipo 2 envolvidas na DPOC



a Com base nos resultados de 5 estudos em pacientes com DPOC sem asma. Os níveis de eosinófilos usados para definir a inflamação tipo 2 variaram de ≥300 células/uL a ≥340 células/HL (sangue), ≥2% no escarro induzido ou 3% no sangue periférico. As porcentagens de pacientes com inflamação tipo 2 variaram de 12,3% a -40% 23,24
b Uma exacerbação grave foi definida como uma hospitalização devido à DPOC. As exacerbações deveriam ter um intervalo mínimo de 4 semanas para serem consideradas exacerbações separadas. 27
c Em uma coorte de pacientes com EOS >200 células/uL. 26
d Reproduzido com permissão da American Thoracic Society. Fritzsching B et al. Sou J Respir Crit Care Med. 2015;191(8):902-913 25
e Coloração PAS com azul Alcian de muco em células epiteliais das vias aéreas. 23
f Resultados de um estudo observacional de 1.553 pacientes com DPOC de grau 2-4 de espirometria GOLD (relação VEF1/CVF pós-broncodilatador <0,7, com VEF, >80% do previsto) 23
g Resultados de um estudo observacional de 1 ano com 479 pacientes com DPOC, 173 dos quais apresentavam níveis de eosinófilos no sangue ≥200 células/uL e/ou ≥2% da contagem total de leucócitos. 24
DPOC, doença pulmonar obstrutiva crônica; EOS, eosinófilos; VEF1, volume expiratório forçado no primeiro segundo; CVF, capacidade vital forçada; GOLD, Iniciativa Global para Doença Pulmonar Obstrutiva Crônica; IFN-y, interferon-gama; ILC2, células linfóides inatas tipo 2; MUC5AC, mucina 5AC; PAS, ácido periódico de Schiff; TNF-a, fator de necrose tumoral alfa; TSLP, linfopoietina estromal tímica.
Referências
- Halpin DMG, Dransfield MT, Han MK, et al. O efeito do histórico de exacerbações nos resultados do ensaio IMPACT. Eur Respir J. 2020;55:1901921. doi:10.1183/13993003.01921-2019
- Suissa S, Dell'Anniello S, Ernst P. História natural de longo prazo da doença pulmonar obstrutiva crônica: exacerbações graves e mortalidade. Tórax. 2012;67 (11):957-963.
- Halpin DMG, Decramer M, Celli BR, Mueller A, Metzdorf N, Tashkin DP. Efeito de uma única exacerbação no declínio da função pulmonar na DPOC. Respir Med. 2017;128:85-91.
- Cósio Piqueras MG, Cósio MG. Doença das vias aéreas na doença pulmonar obstrutiva crônica. Eur Respir J. 2001;18(supp| 34):41s-49s.
- Tajti G, Gesztelyi R, Pak K, et al. Correlação positiva de resistência das vias aéreas e nível sérico assimétrico de dimetilarginina em pacientes com DPOC com marcadores sistêmicos de inflamação de baixo grau. Int J Chron Obstrução Pulmon Dis. 2017;12:873-884.
- Higham A, Quinn AM, Cançado JED, Singh D. A patologia das doenças das pequenas vias aéreas na DPOC: aspectos históricos e direções futuras. Respir Res. 2019;20(1):49.| doi:10.1186/s12931-019-1017-y
- O'Donnell DE, Parker CM. Exacerbações da DPOC. 3: Fisiopatologia. Tórax. 200661(4):354-361.|
- Calverley PMA. Insuficiência respiratória na doença pulmonar obstrutiva crônica. Eur Respir J. 2003;22:26s-30s.
- Roussos C, Koutsoukou A. Insuficiência respiratória. Eur Respir J. 2003;22(suppl 47):3s-14s.
- Aghapour M, Raee P, Moghaddam SJ, Hiemstra PS, Heijink IH. Disfunção da barreira epitelial das vias aéreas na doença pulmonar obstrutiva crônica: papel da exposição à fumaça de cigarro. Sou J Respir Cell Mol Biol. 2018;58(2):157-169.
- Brightling CE, Saha S, Hollins F. Interleucina-13: perspectivas para novo tratamento. Clin Exp Alergia. 2010;40(1):42-49.
- Barberà JA, Peinado VI, Santos S. Hipertensão pulmonar na doença pulmonar obstrutiva crônica. Eur Respir J. 2003;21(5):892-905.
- Iniciativa Global para Doença Pulmonar Obstrutiva Crónica. Estratégia global para o diagnóstico, gestão e prevenção da doença pulmonar obstrutiva crónica (relatório de 2024). Acessado em (9 de fevereiro de 2024). https://goldcopd.org/2024-gold-report-2/
- Jones PW. Questionário respiratório de St George: MCID. DPOC. Março de 2005;2(1):75-79.
- Manual do Questionário Respiratório de Jones P. St George. [Versão 2.4, março de 2022). Acessado em (9 de fevereiro de 2024). https://www.sgul.ac.uk/research/research-operations/research-administration/st-georges-respiratory-questionnaire/docs/SGRQ-Manual-March-2022.pdf
- Site da Evidera. Conteúdo EXATO e E-RS:DPOC. Acessado em (9 de fevereiro de 2024). https://www.evidera.com/what-we-do/paciente-centered-research/coa-instrument-management-services/exact-program/ exact-content/
- Leidy NK, Bushnell DM, Thach C, Hache C, Gutzwiller FS. Interpretando a avaliação dos sintomas respiratórios nas pontuações do diário de DPOC em ensaios clínicos: terminologia, métodos e recomendações. Obstr crônica Pulm Dis. 2022;9(4):576-590.
- Oshagbemi OA, Franssen FME, van Kraaij S, et al. Contagem de eosinófilos no sangue, retirada de corticosteróides inalados e risco de exacerbações e mortalidade da DPOC no datalink de pesquisa de prática clínica (CPRD). DPOC. 2019;16(2):152-159.
- Casanova C, Celli BR, de-Torres JP, et al. Prevalência de eosinofilia sanguínea persistente: relação com desfechos em pacientes com DPOC. Eur Respir J. 2017;50:1701162. doi:10.1183/13993003.01162-2017
- Singh D, Kolsum U, Brightling CE, Locantore N, Agusti A, Tal-Singer R; Investigadores do ECLIPSE. Inflamação eosinofílica na DPOC: prevalência e características clínicas. Eur Respir J. 2014;44(6):1697-1700.
- Bafadhel M, McKenna S, Terry S, et al. Exacerbações agudas da doença pulmonar obstrutiva crônica: identificação de clusters biológicos e seus biomarcadores. Sou J Respir Crit Care Med. 2011;184(6):662-671.
- Oshagbemi OA, Burden AM, Braeken DCW, et al. Estabilidade dos eosinófilos no sangue em pacientes com doença pulmonar obstrutiva crônica e em indivíduos controle, e o impacto do sexo, idade, tabagismo e contagens basais. Sou J Respir Crit Care Med. 2017;195(10):1402-1404.|
- Yun JH, Cordeiro A, Chase R, e outros; Investigadores COPDGene e ECLIPSE. Limiares e exacerbações da contagem de eosinófilos no sangue em pacientes com doença pulmonar obstrutiva crônica. J Allergy Clin Immunol. 2018;141(6):2037-2047.e10. doi:10.1016/j-jaci.2018.04.010
- Belanger M, Couillard S, Courteau J, et al. Contagem de eosinófilos nas primeiras hospitalizações por DPOC: uma comparação da utilização dos serviços de saúde. Int J Chron Obstrução Pulmon Dis. 2018;13:3045-3054.
- Fritzsching B, Zhou-Suckow Z, Trojanek JB, et al. A necrose epitelial hipóxica desencadeia inflamação neutrofílica via sinalização do receptor de IL-1 na doença pulmonar por fibrose cística. Sou J Respir Crit Care Med. 2015;191(8):902-913.
- Vedel-Krogh S, Nielsen SF, Lange P, Vestibo J, Nordestgaard BG. Eosinófilos sanguíneos e exacerbações na doença pulmonar obstrutiva crônica. O Estudo da População Geral de Copenhague. Sou J Respir Crit Care Med. 2016;193(9):965-974.
- George L, Taylor AR, Esteve-Codina A, et al; U-BIOPRED e as equipes de estudo EvA. Contagem de eosinófilos no sangue e relações do transcriptoma epitelial das vias aéreas na DPOC versus asma. Alergia. 2020;75(2):370-380.
- Yousuf A, Ibrahim W, Greening NJ, Brightling CE. Produtos biológicos T2 para doença pulmonar obstrutiva crônica. J Allergy Clin Immunol Pract. 2019;7(5):1406-1416.|
- Barnes PJ. Endótipos inflamatórios na DPOC. Alergia. 2019;74(7):1249-1256.
- Oishi K, Matsunaga K, Shirai T, Hirai K, Gon Y. Papel dos biomarcadores inflamatórios tipo 2 na doença pulmonar obstrutiva crônica. J Clin Med. 2020;9(8):2670. doi:10.3390/jcm9082670
- Gabryelska A, Kuna P, Antozak A, Biatasiewicz P, Panek M. Inflamação mediada por IL-33 em doenças respiratórias crônicas - compreendendo o papel do membro da superfamilia IL-1. Imunol frontal. 2019;10:692. doi:10.3389/fimmu.2019.00692
- Allinne J, Scott G, Lim WK, et al. O bloqueio da IL-33 afeta mediadores de persistência e exacerbação em um modelo de inflamação crônica das vias aéreas. J Allergy Clin Immunol. 2019;144(6):1624-1637.e10.
- Calderon AA, Dimond C, Choy DF, et al. Visando as vias da interleucina-33 e da linfopoietina estromal do timo para novas terapéuticas pulmonares na asma e na DPOC. 2023;32(167):220144. doi:10.1183/16000617.0144-2022
- Gandhi NA, Bennett BL, Graham NMH, Pirozzi G, Stahl N, Yancopoulos D. Visando os principais fatores proximais da inflamação tipo 2 na doença. Nat Rev Drug Discov. 2016;15 (1):35-50.
- Rosenberg HF, Phipps S, Foster PS. Tráfico de eosinófilos em alergia e asma. J Allergy Clin Immunol. 2007;119(6):1303-1310.
- Doyle AD, Mukherjee M, LeSuer WE, et al. A IL-13 derivada de eosinófilos promove enfisema. Eur Respir J. 2019;53(5):1801291. doi:10.1183/13993003.01291-2018
- Barnes PJ. Mecanismos inflamatórios em pacientes com doença pulmonar obstrutiva crónica. J Allergy Clin Immunol. 2016,138(1):16-27.
- Defrance T, Carayon P, Billian G, et al. A interleucina 13 é um fator estimulador de células B. J Exp Med. 1994;179(1):135-143.
- Yanagihara Y, Ikizawa K, Kajiwara K, Koshio T, Basaki Y, Akiyama K. Significado funcional do receptor de IL-4 em células B na produção de IgE humana induzida por IL-4. J Allergy Clin Immunol. 1995;96(6 pt 2):1145-1151.
- Gandhi NA, Pirozzi G, Graham NMH. Comunalidade da via IL-4/IL-13 em doenças atópicas. Especialista Rev Clin Immunol. 2017;13(5):425-437,
- Kaur D, Hollins F, Woodman L, et al. Os mastócitos expressam IL-13Ral: IL-13 promove a proliferação de mastócitos pulmonares humanos e a expressão de FceRI. Alergia. 2006;61(9):1047-1053.
- Saatian B, Rezaee F, Desando S, et al. A interleucina-4 e a interleucina-13 causam disfunção de barreira nas células epiteliais humanas. Barreiras teciduais. 2013;1(2):e24333. doi:10.4161/tisb.24333
- Zheng T, Zhu Z, Wang Z, et al. O direcionamento indutível de IL-13 para o pulmão adulto causa enfisema dependente de metaloproteinase de matriz e catepsina. J Clin Invest. 2000;106(9):1081-1093.
- Garudadri S, Woodruff PG. Visando fenótipos, endótipos e biomarcadores de doença pulmonar obstrutiva crônica. Ann Am Thorac Soc. 2018;15(suplemento 4):5234-S238.
- Alevy YG, Patel AC, Romero AG, et al. A produção de muco nas vias aéreas induzida por IL-13 é atenuada pela inibição da MAPK13. J Clin Invest. 2012;122(12):4555-4568.
- Singanayagam A, Footitt J, Marczynski M, et al. As mucinas das vias aéreas promovem imunopatologia na doença pulmonar obstrutiva crônica exacerbada por vírus. J Clin Invest. 2022;132(8):e12901. doi:10.1172/JCl120901
- Zhu Z, Homer RJ, Wang Z, et al. A expressão pulmonar da interleucina-13 causa inflamação, hipersecreção de muco, fibrose subepitelial, anormalidades fisiológicas e produção de eotaxina. J Clin Invest. 1999;103(6):779-788.
- Cooper PR, Poll CT, Barnes PJ, Sturton RG. Envolvimento da IL-13 nas alterações induzidas pela fumaça do tabaco na estrutura e função das vias aéreas intrapulmonares de ratos. Sou J Respir Cell Mol Biol. 2010;43(2):220-226.
- Arora S, Dev K, Agarwal B, Das P, Syed MA. Macrófagos: seu papel, ativação e polarização nas doenças pulmonares. Imunobiologia. 2018;223(4-5):383-396.
- He S, Xie L, Lu J, Sun S. Características e papel potencial dos macrófagos M2 na DPOC. Int J Chron Obstrução Pulmon Dis. 2017;12:3029-3039.
- Wang X, Xu C, Ji J, et al. IL-4 / IL-13 regula positivamente a expressão do Sonic hedgehog para induzir a remodelação epitelial alérgica das vias aéreas. Am J Physiol Lung Cell Mol Physiol. 2020;318(5):L888-L899.
- Linden D, Guo-Parke H, Coyle PV, et al. Infecção viral respiratória: um potencial "elo perdido" na patogênese da DPOC. 2019;28(151):180063. doi:10.1183/16000617.0063-2018
- Wang Z, Bafadhel M, Haldar K, et al. Dinâmica do microbioma pulmonar nas exacerbações da DPOC. Eur Respir J. 2016;47(4):1082-1092.
MAT-BR-2402393 - jun/24