- Artigo
- Fonte: Campus Sanofi
- 10 de set. de 2024
O fardo e o risco de exacerbações na DPOC segundo o Dr. Surya Bhatt

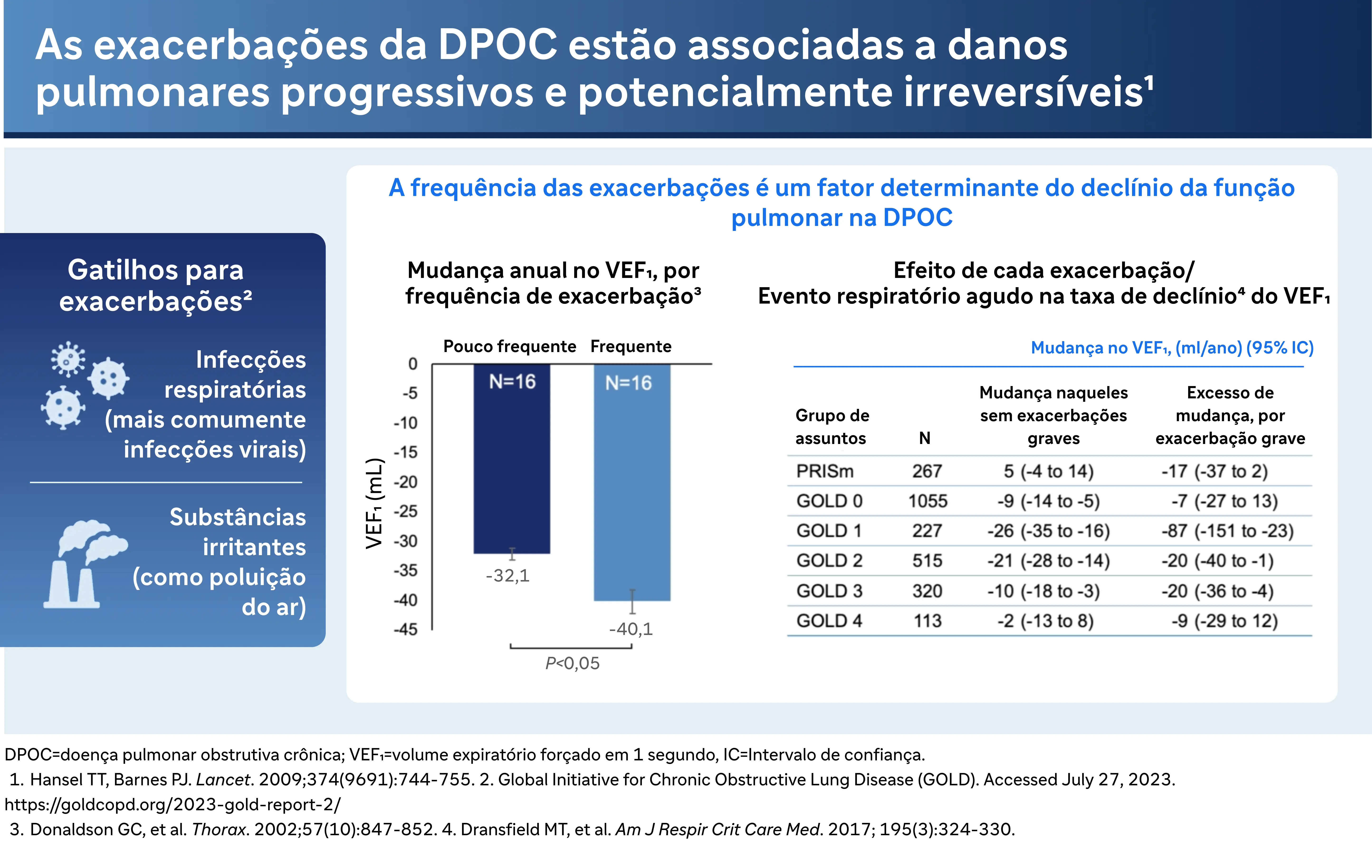
Meu nome é Surya Bhatt. Sou professor de medicina na Universidade do Alabama em Birmingham e pesquisador de DPOC. Esta palestra é patrocinada pela Sanofi e Regeneron, e você não receberá nenhum crédito de CME. Uma das coisas mais importantes na DPOC são as exacerbações agudas. E elas não são apenas um inconveniente, mas estão associadas à progressão significativa da doença. Agora, há muitos dados na literatura que sugerem que essas exacerbações estão associadas ao declínio da função pulmonar. Elas são comumente causadas por infecções como vírus e infecções bacterianas, às vezes devido à poluição ambiental e exposições ocupacionais. Independentemente da causa, a gravidade é determinada pelo local onde são tratadas, o que não é o ideal. Se os pacientes conseguem controlar os sintomas em casa com antibióticos e corticoides, isso é classificado como uma exacerbação moderada. Mas, se for grave o suficiente para causar hospitalização, é considerada uma exacerbação grave. As pessoas que sofrem exacerbações terão uma taxa mais rápida de declínio da função pulmonar do que aquelas que não têm exacerbações. E aqui à direita estão os dados do estudo COPD Gene, onde eles observaram o declínio do VEF por exacerbação ou a frequência das exacerbações.
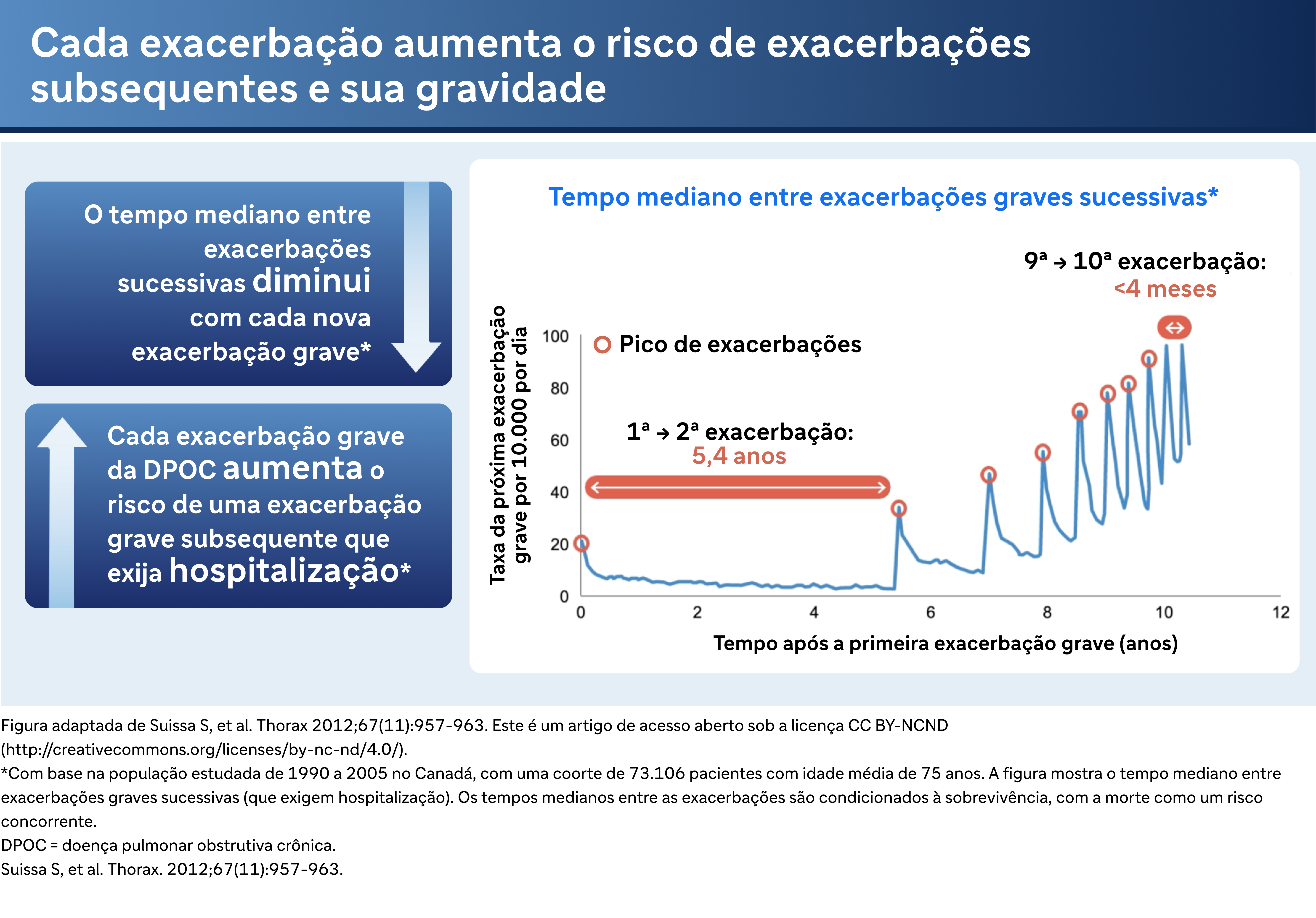
E especialmente para exacerbações graves, e especialmente para aqueles com doença mais moderada que têm mais função pulmonar para perder, o efeito pode ser bastante dramático. O declínio do VEF pode ser de até 87 ml para uma exacerbação grave no estágio mundial um, por exemplo. E como você pode imaginar, se você tiver 4 ou 5 exacerbações, você pode perder até meio litro de VEF1 nos próximos 4 a 5 anos. As exacerbações graves parecem ser eventos sentinelas no curso dos pacientes com DPOC. Quando alguém tem uma primeira exacerbação, parece que isso gera mais exacerbações. Em um estudo retrospectivo de Sammy Sosa com cerca de 75.000 pacientes no Canadá, ele modelou a frequência de exacerbação grave e descobriu que o intervalo médio usual entre uma primeira e uma segunda exacerbação é de cerca de cinco anos e meio, e então as exacerbações acontecem em intervalos progressivamente mais curtos a ponto de que por volta da 10a exacerbação o intervalo médio é de cerca de quatro meses. Então você pode imaginar um paciente, dentro de alguns anos, estabelecendo um padrão de 3 a 4exacerbações necessitando de hospitalização em um único ano.
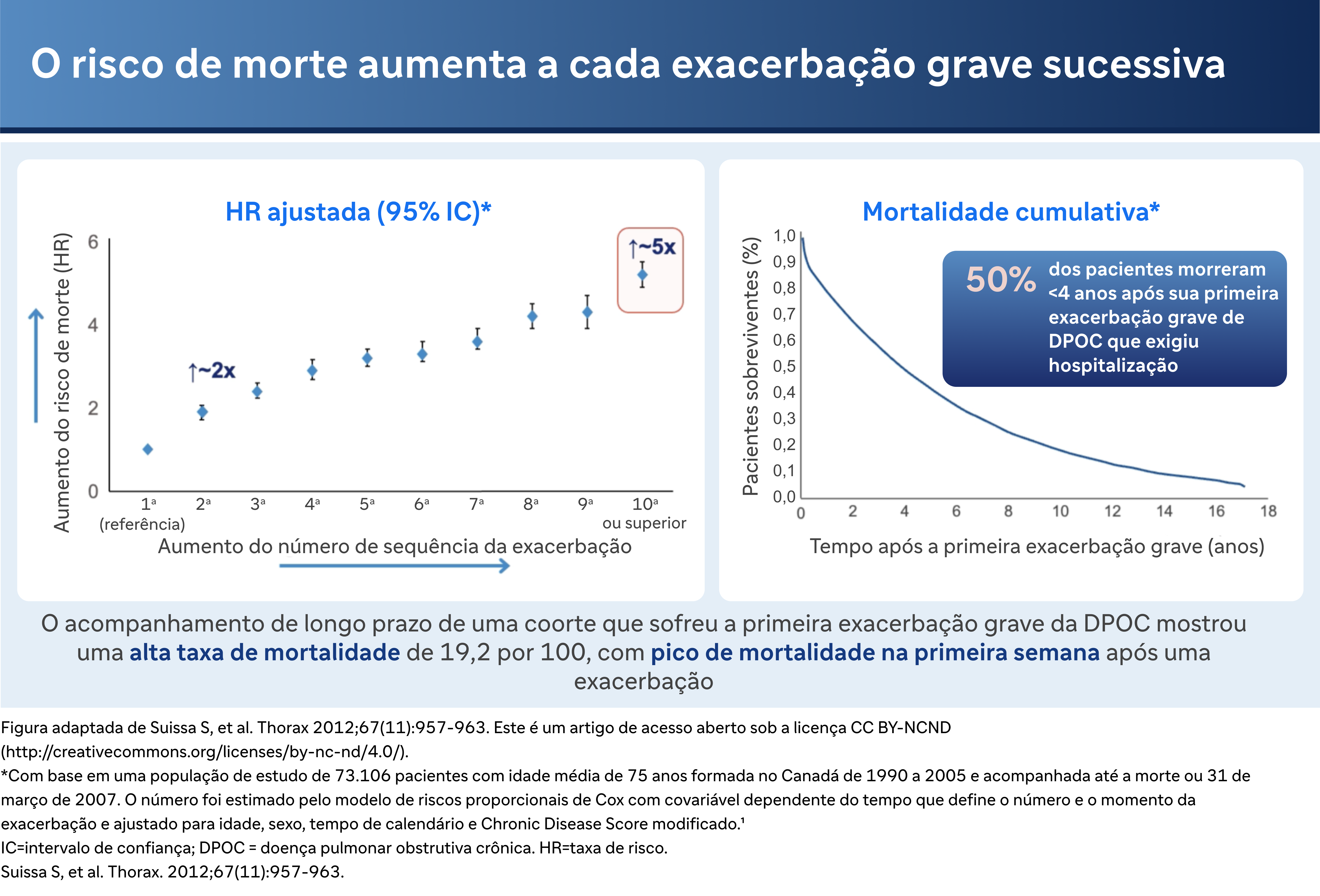
E isso não é sem consequências. Esse tipo de exacerbação pode ter um efeito na mortalidade. Os riscos de mortalidade são cerca de duas vezes maiores, se você tiver duas exacerbações graves em vez de uma exacerbação grave. E os riscos de mortalidade são cinco vezes maiores, se você tiver dez exacerbações em vez de uma exacerbação grave. Então, há quase um aumento monotônico nos riscos com o aumento da frequência de exacerbação grave. E a curva à direita mostra seu risco de morrer após uma única exacerbação grave que exija hospitalização. Então, a mortalidade em um ano é de cerca de 25%, e a mortalidade em quatro anos após a alta após a primeira exacerbação grave é de 50%.
O que é DPOC?
DPOC é uma doença pulmonar inflamatória crônica que causa obstrução do fluxo de ar dos pulmões. Os sintomas incluem dificuldade para respirar, tosse, produção de muco (escarro) e chiado. É tipicamente causada pela exposição prolongada a gases irritantes ou material particulado, mais frequentemente da fumaça do cigarro. Indivíduos com DPOC têm maior risco de desenvolver doenças cardíacas, câncer de pulmão e uma variedade de outras condições.
O papel crítico das exacerbações na progressão da DPOC
O Dr. Bhatt enfatiza que as exacerbações agudas da DPOC não são meramente inconvenientes,e sim eventos cruciais que influenciam significativamente o curso da doença. "Uma das outras coisas que são muito importantes na DPOC são as exacerbações agudas. E estas não são apenas um inconveniente, mas estão associadas à progressão significativa da doença", ele afirma. As exacerbações são tipicamente desencadeadas por infecções como vírus e infecções bacterianas ou por poluição ambiental e exposições ocupacionais.
Impacto na função pulmonar
As exacerbações têm um impacto profundo na função pulmonar, com dados sugerindo uma ligação entre exacerbações e declínio acelerado da função pulmonar. O Dr. Bhatt observa: "Há muitos dados que sugerem que essas exacerbações estão associadas ao declínio da função pulmonar". Esse declínio é mais grave no caso de exacerbações frequentes. Por exemplo, ele cita o estudo COPD Gene, que mostra como a frequência de exacerbações se correlaciona com a taxa de declínio do VEF1 — uma medida da função pulmonar.
Gravidade e tratamento
A gravidade das exacerbações pode variar, afetando significativamente as abordagens e os resultados do tratamento. "Mas, se eles conseguem utilizar corticoides e antibióticos para controlar a exacerbação, isso classifica como uma exacerbação moderada. Mas se for grave o suficiente para levar a hospitalização, então isso causa uma exacerbação grave", explica o Dr. Bhatt. A distinção entre exacerbações moderadas e graves é crucial, pois exacerbação grave", determina o protocolo de tratamento imediato e a estratégia de gerenciamento de longo prazo.
Os efeitos em cascata das exacerbações graves
Exacerbações graves são particularmente preocupantes devido aos seus efeitos em cascata sobre a saúde. O Dr. Bhatt discute um estudo de Sammy Sosa, que avaliou a frequência de exacerbações graves entre aproximadamente 75.000 pacientes no Canadá. O estudo descobriu que o intervalo entre as exacerbações tende a diminuir ao longo do tempo, indicando um padrão de piora da doença. "Quando alguém tem uma primeira exacerbação, parece que isso gera mais exacerbações", ele explica.
Riscos de mortalidade
Os riscos de mortalidade associados a exacerbações graves são gritantes. O Dr. Bhatt destaca: "Os riscos de mortalidade são cerca de duas vezes maiores se você tiver duas exacerbações graves em vez de uma exacerbação grave. E os riscos de mortalidade são cinco vezes maiores se você tiver dez exacerbações em vez de uma exacerbação grave." Além disso, o risco de morrer dentro de um ano após uma exacerbação grave que exija hospitalização é de cerca de 25% e aumenta para 50%, quatro anos após a alta hospitalar.
Resumindo
Os insights fornecidos pelo Dr. Surya Bhatt esclarecem as implicações severas das exacerbações da DPOC. Entender os gatilhos, a frequência e a gravidade dessas exacerbações é crucial para manejar a DPOC de forma eficaz A medida que a pesquisa continia a evoluir é essencial que os profissionais de saúde se mantenham informados sobre as melhores práticas para tratar e gerenciar exacerbações para melhorar a qualidade de vida dos pacientes com DPOC. Além disso, estratégias preventivas, incluindo cessação do tabagismo e redução da exposição a poluentes, continuam sendo componentes-chave do manejo da DPOC. Por meio de uma abordagem abrangente que inclui prevenção e gerenciamento eficaz de exacerbações, o impacto da DPOC pode ser significativamente mitigado.
Referências
- Gandhi NA, Bennett BL, Graham NMH, et al. Visando os principais impulsionadores proximais da inflamação tipo 2 na doença. Nat Rev Drug Discov. 2016;15(1):35-50.
- Yousuf A, Ibrahim W, Greening NJ, et al. T2 Biologics para doença pulmonar obstrutiva crônica. J Allergy Clin Immunol Pract. 2019;7(5):1405-1416.
- Aghapour M, Raee P, Moghaddam SJ, et al. Disfunção da barreira epitelial das vias aéreas na doença pulmonar obstrutiva crônica: papel da exposição à fumaça de cigarro. Am J Respir Cell Mol Biol. 2018;58(2):157-169.
- Barnes JP. Endótipos inflamatórios na DPOC. Alergia. 2019;74(7):1249-1256.
- Wang Z, Bafadhel M, Haldar K, et al. Dinâmica do microbioma pulmonar em exacerbações de DPOC. Eur Respir J. 2016;47(4):1082-1092.
- Smithgall MD, Comeau MR, Yoon BRP, et al. IL-33 amplifica as respostas do tipo Thl e Th2 por meio de sua atividade em basófilos humanos, células Th2 reativas a alérgenos, células iNKT e NK. Int Immunol.2008;20(8):1019-1030.
- Senra L, Mylonas A, Kavanagh RD, e outros. IL-17E (IL-25) melhora as respostas imunes inatas durante a inflamação da pele. J Invest Dermatol. 2019;139(8):1732-1742.
- Linden D, Guo-Parke H, Coyle PV, et al. Infecção viral respiratória: um potencial "elo perdido" na patogênese da DPOC. Eur Respir Rev. 2019; 28(151):180063.
- Iniciativa Global para Doença Pulmonar Obstrutiva Crônica (GOLD). Acessado em 27 de julho de 2023. https://goldcopd.org/2023-gold-report-2/.
- Calderon AA, Dimond C, Choy DF, et al. Visando as vias da interleucina-33 e da linfopoietina estromal tímica para novas terapêuticas pulmonares em asma e DPOC. Eur Respir Rev. 2023;32(167):220144.
- Kurokawa M, Matsukura S, Kawaguchi M, et al. Células dendríticas ativadas por interleucina-33 induzem a produção de timo e quimiocina regulada por ativação e quimiocina derivada de macrófago. Int Arch Allergy Immunol. 2013;161(Suppl 2):52-57.
- Griesenauer B, Paczesny S. O eixo ST2/IL-33 em células imunes durante doenças inflamatórias. Front Immunol. 2017;8:475.
- Borowczyk J, Shutova M, Brembilla NC, et al. IL-25 (IL-17E) em imunologia e fisiopatologia epitelial. J Allergy Clin Immunol. 2021;148(1):40-52.
- Claudio E, Wang H, Kamenyeva O, et al. IL-25 orquestra ativação de células Th via células dendríticas convencionais em tecido para exacerbar patologia crônica de asma induzida por ácaros da poeira doméstica. J Immunol. 2019;203(8)2319-2327.
- Kotlyarov S. Envolvimento do sistema imune inato na patogênese da doença pulmonar obstrutiva crônica. Int J Mol Sci. 2022;23(2):985.
- Gandhi NA, Pirozzi G, Graham NMH. Comunalidade da via IL-4/IL-13 em doenças atópicas. Especialista Rev Clin Immunol. 2017;13(5):425-437.
- Saatian B, Rezaee F, Desando S, et al. Interleucina-4 e interleucina-13 causam disfunção de barreira em células epiteliais das vias aéreas humanas.Tissue Barriers. 2013;1(2):e24333.
- Zheng T, Zhu Z, Wang Z, et al. O direcionamento induzível de IL-13 para o pulmão adulto causa enfisema dependente de metaloproteinase de matriz e catepsina. J Clin Invest. 2000;106(9):1081-1093.
- Zhu Z, Homer RJ, Wang Z, et al. A expressão pulmonar da interleucina-13 causa inflamação, hipersecreção de muco, fibrose subepitelial, anormalidades fisiológicas e produção de eotaxina. J Clin Invest. 1999;103(6):779-788.
- Alevy YG, Patel AC, Romero AG, et al. A produção de muco nas vias aéreas induzida por IL-13 é atenuada pela inibição de MAPK13. J Clin Invest. 2012;122(12):4555-4568.
- Wang X, Xu C, Ji J, et al. IL-4/IL-13 aumenta a expressão do Sonic hedgehog para induzir remodelação epitelial alérgica das vias aéreas. Am J Physiol Lung Cell Mol Physiol. 2020;318(5):L888-L899.
- Cooper PR, Poll CT, Barnes PJ, et al. Envolvimento da IL-13 em alterações induzidas pela fumaça do tabaco na estrutura e função das vias aéreas intrapulmonares de ratos. Am J Respir Cell Mol Biol. 2010;43(2):220-226.
- Doyle AD, Mukherjee M, LeSuer WE, et al. IL-13 derivada de eosinófilos promove enfisema. Eur Respir J. 2019;53(5):1801291.
- Sun J, Liu T, Yan Y, et al. O papel das citocinas Th1/Th2 desempenhado na regulação da conversão e ativação de células Th1 CD4 específicas durante a reação inflamatória da doença pulmonar obstrutiva crônica.Scand J Immunol. 2018;88(1):e12674.
- Kim CH, Kim KE, Yoon JH, et al. Upregulation da expressão do gene MUC5AC por IL-4 através de CREB em células epiteliais das vias aéreas humanas. J Cell Biochem. 2009;108(4):974-981.
- Yu H, Li Q, Kolosov VP, et al. Interleucina-13 induz produção de mucina 5AC envolvendo STAT6/SPDEF em células epiteliais das vias aéreas humanas. Cell Commun Adhes. 2010;17(4-6):83-92.