- Artigo
- Fonte: Campus Sanofi
- 3 de jun. de 2025
Uma revisão das implicações clínicas da estabilidade dos eosinófilos e da capacidade preditiva na DPOC
Os eosinófilos no sangue têm uma função na DPOC?
Na DPOC, os níveis elevados de eosinófilos no sangue (EOS) estão associados à inflamação do tipo 21 e têm sido associados a um risco maior de exacerbações.2 Compreender a função dos níveis de EOS e sua evolução ao longo do tempo pode ser importante para que façam a fenotipagem de seus pacientes e avaliem o risco potencial de exacerbação.3 No entanto, pode ser necessário de avaliação retrospectiva (denominada "Active COPD reescreening") dos EOS sanguíneos, pois o normal é haver flutuação na concentração plasmática dos EOS como resultado do tratamento ou mesmo pela evolução da DPOC.4
Saiba mais sobre o papel da inflamação do tipo 2
Endótipo da inflamação eosinofílica
A inflamação eosinofílica é um endótipo estável. O estudo AERIS investigou a estabilidade desse fenótipo ao longo do tempo. Os resultados do estudo demonstraram que a inflamação eosinofílica (contagem de EOS no sangue ≥2%) é comum no momento da exacerbação em pacientes com EOS predominantemente elevada durante o estado estável.5 A probabilidade de uma exacerbação ser eosinofílica foi nove vezes maior em pacientes com EOS sanguíneos ≥2% do que naqueles com EOS sanguíneos <2% no momento da avaliação desses pacientes (OR = 9,16; IC 95%: 4,10-20,47; P <0 ,001).5
O que se sabe sobre a estabilidade dos níveis de EOS?
Estabilidade temporal dos níveis de EOS
O conceito de estabilidade temporal refere-se à consistência de um biomarcador ao longo do tempo.6 Em um estudo de Landis et al., as contagens de EOS no sangue realizadas durante a DPOC estável foram razoavelmente reprodutíveis.7
Este estudo realizado por Long et al. forneceu dados robustos sobre a estabilidade temporal dos níveis de EOS sanguíneos em pacientes com DPOC.Em sua análise de 225 pacientes da coorte COPDMAP, Long e seus colegas investigaram a estabilidade dos EOS sanguíneos ao longo de 1 ano utilizando dos padrões do GOLD 2019 para DPOC (<100,100-<300 e ≥300 EOS/mm3).8 Eles descobriram que 69,3% dos pacientes apresentaram boa estabilidade dos níveis de EOS da linha de base até 1 ano (medições feitas durante o estado estável) dentro dos mesmos limiares GOLD 2019 para DPOC.8 Essa estabilidade temporal indica que os níveis de EOS medidos durante a fase estável da DPOC não são flutuações aleatórias, mas refletem um fenótipo inflamatório subjacente e consistente. Além disso, o estudo demonstrou que os pacientes (sem exacerbação, 66,7% dos pacientes; ≥1 exacerbação, 72,7% dos pacientes; ≥2 exacerbações, 74,3% dos pacientes) apresentaram níveis estáveis de EOS no sangue ao longo de 1 ano quando estratificados em subgrupos por número de exacerbações em um ano.8
Associação entre os níveis de EOS e o risco de exacerbação futura9, 10
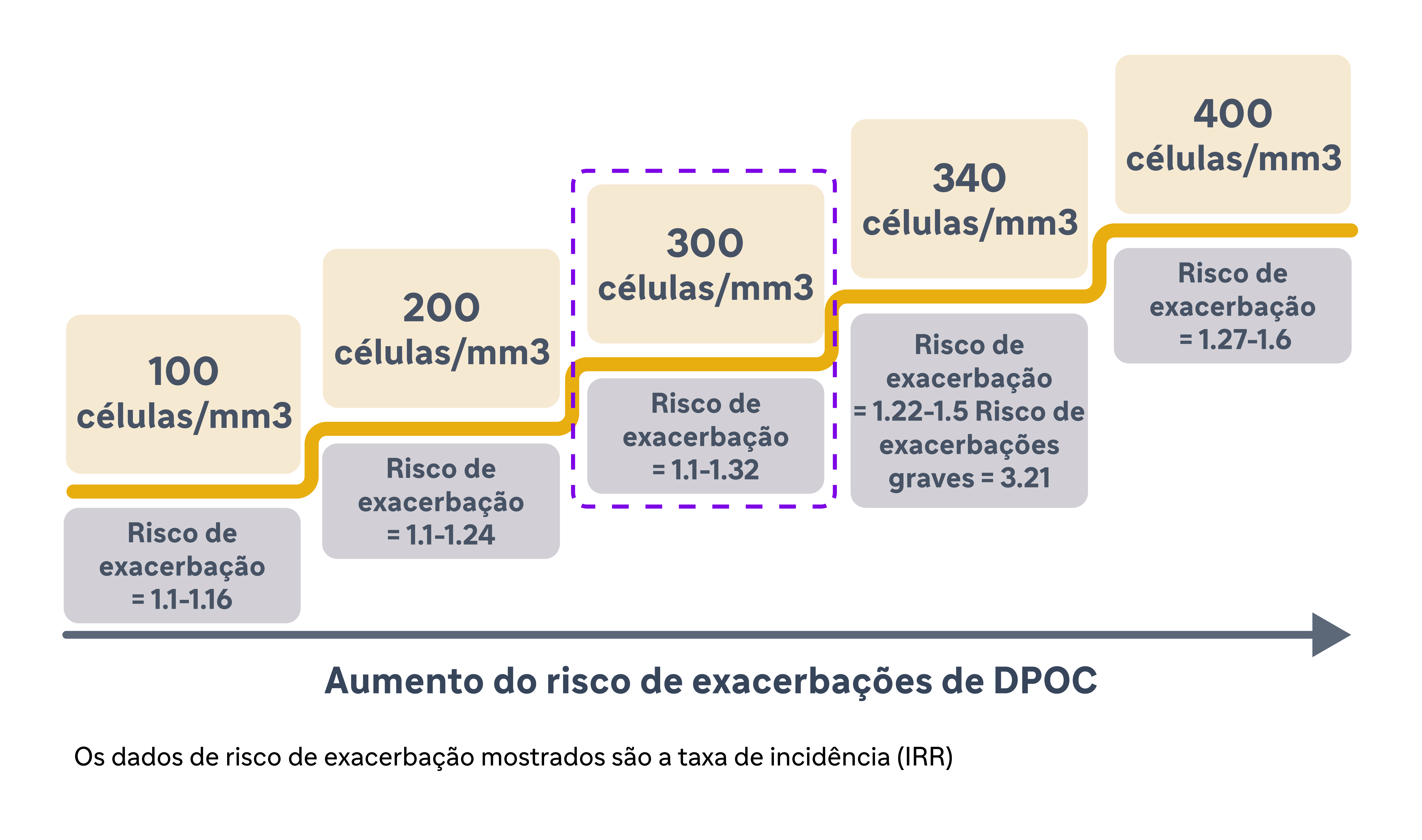
Yun et al. validaram prospectivamente a associação da concentração aumentada de EOS sanguíneos com exacerbações na DPOC no estudo ECLIPSE.9 Nesse estudo, os pesquisadores mediram os níveis de EOS sanguíneos durante a fase estável e acompanharam a ocorrência de exacerbações em um período de 3 anos.9 Eles descobriram que o nível elevado de EOS (≥300 células/mm3) na linha de base durante a fase estável foi um preditor consistente do risco de exacerbações no ano seguinte (IRR = 1,20; IC de 95%: 1,05-1,36 em um ano).9 Especificamente, o risco de exacerbação foi maior em pacientes com níveis de EOS persistentemente elevados (vs. baixos), indicando que esses pacientes possuiam o maior risco. Além disso, o estudo revelou que a capacidade preditiva dos níveis de EOS se estendeu para além de apenas um ano (IRR = 1,22; 95% CI: 1,06-1,42 para o período total do estudo).9 Pacientes com níveis elevados de EOS apresentaram uma probabilidade consistentemente maior de exacerbação ao longo de 3 anos. Essa capacidade preditiva estendida ressalta a utilidade do nível de EOS como um indicador de longo prazo do risco de exacerbação, permitindo estratégias de manejo antecipado e proativo.9

Impacto do uso de corticosteroides orais nos níveis de EOS no sangue em pacientes com DPOC
Uma relação linear inversa entre os níveis sanguíneos de EOS e a dose de corticosteroides orais (COs) foi observada por Prazma et al. em pacientes com asma grave, com um aumento de 41% nos níveis sanguíneos de EOS para cada redução de 5 mg/dia na dose de COs.11 Até onde sabemos, o impacto do uso de COs nos níveis sanguíneos de EOS não foi estudado em pacientes com DPOC. No entanto, sabe-se que o uso de COs suprime também os níveis de EOS sanguíneos em portadores de DPOC.12 Um estudo relatou uma redução significativa na contagem de EOS no escarro de seis vezes, após o uso diário de COs por 2 semanas.13 A medição dos níveis de EOS em pacientes cujos níveis estão suprimidos por uso de COs pode fornecer uma avaliação imprecisa dos níveis de EOS.12
Saiba mais sobre Eosinófilos no sangue como biomarcador em pacientes com DPOC
Quais são as implicações clínicas da estabilidade e da capacidade preditiva da concentração sanguínea dos EOS?
As evidências que apóiam a estabilidade8 e a capacidade preditiva de longo prazo9 dos níveis de EOS sanguínios na DPOC têm implicações clínicas significativas. Ao identificar pacientes com níveis de EOS consistentemente elevados, os profissionais de saúde podem estratificar os pacientes com base em seu risco de exacerbações futuras. Essa estratificação pode orientar as decisões de tratamento, principalmente o uso de de corticoides orais (COs),14 inalatórios (CIs)15 ou biológicos16 que têm como alvo a inflamação do tipo 2. Por exemplo, um paciente com DPOC com níveis consistentemente altos de EOS (>300 células/mm3) durante a fase estável pode ser um candidato ideal para a intervenção precoce com CIs,15 que demonstrou reduzir a frequência e a gravidade das exacerbações na DPOC eosinofílica.17,18 Ao contrário, a ausência de níveis elevados de EOS no sangue >2% pode ajudar a identificar um subgrupo com um impacto adverso de COs em sua recuperação.14 A estabilidade dos níveis de EOS ao longo do tempo permite que os médicos monitorem esses níveis como parte do tratamento de rotina, facilitando a identificação de alterações no perfil inflamatório do paciente e o ajuste do tratamento.
Para obter mais orientações sobre como manejar pacientes com DPOC, consulte as Recomendações GOLD para Tratamento e Gerenciamento da DPOC

A capacidade preditiva de longo prazo dos níveis sanguíneos de EOS9 é particularmente útil, pois permite que os profissionais de saúde antecipem e reduzam o risco de exacerbações, que são um dos principais fatores de morbidade e custos de saúde na DPOC.14,19,20
Como as medições de EOS podem ser incorporadas à prática clínica?
A incorporação das medições de EOS sanguíneos no manejo rotineiro da DPOC exige uma consideração cuidadosa dos limiares de dados e do contexto clínico específico. O limiar de ≥300 células/mm3 é comumente usado para definir níveis elevados de EOS,9 com base em evidências de vários estudos, inclusive o de Yun et al.9 No entanto, existe alguma variabilidade no limiar ideal, dependendo da população de pacientes e dos resultados específicos que estão sendo previstos.21
Na prática, a medição dos níveis de EOS sanguíneos durante a fase estável da DPOC pode ser facilmente integrada aos exames de sangue de rotina.22 Considerando as evidências de estabilidade temporal, uma única medição pode fornecer uma avaliação confiável do fenótipo eosinofílico do paciente.7 Os pacientes com níveis elevados de EOS devem ser monitorados de perto quanto a sinais de exacerbação,23 e deve-se considerar o início precoce de CIs.1 Atualmente, vários ensaios clínicos estão em andamento para avaliar o papel das terapias que visam à inflamação do tipo 2 na DPOC com níveis elevados de EOS.24
Além disso, a capacidade preditiva dos níveis de EOS significa que essas medições podem informar estratégias de manejo a longo prazo. Por exemplo, os pacientes com níveis basais elevados de EOS podem exigir um acompanhamento mais intensivo e um limite mais baixo para aumentar o tratamento no caso de sinais precoces de exacerbação. Essa abordagem proativa pode ajudar a reduzir a frequência e a gravidade das exacerbações, melhorando, em última análise, os resultados dos pacientes e reduzindo a carga sobre os sistemas de saúde.22
Desafios e direções futuras
Embora as evidências que apoiam o uso dos níveis de EOS como biomarcador na DPOC sejam convincentes, ainda há vários desafios. Um deles é a variabilidade nos níveis de EOS devido a fatores externos, como infecções,25 medicamentos,21 e exposições ambientais.26 Esses fatores podem influenciar os níveis de EOS e possivelmente confundir seu valor preditivo. Portanto, é essencial que os médicos interpretem as medições de EOS no contexto do quadro clínico geral do paciente e considerem repetir as medições, se necessário.
Outro desafio é a necessidade de mais pesquisas para refinar os limiares dos níveis de EOS em diferentes cenários clínicos. Embora o limite de ≥300 células/μL seja amplamente utilizado, há necessidade de mais dados para estabelecer os pontos de corte ideais para diferentes populações de pacientes e validar esses limites em diversos cenários clínicos.23
Pesquisas futuras também devem explorar o potencial de combinação dos níveis de EOS com outros biomarcadores e características clínicas para aumentar a precisão da previsão. Por exemplo, a integração das medições de EOS com marcadores de inflamação das vias aéreas27 ou com características clínicas, como histórico de exacerbação,28 poderia fornecer uma ferramenta de avaliação de risco mais abrangente para pacientes com DPOC.
Referências
- Singh D. Blood eosinophil counts in chronic obstructive pulmonary disease: a biomarker of inhaled corticosteroid effects. Tuber Respir Dis (Seoul). 2020;83(3):185–194. Doi: 10.4046/trd.2020.0026. PMID: 32578413.
- Komura M, Sato T, Suzuki Y, Yoshikawa H, Nitta NA, Hayashi M, Kawasaki E, Horikoshi K, Nishioki T, Mori M, Kodama Y, Sasaki S, Takahashi K. Blood Eosinophil Count as a Predictive Biomarker of Chronic Obstructive Pulmonary Disease Exacerbation in a Real-World Setting. Can Respir J. 2023 May 25;2023:3302405. doi: 10.1155/2023/3302405. PMID: 37275320; PMCID: PMC10234729.
- David B, Bafadhel M, Koenderman L, De Soyza A. Eosinophilic inflammation in COPD: from an inflammatory marker to a treatable trait. Thorax. 2021 Feb;76(2):188-195. doi: 10.1136/thoraxjnl-2020-215167. Epub 2020 Oct 29. PMID: 33122447; PMCID: PMC7815887.
- Sivapalan P, Bikov A, Jensen JU. Using Blood Eosinophil Count as a Biomarker to Guide Corticosteroid Treatment for Chronic Obstructive Pulmonary Disease. Diagnostics (Basel). 2021 Feb 3;11(2):236. doi: 10.3390/diagnostics11020236. PMID: 33546498; PMCID: PMC7913607.
- Kim VL, Coombs NA, Staples KJ, Ostridge KK, Williams NP, Wootton SA, Devaster JM, Aris E, Clarke SC, Tuck AC, Bourne SC. Impact and associations of eosinophilic inflammation in COPD: analysis of the AERIS cohort. Eur Respir. 2017;50(4). doi: 10.1183/13993003.00853-2017. PMID: 29025891.
- Walsh CP, Lindsay EK, Grosse P, Natale BN, Fairlie S, Bwint A, Schaffer L, McMahon K, Del Duke C, Forse J, Lamonja-Vicente N. A systematic review and meta-analysis of the stability of peripheral immune markers in healthy adults. Brain Behav Immun.2023;107:32–46. doi: 10.1016/j.bbi.2022.09.011. PMID: 36152782.
- Landis SH, Suruki R, Hilton E, Compton C, Galwey NW. Stability of blood eosinophil count in patients with COPD in the UK clinical practice research datalink. COPD. 2017;14(4):382–388. doi: 10.1080/15412555.2017.1313827. PMID: 28569614.
- Long GH, Southworth T, Kolsum U, Donaldson GC, Wedzicha JA, Brightling CE, Singh D. The stability of blood Eosinophils in chronic obstructive pulmonary disease. Respir Res.2020;21:1–4. doi: 10.1186/s12931-020-1279-4. PMID: 31924207.
- Yun JH, Lamb A, Chase R, Singh D, Parker MM, Saferali A, Vestbo J, Tal-Singer R, Castaldi PJ, Silverman EK, Hersh CP. Blood eosinophil count thresholds and exacerbations in patients with chronic obstructive pulmonary disease. J Allergy Clin Immunol.2018;141(6):2037–2047. doi: 10.1016/j.jaci.2018.04.010. PMID: 29709670.
- Vedel-Krogh S, Nielsen SF, Lange P, Vestbo J, Nordestgaard BG. Blood eosinophils and exacerbations in chronic obstructive pulmonary disease. The Copenhagen General Population Study. Am J Respir Crit Care Med.2016 May 1;193(9):965–74. doi: 10.1164/rccm.201509-1869OC. PMID: 26641631.
- Prazma CM, Bel EH, Price RG, Bradford ES, Albers FC, Yancey SW. Oral corticosteroid dose changes and impact on peripheral blood eosinophil counts in patients with severe eosinophilic asthma: a post hoc analysis. Respir Res. 2019 May 3;20(1):83. doi: 10.1186/s12931-019-1056-4. PMID: 31053134; PMCID: PMC6499981.
- Mathioudakis AG, Bikov A, Foden P, Lahousse L, Brusselle G, Singh D, Vestbo J. Change in blood eosinophils following treatment with inhaled corticosteroids may predict long-term clinical response in COPD. Eur Respir J. 2020 May 27;55(5):1902119. doi: 10.1183/13993003.02119-2019. PMID: 32108044.
- Brightling CE, Monteiro W, Ward R, Parker D, Morgan MD, Wardlaw AJ, Pavord ID. Sputum eosinophilia and short-term response to prednisolone in chronic obstructive pulmonary disease: a randomised controlled trial. Lancet. 2000 Oct 28;356(9240):1480-5. doi: 10.1016/S0140-6736(00)02872-5. PMID: 11081531.
- Bafadhel M, McKenna S, Terry S, Mistry V, Pancholi M, Venge P, Lomas DA, Barer MR, Johnston SL, Pavord ID, Brightling CE. Blood eosinophils to direct corticosteroid treatment of exacerbations of chronic obstructive pulmonary disease: a randomized placebo-controlled trial. Am J Respir Crit Care Med.2012;186(1):48–55. doi: 0.1164/rccm.201108-1553OC. PMID: 22447964.
- Lea S, Higham A, Beech A, Singh D. How inhaled corticosteroids target inflammation in COPD. Eur Respir Rev.2023;32(170). doi: 10.1183/16000617.0084–2023. PMID: 37852657.
- Ohnishi H, Eitoku M, Yokoyama A. A systematic review and integrated analysis of biologics that target Type 2 inflammation to treat COPD with increased peripheral blood eosinophils. Heliyon. 2022;8(6). doi: 10.1016/j.heliyon.2022.e09736. PMID: 35756113.
- Quint JK, Ariel A, Barnes PJ. Rational use of inhaled corticosteroids for the treatment of COPD. NPJ Prim Care Respir Med. 2023;33(1):27. doi: 10.1038/s41533-023-00347-6. PMID: 37488104.
- Mkorombindo T, Dransfield MT. Inhaled corticosteroids in chronic obstructive pulmonary disease: benefits and risks. Clin Chest Med. 2020;41(3):475–484. doi: 10.1016/j.ccm.2020.05.006. PMID: 32800200.
- Ritchie AI, Wedzicha JA. Definition, causes, pathogenesis, and consequences of chronic obstructive pulmonary disease exacerbations. Clin Chest Med.2020;41(3):421–438. doi: 10.1016/j.ccm.2020.06.007. PMID: 32800196.
- Bafadhel M, Davies L, Calverley PM, Aaron SD, Brightling CE, Pavord ID. Blood eosinophil guided prednisolone therapy for exacerbations of COPD: a further analysis. Eur Respir. 2014;44(3):789–91. doi: 10.1183/09031936.00062614. PMID: 24925917.
- Benson VS, Hartl S, Barnes N, Galwey N, Van Dyke MK, Kwon N. Blood eosinophil counts in the general population and airways disease: a comprehensive review and meta-analysis. Eur Respir J. 2022;59(1). doi: 10.1183/09031936.00062614. PMID: 24925917.
- Bartziokas K, Gogali A, Kostikas K. The role of blood eosinophils in the management of COPD: an attempt to answer the important clinical questions. COPD. 2021;18(6):690–699. doi: 10.1080/15412555.2021.1985989. PMID: 34657541.
- Oliver B, Tonga K, Darley D, Rutting S, Zhang X, Chen H, Wang G. COPD treatment choices based on blood eosinophils: are we there yet?. Breathe (Sheff). 2019;15(4):318–323. doi: 10.1183/20734735.0254-2019. PMID: 31803266.
- Rabe KF, Rennard S, Martinez FJ, Celli BR, Singh D, Papi A, Bafadhel M, Heble J, Radwan A, Soler X, Jacob Nara JA. Targeting type 2 inflammation and epithelial alarmins in chronic obstructive pulmonary disease: a biologics outlook. Am J Respir Crit Care Me. 2023 Aug 15;208(4):395–405. doi: 10.1164/rccm.202303-0455CI. PMID: 37348121.
- Roufosse F, Weller PF. Practical approach to the patient with hypereosinophilia. Allergy Clin Immunol.2010 Jul 1;126(1):39–44. doi: 10.1016/j.jaci.2010.04.011. PMID: 20538328.
- Chipps BE, Jarjour N, Calhoun WJ, Iqbal A, Haselkorn T, Yang M, Brumm J, Corren J, Holweg CT, Bafadhel M. A comprehensive analysis of the stability of blood eosinophil levels. Ann Am Thorac Soc. 2021;18(12):1978–1987. doi: 10.1513/AnnalsATS.202010-1249OC. PMID: 33891831.
- Oishi K, Matsunaga K, Shirai T, Hirai K, Gon Y. Role of Type2 Inflammatory Biomarkers in Chronic Obstructive Pulmonary Disease. J Clin Med. 2020 Aug 18;9(8):2670. doi: 10.3390/jcm9082670. PMID: 32824775; PMCID: PMC7464674.
- Haughney J, Lee AJ, Nath M, Müllerová H, Holmgren U, Nigris ED, Ding B. The long-term clinical impact of COPD exacerbations: a 3-year observational study (SHERLOCK). Ther Adv Respir Dis.2022;16:17534666211070139. doi: 10.1177/17534666211070139. PMID: 35156488.
MAT-BR-2502010 - Mai/2025