- Wissen
- Quelle: Campus Sanofi
- 08.10.2025
Früh handeln, ganzheitlich denken

Menschen mit Diabetes mellitus Typ 2 (T2D) und atherosklerotischer kardiovaskulärer Erkrankung (ASCVD) weisen ein deutlich erhöhtes Risiko für kardiovaskuläre Ereignisse auf. Dennoch bleibt ein erheblicher Anteil dieser Patientengruppe unterbehandelt.1 Die aktuellen Leitlinien der EASD/ADA (2022) sowie der ESC (2023) betonen die Bedeutung einer frühzeitigen Insulintherapie und einer konsequenten Lipidsenkung im Rahmen eines ganzheitlichen Ansatzes. Eine gleichzeitige Kontrolle von Blutzucker- und Lipidwerten ist entscheidend, um kardiovaskuläre Komplikationen bei T2D zu reduzieren.2,3
Aktuelle Daten der International Diabetes Federation zeigen, dass Diabetes zu den am schnellsten wachsenden globalen Gesundheitsproblemen gehört, mehr als 90 % der Fälle entfallen auf T2D.4
- Nach Schätzungen aus dem Jahr 2024 leben weltweit etwa 589 Millionen Menschen mit Diabetes, wobei Prognosen zeigen, dass diese Zahl bis 2050 auf über 850 Millionen ansteigen könnte.4
- Außerdem bleiben kardiovaskuläre Erkrankungen (CVD) die führende Todesursache bei Menschen mit Diabetes.*,1

Die meisten Menschen mit T2D erreichen ihre Behandlungsziele nicht, was das Risiko für ASCVD erheblich erhöht.5-10
Trotz wachsender Evidenz zeigt sich, dass eine unzureichende Kontrolle der wichtigsten modifizierbaren Risikofaktoren zu ungünstigen klinischen Verläufen führt. So haben Menschen mit T2D ein bis zu vierfach höheres Risiko, im Laufe ihres Lebens eine CVD zu entwickeln; das Vorliegen einer ASCVD steigert das Risiko zusätzlich.3
Diese Versorgungslücken spiegeln sich in mehreren modifizierbaren Risikofaktoren wider:
haben ihren Blutdruck nicht im Zielbereich†,5
erreichen ihr HbA1c-Ziel nicht†,5
erreichen nicht ihr LDL-C-Behandlungsziel‡,§,¥,6–8
sind übergewichtig oder adipös9
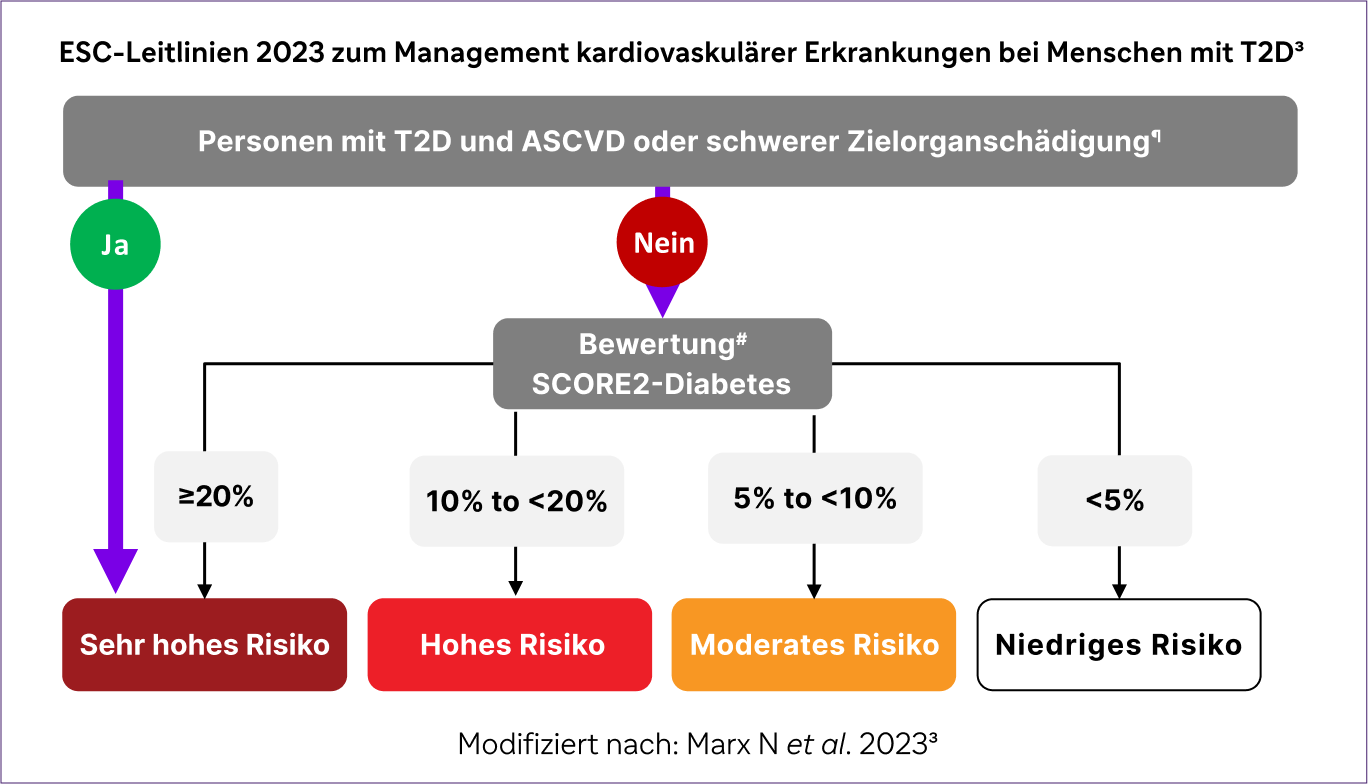
Diese niedrige Zielerreichung beeinflusst die Risikobewertung und das Management erheblich. Die ESC-Leitlinien 2023 stufen Menschen mit T2D und bestehender ASCVD oder schwerer Zielorganschädigung automatisch als Personen mit sehr hohem Risiko ein. Für alle anderen erfolgt die Risikostratifikation mithilfe des SCORE2-Diabetes-Algorithmus basierend auf dem geschätzten 10-Jahres-Risiko.3
Da die Mehrheit der Betroffenen ihre Zielwerte bei Blutdruck, HbA1c, LDL-C oder Gewicht nicht erreicht, fällt ein großer Teil in die Kategorien „hohes“ oder „sehr hohes Risiko“.3
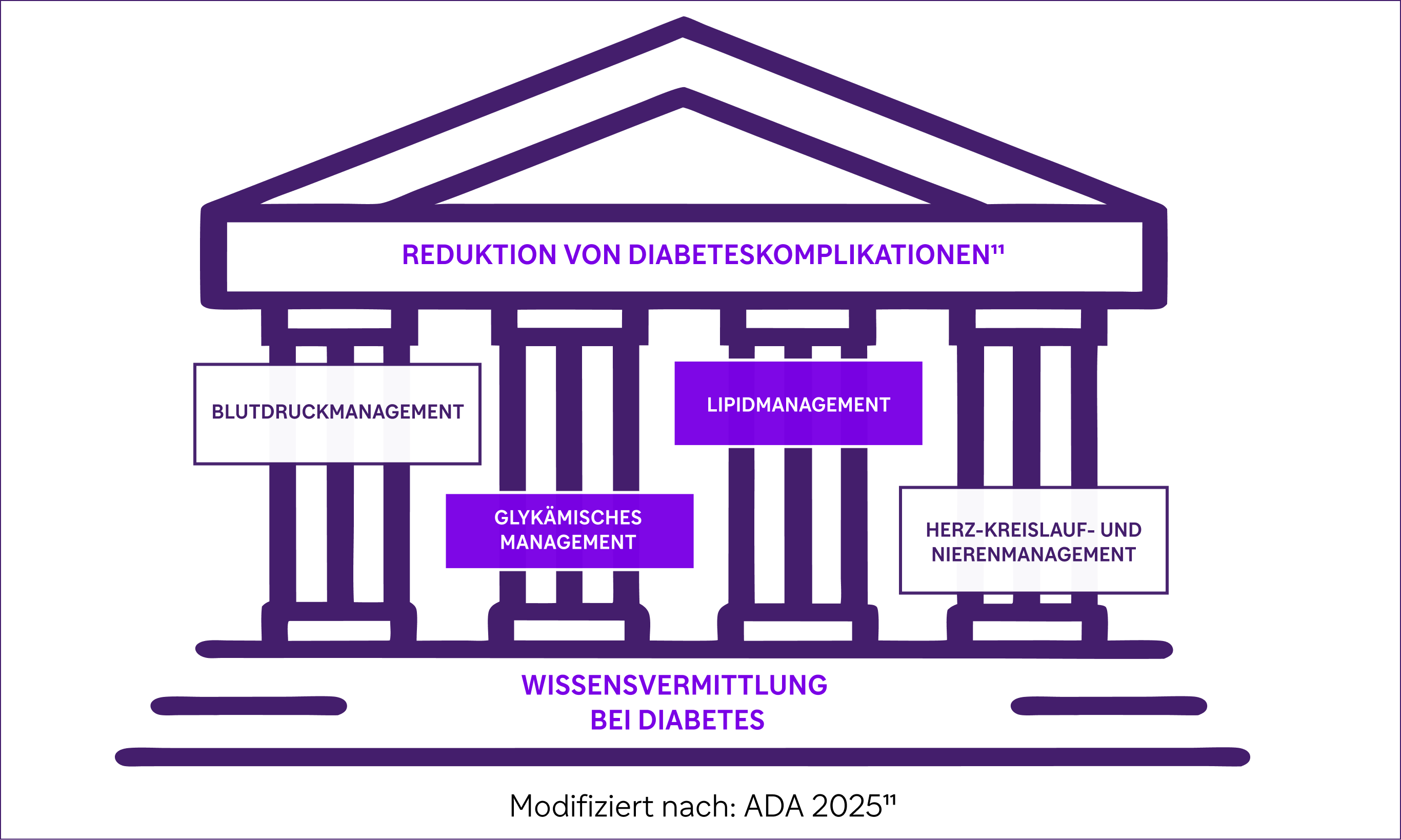
Dies unterstreicht die Notwendigkeit einer intensiven, multifaktoriellen Intervention im Einklang mit den internationalen Leitlinien.2,3,11
Die EASD/ADA-Leitlinien 2022 sowie die ESC-Leitlinien 2023 unterstreichen die Bedeutung eines ganzheitlichen, multifaktoriellen Ansatzes für Menschen mit T2D. Dazu gehören eine sorgfältige glykämische und lipidologische Kontrolle, um das Risiko kardiovaskulärer Ereignisse wirksam zu senken.2,3
Trotz klarer Leitlinien wird die Behandlung oft nicht rechtzeitig intensiviert:
Menschen mit T2D erleben häufig verlängerte Phasen unzureichender glykämischer Kontrolle. Eine große retrospektive britische Studie mit über 80.000 Personen zeigte, dass bei Menschen mit zu hohem HbA1c die Zeit bis zum Beginn der Insulintherapie über 7 Jahre betrug – selbst bei Personen, die bereits zwei oder mehr orale Antidiabetika erhielten.**,12
Ähnlich unzureichend ist die lipidsenkende Behandlung bei Menschen mit hohem oder sehr hohem Risiko. Obwohl die Leitlinien zunehmend eine frühzeitige und intensive Senkung des LDL-C empfehlen, erreichen viele Menschen mit T2D ihre Zielwerte nicht, häufig aufgrund der unzureichenden Nutzung von Kombinationstherapien. Eine globale Analyse zur Versorgung von Dyslipidämie zeigte, dass Ezetimib und PCSK9-Inhibitoren nur begrenzt eingesetzt werden, auch bei Menschen mit etablierter ASCVD.††,13,14
Rechtzeitig handeln, um HbA1c- und LDL-C-Ziele bei T2D zu erreichen
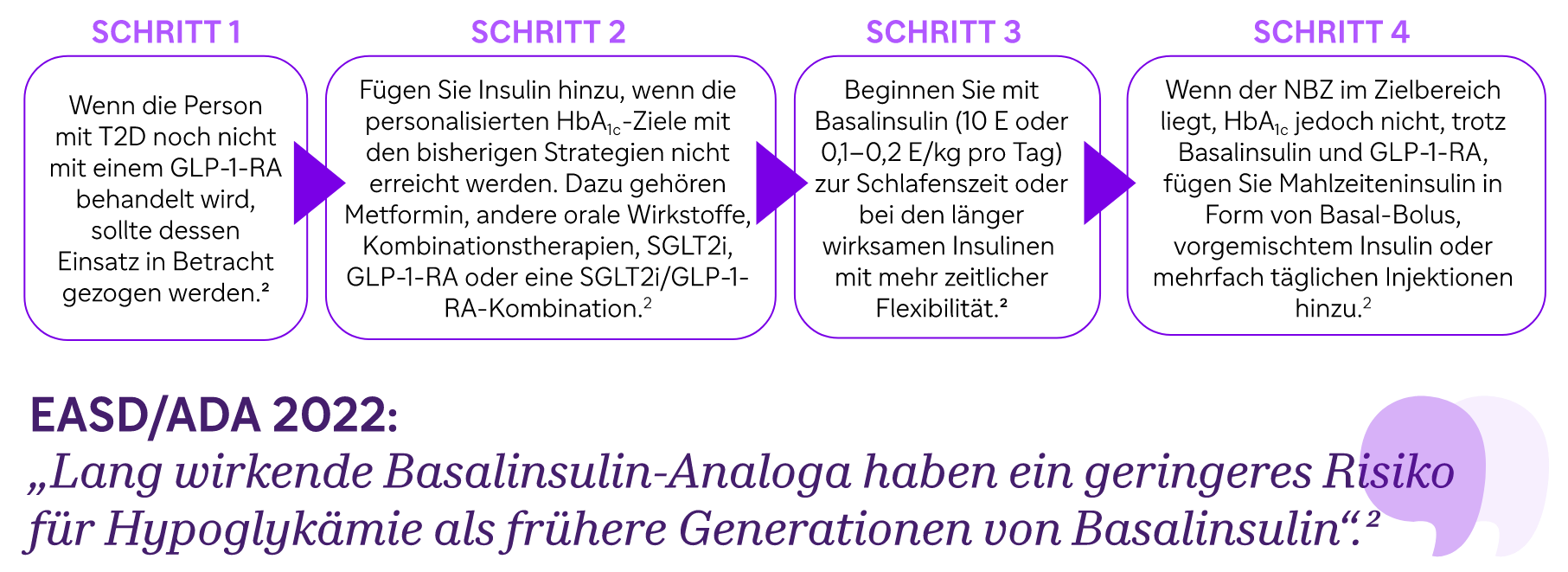
Was empfehlen die EASD/ADA-Leitlinien 2022 für die glykämische Kontrolle bei Menschen mit unzureichend kontrolliertem T2D?
Die aktuellen EASD/ADA-Konsensusleitlinien empfehlen: „Wenn Menschen mit T2D die Zielwerte nicht erreichen und Insulin die beste Wahl für die Person ist, sollte die Insulintherapie nicht verzögert werden“.2
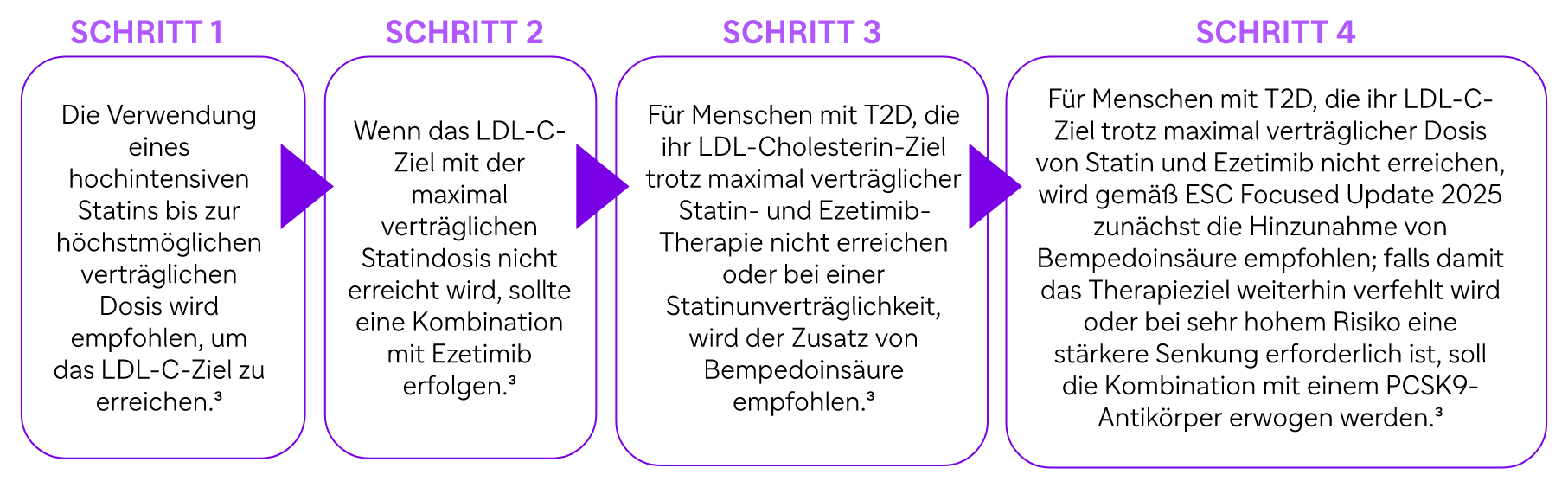
Was empfehlen die ESC-Leitlinien 2023 zur Lipidkontrolle bei Menschen mit T2D und sehr hohem kardiovaskulären Risiko?
Menschen mit T2D und klinisch etablierter ASCVD werden als Personen mit sehr hohem Risiko definiert, und diese Personen sollten einen LDL-C-Zielwert von < 55 mg/dl anstreben und eine Reduktion von mindestens 50 %.‡‡,3
Aktuelle ESC-Leitlinien betonen einen konsequenten, intensiven Ansatz zur LDL-C-Senkung bei Personen mit sehr hohem kardiovaskulären Risiko und empfehlen:3
RECHTZEITIG HANDELN, UM HbA1c- UND LDL-C-ZIELE BEI T2D ZU ERREICHEN
* About two-thirds of deaths in people with T2D are due to cardiovascular disease: of these, approximately 40% are from ischemic heart disease, 15% from other forms of heart disease, principally congestive heart failure, and about 10% from stroke.1
† Meta-analysis of 24 observational studies (n=369,251) from 20 countries to evaluate global attainment of ADA, EASD, and NICE treatment targets in adults with T2D. Data from 2006–2017 showed that only 42.8% achieved HbA1c goals, 29.0% reached blood pressure targets, and 49.2% met LDL-C thresholds, with significant variation by region and no improvement over time.5
# Multicenter Spanish study (n=380) evaluating LDL-C goal attainment in T2D patients across 7 endocrinology clinics. Based on 2016 and 2019 ESC/EAS guidelines, only 62.1% and 39.7% of patients, respectively, met LDL-C targets – despite 72.1% being classified as very high-risk. Treatment was adjusted in just 36.1% of those not
at goal.6
§ Cross-sectional study in the Netherlands (n=428) showed that while 78% of high-risk T2D patients reached LDL-C ≤2.5 mmol/L, only 43% met the <1.8 mmol/L goal. Poor adherence to lifestyle guidelines was widespread, and high-intensity statin use remained uncommon among those not at goal.7
¥ Observational study in France (n=654) found 59% of patients with diabetes at very high cardiovascular risk failed to meet LDL-C targets (<1.8 mmol/L) despite statin therapy.8
¶ Severe target-organ damage defined as eGFR <45 mL/min/1.73 m2 irrespective of albuminuria; or eGFR 45–59 mL/min/1.73 m2 and microalbuminuria (UACR 30–300 mg/g; stage A2); or proteinuria (UACR >300 mg/g; stage A3), or presence of microvascular disease in at least three different sites [e.g. microalbuminuria (stage A2) plus retinopathy plus neuropathy].3
# The thresholds (10-year CVD risk) suggested are not definitive but rather designed to prompt joint decision-making conversations with patients about intensity of treatment, as well as additional interventions. SCORE2-Diabetes refers to patients aged ≥40 years.3
** Observed in a large retrospective cohort of over 81,000 UK patients, where the median time to insulin intensification was >7.1 years in those already on two or three oral antidiabetic drugs, and >6.0 years even at higher HbA 1c thresholds. Mean HbA 1c at insulin initiation exceeded 9% in most cases.12
†† Observed in a prospective, multinational, observational, non-interventional cohort study conducted across 14 European countries between 2020 and 2021. It enrolled 9,602 adults at high or very high cardiovascular risk to document real-world lipid-lowering therapy use and LDL-C goal attainment based on 2019 ESC/EAS Guidelines. Statin monotherapy was used in 50.2% of all patients (54.5% and 48.4% of patients in the high- and very high-risk groups, respectively). The use of other LLT as monotherapies among all patients was low: 1.8% on ezetimibe, 1.7% on PCSK9 inhibitors, and 0.6% on other oral LLT. Combination LLT were used in 24.0% of all patients and more frequently used in the very high-risk group (26.4%), compared with the high-risk group (18.1%). Combination therapy includes: 16.0% of patients on statin plus ezetimibe, 4.5% on a PCSK9 inhibitor plus oral LLT, 3.5% receiving any other oral combination therapy. The pattern was similar for patients with and without ASCVD.13
‡‡ Patients with severe target-organ damage or 10-years CVD risk ≥20% using SCORE2-Diabetes are also classed as very high CV risk.3
ADA = American Diabetes Association; ASCVD = atherosklerotische kardiovaskuläre Erkrankung; CV = kardiovaskulär; CVD = kardiovaskuläre Erkrankung; EASD = European Association for the Study of Diabetes; eGFR = geschätzte glomeruläre Filtrationsrate; ESC = European Society of Cardiology; FPG = Nüchtern-Plasmaglukose; GLP-1 RA = Glucagon-like peptide-1 Receptor-Agonist; HbA1c = glykosyliertes Hämoglobin; LDL-C = Lipoprotein-Cholesterin niederer Dichte; LLT = lipidsenkende Therapie; NBZ = Nüchternblutzucker; NICE = Natrional Institute for Health and Care Excellence; PCSK9 = Proproteinkonvertase-Subtilisin/Kexin-Typ-9; SCORE = Systematic National Coronary Risk Estimation (systematische Schätzung des koronaren Risikos); SGLT2i = Natrium/Glukose-Transporter-2-Inhibitor; T2D = Typ-2-Diabetes; TIR = Zeit im Zielbereich; UACR = Albumin/Kreatinin-Quotient im Urin.
-
Wang CCL, et al. Circulation. 2016;133:2549–502;
-
Davies MJ, et al. Diabetes Care. 2022;45:2753–2786;
-
Marx N, et al. Eur Heart J. 2023;44(39):4043–4140. Mach F et al. (2025) Eur Heart J doi:10.1093/eurheartj/ehaf190;
-
International Diabetes Federation (IDF). IDF Diabetes Atlas 11th Edition. https://diabetesatlas.org/resources/idf-diabetes-atlas-2025/#, letzter Zugriff: 15.9.2025;
-
Khunti K, et al. Diabetes Res Clin Pract. 2018;137:137–148;
-
Villar-Taibo R, et al. Endocrinol Diabetes Nutr (Engl Ed). 2023;70(1):29–38;
-
Gant CM, et al. Nutr Diabetes. 2018;8(1):24;
-
Breuker C, et al. Int J Cardiol. 2018;268:195–199;
-
Grant B, et al. Clin Med (Lond). 2021;21(4):e327–e231;
-
World Health Organization (WHO). Cardiovascular diseases (CVDs). https://www.who.int/news-room/fact-sheets/detail/cardiovascular-diseases-(cvds), letzter Zugriff: 15.9.2025;
-
American Diabetes Association. Diabetes Care. 2025;48(Supplement_1):S207–S238;
-
Khunti K, et al. Diabetes Care. 2013;36(11):3411–3417;
-
Ray KK, et al. Lancet Reg Health Eur. 2023;29:100624;
-
Mach F et al. (2025) Eur Heart J doi:10.1093/eurheartj/ehaf190.
MAT-DE-2503588-1.0-10/2025