- Wissen
- Quelle: Campus Sanofi
- 01.09.2025
Betazellfunktion bei T1D: entscheidend für Verlauf

Viele Betroffene mit Typ-1-Diabetes erfahren erst von ihrer Erkrankung, wenn sich diese bereits manifestiert hat. Informieren Sie sich hier, wie Sie durch Früherkennungsmaßnahmen das Risiko Ihrer Patient*innen, einen klinisch manifesten T1D zu entwickeln, ermitteln können, damit Sie diese Patienten gezielt überwachen können.
Typ-1-Diabetes (T1D) ist eine Autoimmunerkrankung, bei der nach und nach die insulinproduzierenden Betazellen des Pankreas zerstört werden. Dies führt zu einem absoluten Insulinmangel und kann unbehandelt lebensbedrohliche Ketoazidosen verursachen.1 Meist erfolgt die T1D-Diagnose anhand der klinischen Symptomatik und der über die Diagnosekriterien erhöhten Blutzuckerwerte (Hyperglykämie) – die Erkrankung ist bis dahin jedoch schon weit fortgeschritten.1,2
Verlust der Betazellfunktion kennzeichnet T1D
Die progressive Zerstörung der Betazellen ist ein Kennzeichen für den autoimmunen Typ-1-Diabetes (T1D).1 Dieser manifestiert sich in 3 Stadien: Von den präsymptomatischen Stadien 1 und 2 bis zur klinischen Manifestation (Stadium 3).2,3 Der Langzeit-T1D wird auch als Stadium 4 bezeichnet
(siehe Abb. 1).4
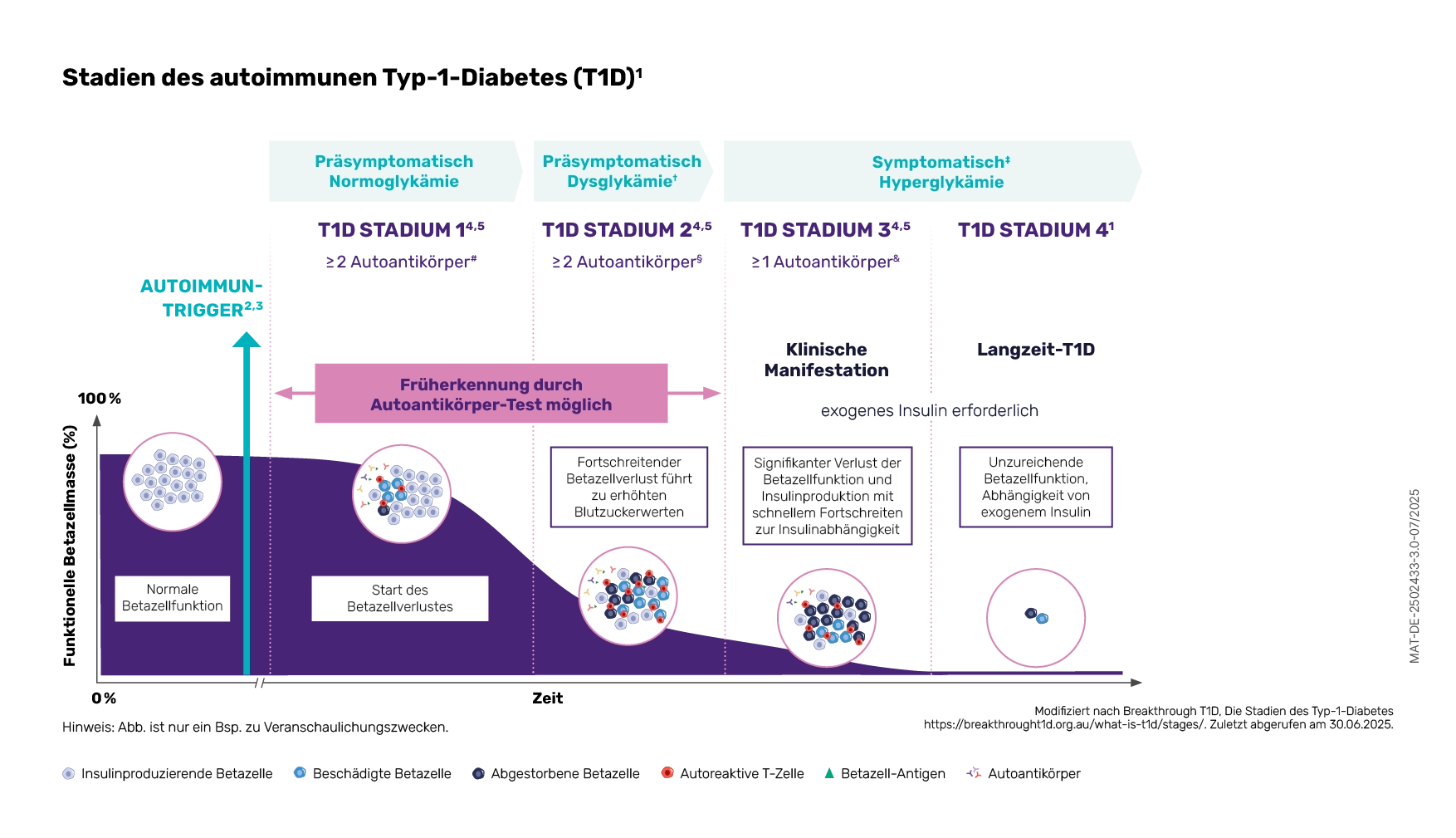
Abb. 1: Stadien des autoimmunem T1D2-8, Mod. nach9
# Autoantikörper gegen Betazell-Autoantigene (Insulin, Glutamatdecarboxylase [GAD65], Insulinoma-assoziiertes Antigen 2 [IA-2] oder Zinktransporter 8 [ZnT8]) im Patientenserum nachgewiesen2
† Nüchternplasmaglukose 100–125 mg/dl (5,6–6,9 mmol/l) oder 2-stündige Plasmaglukose während eines oralen Glukose-Toleranztests (oGTT) 140–199 mg/dl (7,8–11,0 mmol/l) oder HbA1c 5,7 %–6,4 % (39–47 mmol/mol) oder ≥ 10 % Anstieg des HbA1c3
‡ Häufige Symptome von T1D sind Polydipsie, Polyurie, starke Müdigkeit, verschwommenes Sehen und Gewichtsverlust.2,7
§ Bei einigen Personen mit zuvor bestätigten multiplen Autoantikörpern kann eine Rückkehr zu einem singulären oder negativen Autoantikörperstatus auftreten.8
& Bei einigen Patientinnen und Patienten können Autoantikörper im T1D-Stadium 3 fehlen.3
HbA1c: Hämoglobin A1C; T1D: Typ-1-Diabetes
Weniger T1D-Komplikationen bei höherer Betazellrestfunktion
Der Verlust der Betazellfunktion führt zu Stoffwechselversagen, vaskulären Komplikationen und einer lebenslangen Abhängigkeit von einer exogenen Insulintherapie.4,9-14 Die (Rest-)Funktion der Betazellen spielt somit eine zentrale Rolle für den Verlauf des T1D. So haben Patientinnen und Patienten mit höheren C-Peptid-Werten (C-Peptid: ein direktes und quantitatives Maß zur Beurteilung der Betazellfunktion15-19) ein signifikant geringeres Risiko für diabetische Ketoazidosen (DKA)20 und schwere Hypoglykämien.17,21-23
Darüber hinaus werden mit einer höheren Betazellrestfunktion signifikant häufiger HbA1c-Zielwerte erreicht15,17,20-27 und es kommt seltener zu langfristigen mikrovaskulären Komplikationen, wie:
- Retinopathie17,21,23,25
- Nephropathie17,21,25
- Neuropathie23,25
Alter bei Manifestation entscheidet über Betazellverlust
Je geringer das Alter bei T1D-Manifestation, desto größer das Ausmaß der Betazellstörung.28-33 So zeigen Patientinnen und Patienten, die vor dem 7. Lebensjahr diagnostiziert wurden, ein aggressiveres Krankheitsbild als Betroffene, die mind. 13 Jahre alt sind.28,29 Im Jugendlichen- oder Erwachsenenalter verläuft der Verlust hingegen langsamer und es bleibt häufiger eine messbare Betazellreserve erhalten.28,29,33
Rechtzeitige Intervention kann helfen, Betazellen zu erhalten34
T1D kann in den präklinischen Stadien 1 und 2 mittlerweile durch den Nachweis von Inselautoantikörpern sicher diagnostiziert werden.35 Sie können bereits im Säuglingsalter auftreten – meist zwischen 6 Monaten und 3 Jahren –, wobei der Höhepunkt bei ca. 2 Jahren liegt.36 Dabei gibt der Nachweis von ≥ 2 Autoantikörpern eine nahezu 100 %ige Sicherheit für eine T1D-Diagnose in präsymptomatischen Stadien.35
Gut zu wissen: 60–90 % des Betazellverlustes ereignen sich in Stadium 1 und 2.37-40
Kinder mit bekanntem Frühstadium des autoimmunen T1D und somit Zugang zu regelmäßigem Stoffwechsel-Monitoring, hatten in einer Studie einen milderen Einstieg in die Erkrankung bei Manifestation im Vergleich zu Kindern ohne T1D-Früherkennung. Dies zeigte sich in:34
- Niedrigeren HbA1c-Werten
- Niedrigeren Nüchternblutzucker-Werten
- Geringeren Gewichtsabnahme
- Höheren C-Peptid-Spiegeln
Dies kann sich positiv auf das langfristige Erreichen und Halten guter Blutzuckerwerte auswirken.
Wer hat ein hohes Risiko für T1D?
- Insbesondere Patientinnen und Patienten mit erhöhtem Risiko können von einer Früherkennung profitieren.
- Zu diesen zählen insbesondere Personen mit familiärer Vorbelastung8,41 und Menschen mit bestehenden oder familiär auftretenden autoimmunen Erkrankungen41 (u. a. Zöliakie und Schilddrüsenerkrankungen).
- Bis zu 90 % der Betroffenen haben jedoch keine nahen Verwandten mit T1D.1 Das heißt, T1D kann jeden treffen.

Diabetische Ketoazidosen erkennen & vermeiden

Früherkennung

Neue Erkenntnisse bei Typ-1-Diabetes

Typ-1-Diabetes neu denken

Diabetische Ketoazidosen erkennen & vermeiden

Früherkennung

Neue Erkenntnisse bei Typ-1-Diabetes

Typ-1-Diabetes neu denken
Früherkennungsstudien Fr1da und Fr1da für Verwandte in Deutschland
Kinder im Alter von 2 bis 10 Jahren können – je nach regionaler Verfügbarkeit – an der Fr1da-Studie teilnehmen und sich auf Inselautoantikörper testen lassen. Erfahren Sie mehr zum Früherkennungstest in der Fr1da-Studie!
Verwandte 1. oder 2. Grades von Patient*innen mit Typ-1-Diabetes, im Alter von 1 bis 21 Jahren und mit Wohnsitz in Deutschland können deutschlandweit auf Inselautoantikörper getestet werden. Erfahren Sie mehr zum Früherkennungstest in der Fr1da-Studie für Verwandte!
Mehr Infos: https://www.typ1diabetes-frueherkennung.de/
Die Fr1da-Studie ist eine unabhängige wissenschaftliche Studie des Helmholtz Munich.
- S3-Leitlinie Therapie des Typ-1-Diabetes. AWMF online 2023. Reg.-Nr.: 057-013; unter: https://register.awmf.org/assets/guidelines/057-013l_S3-Therapie-Typ-1-Diabetes_2023-09_1.pdf (abgerufen am 20.08.2025).
- Insel RA et al. Staging presymptomatic type 1 diabetes: a scientific statement of JDRF, the Endocrine Society, and the American Diabetes Association. Diabetes Care. 2015;38(10):1964-1974.
- American Diabetes Association Professional Practice C. Introduction and Methodology: Standards of Care in Diabetes-2025. Diabetes Care. 2025;48(1 Suppl 1):S1-S5.
- Haller MJ et al. ISPAD Clinical Practice Consensus Guidelines 2024: Screening, Staging, and Strategies to Preserve Beta-Cell Function in Children and Adolescents with Type 1 Diabetes. Horm Res Paediatr. 2024;97(6):529-545.
- van Belle TL et al. Type 1 diabetes: etiology, immunology, and therapeutic strategies. Physiol Rev. 2011;91(1):79-118.
- Jacobsen LM et al. The risk of progression to type 1 diabetes is highly variable in individuals with multiple autoantibodies following screening. Diabetologia. 2020;63(3):588-596.
- diabinfo: Was ist Diabetes Typ 1?, unter: https://www.diabinfo.de/leben/typ-1-diabetes/grundlagen/krankheitsbild-und-symptome.html, zuletzt abgerufen am 20.08.2025.
- Phillip M et al. Consensus guidance for monitoring individuals with islet autoantibody-positive pre-stage 3 type 1 diabetes. Diabetologia. 2024.
- Breakthrough T1D, Die Stadien des Typ-1-Diabetes, unter: https://breakthrought1d.org.au/what-is-t1d/stages/, zuletzt abgerufen am 20.08.2025.
- Herold KC et al. The immunology of type 1 diabetes. Nat Rev Immunol. 2024;24(6):435-451.
- O'Donovan AJ et al. Shifting the paradigm of type 1 diabetes: a narrative review of disease modifying therapies. Front Endocrinol (Lausanne). 2024;15:1477101.
- Ozen G et al. The Association of Autoimmune Diseases with Type 1 Diabetes Mellitus in Children Depends Also by the Length of Partial Clinical Remission Phase (Honeymoon). Int J Endocrinol. 2020;2020:2630827.
- Nagy G et al. New therapeutic approaches for type 1 diabetes: Disease-modifying therapies. World J Diabetes. 2022;13(10):835-850.
- Fowler M. Microvascular and Macrovascular Complications of Diabetes. Clin Diabetes. 2008;26(2):77–82.
- Latres E et al. Evidence for C-Peptide as a Validated Surrogate to Predict Clinical Benefits in Trials of Disease-Modifying Therapies for Type 1 Diabetes. Diabetes. 2024;73(6):823-833.
- Galderisi A et al. Quantifying beta cell function in the preclinical stages of type 1 diabetes. Diabetologia. 2023;66(12):2189-2199.
- Palmer JP et al. C-peptide is the appropriate outcome measure for type 1 diabetes clinical trials to preserve beta-cell function: report of an ADA workshop, 21-22 October 2001. Diabetes. 2004;53(1):250-264.
- Leighton E et al. A Practical Review of C-Peptide Testing in Diabetes. Diabetes Ther. 2017;8(3):475-487.
- Yang Y et al. Solution structure of proinsulin: connecting domain flexibility and prohormone processing. J Biol Chem. 2010;285(11):7847-7851.
- Mellor JH et al. Langzeit-Wirkung von C-Peptid auf klinische Ergebnisse in der schottischen Type-1-Bioresource-Kohorte, Diabetologie und Stoffwechsel 2025; 20: S38–9.
- Steffes MW et al. Beta-cell function and the development of diabetes-related complications in the diabetes control and complications trial. Diabetes Care. 2003;26(3):832-836.
- Gubitosi-Klug RA et al. Residual beta cell function in long-term type 1 diabetes associates with reduced incidence of hypoglycemia. J Clin Invest. 2021;131(3).
- Lachin JM et al. Impact of C-peptide preservation on metabolic and clinical outcomes in the Diabetes Control and Complications Trial. Diabetes. 2014;63(2):739-748.
- Sorensen JS et al. Residual beta-Cell function 3-6 years after onset of type 1 diabetes reduces risk of severe hypoglycemia in children and adolescents. Diabetes Care. 2013;36(11):3454-3459.
- Nathan DM. Realising the long-term promise of insulin therapy: the DCCT/EDIC study. Diabetologia. 2021;64(5):1049-1058.
- Fuhri Snethlage CM et al. Residual beta-Cell Function Is Associated With Longer Time in Range in Individuals With Type 1 Diabetes. Diabetes Care. 2024;47(7):1114-1121.
- Jeyam A et al. Clinical Impact of Residual C-Peptide Secretion in Type 1 Diabetes on Glycemia and Microvascular Complications. Diabetes Care. 2021;44(2):390-398.
- Leete P et al. Differential Insulitic Profiles Determine the Extent of beta-Cell Destruction and the Age at Onset of Type 1 Diabetes. Diabetes. 2016;65(5):1362-1369.
- Leete P et al. The Effect of Age on the Progression and Severity of Type 1 Diabetes: Potential Effects on Disease Mechanisms. Curr Diab Rep. 2018;18(11):115.
- Pipeleers D et al. Restoring a functional beta-cell mass in diabetes. Diabetes Obes Metab. 2008;10 Suppl 4:54-62.
- Poudel A et al. Beta-cell destruction and preservation in childhood and adult onset type 1 diabetes. Endocrine. 2015;49(3):693-702.
- Gepts W. Pathologic anatomy of the pancreas in juvenile diabetes mellitus. Diabetes. 1965;14(10):619-633.
- Marcovecchio ML et al. The INNODIA Type 1 Diabetes Natural History Study: a European cohort of newly diagnosed children, adolescents and adults. Diabetologia. 2024;67(6):995-1008.
- Hummel S et al. Children diagnosed with presymptomatic type 1 diabetes through public health screening have milder diabetes at clinical manifestation. Diabetologia. 2023;66(9):1633-1642.
- Ziegler AG et al. Seroconversion to multiple islet autoantibodies and risk of progression to diabetes in children. Jama. 2013;309(23):2473-2479.
- Marcus BA et al. Typ-1-Diabetes: Früherkennung und Ansätze zur Prävention. Der Diabetologe. 2020;16(7):654-661.
- Gitelman SE et al. beta-Cell Glucose Sensitivity to Assess Changes in beta-Cell Function in Recent-Onset Stage 3 Type 1 Diabetes. Diabetes. 2023;72(9):1289-1296.
- Wang YN et al. The role of B cells in the pathogenesis of type 1 diabetes. Front Immunol. 2024;15:1450366.
- Kawasaki E. Anti-Islet Autoantibodies in Type 1 Diabetes. Int J Mol Sci. 2023;24(12).
- Breakthrough T1D. Early detection: How type 1 diabetes screening can change lives, unter: https://breakthrought1d.org.uk/resources/early-detection-how-type-1-diabetes-screening-can-change-lives/, zuletzt abgerufen am 20.08.2025.
- Moore DJ et al. Recommendations for Screening and Monitoring the Stages of Type 1 Diabetes in the Immune Therapy Era. Int J Gen Med. 2024;17:3003-3014.
MAT-DE-2503726-1.0-09/2025