- Articolo
- Fonte: Campus Sanofi
- 17 apr 2025
Quali esami possono aiutare a diagnosticare e monitorare i pazienti con BPCO?

La diagnosi di BPCO è sospettata quando un paziente presenta sintomi di dispnea, tosse cronica o produzione di espettorato. Gli indicatori clinici chiave che aumentano la probabilità di una diagnosi di BPCO sono la dispnea progressiva e persistente, il peggioramento con l'esercizio fisico, il respiro sibilante ricorrente, la tosse cronica, le infezioni ricorrenti delle basse vie respiratorie e una storia di fattori di rischio. Tuttavia, per stabilire la diagnosi di BPCO è necessaria la spirometria.1
La BPCO deve essere diagnosticata accuratamente per una gestione ottimale. Pertanto, le diagnosi differenziali, come l'asma, l'insufficienza cardiaca congestizia, le bronchiectasie, la tubercolosi, la bronchiolite obliterante e la panbronchiolite diffusa, devono essere prese in considerazione per fare una chiara distinzione dalla BPCO.1 In alcuni pazienti è difficile distinguere l'asma dalla BPCO con le attuali modalità di imaging o con i test fisiologici.1
Dopo aver stabilito la diagnosi di BPCO, è necessaria un'ulteriore valutazione per guidare il trattamento. Gli obiettivi della valutazione iniziale della BPCO sono la determinazione della gravità dell'ostruzione al flusso aereo, l'impatto della malattia sullo stato di salute del paziente e il rischio di eventi futuri.1
Esistono diversi strumenti per il monitoraggio della BPCO.
Spirometria
La spirometria è uno degli strumenti utili per il test di funzionalità polmonare per la BPCO.2 È facilmente disponibile, non invasivo, riproducibile e oggettivo.1 Nelle fasi iniziali della BPCO, quando i sintomi respiratori possono essere assenti, la spirometria può aiutare a identificare la BPCO.1
Variabili chiave associate alla spirometria
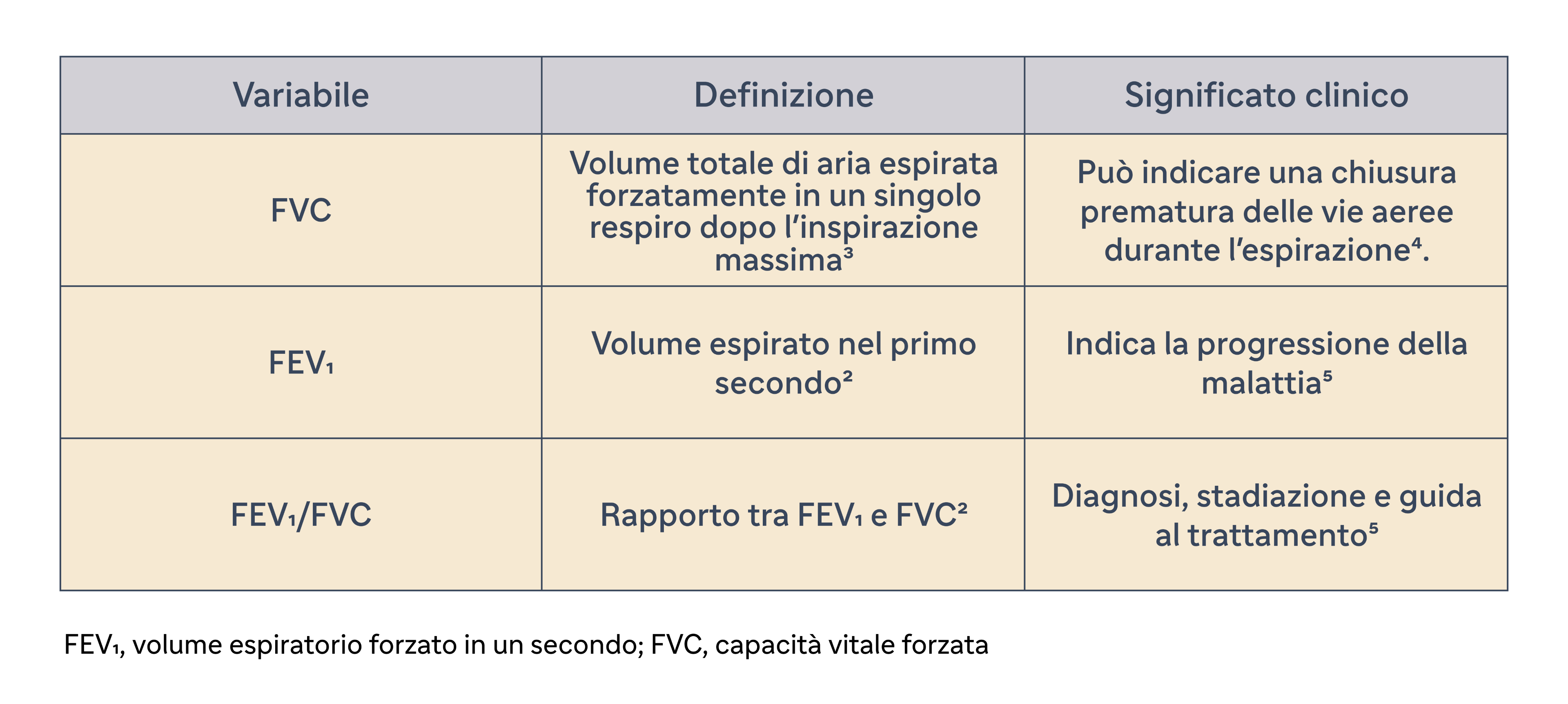
La valutazione della funzione polmonare mediante spirometria, in particolare il FEV1 post-broncodilatatore, svolge un ruolo importante nel determinare la gravità della BPCO e nel guidare il trattamento.5 Possibili protocolli per la misurazione del FEV1 post-broncodilatatore sono 10-15 minuti dopo la somministrazione per via inalatoria di un beta2-adrenergico a breve durata d'azione.2-(dose: 400 mcg) o 30-45 minuti dopo un anticolinergico a breve durata d'azione (dose: 160 mcg) o una combinazione di entrambe le classi di farmaci.1 Un calo del FEV1 nel tempo è indicativo della progressione della malattia.5
Gradi GOLD e gravità dell'ostruzione al flusso aereo nella BPCO (in base al FEV1 post-broncodilatatore)1

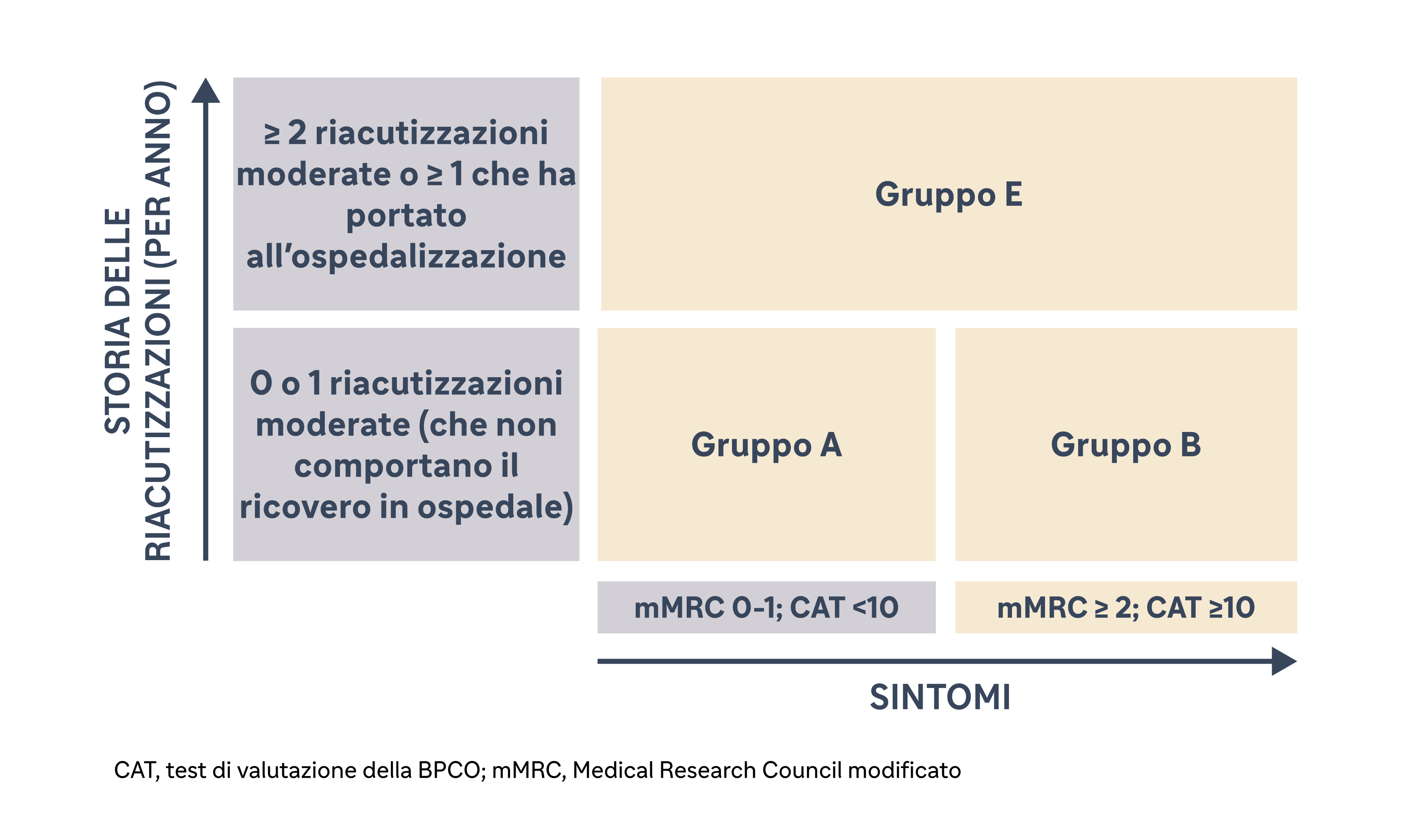
È stato proposto lo strumento di valutazione GOLD ABE, che combina la gravità delle riacutizzazioni e dei sintomi, per guidare il trattamento farmacologico. Il livello dei sintomi è valutato in base alla scala di dispnea Medical Research Council modificato, (mMRC) o al test di valutazione della BPCO (CAT™).
Diversi gradi di gravità della malattia sulla base dello strumento di valutazione GOLD ABE1
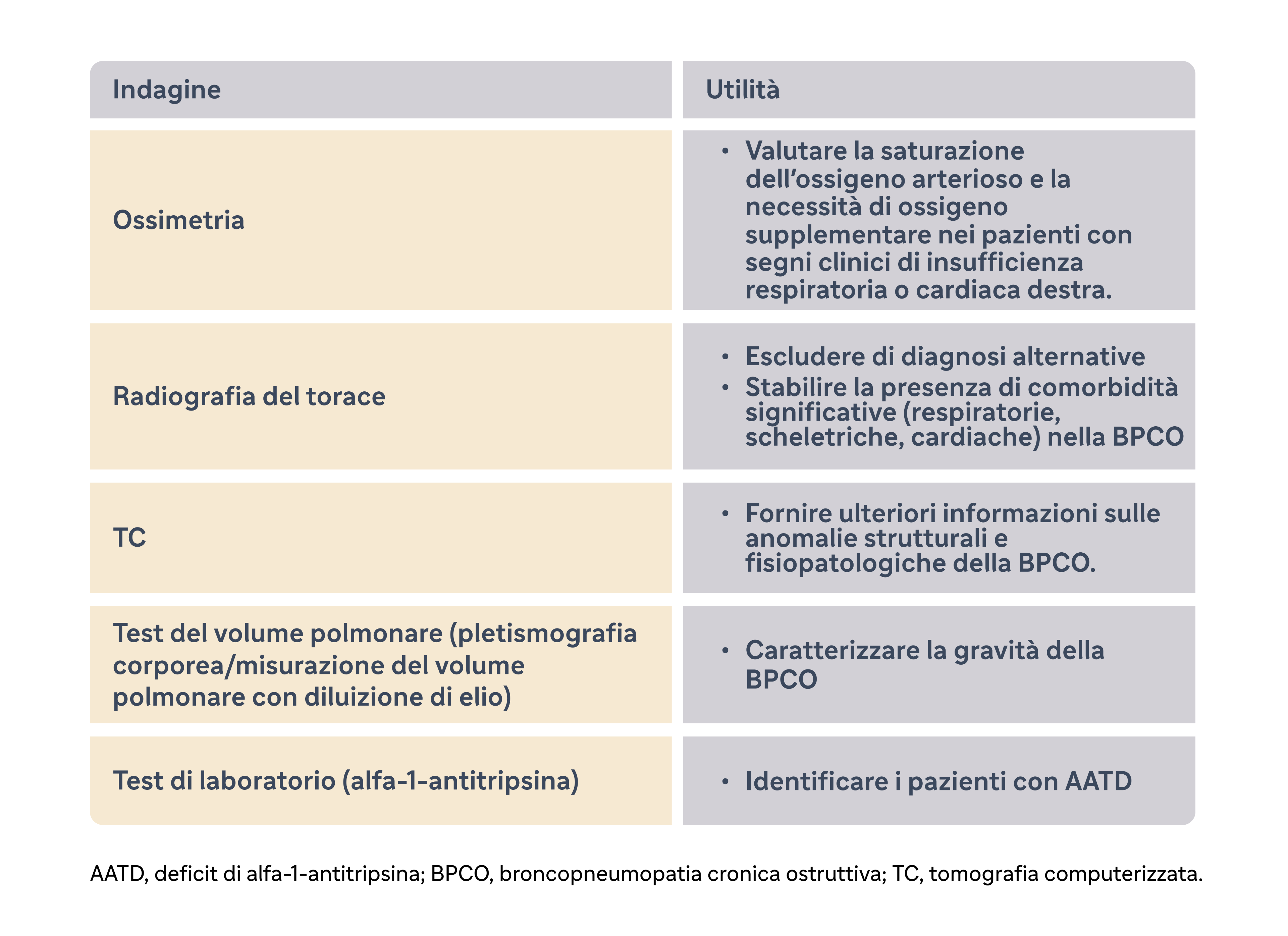
Valutazioni cliniche aggiuntive1
In pazienti specifici possono essere necessarie altre valutazioni cliniche per caratterizzare la gravità, guidare la gestione della malattia, fare una diagnosi differenziale e identificare comorbidità o altre anomalie sottostanti.1
Valutazione dei sintomi mediante questionari validati
La BPCO ha un impatto sulla vita dei pazienti che va oltre la dispnea.1 La gravità dell'ostruzione al flusso aereo è debolmente correlata alla gravità dei sintomi e alla compromissione dello stato di salute.1Pertanto, le variazioni del FEV1 non sono in grado di cogliere l'impatto della BPCO sulla salute del paziente nella sua interezza.7,8 I brevi questionari incentrati sul paziente sono gli strumenti più efficaci e accurati per valutare la gravità dei sintomi, la limitazione nelle attività della vita quotidiana e la qualità della vita correlata alla salute (HRQoL).6
L'implementazione di questionari rapidi e facili da usare nella pratica clinica di routine può consentire ai medici di comprendere appieno la HRQoL dei loro pazienti e, migliorare la prescrizione di un trattamento appropriato e di un monitoraggio efficace della BPCO.7,8
La scala di dispnea del Medical Research Council modificato(mMRC)
La dispnea è una misura soggettiva; mostra una scarsa associazione con la valutazione oggettiva della funzione polmonare, della capacità di esercizio e di altri risultati.5 La scala di dispnea mMRC è un questionario semplice da somministrare, che valuta la gravità della dispnea classificando il suo impatto sulle attività quotidiane su una scala da 0 a 4.6 I pazienti devono selezionare, su una scala autoapplicata, una delle cinque affermazioni che descrivono più fedelmente per loro le attività quotidiane o le situazioni che provocano la dispnea e il livello di compromissione.5,8
Test di valutazione della BPCO (COPD Assessment Test, CAT™)
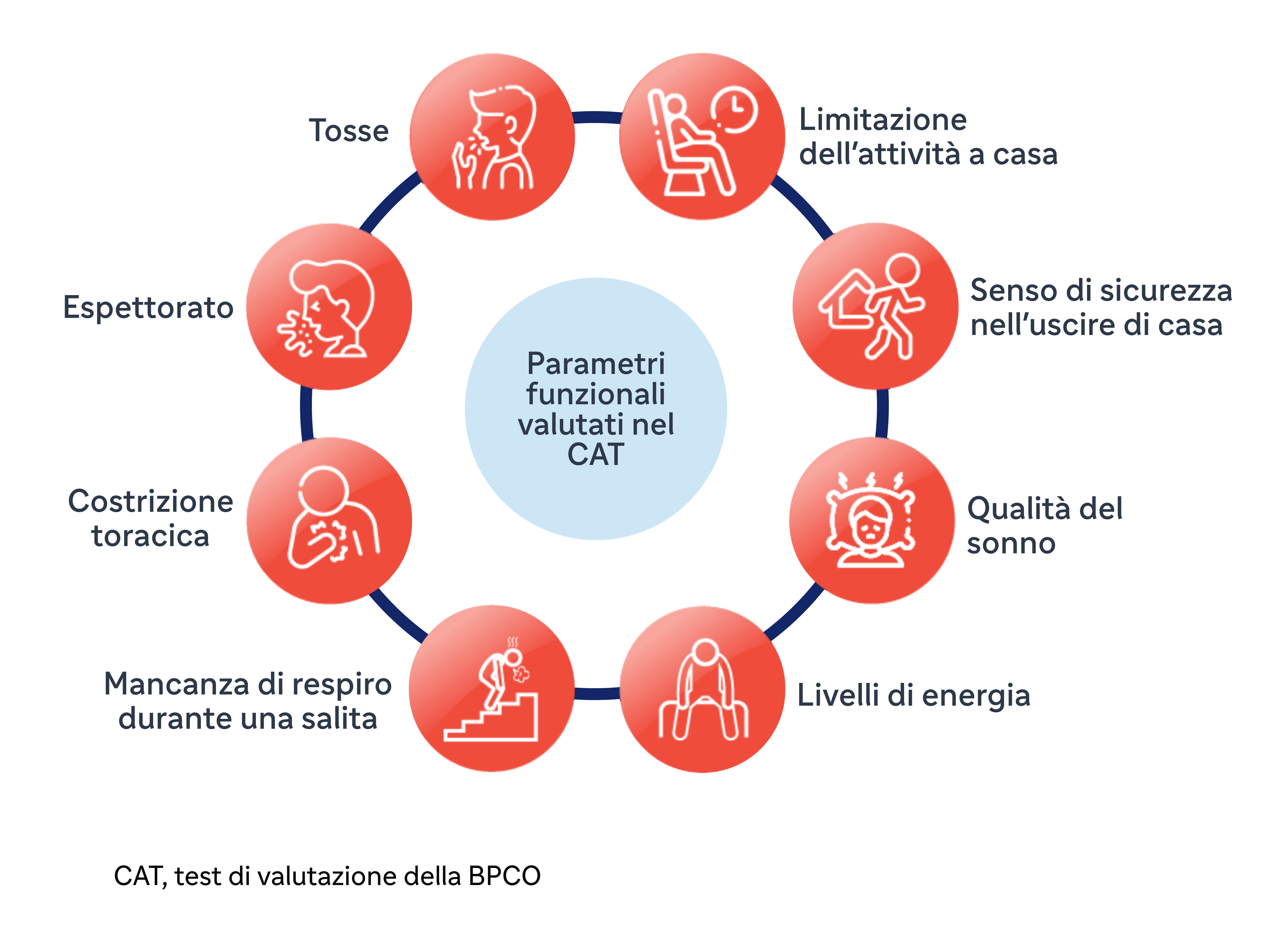
Per l'uso di routine nella pratica clinica, il CAT è un questionario breve, affidabile, validato, pratico e semplice, incentrato sul paziente, che può quantificare l'impatto della BPCO sulla salute del paziente.6,7 Le voci della CAT sono ampie e riguardano diversi aspetti della BPCO in relazione alla salute del paziente.7 Il CAT assegna un punteggio a 8 voci su una scala da 1 a 5 con un punteggio totale massimo di 40.
Leggi la Guida all'uso e FAQ del CAT per HCP per saperne di più sul test di valutazione della BPCO
Parametri funzionali valutati con il CAT™1,8
Conta degli eosinofili nel sangue
Nello studio ECLIPSE, il 37,4% dei pazienti con BPCO presentava un aumento persistente della conta degli eosinofili nel sangue (≥2%) nell'arco di 3 anni.9 Se non influenzata dall'uso di corticosteroidi per via inalatoria (ICS), la conta degli eosinofili nel sangue ha un ruolo potenziale come biomarcatore prognostico del declino della funzione polmonare.1

La conta degli eosinofili nel sangue può servire come marcatore surrogato degli eosinofili nell'espettorato per guidare il trattamento con corticosteroidi orali delle riacutizzazioni della BPCO.9 Può aiutare a identificare i pazienti adatti all'aggiunta di ICS alla terapia broncodilatatrice regolare, consentendo l'uso di corticosteroidi in modo più personalizzato.1
Sapete Come la conta degli eosinofili nel sangue può aiutare a guidare il trattamento?
Test di fisiologia polmonare
In caso di divario sostanziale tra i sintomi percepiti e la gravità dell'ostruzione al flusso aereo, è necessaria una migliore comprensione della fisiologia polmonare, che può richiedere ulteriori valutazioni.1 Pertanto, nei pazienti con sintomi persistenti dopo il trattamento iniziale, si può prendere in considerazione un'ulteriore valutazione clinica, compresa la misurazione dei volumi polmonari, la capacità di diffusione, il test da sforzo e/o l'imaging polmonare. 1
Bibliografia
- Global Initiative for Chronic Obstructive Lung Disease. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease (2025 report).]. https://goldcopd.org/wp-content/uploads/2024/11/GOLD-2025-Report-v1.0-15Nov2024_WMV.pdf
- Lamb K, Theodore D, Bhutta BS. Spirometry. StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024.
- Yawn BP. Differential assessment and management of asthma vs chronic obstructive pulmonary disease. Medscape J Med 2009;11:20.
- David S and Edwards CW. Forced Expiratory Volume. StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024.
- Glaab T, Vogelmeier C, and Buhl R. Outcome measures in chronic obstructive pulmonary disease (COPD): strengths and limitations. Respir Res. 2010;11(1):79.
- Vogelmeier CF, Roman-Rodríguez M, Singh D, et al. Goals of COPD treatment: Focus on symptoms and exacerbations. Respir Med. 2020;166:105938.
- COPD assessment test. User guide. Expert guidance on frequently asked question. Available at: https://www.catestonline.org/content/dam/global/catestonline/documents/CAT_HCP%20User%20Guide.pdf . Last accessed: August 14, 2024
- van der Molen T, Miravitlles M, and Kocks JWH. COPD management: role of symptom assessment in routine clinical practice. Int J Chron Obstruct Pulmon Dis. 2013;8:461-71.
- Singh D, Kolsum U, Brightling CE, Locantore N, Agusti A, Tal-Singer R; ECLIPSE investigators. Eosinophilic inflammation in COPD: prevalence and clinical characteristics. Eur Respir J. 2014;44(6):1697-700.
- Yun JH, Lamb A, Chase R, et al. Blood eosinophil count thresholds and exacerbations in patients with chronic obstructive pulmonary disease. J Allergy Clin Immunol. 2018;141(6):2037–2047.
- Bélanger M, Couillard S, Courteau J et al. Eosinophil counts in first COPD hospitalizations: a comparison of health service utilization. Int J Chron Obstruct Pulmon Dis. 2018;13:3045–3054.
- Vedel-Krogh S, Nielsen SF, Lange P et al. Blood Eosinophils and Exacerbations in Chronic Obstructive Pulmonary Disease. The Copenhagen General Population Study. Am J Respir Crit Care Med. 2016; 193:965–974.
MAT-IT-2501039