- Articolo
- Fonte: Campus Sanofi
- 24 set 2024
L'impatto delle riacutizzazioni nella BPCO


È stato dimostrato che il rischio di riacutizzazione della BPCO aumenta dopo ogni riacutizzazione.2,a
Il rischio di riacutizzazione aumenta dopo ogni riacutizzazione 1
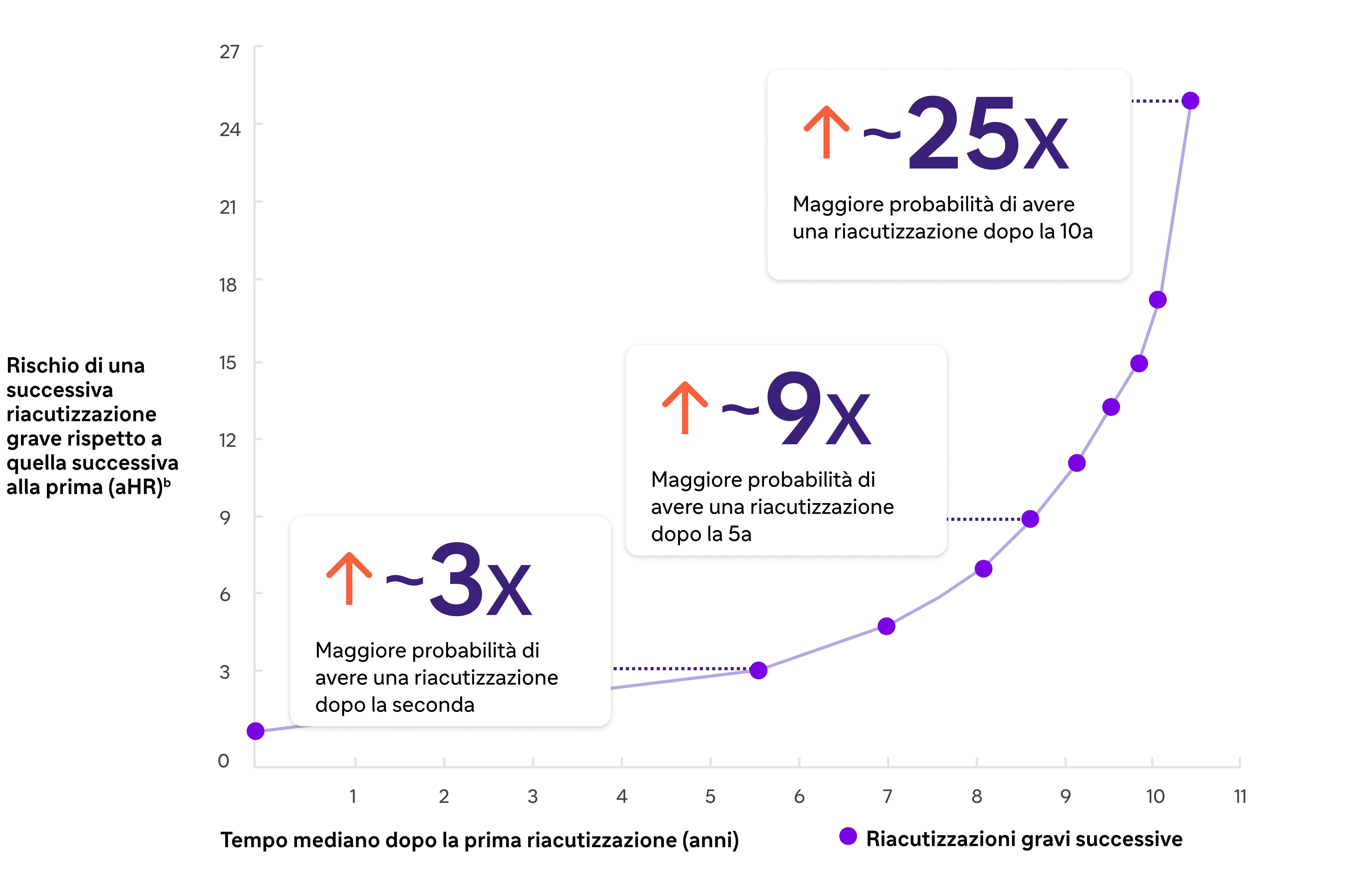
*Sono state definite riacutizzazioni gravi quelle che hanno comportato il ricovero in ospedale con une diagnosi primaria di BPCO2
Nonostante la triplice terapia inalatoria, l'attuale standard di cura, molti pazienti rimangono sintomatici, definiti da sintomi persistenti e riacutizzazioni.

Ascoltate il professore Nicola Hanania: "La prevenzione delle riacutizzazioni è l'obiettivo principale".
2:07 minuti
Nicola Hanania è professore di medicina, direttore del reparto di terapia critica polmonare e medicina del sonno presso l'ospedale Ben Taub di Houston, Texas, e direttore del Centro di ricerca clinica sulle vie aeree, ACRC, presso il Bear College of Medicine.
Ascoltate l'intero episodio del podcast suSito web EMJ
Sponsorizzato da Sanofi e Regeneron, in collaborazione con EMJ.
La BPCO purtroppo è una malattia cronica, come suggerisce il nome ed è una malattia progressiva. Anche se non possiamo curarla, possiamo gestirla, possiamo trattarla. Sfortunatamente, ci sono diversi eventi nel decorso della malattia che peggiorano la situazione, non solo per il paziente ma per il sistema sanitario: aumentano il rischio di ospedalizzazione, mortalità... E uno di questi sono le riacutizzazioni. Io le chiamo « attacchi polmonari ». Tendenzialmente quello che succede con le riacutizzazioni è che questi pazienti che hanno sintomi quotidiani, iniziano ad avere maggiori sintomi, possono avere più tosse, aumentare la produzione di espettorato. A volte queste riacutizzazioni sono guidate dalle infezioni – la maggior parte delle volte in realtà – e finiscono per aver bisogno di sempre più trattamenti inclusi antibiotici, steroidi. E a volte purtroppo questo può finire per spingere il paziente a recarsi al pronto soccorso o a farsi ricoverare in ospedale. Sfortunatamente, le riacutizzazioni non comportano solo il fatto che si verificano e dobbiamo trattarle, ma che ogni volta che il paziente subisce una riacutizzazione, la sua funzionalità polmonare diminuisce.
Effettivamente, ora sono disponibili buoni dati che dimostrano come le riacutizzazioni ripetute possano contribuire ad aumentare il rischio di peggioramento ulteriore delle riacutizzazioni, peggiorano la funzione polmonare nel lungo periodo e non consentono il recupero della funzione polmonare. Quindi, ogni volta che si verifica una riacutizzazione, diminuisce sia la funzione polmonare che la qualità della vita. Esistono sicuramente dati validi per dimostrare che le riacutizzazioni ripetute sono collegate ad un aumento della mortalità e così via. Ecco perché uno degli obiettivi principali nella gestione di questa malattia è cercare di prevenire il verificarsi di questi "attacchi polmonari". La prevenzione delle riacutizzazioni è l’obiettivo chiave nella gestione di questa malattia. Naturalmente le riacutizzazioni tendono ad essere più frequenti nei pazienti con malattia più grave, ma in alcune situazioni possono verificarsi anche nella BPCO moderata.
BPCO : Le riacutizzazioni possono portare ad un declino accelerato della funzione polmonare.3,e

-
La perdita di funzionalità polmonare è quasi raddoppiata3
-
Il declino irreversibile della funzione polmonare può verificarsi dopo una sola riacutizzazione della BPCO.3
aBasato sui dati di un'ampia coorte basata sulla popolazione di 73.106 pazienti canadesi (età media 75 anni) che sono stati ricoverati per la prima volta a causa di una grave esacerbazione della BPCO (1990-2005, seguiti fino alla morte o al 31 marzo 2007).2
bCorretto per età, sesso, tempo di calendario e punteggio di malattia cronica modificato.2
cOppure raddoppiare la terapia inalatoria se l'ICS è controindicato.15
dStudio di fase 3, randomizzato, in doppio cieco, della durata di 52 settimane, che ha valutato l'efficacia e la sicurezza della triplice terapia fluticasone furoato/umeclidinio/vilanterolo rispetto a fluticasone furoato/vilanterolo o umeclidinio/vilanterolo in pazienti di età ≥40 anni con BPCO sintomatica e una storia di esacerbazioni.2
edeclino del FEV1 dopo una singola esacerbazione moderata-grave. Basato su un'analisi retrospettiva dei dati di 586 pazienti con BPCO moderata-grave.5
aHR, hazard ratio aggiustato; COPD, broncopneumopatia cronica ostruttiva; FEV1, volume espiratorio forzato in 1 secondo; QoL, qualità della vita
Bibliografia
1. Halpin DMG, Dransfield MT, Han MK, et al. The effect of exacerbation history on outcomes in the IMPACT trial. Eur Respir J. 2020;55:1901921. doi:10.1183/13993003.01921-2019
2. Suissa S, Dell’Anniello S, Ernst P. Long-term natural history of chronic obstructive pulmonary disease: severe exacerbations and mortality. Thorax. 2012;67(11):957-963.
3. Halpin DMG, Decramer M, Celli BR, Mueller A, Metzdorf N, Tashkin DP. Effect of a single exacerbation on decline in lung function in COPD. Respir Med. 2017;128:85-91.
4. Cosio Piqueras MG, Cosio MG. Disease of the airways in chronic obstructive pulmonary disease. Eur Respir J. 2001;18(suppl 34):41s-49s.
5. Tajti G, Gesztelyi R, Pak K, et al. Positive correlation of airway resistance and serum asymmetric dimethylarginine level in COPD patients with systemic markers of low-grade inflammation. Int J Chron Obstruct Pulmon Dis. 2017;12:873-884.
6. Higham A, Quinn AM, Cançado JED, Singh D. The pathology of small airways disease in COPD: historical aspects and future directions. Respir Res. 2019;20(1):49. doi:10.1186/s12931-019-1017-y
7. O’Donnell DE, Parker CM. COPD exacerbations. 3: Pathophysiology. Thorax. 200661(4):354-361.
8. Calverley PMA. Respiratory failure in chronic obstructive pulmonary disease. Eur Respir J. 2003;22:26s-30s.
9. Roussos C, Koutsoukou A. Respiratory failure. Eur Respir J. 2003;22(suppl 47):3s-14s.
10. Aghapour M, Raee P, Moghaddam SJ, Hiemstra PS, Heijink IH. Airway epithelial barrier dysfunction in chronic obstructive pulmonary disease: role of cigarette smoke exposure. Am J Respir Cell Mol Biol. 2018;58(2):157-169.
11. Brightling CE, Saha S, Hollins F. Interleukin-13: prospects for new treatment. Clin Exp Allergy. 2010;40(1):42-49.
12. Barberà JA, Peinado VI, Santos S. Pulmonary hypertension in chronic obstructive pulmonary disease. Eur Respir J. 2003;21(5):892-905.
13. Global Initiative for Chronic Obstructive Lung Disease. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease (2024 report). Accessed [February 9, 2024]. https://goldcopd.org/2024-gold-report-2/
14. Jones PW. St George’s Respiratory Questionnaire: MCID. COPD. 2005 Mar;2(1):75-79.
15. Jones P. St George’s Respiratory Questionnaire Manual. [Version 2.4, March 2022]. Accessed [February 9, 2024]. https://www.sgul.ac.uk/research/research-operations/research-administration/st-georges-respiratory-questionnaire/docs/SGRQ-Manual-March-2022.pdf
16. Evidera website. EXACT and E-RS:COPD content. Accessed [February 9, 2024]. https://www.evidera.com/what-we-do/patient-centered-research/coa-instrument-management-services/exact-program/ exact-content/
17. Leidy NK, Bushnell DM, Thach C, Hache C, Gutzwiller FS. Interpreting Evaluating Respiratory Symptoms in COPD diary scores in clinical trials: terminology, methods, and recommendations. Chronic Obstr Pulm Dis. 2022;9(4):576-590.
18. Oshagbemi OA, Franssen FME, van Kraaij S, et al. Blood eosinophil counts, withdrawal of inhaled corticosteroids and risk of COPD exacerbations and mortality in the clinical practice research datalink (CPRD). COPD. 2019;16(2):152-159.
19. Casanova C, Celli BR, de-Torres JP, et al. Prevalence of persistent blood eosinophilia: relation to outcomes in patients with COPD. Eur Respir J. 2017;50:1701162. doi:10.1183/13993003.01162-2017
20. Singh D, Kolsum U, Brightling CE, Locantore N, Agusti A, Tal-Singer R; ECLIPSE investigators. Eosinophilic inflammation in COPD: prevalence and clinical characteristics. Eur Respir J. 2014;44(6):1697-1700.
21. Bafadhel M, McKenna S, Terry S, et al. Acute exacerbations of chronic obstructive pulmonary disease: identification of biologic clusters and their biomarkers. Am J Respir Crit Care Med. 2011;184(6):662-671.
22. Oshagbemi OA, Burden AM, Braeken DCW, et al. Stability of blood eosinophils in patients with chronic obstructive pulmonary disease and in control subjects, and the impact of sex, age, smoking, and baseline counts. Am J Respir Crit Care Med. 2017;195(10):1402-1404.
23. Yun JH, Lamb A, Chase R, et al; COPDGene and ECLIPSE Investigators. Blood eosinophil count thresholds and exacerbations in patients with chronic obstructive pulmonary disease. J Allergy Clin Immunol. 2018;141(6):2037-2047.e10. doi:10.1016/j.jaci.2018.04.010
24. Bélanger M, Couillard S, Courteau J, et al. Eosinophil counts in first COPD hospitalizations: a comparison of health service utilization. Int J Chron Obstruct Pulmon Dis. 2018;13:3045-3054.
25. Fritzsching B, Zhou-Suckow Z, Trojanek JB, et al. Hypoxic epithelial necrosis triggers neutrophilic inflammation via IL-1 receptor signaling in cystic fibrosis lung disease. Am J Respir Crit Care Med. 2015;191(8):902-913.
26. Vedel-Krogh S, Nielsen SF, Lange P, Vestbo J, Nordestgaard BG. Blood eosinophils and exacerbations in chronic obstructive pulmonary disease. The Copenhagen General Population Study. Am J Respir Crit Care Med. 2016;193(9):965-974.
27. George L, Taylor AR, Esteve- Codina A, et al; U-BIOPRED and the EvA study teams. Blood eosinophil count and airway epithelial transcriptome relationships in COPD versus asthma. Allergy. 2020;75(2):370-380.
28. Yousuf A, Ibrahim W, Greening NJ, Brightling CE. T2 biologics for chronic obstructive pulmonary disease. J Allergy Clin Immunol Pract. 2019;7(5):1406-1416.
29. Barnes PJ. Inflammatory endotypes in COPD. Allergy. 2019;74(7):1249-1256.
30. Oishi K, Matsunaga K, Shirai T, Hirai K, Gon Y. Role of type 2 inflammatory biomarkers in chronic obstructive pulmonary disease. J Clin Med. 2020;9(8):2670. doi:10.3390/jcm9082670
31. Gabryelska A, Kuna P, Antczak A, Białasiewicz P, Panek M. IL-33 mediated inflammation in chronic respiratory diseases—understanding the role of the member of IL-1 superfamily. Front Immunol. 2019;10:692. doi:10.3389/fimmu.2019.00692
32. Allinne J, Scott G, Lim WK, et al. IL-33 blockade affects mediators of persistence and exacerbation in a model of chronic airway inflammation. J Allergy Clin Immunol. 2019;144(6):1624-1637.e10.
33. Calderon AA, Dimond C, Choy DF, et al. Targeting interleukin-33 and thymic stromal lymphopoietin pathways for novel pulmonary therapeutics in asthma and COPD. Eur Respir Rev. 2023;32(167):220144. doi:10.1183/16000617.0144-2022
34. Gandhi NA, Bennett BL, Graham NMH, Pirozzi G, Stahl N, Yancopoulos D. Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov. 2016;15(1):35-50.
35. Rosenberg HF, Phipps S, Foster PS. Eosinophil trafficking in allergy and asthma. J Allergy Clin Immunol. 2007;119(6):1303-1310.
36. Doyle AD, Mukherjee M, LeSuer WE, et al. Eosinophil-derived IL-13 promotes emphysema. Eur Respir J. 2019;53(5):1801291. doi:10.1183/13993003.01291-2018
37. Barnes PJ. Inflammatory mechanisms in patients with chronic obstructive pulmonary disease. J Allergy Clin Immunol. 2016;138(1):16-27.
38. Defrance T, Carayon P, Billian G, et al. Interleukin 13 is a B cell stimulating factor. J Exp Med. 1994;179(1):135-143.
39. Yanagihara Y, Ikizawa K, Kajiwara K, Koshio T, Basaki Y, Akiyama K. Functional significance of IL-4 receptor on B cells in IL-4– induced human IgE production. J Allergy Clin Immunol. 1995;96(6 pt 2):1145-1151.
40. Gandhi NA, Pirozzi G, Graham NMH. Commonality of the IL-4/IL-13 pathway in atopic diseases. Expert Rev Clin Immunol. 2017;13(5):425-437.
41. Kaur D, Hollins F, Woodman L, et al. Mast cells express IL-13Rα1: IL-13 promotes human lung mast cell proliferation and FcεRI expression. Allergy. 2006;61(9):1047-1053.
42. Saatian B, Rezaee F, Desando S, et al. Interleukin-4 and interleukin-13 cause barrier dysfunction in human epithelial cells. Tissue Barriers. 2013;1(2):e24333. doi:10.4161/tisb.24333
43. Zheng T, Zhu Z, Wang Z, et al. Inducible targeting of IL-13 to the adult lung causes matrix metalloproteinase– and cathepsin-dependent emphysema. J Clin Invest. 2000;106(9):1081-1093.
44. Garudadri S, Woodruff PG. Targeting chronic obstructive pulmonary disease phenotypes, endotypes, and biomarkers. Ann Am Thorac Soc. 2018;15(suppl 4):S234-S238.
45. Alevy YG, Patel AC, Romero AG, et al. IL-13–induced airway mucus production is attenuated by MAPK13 inhibition. J Clin Invest. 2012;122(12):4555-4568.
46. Singanayagam A, Footitt J, Marczynski M, et al. Airway mucins promote immunopathology in virus-exacerbated chronic obstructive pulmonary disease. J Clin Invest. 2022;132(8):e12901. doi:10.1172/JCI120901
47. Zhu Z, Homer RJ, Wang Z, et al. Pulmonary expression of interleukin-13 causes inflammation, mucus hypersecretion, subepithelial fibrosis, physiologic abnormalities, and eotaxin production. J Clin Invest. 1999;103(6):779-788.
48. Cooper PR, Poll CT, Barnes PJ, Sturton RG. Involvement of IL-13 in tobacco smoke-induced changes in the structure and function of rat intrapulmonary airways. Am J Respir Cell Mol Biol. 2010;43(2):220-226.
49. Arora S, Dev K, Agarwal B, Das P, Syed MA. Macrophages: their role, activation, and polarization in pulmonary diseases. Immunobiology. 2018;223(4-5):383-396.
50. He S, Xie L, Lu J, Sun S. Characteristics and potential role of M2 macrophages in COPD. Int J Chron Obstruct Pulmon Dis. 2017;12:3029-3039.
51. Wang X, Xu C, Ji J, et al. IL-4/IL-13 upregulates Sonic hedgehog expression to induce allergic airway epithelial remodeling. Am J Physiol Lung Cell Mol Physiol. 2020;318(5):L888-L899.
52. Linden D, Guo-Parke H, Coyle PV, et al. Respiratory viral infection: a potential “missing link” in the pathogenesis of COPD. Eur Respir Rev. 2019;28(151):180063. doi:10.1183/16000617.0063-2018
53. Wang Z, Bafadhel M, Haldar K, et al. Lung microbiome dynamics in COPD exacerbations. Eur Respir J. 2016;47(4):1082-1092.
Codice deposito aziendale: MAT-IT-2402483