- Articolo
- Fonte: Campus Sanofi
- 23 mag 2025
Implicazioni dei livelli ematici degli eosinofili nella BPCO
Questo articolo descrive la stabilità e il valore predittivo dei livelli di eosinofili nel sangue nella BPCO, evidenziando il loro forte legame con il rischio di riacutizzazione. Livelli di eosinofili elevati possono guidare nella scelta di un trattamento personalizzato, compreso l'uso precoce di corticosteroidi per via inalatoria (ICS). L'integrazione della misurazione degli eosinofili nella pratica clinica di routine può aiutare a migliorare la gestione della malattia a lungo termine e gli outcome dei pazienti con BPCO.
Gli eosinofili nel sangue hanno un ruolo nella BPCO?
Nella BPCO, livelli elevati di eosinofili nel sangue (EOS) sono indicativi della presenza di infiammazione di tipo 21 e sono stati collegati a un rischio maggiore di riacutizzazioni.2 Comprendere il ruolo dei livelli di EOS e la loro evoluzione nel tempo può essere fondamentale per i clinici al fine di endofenotipizzare i loro pazienti e valutare accuratamente il rischio di riacutizzazione.3
Tuttavia, nella valutazione dei livelli di EOS nei pazienti con BPCO, è consigliabile una valutazione dei dati passati in quanto i livelli degli EOS possono fluttuare a causa del trattamento.4
Per saperne di più consultate l'articolo Ruolo dell'infiammazione di tipo 2 nella BPCO
Endotipo dell'infiammazione eosinofila
L'infiammazione eosinofila è un endotipo stabile. Lo studio AERIS ha analizzato la stabilità di questo fenotipo nel tempo: i risultati hanno dimostrato che una conta degli EOS nel sangue ≥2% è comune durante le riacutizzazioni in quei pazienti che presentano EOS prevalentemente elevati durante lo stato stabile.5 La probabilità che una riacutizzazione fosse eosinofila era nove volte più alta nei pazienti con infiammazione di tipo 2, caratterizzata da EOS ematici ≥2%, rispetto a quelli con EOS ematici <2% all'arruolamento (OR = 9,16; 95% CI: 4,10-20.47;P<0.001).5 Al contrario, invece, livelli elevati di eosinofili nel sangue, rilevati durante un ricovero per riacutizzazione grave di BPCO, hanno una bassa accuratezza nel prevedere, sia a breve che a lungo termine, il rischio di mortalità e di riammissione ospedaliera, come osservato nella metanalisi di Para et al., che ha analizzato 14 studi con oltre 23.000 pazienti.6 Gli autori concludono che la misurazione di routine degli eosinofili nel sangue durante le riacutizzazioni acute potrebbe non essere giustificata per scopi prognostici.6
Cosa si sa della stabilità del livello degli EOS?
Stabilità temporale dei livelli degli EOS
Il concetto di stabilità temporale si riferisce alla consistenza di un biomarcatore nel tempo.7 In uno studio di Baraldi et al., si è osservato che una parte dei pazienti BPCO presenta una conta eosinofilica costantemente elevata, mentre una frazione è caratterizzata da una fluttuazione importante nei livelli.8 Lo studio ha incluso 100 pazienti, che sono stati sottoposti a 4 visite annuali, durante le quali sono stati raccolti dati demografici, spirometria, questionari sulla qualità della vita e campioni di sangue. È stato utilizzato un valore soglia di 300 cellule/μL di eosinofili nel sangue per classificare i pazienti in tre gruppi: persistente (almeno tre visite con valori alti), intermittente (una o due visite con valori alti) e mai (nessuna visita con valori alti). I risultati mostrano che il 18% dei pazienti ha una conta di eosinofili nel sangue persistentemente elevato, mentre il 29% fluttua tra alto e basso, sottolineando l'importanza di misurazioni ripetute degli eosinofili, poiché una singola misurazione potrebbe non identificare correttamente fino al 29% dei pazienti con EOS elevati.8
Associazione tra i livelli di EOS e il rischio di riacutizzazione futura9,10
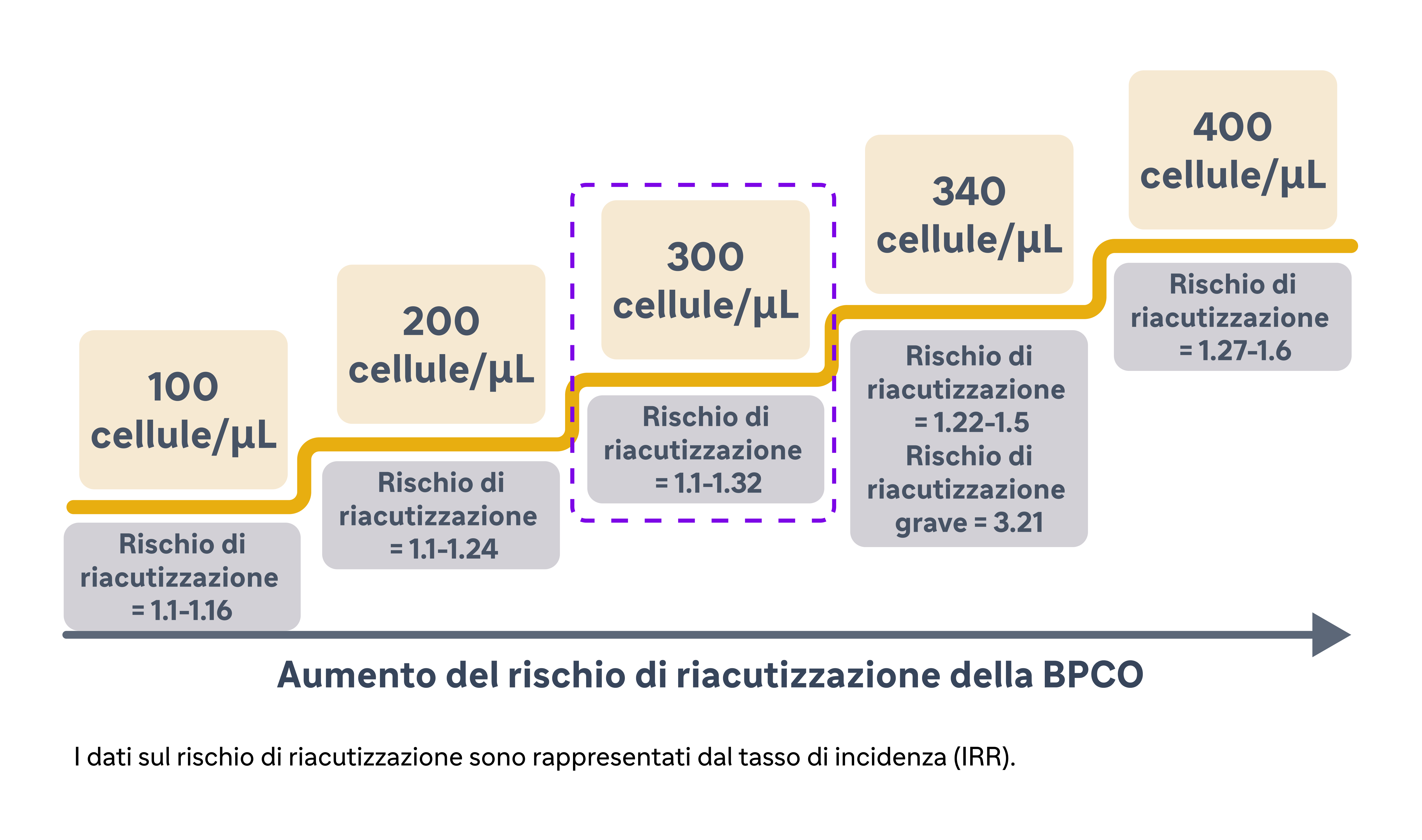
Yun et al. hanno determinato l'associazione tra l'aumento dei livelli di EOS e le riacutizzazioni nella BPCO nel COPDGene, correlazione poi convalidata in modo prospettico nello studio ECLIPSE.9 In questo studio, i ricercatori hanno misurato i livelli di EOS durante la fase stabile e hanno seguito la comparsa di riacutizzazioni per un periodo di 3 anni.9 Hanno riscontrato che l'aumento del livello di EOS (≥300 cellule/μL) al basale durante la fase stabile era un predittore consistente del rischio di riacutizzazioni nell'anno successivo (IRR = 1,20; 95% CI: 1,05-1,36 a 1 anno).9 In particolare, il rischio di riacutizzazioni era più elevato nei pazienti con livelli di EOS persistentemente elevati (rispetto a quelli bassi), indicando che questi pazienti presentavano un rischio maggiore. Inoltre, lo studio ha rivelato che la capacità predittiva dei livelli di EOS si estendeva oltre l'anno (IRR = 1,22; 95% IC: 1,06-1,42 per l'intero periodo di studio).9 I pazienti con livelli elevati di EOS avevano costantemente una maggiore probabilità di riacutizzazione nell'arco di 3 anni. Questa capacità predittiva estesa sottolinea l'utilità del livello di EOS come predittore a lungo termine del rischio di riacutizzazione, consentendo strategie di gestione precoci e proattive.9

Impatto dell'uso di corticosteroidi orali sui livelli ematici di EOS nei pazienti con BPCO
Una relazione lineare inversa tra i livelli di EOS nel sangue e la dose di corticosteroidi orali (OCS) è stata osservata da Prazma et al. in pazienti con asma grave, con un aumento dei livelli di EOS nel sangue del 41% per ogni diminuzione di 5 mg/die della dose di OCS.11 A nostra conoscenza, l'impatto dell'uso di OCS sui livelli ematici di EOS non è stato studiato nei pazienti con BPCO. Tuttavia, è noto che l'uso di OCS sopprime i livelli di EOS nei pazienti con BPCO.12 Uno studio ha riportato una riduzione significativa della conta degli EOS nell'espettorato di sei volte, dopo l'uso quotidiano di OCS per 2 settimane.13 È importante tenere in considerazione la terapia somministrata ai pazienti, in quanto la misurazione dei livelli di EOS in pazienti, i cui livelli sono soppressi a causa della somministrazione di OCS, potrebbe fornire una valutazione imprecisa dei livelli di EOS.12
Per saperne di più consultate l'articolo Eosinofili nel sangue come biomarcatore nei pazienti con BPCO
Quali sono le implicazioni cliniche della capacità predittiva dei livelli circolanti di EOS?
Le prove a sostegno della capacità di previsione a lungo termine9 dei livelli di EOS nella BPCO ha implicazioni cliniche significative. Identificando i pazienti con livelli di EOS elevati, gli operatori sanitari possono stratificare i pazienti in base al rischio di future riacutizzazioni. Questa stratificazione può guidare le decisioni terapeutiche, in particolare l'uso di OCS,14 ICS15 o dei biologici16 che agiscono sull'infiammazione di tipo 2. Infatti, un paziente con BPCO che presenta livelli di EOS elevati (>300 cellule/μL) durante la fase stabile può essere un candidato ideale per un intervento precoce con ICS,15che ha dimostrato di ridurre la frequenza e la gravità delle riacutizzazioni.17,18 Al contrario, l'assenza di un aumento dei livelli di EOS nel sangue >2% può aiutare a identificare un sottogruppo in cui l’OCS potrebbe avere un impatto negativo sul recupero.14
Per ulteriori indicazioni su come gestire i pazienti affetti da BPCO, consultate l'articolo Raccomandazioni GOLD per il trattamento e la gestione della BPCO

La capacità predittiva a lungo termine dei livelli di EOS nel sangue9 è particolarmente utile, in quanto consente agli operatori sanitari di anticipare e ridurre il rischio di riacutizzazione, che sono uno dei principali fattori di morbilità e di costi sanitari nella BPCO.14,19,20
In che modo la valutazione degli EOS può essere inserita nella pratica clinica?
L'integrazione della valutazione degli EOS nella gestione routinaria della BPCO richiede un'attenta considerazione delle soglie dei dati e del contesto clinico specifico. La soglia di ≥300 cellule/μL è comunemente utilizzata per definire livelli elevati di EOS9 sulla base delle evidenze di diversi studi, tra cui quello di Yun et al.9 Tuttavia, esiste una certa variabilità nella soglia ottimale a seconda della popolazione di pazienti e degli esiti specifici da prevedere.21
Nella pratica clinica, la misurazione dei livelli di EOS durante la fase stabile della BPCO può essere facilmente integrata negli esami del sangue di routine.22 Data l'evidenza della potenziale fluttuazione temporale, una singola misurazione che attesta livelli bassi di EOS non definisce l’assenza di fenotipo con infiammazione di tipo 2 nel paziente; anzi, ripetute misurazioni allo stato stabile possono aiutare a identificare soggetti a rischio maggiore di riacutizzazione.8 I pazienti con livelli elevati di EOS devono essere monitorati attentamente per individuare eventuali segni di riacutizzazione23 e si dovrebbe prendere in considerazione l'inizio precoce dell'ICS.1 Attualmente sono in corso diversi studi clinici per valutare il ruolo di terapie che agiscono sull'infiammazione di tipo 2 nella BPCO con livelli elevati di EOS, e un biologico tra questi ha già avuto l’approvazione da FDA e EMA ed è inserito nell’algoritmo terapeutico del report GOLD 2025.24,25
Inoltre, la capacità predittiva dei livelli di EOS significa che queste misurazioni possono informare le strategie di gestione a lungo termine. Ad esempio, i pazienti con elevati livelli al basale di EOS possono richiedere un follow-up più frequente e una soglia più bassa per l'intensificazione del trattamento in caso di segni precoci di riacutizzazione. Questo approccio proattivo può contribuire a ridurre la frequenza e la gravità delle riacutizzazioni, migliorando in ultima analisi i risultati per i pazienti e riducendo l'onere per i sistemi sanitari.22
Sfide e direzioni future
Sebbene le prove a sostegno dell'uso dei livelli di EOS come biomarcatore nella BPCO siano convincenti, rimangono diverse sfide. Una di queste è la variabilità dei livelli di EOS, sia per cause intrinseche all'organismo, sia per influenze esterne come infezioni,26 farmaci21 ed esposizioni ambientali.27 Questi fattori possono influenzare i livelli di EOS e potenzialmente confondere il loro valore predittivo. Pertanto, è essenziale che i medici interpretino le misurazioni degli EOS nel contesto del quadro clinico generale del paziente e prendano in considerazione la possibilità di ripetere le misurazioni, se necessario.
Un'altra sfida è la necessità di ulteriori ricerche per affinare le soglie dei livelli di EOS in diversi scenari clinici. Sebbene la soglia ≥300 cellule/μL sia ampiamente utilizzata, sono necessari ulteriori dati per stabilire i punti di cut-off ottimali per le diverse popolazioni di pazienti e per convalidare queste soglie in diversi contesti clinici.23
La ricerca futura dovrebbe anche esplorare la possibilità di combinare i livelli di EOS con altri biomarcatori e caratteristiche cliniche per migliorare l'accuratezza predittiva. Ad esempio, integrare le misurazioni di EOS con marcatori dell'infiammazione delle vie aeree, 28 o con caratteristiche cliniche come l'anamnesi di riacutizzazioni,29potrebbe fornire uno strumento di valutazione del rischio più completo per i pazienti affetti da BPCO.
Bibliografia
- Singh D. Blood eosinophil counts in chronic obstructive pulmonary disease: a biomarker of inhaled corticosteroid effects. Tuber Respir Dis (Seoul). 2020;83(3):185–194. Doi: 10.4046/trd.2020.0026. PMID: 32578413.
- Komura M, Sato T, Suzuki Y, Yoshikawa H, Nitta NA, Hayashi M, Kawasaki E, Horikoshi K, Nishioki T, Mori M, Kodama Y, Sasaki S, Takahashi K. Blood Eosinophil Count as a Predictive Biomarker of Chronic Obstructive Pulmonary Disease Exacerbation in a Real-World Setting. Can Respir J. 2023 May 25;2023:3302405. doi: 10.1155/2023/3302405. PMID: 37275320; PMCID: PMC10234729.
- David B, Bafadhel M, Koenderman L, De Soyza A. Eosinophilic inflammation in COPD: from an inflammatory marker to a treatable trait. Thorax. 2021 Feb;76(2):188-195. doi: 10.1136/thoraxjnl-2020-215167. Epub 2020 Oct 29. PMID: 33122447; PMCID: PMC7815887.
- Sivapalan P, Bikov A, Jensen JU. Using Blood Eosinophil Count as a Biomarker to Guide Corticosteroid Treatment for Chronic Obstructive Pulmonary Disease. Diagnostics (Basel). 2021 Feb 3;11(2):236. doi: 10.3390/diagnostics11020236. PMID: 33546498; PMCID: PMC7913607.
- Kim VL, Coombs NA, Staples KJ, Ostridge KK, Williams NP, Wootton SA, Devaster JM, Aris E, Clarke SC, Tuck AC, Bourne SC. Impact and associations of eosinophilic inflammation in COPD: analysis of the AERIS cohort. Eur Respir. 2017;50(4). doi: 10.1183/13993003.00853-2017. PMID: 29025891.
- Para O, Cassataro G, Fantoni C, Bertù L, Tieri C, Caruso L, Rotunno S, Dentali F. Prognostic role of blood eosinophils in acute exacerbations of chronic obstructive pulmonary disease: systematic review and meta-analysis. Monaldi Arch Chest Dis. 2025. doi: 10.4081/monaldi.2025.3298. PMID: 40152975.
- Walsh CP, Lindsay EK, Grosse P, Natale BN, Fairlie S, Bwint A, Schaff er L, McMahon K, Del Duke C, Forse J, Lamonja-Vicente N. A systematic review and meta-analysis of the stability of peripheral immune markers in healthy adults. Brain Behav Immun.2023;107:32–46. doi: 10.1016/j.bbi.2022.09.011. PMID: 36152782.
- Baraldi F, Bartlett-Pestle S, Allinson JP, Macleod M, Mah J, Bloom C, Brady-Green A, Marion A, Papi A, Wedzicha JA, Finney LJ. Blood Eosinophil Count Stability in COPD and the Eosinophilic Exacerbator Phenotype. Am J Respir Crit Care Med. 2025. doi: 10.1164/rccm.202407-1287RL. PMID: 39813681.
- Yun JH, Lamb A, Chase R, Singh D, Parker MM, Saferali A, Vestbo J, Tal-Singer R, Castaldi PJ, Silverman EK, Hersh CP. Blood eosinophil count thresholds and exacerbations in patients with chronic obstructive pulmonary disease. J Allergy Clin Immunol.2018;141(6):2037–2047. doi: 10.1016/j.jaci.2018.04.010. PMID: 29709670.
- Vedel-Krogh S, Nielsen SF, Lange P, Vestbo J, Nordestgaard BG. Blood eosinophils and exacerbations in chronic obstructive pulmonary disease. The Copenhagen General Population Study. Am J Respir Crit Care Med.2016 May 1;193(9):965–74. doi: 10.1164/rccm.201509-1869OC. PMID: 26641631.
- Prazma CM, Bel EH, Price RG, Bradford ES, Albers FC, Yancey SW. Oral corticosteroid dose changes and impact on peripheral blood eosinophil counts in patients with severe eosinophilic asthma: a post hoc analysis. Respir Res. 2019 May 3;20(1):83. doi: 10.1186/s12931-019-1056-4. PMID: 31053134; PMCID: PMC6499981.
- Mathioudakis AG, Bikov A, Foden P, Lahousse L, Brusselle G, Singh D, Vestbo J. Change in blood eosinophils following treatment with inhaled corticosteroids may predict long-term clinical response in COPD. Eur Respir J. 2020 May 27;55(5):1902119. doi: 10.1183/13993003.02119-2019. PMID: 32108044.
- Brightling CE, Monteiro W, Ward R, Parker D, Morgan MD, Wardlaw AJ, Pavord ID. Sputum eosinophilia and short-term response to prednisolone in chronic obstructive pulmonary disease: a randomised controlled trial. Lancet. 2000 Oct 28;356(9240):1480-5. doi: 10.1016/S0140-6736(00)02872-5. PMID: 11081531.
- Bafadhel M, McKenna S, Terry S, Mistry V, Pancholi M, Venge P, Lomas DA, Barer MR, Johnston SL, Pavord ID, Brightling CE. Blood eosinophils to direct corticosteroid treatment of exacerbations of chronic obstructive pulmonary disease: a randomized placebo-controlled trial. Am J Respir Crit Care Med.2012;186(1):48–55. doi: 0.1164/rccm.201108-1553OC. PMID: 22447964.
- Lea S, Higham A, Beech A, Singh D. How inhaled corticosteroids target inflammation in COPD. Eur Respir Rev.2023;32(170). doi: 10.1183/16000617.0084–2023. PMID: 37852657.
- Ohnishi H, Eitoku M, Yokoyama A. A systematic review and integrated analysis of biologics that target Type 2 inflammation to treat COPD with increased peripheral blood eosinophils. Heliyon. 2022;8(6). doi: 10.1016/j.heliyon.2022.e09736. PMID: 35756113.
- Quint JK, Ariel A, Barnes PJ. Rational use of inhaled corticosteroids for the treatment of COPD. NPJ Prim Care Respir Med. 2023;33(1):27. doi: 10.1038/s41533-023-00347-6. PMID: 37488104.
- Mkorombindo T, Dransfield MT. Inhaled corticosteroids in chronic obstructive pulmonary disease: benefits and risks. Clin Chest Med. 2020;41(3):475–484. doi: 10.1016/j.ccm.2020.05.006. PMID: 32800200.
- Ritchie AI, Wedzicha JA. Definition, causes, pathogenesis, and consequences of chronic obstructive pulmonary disease exacerbations. Clin Chest Med.2020;41(3):421–438. doi: 10.1016/j.ccm.2020.06.007. PMID: 32800196.
- Bafadhel M, Davies L, Calverley PM, Aaron SD, Brightling CE, Pavord ID. Blood eosinophil guided prednisolone therapy for exacerbations of COPD: a further analysis. Eur Respir. 2014;44(3):789–91. doi: 10.1183/09031936.00062614. PMID: 24925917.
- Benson VS, Hartl S, Barnes N, Galwey N, Van Dyke MK, Kwon N. Blood eosinophil counts in the general population and airways disease: a comprehensive review and meta-analysis. Eur Respir J. 2022;59(1). doi: 10.1183/09031936.00062614. PMID: 24925917.
- Bartziokas K, Gogali A, Kostikas K. The role of blood eosinophils in the management of COPD: an attempt to answer the important clinical questions. COPD. 2021;18(6):690–699. doi: 10.1080/15412555.2021.1985989. PMID: 34657541.
- Oliver B, Tonga K, Darley D, Rutting S, Zhang X, Chen H, Wang G. COPD treatment choices based on blood eosinophils: are we there yet?. Breathe (Sheff). 2019;15(4):318–323. doi: 10.1183/20734735.0254-2019. PMID: 31803266.
- Rabe KF, Rennard S, Martinez FJ, Celli BR, Singh D, Papi A, Bafadhel M, Heble J, Radwan A, Soler X, Jacob Nara JA. Targeting type 2 inflammation and epithelial alarmins in chronic obstructive pulmonary disease: a biologics outlook. Am J Respir Crit Care Me. 2023 Aug 15;208(4):395–405. doi: 10.1164/rccm.202303-0455CI. PMID: 37348121.
- Global Initiative for Chronic Obstructive Lung Disease. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease (2025 report).]. goldcopd.org/wp-content/uploads/2024/11/GOLD-2025-Report-v1.0-15Nov2024_WMV.pdf
- Roufosse F, Weller PF. Practical approach to the patient with hypereosinophilia. Allergy Clin Immunol.2010 Jul 1;126(1):39–44. doi: 10.1016/j.jaci.2010.04.011. PMID: 20538328.
- Chipps BE, Jarjour N, Calhoun WJ, Iqbal A, Haselkorn T, Yang M, Brumm J, Corren J, Holweg CT, Bafadhel M. A comprehensive analysis of the stability of blood eosinophil levels. Ann Am Thorac Soc. 2021;18(12):1978–1987. doi: 10.1513/AnnalsATS.202010-1249OC. PMID: 33891831.
- Oishi K, Matsunaga K, Shirai T, Hirai K, Gon Y. Role of Type2 Inflammatory Biomarkers in Chronic Obstructive Pulmonary Disease. J Clin Med. 2020 Aug 18;9(8):2670. doi: 10.3390/jcm9082670. PMID: 32824775; PMCID: PMC7464674.
- Haughney J, Lee AJ, Nath M, Müllerová H, Holmgren U, Nigris ED, Ding B. The long-term clinical impact of COPD exacerbations: a 3-year observational study (SHERLOCK). Ther Adv Respir Dis.2022;16:17534666211070139. doi: 10.1177/17534666211070139. PMID: 35156488.
MAT-IT-2501362