- Articolo
- Fonte: Campus Sanofi
- 12 mar 2025
Biomarcatori proteici nella malattia del trapianto contro l’ospite dopo trapianto allogenico di cellule staminali ematopoietiche

Questa recensione evidenzia l'applicazione approfondita della proteomica nella malattia da trapianto contro l'ospite (GVHD), sottolineando il suo ruolo nell'avanzamento della scoperta di biomarcatori attraverso biopsie minimamente invasive e l'analisi di profili proteici complessi.
I principali punti emersi includono:
- Fonti Primarie di Biomarcatori Proteici:
Tessuti e fluidi corporei, tra cui siero, plasma, saliva, urina e midollo osseo. - Biomarcatori Proteici per aGVHD:
- Biomarcatori Basati su Citochine:
Biomarcatori diagnostici: IL-7 (basato su siero), sIL-7, sIL-7R, IL-8 e IFN-γ (basati su plasma), IL-12 e IFN-γ (basati su monociti).
Biomarcatore prognostico: IL-8 (basato su siero). - Altri Biomarcatori Proteici Emergenti:
sST2, VEGF, TIM3 e MIF (fattore inibitorio della migrazione dei macrofagi). - Pannelli Proteici Salivari:
Livelli elevati di lattotransferrina, cistatina SN, albumina e amilasi salivare. - Pannelli Proteici Plasmatici:
Quattro marcatori diagnostici plasmatici (IL-2Rα, TNFR1, IL-8, HGF) identificati come potenziali indicatori dell'insorgenza di GVHD.
- Biomarcatori Basati su Citochine:
- Biomarcatori Proteici per cGVHD:
CXCL9, IL-10, fibronectina, CD29, sBAFF, CD13 (basati su plasma) e CXCL9 (basato su siero). - Importanza del Coinvolgimento Specifico per Sito:
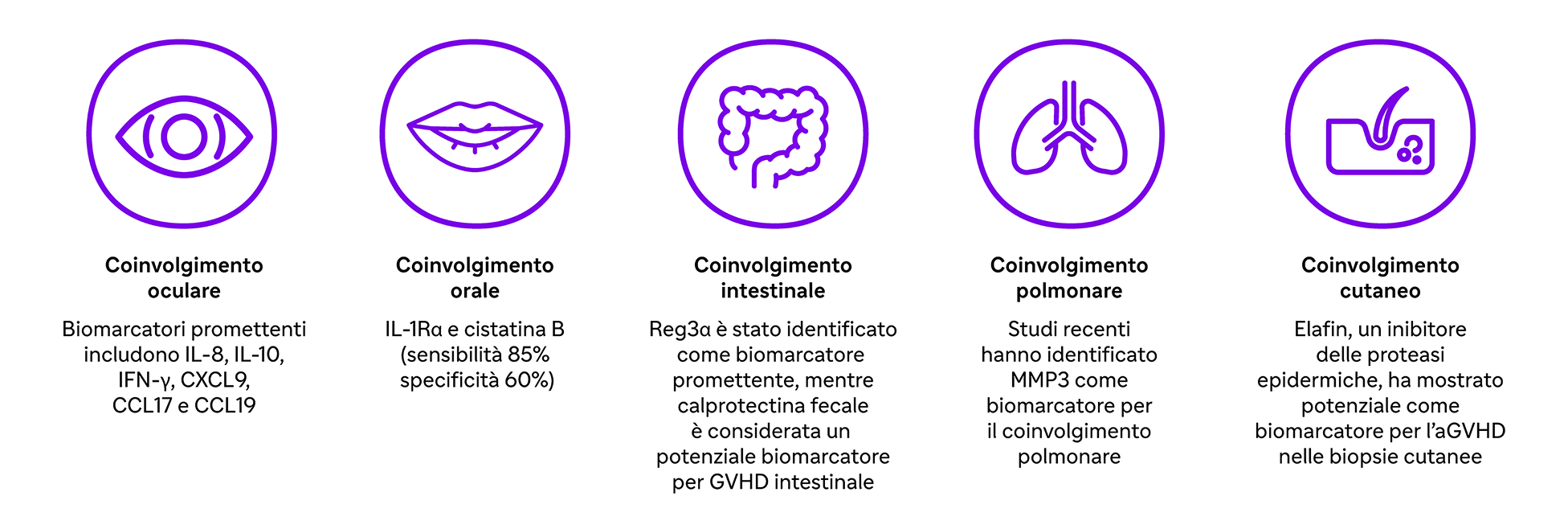
La GVHD può colpire pelle, tratto gastrointestinale, occhi e polmoni.- Occhi: Biomarcatori chiave includono IL-8, IL-10, IFN-γ, CXCL9, CCL17 e CCL19.
- Bocca: IL-1Rα e cistatina B (sensibilità 85%, specificità 60%).
- Intestino: Reg3α per il coinvolgimento intestinale.
- Polmoni: Studi recenti evidenziano MMP3 come biomarcatore per il coinvolgimento polmonare.
Perché è Importante

- Sfide nella Gestione della GVHD:
Una delle principali difficoltà nella gestione della GVHD riguarda:- L'identificazione tempestiva dei pazienti a rischio.
- La riduzione dell'uso di procedure diagnostiche invasive.
- L'intervento rapido ed efficace.
- Potenziale dei Biomarcatori:
- L'identificazione di biomarcatori affidabili potrebbe consentire una diagnosi più rapida e specifica per organo, facilitando trattamenti mirati.
- Gap Attuale: Attualmente, non esistono biomarcatori specifici validati per la GVHD, e la diagnosi clinica si basa spesso sull'analisi invasiva di campioni biologici.
- Obiettivo della Revisione:
Questa revisione ha esplorato i biomarcatori basati su proteine con l'obiettivo di migliorare l'accuratezza diagnostica e gli esiti terapeutici nella GVHD post-allo-HSCT.
Punti salienti principali
Proteomica nella scoperta di biomarcatori

- Ruolo delle proteine:
Le proteine sono fondamentali per comprendere le malattie e rappresentano obiettivi chiave per i farmaci. Sia le proteine di membrana che quelle solubili offrono un grande potenziale come biomarcatori:- Le proteine di membrana sono essenziali per segnalazione, trasporto e adesione, e le loro alterazioni riflettono lo stato della malattia.
- Le proteine solubili nei fluidi corporei offrono informazioni non invasive e in tempo reale come biomarcatori.
- Analisi del proteoma:
L'analisi del proteoma nei campioni biologici aiuta a identificare biomarcatori utilizzabili clinicamente. Le principali fonti di marcatori proteici includono tessuti, siero, plasma, saliva, urina e midollo osseo. - Biomarcatori proteici per aGVHD:
Le citochine sono state studiate come biomarcatori diagnostici e predittivi per il loro ruolo nell'infiammazione sistemica durante aGVHD.- Biomarcatori diagnostici:
- IL-7 (basato su siero), sIL-7, sIL-7R, IL-8 e IFN-γ (basati su plasma), IL-12 e IFN-γ (basati su monociti).
- Biomarcatori prognostici:
- IL-8 (basato su siero).
- Biomarcatori diagnostici:
- Altri biomarcatori proteici emergenti:
- sST2: Associato alla gravità dell’aGVHD, agisce come un decoy per IL-33, ma il suo rilascio può essere ritardato nella risposta infiammatoria.
- VEGF: Mostra un valore prognostico misto, con bassi livelli post-trapianto associati a un aumento della mortalità legata al trapianto.
- TIM3: I suoi livelli aumentano prima dell’insorgenza di aGVHD e correlano con la gravità della GVHD intestinale.
- MIF: I livelli di MIF (fattore inibitorio della migrazione dei macrofagi) aumentano nelle fasi acute di GVHD, suggerendo un ruolo nella risposta infiammatoria.
- Proteoma salivare nella GVHD:
Livelli elevati di lattotransferrina, cistatina SN, albumina e amilasi salivare sono stati rilevati in pazienti con GVHD e coinvolgimento della cavità orale. Anche le proteine della famiglia S100 giocano un ruolo nella diagnosi di aGVHD. - Marcatori diagnostici plasmatici:
Quattro marcatori (IL-2Rα, TNFR1, IL-8 e HGF) sono stati identificati come indicatori diagnostici della GVHD all’insorgenza dei sintomi clinici. - Biomarcatori proteici per cGVHD:
La cGVHD inizia tipicamente oltre i tre mesi post-trapianto e può persistere per tutta la vita. La ricerca ha identificato i seguenti biomarcatori:- Biomarcatori diagnostici:
CXCL9, IL-10, fibronectina, CD29 (basati su plasma) e CXCL9 (basato su siero). - Biomarcatori prognostici:
sBAFF, CD13 (basati su plasma).
- Biomarcatori diagnostici:
- Biomarcatori proteici per il coinvolgimento specifico dei siti nella GVHD:
Riferimento
Maria L, Cristina P, Alina U, Cristina M, Diana C, Mihnea Z, et al. Unlocking protein-based biomarker potential for graft-versus-host disease following allogenic hematopoietic stem cell transplants: Front. Immunol. 2024;15:1327035. doi: 10.3389/fimmu.2024.1327035. PMID: 38433830.
GVHD, Malattia del trapianto contro l’ospite; cGVHD, malattia cronica del trapianto contro l’ospite; aGVHD, Malattia acuta del trapianto contro l’ospite; allo-HSCT, trapianto allogenico di cellule staminali ematopoietiche; ELISA, Saggio di immunoassorbimento enzimatico PD-1, Inibitore della proteina 1 di morte cellulare programmata; CTLA4, Antigene 4 dei linfociti T citotossici; IL, Interleuchina; sIL-2R, recettore solubile dell’interleuchina-2; VEGF, fattore di crescita endoteliale vascolare; MIF, Fattore inibitorio della migrazione; SM, spettrometria di massa; IL-2Ra, Interleukin-2-receptor-alpha; TNFR1, Tumor-necrosis-factor-receptor-1; HGF, fattore di crescita degli epatociti; TIM3, Immunoglobulina a cellule T e dominio mucinico 3; MMP3, metalloproteinasi di matrice 3; SEN, sensibilità; SPE, specificità; CXCL9, ligando 9 della chemochina con motivo C-X-C.
MAT-IT-2403356 MAT-GLB-2406693