- Articolo
- Fonte: Campus Sanofi
- 5 apr 2024
Fisiopatologia dell'infiammazione di tipo 2

L’infiammazione di tipo 2 nell’asma grave
L’infiammazione di tipo 2 è una condizione patologica, caratterizzata dal rilascio di diverse citochine pro-infiammatorie, riscontrata nella maggior parte delle persone affette da asma grave1-3.
Si stima infatti che il 50-70% dei pazienti adulti e fino all’85% dei bambini tra i 6 e i 17 anni con asma grave presentino un’infiammazione di tipo 2, che può essere associata a sintomi debilitanti e peggioramento della qualità di vita2-4.
Comprendere i meccanismi fisiopatologici dell’infiammazione di tipo 2 è fondamentale per gestire nel modo più efficace la malattia e le sue manifestazioni cliniche nei pazienti adulti e pediatrici.
.png)
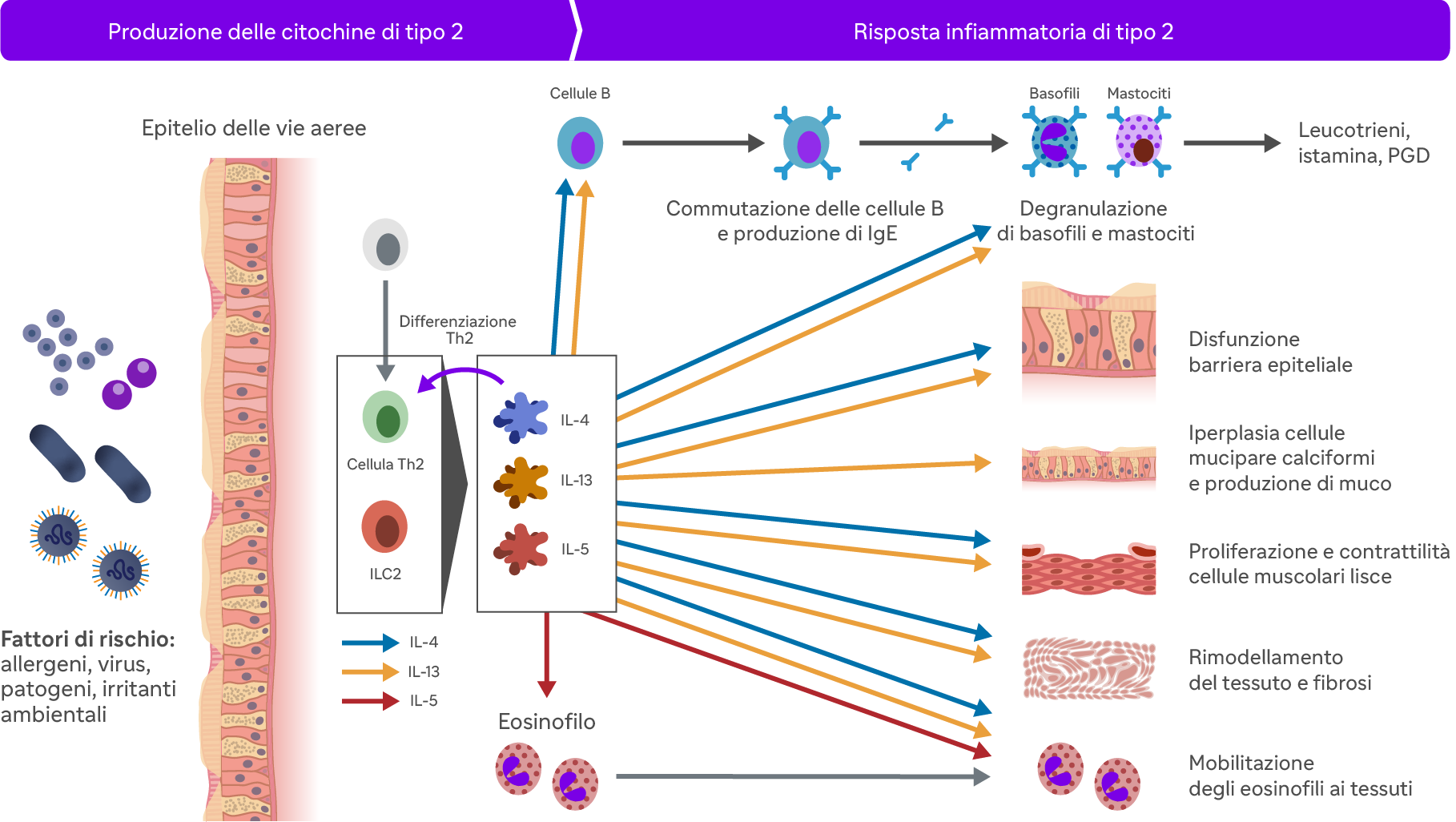
La cascata di eventi che caratterizza l’infiammazione di tipo 2 ha inizio quando allergeni, virus o batteri penetrano l’epitelio attivando una risposta immunitaria innata, attraverso l’azione delle ILC2, oppure adattiva, grazie alle cellule Th24.
Le ILC2 e le Th2 a loro volta stimolano la produzione di diverse interleuchine, in particolare l’IL-4, IL-13 e IL-5, che rivestono un ruolo cruciale nel determinare le manifestazioni cardine dell’infiammazione di tipo 2: produzione di IgE, aumento della produzione di ossido nitrico (FeNO) ed eosinofilia1-4.
IL-4, IL-13 e IL-5: citochine chiave e centrali
Il rilascio di IL-4 e IL-13 produce diversi effetti a livello fisiopatologico, tra cui1-4:
- iperplasia delle cellule mucipare caliciformi;
- proliferazione e contrattilità delle cellule muscolari lisce delle vie aeree;
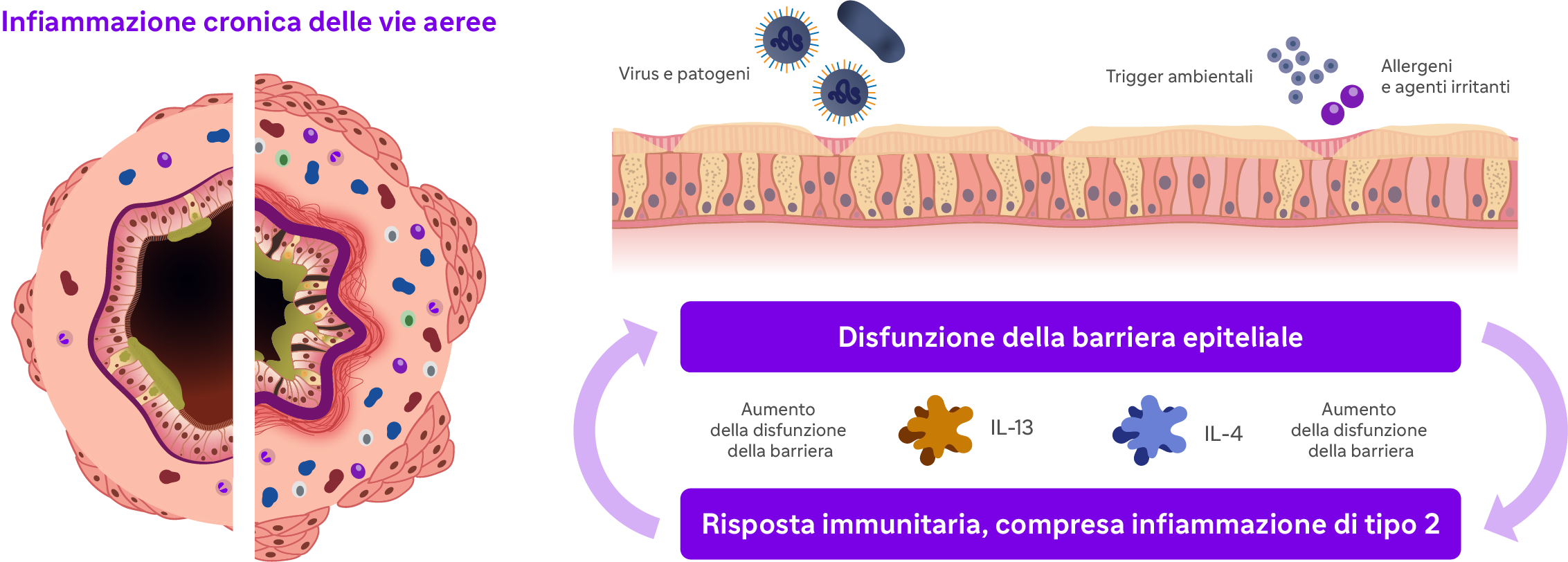
- disfunzione della barriera epiteliale;
- aumento della produzione di ossido nitrico, misurabile come FeNO nell’aria espirata.
Inoltre, IL-4 e IL-13 sono responsabili dello switch isotipico delle cellule B e della conseguente produzione di IgE, che a loro volta promuovono la degranulazione dei mastociti e dei basofili e lo sviluppo di reazioni allergiche nell’asma1-4.
La produzione di IL-4 e IL-13 è stata poi associata a cambiamenti strutturali della mucosa delle vie aeree (es. restringimento del calibro) che possono predisporre i pazienti con asma allo sviluppo di esacerbazioni e sensibilizzazione a sostanze trigger inalate, dando vita ad un circolo vizioso in cui infiammazione e rimodellamento del tessuto si alimentano reciprocamente4.
L’IL-5 promuove la maturazione, l’attivazione e la mobilitazione verso i tessuti degli eosinofili,1,4 il cui aumento nel sangue e nell’espettorato costituisce infatti uno dei biomarcatori di infiammazione di tipo 2 secondo il documento GINA6.
Il dottor Leonard Bacharier MD. presso il Vanderbilt University Medical Center, ci spiega il meccanismo dell'informazione di tipo 2 sulla compromissione polmonare.

Le conseguenze cliniche dell'infiammazione di tipo 2
La combinazione dei sopra citati effetti fisiopatologici del rilascio di IL-4, IL-13 e IL-5, dà origine alle conseguenze cliniche tipiche dell'asma con infiammazione di tipo 21-6:

- riacutizzazioni dell'asma;
- ostruzione delle vie aeree;
- respiro sibilante;
- produzione di muco;
- iperattività delle vie aeree
- costrizione toracica.
Tuttavia, questi sono solo alcuni dei possibili esiti clinici dell’infiammazione di tipo 2, in quanto lo stesso meccanismo fisiopatologico è alla base anche di altre malattie quali rinite allergica, esofagite eosinofila e dermatite atopica, che hanno un’alta probabilità di presentarsi in comorbidità nel paziente asmatico4.
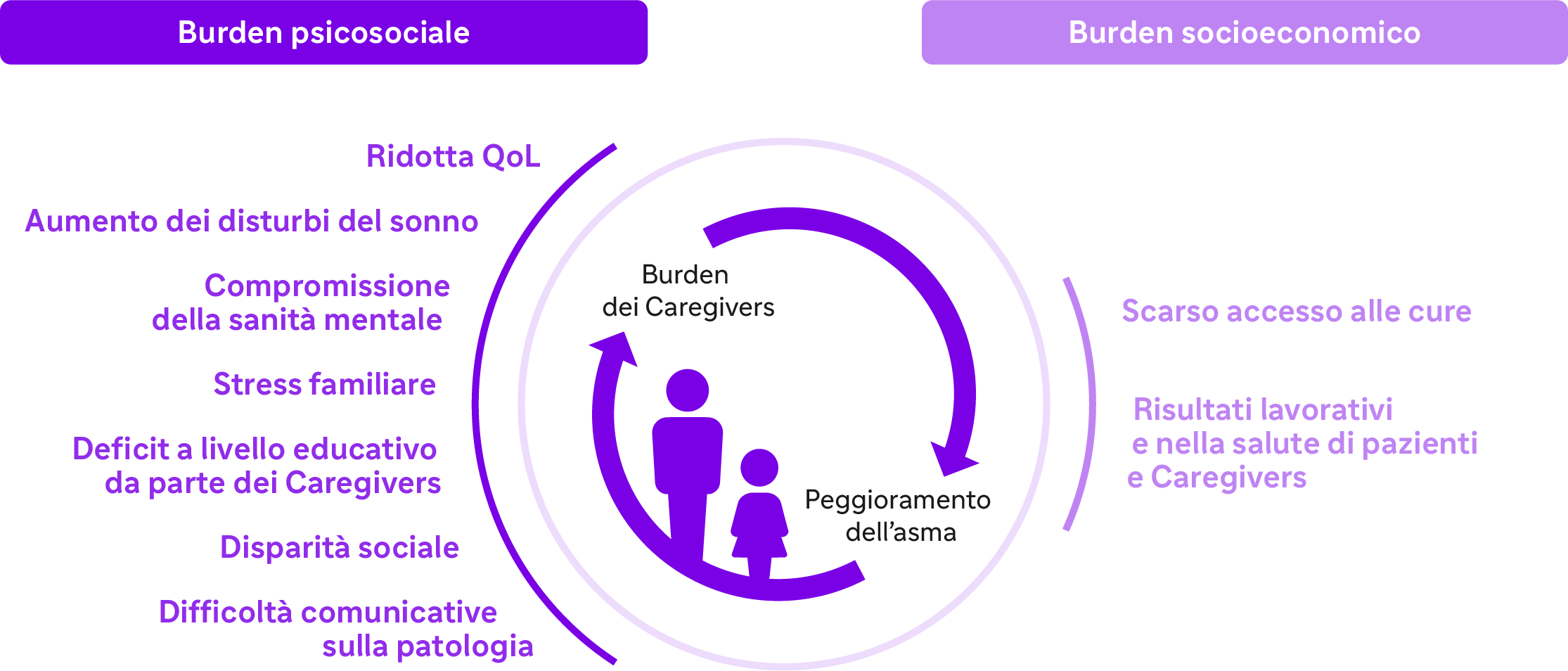
Il burden di malattia nei pazienti pediatrici
La compromissione della funzionalità polmonare impatta sulla gravità dell’asma7 e sul suo controllo.8 Questi fattori nei pazienti pediatrici influiscono sia sulla vita quotidiana dei pazienti pediatrici stessi che su quella dei loro caregiver sia dal punto di vista psicosociale (es. aumento dei disturbi del sonno, peggioramento della salute mentale, deficit educativi), che da quello socioeconomico (es. accesso difficoltoso alle cure, peggioramento delle condizioni di lavoro e salute).
.png)
L'infiammazione di tipo 2 nei pazienti asmatici: come identificarla
Come riconoscere la presenza di infiammazione di tipo 2 negli adulti e nei bambini

La compromissione della funzionalità polmonare nei pazienti pediatrici
Come valutare la funzionalità polmonare per la gestione e il controllo dell'asma
.png)
L'infiammazione di tipo 2 nei pazienti asmatici: come identificarla
Come riconoscere la presenza di infiammazione di tipo 2 negli adulti e nei bambini

La compromissione della funzionalità polmonare nei pazienti pediatrici
Come valutare la funzionalità polmonare per la gestione e il controllo dell'asma
Glossario
FeNO: ossido nitrico esalato
GINA: Global Initiative for Asthma
IgE: immunoglobuline
IL: interleuchina
ILC2: cellule linfoidi innate del gruppo 2
Th2: cellule T-helper di tipo 2

Bibliografia
- Gandhi NA, Bennett BL, Graham NM, Pirozzi G, Stahl N, Yancopoulos GD. Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov. 2016;15(1):35-50. doi:10.1038/nrd4624
- Price D, Menzies-Gow A, Bachert C, et al. Association Between a Type 2 Inflammatory Disease Burden Score and Outcomes Among Patients with Asthma. J Asthma Allergy. 2021;14:1173-1183. Published 2021 Sep 29. doi:10.2147/JAA.S321212
- Tran TN, Zeiger RS, Peters SP, et al. Overlap of atopic, eosinophilic, and TH2-high asthma phenotypes in a general population with current asthma. Ann Allergy Asthma Immunol. 2016;116(1):37-42. doi:10.1016/j.anai.2015.10.027
- Busse WW, Kraft M, Rabe KF, Deniz Y, Rowe PJ, Ruddy M, Castro M. Understanding the key issues in the treatment of uncontrolled persistent asthma with type 2 inflammation. Eur Respir J. 2021 Aug 5;58(2):2003393. doi: 10.1183/13993003.03393-2020.
- Israel E, Reddel HK. Severe and Difficult-to-Treat Asthma in Adults. N Engl J Med. 2017;377(10):965-976. doi:10.1056/NEJMra1608969
- Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, 2023. Disponibile all’indirizzo: www.ginasthma.org (ultimo accesso: marzo 2024).
- Altes TA, Mugler JP 3rd, Ruppert K, Tustison NJ, Gersbach J, Szentpetery S, Meyer CH, de Lange EE, Teague WG. Clinical correlates of lung ventilation defects in asthmatic children. J Allergy Clin Immunol. 2016 Mar;137(3):789-96.e7. doi: 10.1016/j.jaci.2015.08.045. Epub 2015 Oct 29. PMID: 26521043; PMCID: PMC6447058.
- Salviano LDDS, et al. Association between fraction of exhaled nitric oxide and spirometry data and clinical control of asthma in children and adolescents. Rev Paul Pediatr. 2018;36(1):8. Doi: https://doi.org/10.1590/1984-0462/;2018;36;1;00015
- Foronda CL, Kelley CN, Nadeau C, et al. Psychological and Socioeconomic Burdens Faced by Family Caregivers of Children With Asthma: An Integrative Review. J Pediatr Health Care. 2020;34(4):366-376. Doi:10.1016/j.pedhc.2020.02.003
- Easter G, Sharpe L, Hunt CJ. Systematic Review and Meta-Analysis of Anxious and Depressive Symptoms in Caregivers of Children With Asthma. J Pediatr Psychol. 2015;40(7):623-632. doi:10.1093/jpepsy/jsv012
- Waters, D. M., Olson, A. M., Fousheé, N., et al. Perceptions of stress, coping, and intervention preferences among caregivers of disadvantaged children with asthma. Journal of Child and Family Studies. 2017; 26, 1622-1634.
- Costa DD, Pitrez PM, Barroso NF, Roncada C. Asthma control in the quality of life levels of asthmatic patients' caregivers: a systematic review with meta-analysis and meta-regression. J Pediatr (Rio J). 2019;95(4):401-409. doi:10.1016/j.jped.2018.10.010
MAT-IT-2400975