- Articolo
- Fonte: Campus Sanofi
- 5 apr 2024
La compromissione della funzionalità polmonare nei pazienti pediatrici
.png)
La valutazione della funzionalità polmonare nel paziente pediatrico
La funzionalità polmonare viene utilizzata per valutare il livello di gravità delle malattie ostruttive polmonari, tra cui l’asma.1 Essa può non essere strettamente correlata ai sintomi asmatici2, ma ha comunque un ruolo fondamentale come fattore di previsione per il rischio di esacerbazioni2, ed è per questo correlata al grado di controllo della patologia3. L’importanza della sua valutazione nel contesto di un paziente asmatico è sottolineata anche dalle linee guida della Canadian Thoracic Society (CTS). 4
Il dottor Michael Blaiss, MD. presso il Medical College of Georgia, ci spiega il motivo per cui la valutazione della funzionalità polmonare è importante nei pazienti pediatrici
La spirometria è il test utilizzato per misurare la capacità di una persona di inspirare ed espirare aria in un determinato lasso di tempo.1 Tra i suoi principali risultati, il FEV1 (Forced expiratory volume in the first second) è un indicatore che misura il volume d'aria che un individuo può espirare in un secondo durante un respiro forzato, ed è utilizzato per la diagnosi e la valutazione della patologia asmatica.2 L’interpretazione dei valori di FEV1 è descritta dalle linee guida Gina:
- Nei pazienti con valori nella norma (FEV1 > 80% del valore medio previsto1) o vicini alla norma, in caso di sintomi respiratori frequenti, è utile considerare cause alternative all’asma, come disturbi cardiaci o tosse dovuta a scolo retronasale o malattia da reflusso gastroesofageo;
- Nei pazienti con risposta significativa a broncodilatatori (aumento di FEV1>12% e >200mL rispetto al valore base), l’asma potrebbe essere non controllato2.
Il FEV1 è un indicatore influenzato da diversi fattori, tra cui età, genere, caratteristiche fisiche (es. peso, altezza), ed etnia.1 Nel diagnosticare e valutare l’asma nei pazienti pediatrici, che presentano una crescita costante dei polmoni, un marker che considera i fattori sopra citati è il FEV1pp (Forced expiratory volume in the first second percent predicted). Considerando questo indicatore, il valore della misurazione spirometrica risulta normalizzato e più accurato per la valutazione della patologia.2,13 Come indicato dalle linee guida Gina, bassi valori di FEV1pp (FEV1 < 80% del valore medio previsto1) indicano:
- Indipendentemente dai sintomi, un paziente a rischio di esacerbazione, specialmente se il FEV1 è minore del 60% previsto14, 15, 16, 17;
- Il rischio di declino futuro della funzionalità polmonare18;
- Nel caso di sintomi lievi, una limitazione nelle attività quotidiane, o una percezione non corretta dei problemi respiratori19, che potrebbero essere dovuti ad una infiammazione delle vie aeree non trattata20.
Le conseguenze della compromissione della funzionalità polmonare
Il FEV1pp è un indicatore fondamentale per monitorare la funzionalità polmonare per la gestione e il controllo dell’asma. La compromissione della funzionalità polmonare nei pazienti pediatrici è infatti correlata a diversi rischi legati all’asma (es. rischio di esacerbazioni future, aumento della probabilità di eventi sintomatologici, crescita ridotta dei polmoni in età adulta). In particolare, livelli decrescenti di FEV1pp sono associati a:
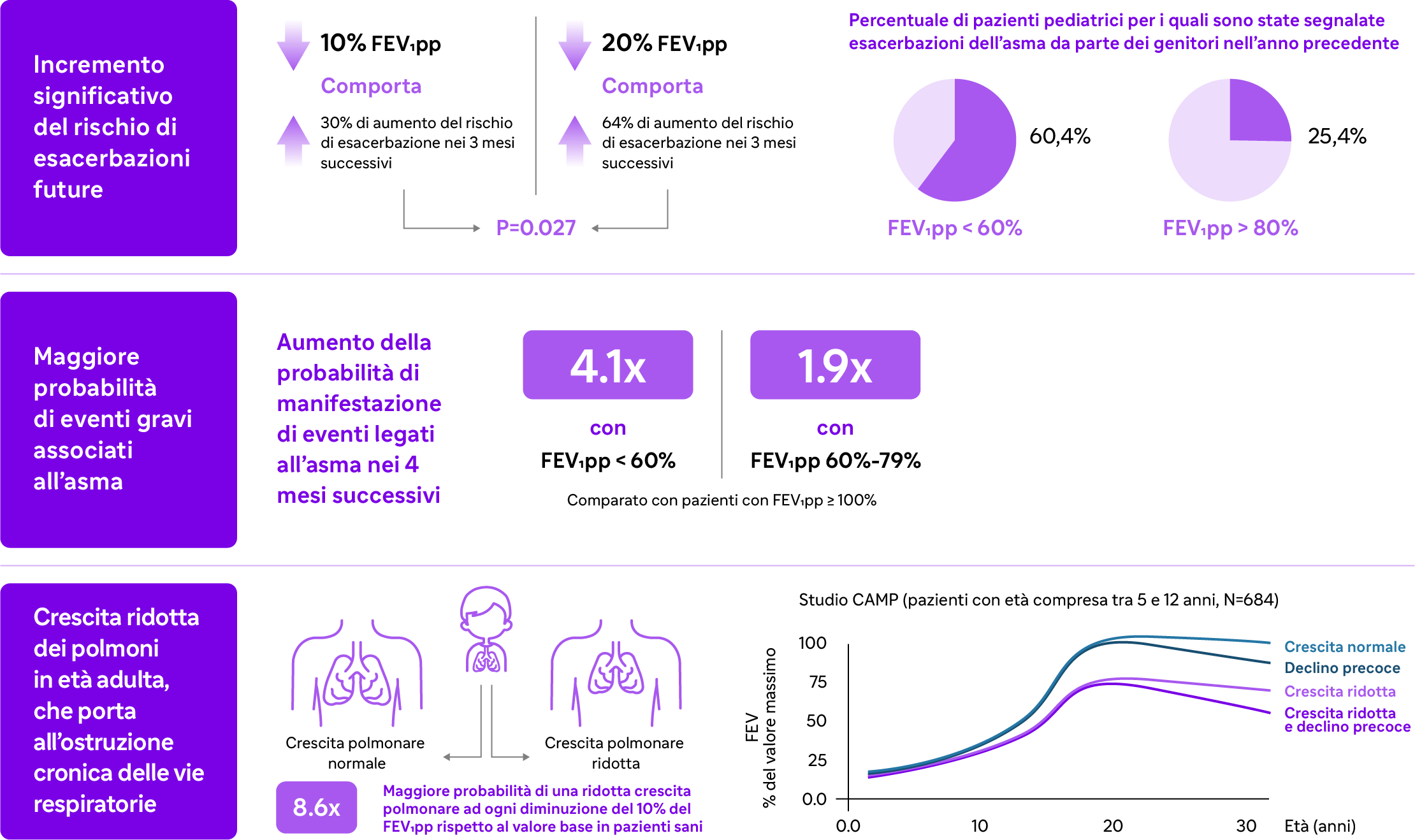
.png)
L'infiammazione di tipo 2 nei pazienti asmatici: come identificarla
Come riconoscere la presenza di infiammazione di tipo 2 negli adulti e nei bambini.

Fisiopatologia dell'infiammazione di tipo 2
Come comprendere i meccanismi fisiopatologici dell'infiammazione di tipo 2 nell'asma grave.
.png)
L'infiammazione di tipo 2 nei pazienti asmatici: come identificarla
Come riconoscere la presenza di infiammazione di tipo 2 negli adulti e nei bambini.

Fisiopatologia dell'infiammazione di tipo 2
Come comprendere i meccanismi fisiopatologici dell'infiammazione di tipo 2 nell'asma grave.
Glossario
CTS: Canadian Thoracic Society
FEV1: Forced expiratory volume
FEV1pp: Forced expiratory volume in the first second percent predicted
GINA: Global Initiative for Asthma
IL: Interleuchina
QoL: Quality of Life

Bibliografia
- David S, Edwards CW. Forced Expiratory Volume. [Updated 2022 Aug 8]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK540970/
- Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, 2023. Disponibile all’indirizzo: www.ginasthma.org (ultimo accesso: marzo 2024).
- Reddel H, Ware S, Marks G, Salome C, Jenkins C, Woolcock A. Differences between asthma exacerbations and poor asthma control. Lancet. 1999 Jan 30;353(9150):364-9. doi: 10.1016/S0140-6736(98)06128-5. Erratum in: Lancet 1999 Feb 27;353(9154):758. PMID: 9950442.
- Yang CL, Hicks EA, Mitchell P, et al. Canadian Thoracic Society 2021 Guideline update: Diagnosis and management of asthma in preschoolers, children and adults Can J Respir Crit Care Sleep Med. 2021;5(6):348–361. DOI: 10.1080/24745332.2021.1945887
- Katial RK, Bensch GW, Busse WW, Chipps BE, Denson JL, Gerber AN, Jacobs JS, Kraft M, Martin RJ, Nair P, Wechsler ME. Changing Paradigms in the Treatment of Severe Asthma: The Role of Biologic Therapies. J Allergy Clin Immunol Pract. 2017 Mar-Apr;5(2S):S1-S14. doi: 10.1016/j.jaip.2016.11.029. Epub 2017 Jan 29. PMID: 28143691.
- Parulekar AD, Diamant Z, Hanania NA. Role of T2 inflammation biomarkers in severe asthma. Curr Opin Pulm Med. 2016 Jan;22(1):59-68. doi: 10.1097/MCP.0000000000000231. PMID: 26574724.
- Gandhi NA, Bennett BL, Graham NM, Pirozzi G, Stahl N, Yancopoulos GD. Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov. 2016 Jan;15(1):35-50. doi: 10.1038/nrd4624. Epub 2015 Oct 16. PMID: 26471366.
- Fahy JV. Type 2 inflammation in asthma—present in most, absent in many. Nat Rev Immunol. 2015 Jan;15(1):57-65. Doi: 10.1038/nri3786. PMID: 25534623; PMCID: PMC4390063.
- Robinson D, Humbert M, Buhl R, Cruz AA, Inoue H, Korom S, Hanania NA, Nair P. Revisiting Type 2-high and Type 2-low airway inflammation in asthma: current knowledge and therapeutic implications. Clin Exp Allergy. 2017 Feb;47(2):161-175. doi: 10.1111/cea.12880. PMID: 28036144.
- Manson ML, Säfholm J, James A, Johnsson AK, Bergman P, Al-Ameri M, Orre AC, Kärrman-Mårdh C, Dahlén SE, Adner M. IL-13 and IL-4, but not IL-5 nor IL-17A, induce hyperresponsiveness in isolated human small airways. J Allergy Clin Immunol. 2020 Mar;145(3):808-817.e2. doi: 10.1016/j.jaci.2019.10.037. Epub 2019 Dec 2. PMID: 31805312.
- Kaur D, Hollins F, Woodman L, Yang W, Monk P, May R, Bradding P, Brightling CE. Mast cells express IL-13R alpha 1: IL-13 promotes human lung mast cell proliferation and Fc epsilon RI expression. Allergy. 2006 Sep;61(9):1047-53. Doi: 10.1111/j.1398-9995.2006.01139.x. PMID: 16918506.
- Le Floc'h A, Allinne J, Nagashima K, Scott G, Birchard D, Asrat S, Bai Y, Lim WK, Martin J, Huang T, Potocky TB, Kim JH, Rafique A, Papadopoulos NJ, Stahl N, Yancopoulos GD, Murphy AJ, Sleeman MA, Orengo JM. Dual blockade of IL-4 and IL-13 with dupilumab, an IL-4Rα antibody, is required to broadly inhibit type 2 inflammation. Allergy. 2020 May;75(5):1188-1204. doi: 10.1111/all.14151. Epub 2020 Jan 3. PMID: 31838750; PMCID: PMC7317958.
- NIH National Heart, Lung, and Blood Institute. https://www.nhlbi.nih.gov/health-topics/guidelines-for-diagnosis-management-of-asthma. Accessed March 25, 2024
- Molly L. Osborne, Kathryn L. Pedula, Mark O'Hollaren, Kenneth M. Ettinger, Thomas Stibolt, A. Sonia Buist, William M. Vollmer, Assessing Future Need for Acute Care in Adult Asthmatics: The Profile of Asthma Risk Study: A Prospective Health Maintenance Organization-Based Study, Chest. 2007, ISSN 0012-3692, https://doi.org/10.1378/chest.05-3084.
- Fuhlbrigge AL, Kitch BT, Paltiel AD, Kuntz KM, Neumann PJ, Dockery DW, Weiss ST. FEV(1) is associated with risk of asthma attacks in a pediatric population. J Allergy Clin Immunol. 2001 Jan;107(1):61-7. doi: 10.1067/mai.2001.111590. PMID: 11149992.
- Li D, German D, Lulla S, Thomas RG, Wilson SR. Prospective study of hospitalization for asthma. A preliminary risk factor model. Am J Respir Crit Care Med. 1995 Mar;151(3 Pt 1):647-55. Doi: 10.1164/ajrccm.151.3.7881651. PMID: 7881651.
- Kitch BT, Paltiel AD, Kuntz KM, Dockery DW, Schouten JP, Weiss ST, Fuhlbrigge AL. A single measure of FEV1 is associated with risk of asthma attacks in long-term follow-up. Chest. 2004 Dec;126(6):1875-82. doi: 10.1378/chest.126.6.1875. PMID: 15596687.
- Ulrik CS. Outcome of asthma: longitudinal changes in lung function. Eur Respir J. 1999 Apr;13(4):904-18. doi: 10.1034/j.1399-3003.1999.13d35.x. PMID: 10362061.
- Killian KJ, Watson R, Otis J, St Amand TA, O'Byrne PM. Symptom perception during acute bronchoconstriction. Am J Respir Crit Care Med. 2000 Aug;162(2 Pt 1):490-6. doi: 10.1164/ajrccm.162.2.9905079. PMID: 10934076.
- Barnes PJ, Szefler SJ, Reddel HK, Chipps BE, Symptoms and perception of airway obstruction in asthmatic patients: Clinical implications for use of reliever medications, Journal of Allergy and Clinical Immunology, Volume 144, Issue 5, 2019, https://doi.org/10.1016/j.jaci.2019.06.040.
- Fielding S, Pijnenburg M, de Jongste JC, Pike KC, Roberts G, Petsky H, Chang AB, Fritsch M, Frischer T, Szefler S, Gergen P, Vermeulen F, Vael R, Turner S. Change in FEV1 and Feno Measurements as Predictors of Future Asthma Outcomes in Children. Chest. 2019 Feb;155(2):331-341. doi: 10.1016/j.chest.2018.10.009. Epub 2018 Oct 22. PMID: 30359613; PMCID: PMC6688975.
- Fuhlbrigge AL, Weiss ST, Kuntz KM, Paltiel AD; CAMP Research Group. Forced expiratory volume in 1 second percentage improves the classification of severity among children with asthma. Pediatrics. 2006 Aug;118(2):e347-55. doi: 10.1542/peds.2005-2962. Epub 2006 Jul 24. PMID: 16864642.
- McGeachie MJ, et al. Patterns of Growth and Decline in Lung Function in Persistent Childhood Asthma. N Engl J Med. 2016;374(19):1842-1852. doi: 10.1056/NEJMoa1513737
Codice deposito aziendale MAT-IT-2400976