- Article
- Source : Campus Sanofi
- 16 avr. 2025
Rythmes circadiens et diabète : comment l'heure de la journée peut influencer la régulation de la glycémie

Introduction aux rythmes circadiens
Pour la plupart des êtres vivants, les horloges circadiennes internes ont évolué pour permettre d'anticiper les changements quotidiens de lumière dus à la rotation de la Terre. Ce lien entre l’horloge biologique et les phases d’éveil et de sommeil est ainsi bien établi1. Toutefois, saviez-vous que le rôle de l’horloge biologique va au-delà du sommeil ? En effet, elle rythme aussi des phénomènes physiologiques comme la sécrétion d’hormones. Ainsi, il a été démontré que le travail de nuit, le décalage horaire ou même des repas à des horaires atypiques sont associés à des perturbations physiologiques2.
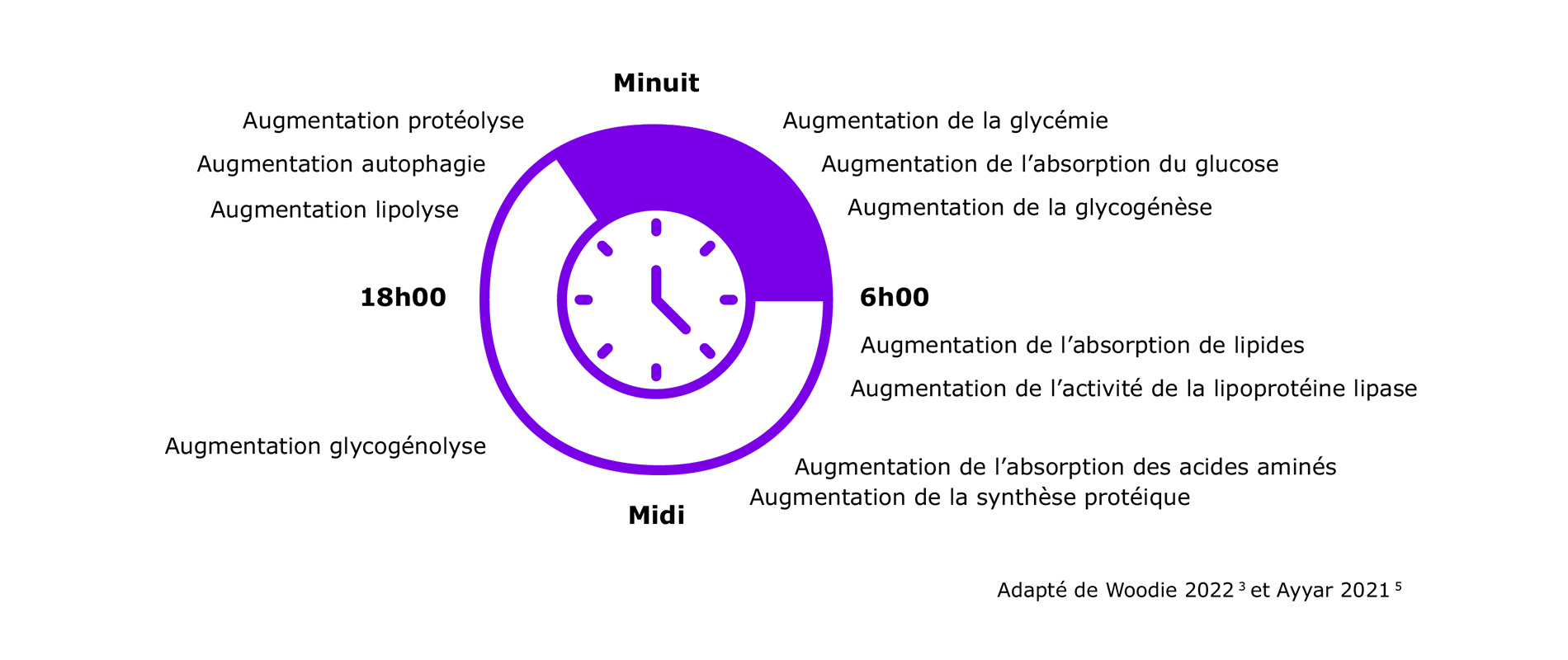
Le rythme circadien métabolique se divise en 2 période principales, permettant des processus spécifiques :
- La phase active, qui correspond à la période de jour, pendant laquelle l’ingestion d’aliments entraîne une augmentation des processus anaboliques3. Ainsi, la présence d'un rythme diurne de la glycémie dans la tolérance orale au glucose, qui était plus faible l'après-midi et le soir que le matin, est bien établie4.
- La phase inactive, qui correspond à la période de nuit, caractérisée par la prédominance des processus cataboliques : glycogénolyse dans les muscles et le foie, lipolyse dans le tissu adipeux, protéolyse et autophagie3.
Perturbations des rythmes circadiens & diabète 4
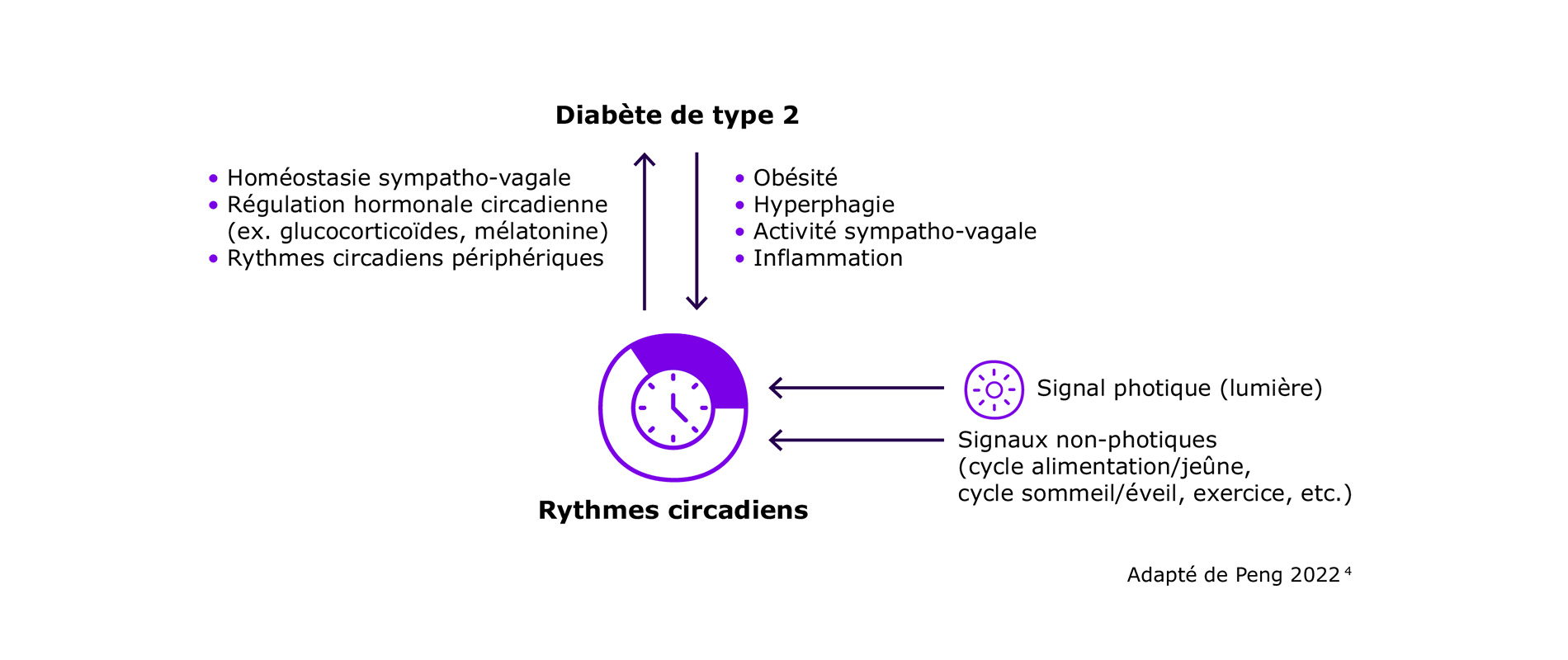
Tel que mentionné précédemment, non seulement la glycémie est influencée par les rythmes circadiens, mais aussi des hormones impliquées dans la pathophysiologie du diabète telles que l’insuline, le glucagon et le GLP-1.
Il est encore difficile d’établir un lien de causalité entre les rythmes circadiens et le diabète : certaines études observent des rythmes circadiens perturbés chez les personnes atteintes de diabète, et il a été suggéré que la perturbation circadienne contribue au développement du diabète de type 2.
Les mécanismes en cause dans le dérèglement des rythmes circadiens sont encore méconnus, mais l'obésité associée au diabète, l'hyperphagie, la modulation circadienne altérée de l'activité sympatho-vagale et l'inflammation pourraient être impliquées.
Un exemple important de l’impact des rythmes circadiens concerne les femmes vivant avec un diabète de type 1. Plusieurs études tendent à démontrer que le profil glycémique varierait en fonction des différentes phases du cycle menstruel. Une étude française a ainsi démontré une tendance à une glycémie plus élevée en phase lutéale et un risque d’hypoglycémie qui pourrait être plus important au milieu de la phase folliculaire6,7.
La chronothérapie et la chrononutrition, des outils en plus dans la prise en charge du diabète ?
Chronothérapie 8
Le concept de chronothérapie peut s’avérer intéressant dans la prise en charge du diabète. La médecine dite circadienne comprend essentiellement 3 approches principales :
- Utilisation de l’horloge biologique : se servir de la connaissance des rythmes physiologiques pour des schémas thérapeutiques adaptés au moment de la journée
- Détection de l'horloge biologique : développer la médecine circadienne dans le cadre de la médecine de précision, grâce à de nouveaux outils de diagnostic qui permettent des interventions personnalisées adaptées au chronotype.
- Ciblage de l'horloge biologique : améliorer ou la resynchroniser des rythmes perturbés par des interventions directes sur les rythmes circadiens.
En effet, puisqu’il existe une variation claire de l'efficacité de certains médicaments en fonction du moment de la journée, la régularité journalière de ceux-ci peut constituer un paramètre important de la prise en charge.
Chrononutrition 9
Depuis le milieu du 20e siècle, les habitudes alimentaires ont évolué vers des heures de repas plus tardives, avec plus d'un tiers de l'apport calorique pouvant être consommé après 18 heures !
Dans les recherches sur la chrononutrition, l’hypothèse des « chronotypes » a émergé. Le chronotype, défini comme la manifestation comportementale des rythmes circadiennes internes d’un individu, permettrait de déterminer une préférence pour le matin ou le soir. Ainsi, les personnes ayant un « chronotype du soir » ou « chronotype tardif », sont biologiquement poussées à consommer des aliments plus tard dans la journée.
Les recherches dans ce domaine ont suggéré que l'heure de la journée peut influencer la réponse glycémique postprandiale, ayant ainsi un effet majeur sur le diabète de type 2. Des études transversales et expérimentales ont montré les bénéfices de consommer des repas tôt dans la journée plutôt que le soir sur la glycémie postprandiale :
• Par exemple, certaines études ont montré une association entre le fait de sauter le petit-déjeuner et la résistance à l’insuline ou le diabète de type 2.
• Un autre exemple concerne la prise d’un repas très tard le soir : une étude de cohorte a démontré qu’un dîner après 20 heures était associé de manière indépendante à une augmentation de l'HbA1c.
Certaines interventions chrononutritionnelles pour le diabète de type 2 ont été proposées, notamment la restriction calorique, le jeûne intermittent et de limiter la consommation de nourriture à une période déterminée pendant la journée (par exemple entre 8h00 et 18h00).
Quelques conseils pratiques de chrononutrition pour le diabète 9

En plus de la valeur nutritionnelle, il peut être intéressant d’évaluer les moments de consommation des repas chez les personnes atteintes de diabète.

Consommer un repas riche en glucides le soir entraîne une augmentation de la glycémie postprandiale par rapport à un repas identique le matin. Par conséquent, il peut être bénéfique de chercher à modifier la composition en macronutriments des repas du soir, en augmentant la teneur en protéines et en lipides comparativement aux glucides.

Encouragez la consommation des repas plus tôt dans la journée.

Manger des aliments à faible indice glycémique le matin contribue à améliorer la réponse glycémique de manière plus importante que le soir.
Références
1. Petrenko V, et al.Type 2 diabetes disrupts circadian orchestration of lipidmetabolism and membrane fluidity in human pancreatic islets. PLOS Biology.2022;20(8):e3001725.
2. Lee Y, Field JM, Sehgal A. Circadian Rhythms, Disease and Chronotherapy. J Biol Rhythms. 2021;36(6):503-531.
3.Woodie LN, et al. The Circadian Regulation of Nutrient Metabolism in Diet-Induced Obesity and Metabolic Disease. Nutrients. 2022;14(15):3136.
4. Peng X, et al. A Growing Link between Circadian Rhythms, Type 2 Diabetes Mellitus and Alzheimer's Disease. Int J Mol Sci. 2022;23(1):504.
5. Ayyar VS, Sukumaran S. Circadian rhythms: influence on physiology, pharmacology, and therapeutic interventions. J Pharmacokinet Pharmacodyn. 2021;48(3):321-338.
6. Tatulashvili S. et al. Ambulatory glucose profile according to different phases of the menstrual cycle in women living with type 1 diabetes. J Clin Endocrinol Metab. 2022;107:2793-800.
7. Brown SA, et al. Fluctuations of hyperglycemia and insulin sensitivity are linked to menstrual cycle phases in women with T1D. J Diabetes Sci Technol. 2015;9(6):1192-1199.
8. Kramer A, et al. Foundations of circadian medicine. PLoS Biol. 2022;20(3):e3001567.
9. Henry CJ, Kaur B, Quek RYC. Chrononutrition in the management of diabetes. Nutr Diabetes. 2020;10(1):6.
250318151221JE - 03/2025