- Article
- Source : Campus Sanofi
- 23 nov. 2023
Quand la peau, les systèmes immunitaire et nerveux ne se comprennent plus : aux origines du prurigo nodulaire

- Quelle est l’origine du prurigo nodulaire ?
- Quels mécanismes physiopathologiques caractérisent le prurigo nodulaire ?
- Quel rôle joue l’inflammation de type-2 ?
Quelle est l’origine du prurigo nodulaire ?
Le prurigo nodulaire est une maladie distincte complexe et son origine n’est pas encore entièrement comprise. Sa physiopathologie serait liée à des lésions cutanées induites par le grattage dans un contexte de prurit chronique de haute intensité1.
Le prurit chronique est le signe initial du prurigo nodulaire. Il peut être d’origine dermatologique, systémique, neurologique, psychiatrique, multifactorielle ou idiopathique2.
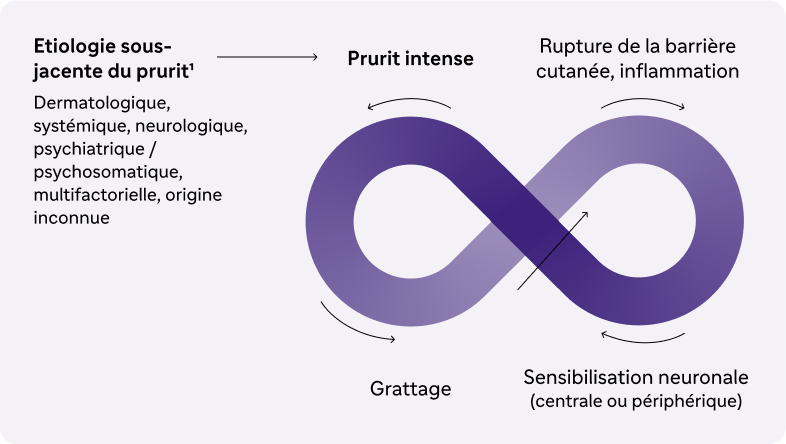
Illustration des mécanismes neurologiques et immunitaires responsables du cycle prurit/grattage chez le patient atteint d'un prurigo nodulaire.1-3
Quelle qu’en soit son origine initiale, le prurit chronique entraîne un grattage prolongé et un cercle vicieux prurit-grattage qui conduit, à terme, à la formation de lésions cutanées caractéristiques. Le prurigo nodulaire est auto-entretenu à la fois par ce cercle vicieux prurit-grattage et par le phénomène de sensibilisation neuronale au prurit1.
Il est important de noter que les symptômes de la maladie peuvent se développer indépendamment de l’origine initiale du prurit et le traitement isolé de son étiologie est souvent insuffisant3.
Dermatite atopique ou prurigo nodulaire ? Le Pr Laurent Misery fait le point sur ces deux maladies chroniques dermatologiques. Écoutez-le dans cet épisode du podcast Derm’Action.
Quels mécanismes physiopathologiques caractérisent le prurigo nodulaire ?
Le prurigo nodulaire entraîne des modifications cutanées, histologiques et immunologiques4,5,6,7 :
- Hyperkératose
- Infiltration de cellules immunitaires inflammatoires dans le derme (lymphocytes, macrophages, éosinophiles, neutrophiles, mastocytes)
- Fibrose du derme avec des fibres de collagène arrangées verticalement
- Dans le derme, augmentation de la densité des fibres nerveuses et surexpression des neuropeptides et des récepteurs du NGF (nerve growth factor) – par opposition à la réduction de la densité des fibres nerveuses dans l’épiderme en conséquence au grattage chronique.
Au niveau cellulaire, la physiopathologie du prurigo nodulaire implique des phénomènes neuronaux et immunitaires.
À force de grattages répétés, la barrière cutanée s’endommage. Cela entraîne la libération de messagers pruritogènes qui fixent les pruricepteurs des fibres nerveuses cutanées et déclenchent de nouvelles démangeaisons par l’intermédiaire d’un signal de prurit envoyé au système nerveux central. C’est ici que débute le cycle prurit-grattage.
Les messagers pruritogènes libérés lors de la rupture de la barrière cutanée peuvent également directement activer les cellules immunitaires (lymphocytes T2, macrophages, mastocytes, éosinophiles et basophiles). Ces dernières vont sécréter des médiateurs inflammatoires et favoriser l’inflammation en recrutant d’avantage de cellules immunitaires au niveau du derme. Les médiateurs (notamment les cytokines de type 2) libérés par les cellules inflammatoires peuvent aussi fixer les pruricepteurs des fibres nerveuses cutanées pour déclencher de nouveaux signaux de prurit et ainsi entretenir le cycle prurit-grattage.
L’activation chronique des pruricepteurs conduit au phénomène d’inflammation neurogène. En effet, la transmission du signal pruritogène au système nerveux central entraîne la libération de neuropeptides par les fibres nerveuses (substance P, CGRP [calcitonin-gene related peptide], VIP [vasoactive intestinal peptide], etc). Les neuropeptides ainsi libérés activent les cellules immunitaires, libérant à leur tour des médiateurs qui pourront à la fois fixer de nouveaux pruricepteurs et favoriser la réponse inflammatoire. Au niveau cutané, ce réseau de communication bidirectionnelle entre les fibres nerveuses et le système immunitaire par l’intermédiaire de cytokines et de neuropeptides constitue l’axe neuro-immun qui est une composante-clé de la physiopathologie du prurigo nodulaire.
La sensibilisation neuronale est un phénomène qui potentialise la réactivité des fibres nerveuses, périphériques et centrales, aux pruritogènes. Parmi les mécanismes à l’origine de la sensibilisation neuronale au prurit, nous pouvons retrouver les exemples ci-dessous :
- Au niveau périphérique :
- Augmentation de la densité des fibres nerveuses cutanées
- Hyperexcitabilité des terminaisons nerveuses
- Diminution du seuil d’activation des fibres nerveuses sensorielles
- Augmentation de l’expression, de la sensibilité et de la réactivité des récepteurs à certains médiateurs pruritogènes
- Au niveau central :
- Anomalies des voies descendantes inhibitrices
- Changements fonctionnels de certaines zones du cerveau conduisant à des modifications de la connectivité cérébrales.
Les conséquences cliniques de ce phénomène sont l’alloknésie (réponse prurigineuse à un stimulus classiquement non prurigineux), l’hyperknésie (réponse accrue à un stimulus prurigineux normal) ainsi que le prurigo chronique.
LE SAVIEZ-VOUS ?
Les démangeaisons sont codées par deux voies neuronales majeures :
- Histaminergiques (dans le prurit aigu)
- Non-histaminergiques (dans le prurit chronique)10.
Le prurigo nodulaire se caractérise par cette sensibilisation au prurit, c’est-à-dire que le système nerveux a un fonctionnement détourné vers ce prurit et qu’il amplifie, pérennise le prurit. Et puis, il y a les interactions neuro-immunes que l’on voit bien dans les lésions de prurigo, avec une augmentation importante du taux de certains neuromédiateurs (…), et aussi la présence de cytokines th2 : (IL-4, IL-13, et IL-31), qui sont capables d’activer directement les terminaisons nerveuses de la peau.
Chef de service de dermatologie au CHU de Brest et responsable du centre expert français sur le prurit
Quel rôle joue l’inflammation de type 2 ?
De nombreux médiateurs sont impliqués dans la physiopathologie du prurit et du prurigo nodulaire et semblent y jouer un rôle moteur. Parmi ceux-ci, se trouvent les cytokines de type 2 telles que l’IL-4, l’IL-13 et l’IL-31.8
Au-delà de leur action pro-inflammatoire, ces cytokines de type 2 sensibilisent les neurones au même titre que les autres pruritogènes (par l’intermédiaire de la voie non-histaminergique)8, 9, 12, 17.
Par ailleurs, elles participent à la fibrose du derme, un phénomène qui fait partie intégrante de la physiopathologie du prurigo nodulaire14, 18. Par exemple, l’IL-4 est une cytokine profibrotique qui stimule la prolifération et la migration des fibroblastes et la production des protéines de la matrice extra-cellulaire19.
Mieux connaître la maladie
Décrypter la physiopathologie du prurigo nodulaire favorise une meilleure prise en charge du patient qui en souffre. Identifiez les principales manifestations cliniques et les comorbidités associées au prurigo nodulaire en lisant notre article consacré au diagnostic.
Références
- Misery L. Chronic prurigo. Br J Dermatol. 2022;187(4):464-471.
- Ständer S, et al. IFSI-guideline on chronic prurigo including prurigo nodularis. Itch. 2020;5:e42.
- Pereira MP, Ständer S. How to define chronic prurigo? Exp Dermatol. 2019;28(12):1455-1460.
- Zeidler C, et al. Chronic Prurigo of Nodular Type: a review. Acta Derm Venereol. 2018;98(2):173-179.
- Weigelt N, Metze D, Ständer S. Prurigo nodularis: systematic analysis of 58 histological criteria in 136 patients. J Cutan Pathol. 2010;37(5):578-86.
- Kowalski EH, et al. Treatment-resistant prurigo nodularis: challenges and solutions. Clin Cosmet Investig Dermatol. 2019;28(12):163-172.
- Zeidler C, Ständer S. The pathogenesis of Prurigo nodularis--'Super-Itch' in exploration. Eur J Pain. 2016;20:37-40.
- Mack MR, Kim BS. The Itch-Scratch Cycle: A Neuroimmune Perspective. Trends Immunol. 2018;39(12):980-991.
- Oetjen LK, et al. Sensory Neurons Co-opt Classical Immune Signaling Pathways to Mediate Chronic Itch. Cell. 2017;171(1):217-228.e13.
- Yosipovitch G, et al. Itch: From mechanism to (novel) therapeutic approaches. J Allergy Clin Immunol. 2018;142(5):1375-1390.
- Kabata H, Artis D. Neuro-immune crosstalk and allergic inflammation. J Clin Invest. 2019;129(4):1475-1482.
- Garcovich S, et al. Pruritus as a Distinctive Feature of Type 2 Inflammation. Vaccines (Basel). 2021;9(3):303.
- Sutaria N, et al. Itch: Pathogenesis and treatment. J Am Acad Dermatol. 2022;86(1):17-34.
- Williams KA, et al. Pathophysiology, diagnosis, and pharmacological treatment of prurigo nodularis. Expert Rev Clin Pharmacol. 2021;14(1):67-77.
- Elmariah S, et al. Practical approaches for diagnosis and management of prurigo nodularis: United States expert panel consensus. Journal of the American Academy of Dermatology. 2021;84(3):747–760.
- Misery L, et al. Basic mechanisms of itch. J Allergy Clin Immunol. 2023;152(1):11-23.
- Agelopoulos K, et al. Cutaneous neuroimmune crosstalk in pruritus. Trends Mol Med. 2022;28(6):452-462.
- Sutaria N, et al. Cutaneous Transcriptomics Identifies Fibroproliferative and Neurovascular Gene Dysregulation in Prurigo Nodularis Compared with Psoriasis and Atopic Dermatitis. J Invest Dermatol. 2022;142(9):2537-2540.
- Nguyen JK, et al. The IL-4/IL-13 Axis in Skin Fibrosis and Scarring: Mechanistic Concepts and Therapeutic Targets. Arch Dermatol Res. 2020;312(2):81–92.
7000043953 - 03/2024