- Article
- Source : Campus Sanofi
- 12 févr. 2024
Des dysfonctionnements à l’origine de l’inflammation de type 2

Points clés
- La dermatite atopique est d’origine multifactorielle et présente un mécanisme complexe associant une prédisposition génétique, une dysfonction de la barrière cutanée et une anomalie de la réponse immunitaire de type 22.
- La réponse inflammatoire de type 2 amorce le cercle vicieux de la dermatite atopique1.
- Les conséquences cliniques de la dermatite atopique impactent la vie des patients3.
- La dermatite atopique constitue généralement la première étape de la marche atopique4.
La dermatite atopique, des origines multiples
La physiopathologie de la dermatite atopique est complexe et multifactorielle2 :
- La maladie est fortement associée à des facteurs de prédisposition génétique2 :
Antécédent familial d'atopie

70% des patients5
1 parent atopique

25% de risques d'atopie pour l'enfant6
2 parents atopiques

50% de risque d'atopie de l'enfant6
- À la prédisposition génétique s’ajoutent les facteurs environnementaux, tels que le grattage, qui entraînent l’altération fonctionnelle de la barrière cutanée qui ne joue alors plus son rôle protecteur7.
- La dysfonction de la barrière cutanée permet ainsi la pénétration de substances irritantes, de bactéries ou d'allergènes dans le derme entraînant une réponse immunitaire de type 2 inadaptée qui physiologiquement protège contre les menaces extérieures comme les parasites7-9.
Il existe 3 types de réponses immunitaires, de types 1, 2 et 3, ayant des rôles protecteurs différents. Leur dérégulation contribue à des maladies inflammatoires chroniques, dont la dermatite atopique1,2,8,9.
Réponses immunitaires et maladies inflammatoires chroniques associées1,2,8,9 :

Adapté de Haddad et al. 2022
Le cercle vicieux de la DA : l’inflammation de type 2
Voies de l'inflammation de type 2 dans la dermatite atopique2,9
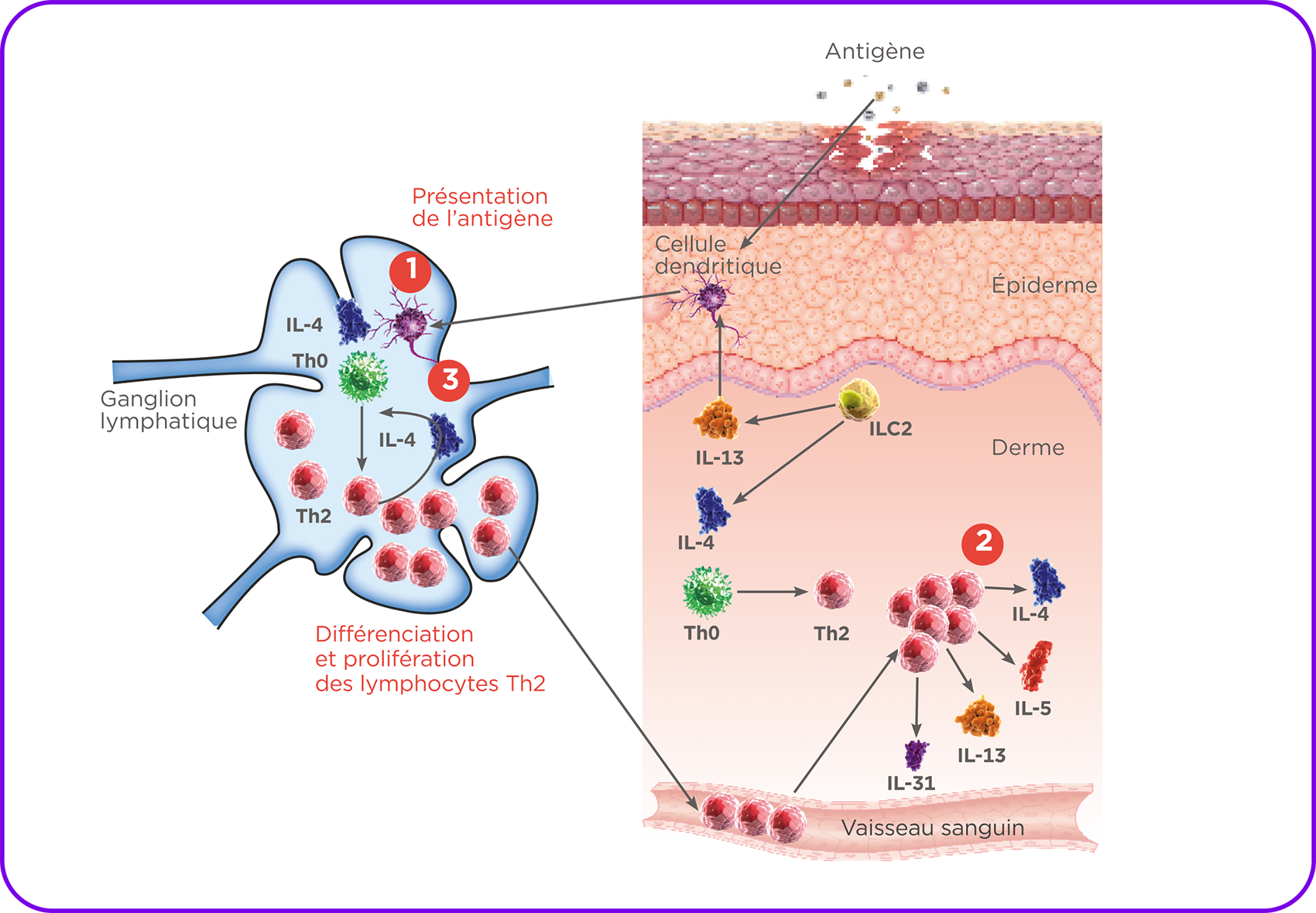
Adapté de Langan et al. 2020, et Haddad et al., 2022.

Chez les patients atteints de dermatite atopique, une réponse immunitaire de type 2 aberrante est stimulée lorsque des agents extérieurs ou des substances irritantes pénètrent dans la peau : la différenciation des lymphocytes T naïf ThO en Th2 est activée et les ILC2 sont activés8,9.
L'inflammation de type 2 est exacerbée8.

Les cellules de défense tellesques les lymphocytes Th2 produisent alors des médiateurs pro-inflammatoires, les interleukines IL-4, IL-13, IL-5 et IL-31, qui sont des protéines majeures dans le mécanisme physiopathologique de la dermatite atopique2,9.
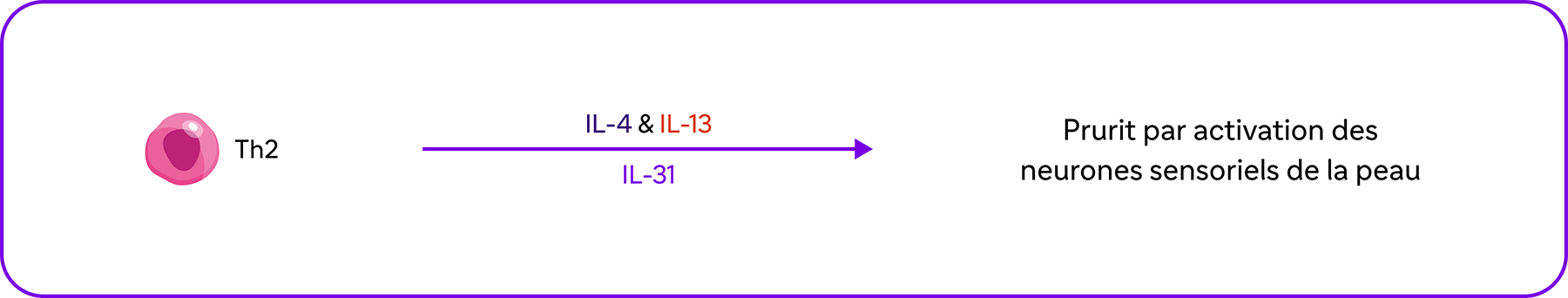
De plus, l'IL-4, l'IL-13 et l'IL-31 participent directement au prurit2.

L'installation de la chronicité implique alors le recrutement d'autres cellules immunitaires et la sécrétion d'autres interleukines3.
Cette réponse exagérée affecte de plus belle la structure et la fonction de l'épiderme augmentant les sensations de démangeaisons.
Il en résulte un cercle vicieux qui entretient le cycle démangeaisons/grattages1.
Des cytokines clés de l’inflammation de type 2
La suractivation de l’inflammation de type 2 est en partie responsable des effets cliniques de la dermatite atopique. Différents types cellulaires interviennent2,8,9 :

L'IL-4 et l'IL-13 ont un rôle central dans l'inflammation avec des fonctions similaires et distinctes8.
L'IL-4 est impliquée dans la différenciation et la prolifération des cellules Th28.
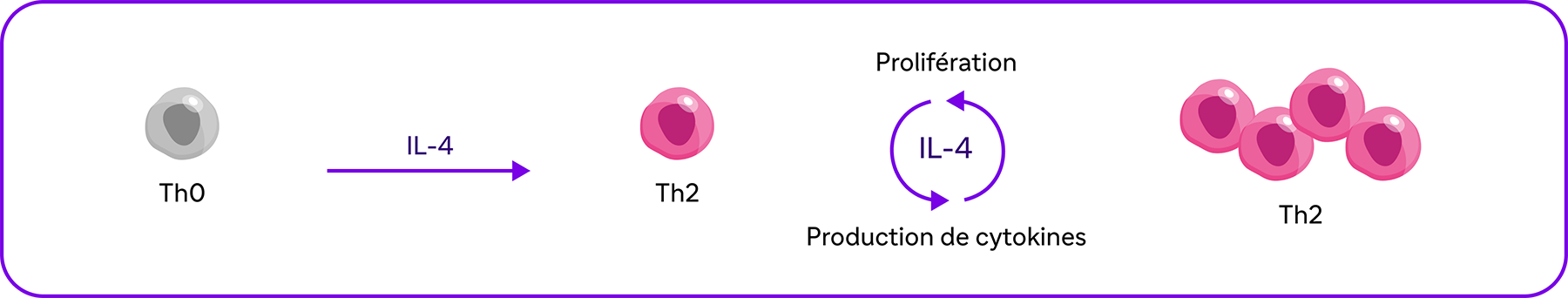
Les ILC2 activées produisent notamment l'IL-13 et l'IL-5 amplifiant la réponse inflammatoire de type 22-10.

La signalisation de l'IL-4 et l'IL-13 peut agir sur les médiateurs qui contrôlent le recrutement des éosinophiles au site de l'inflammation8.

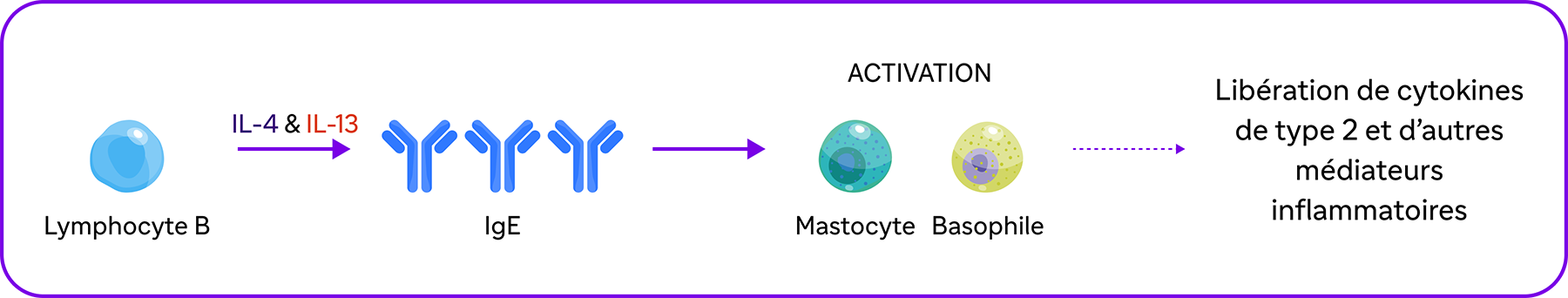
La signalisation de l'IL-4 et l'IL-13 favorise la production d'IgE via les lymphocytes B, induisant l'activation des mastocytes et des basophiles et la libération de cytokines de type 2 et d'autres médiateurs inflammatoires2,8,9.
L'IL-4, l'IL-13 et l'IL-31 induisent le prurit en activant directement les terminaisons nerveuses2,10.
Visionnez la vidéo ci-dessous pour en savoir davantage sur les mécanismes responsables de la dermatite atopique :
La compréhension du mécanisme de l’inflammation de type 2 est déterminante pour2,3,8-10 :
Des conséquences cliniques pour le patient
La dysfonction de la barrière cutanée est observée chez les patients atteints de dermatite atopique avec ou sans lésions cutanées2. Les patients présentent des lésions cutanées érythémateuses toujours associées à un prurit5. Ces lésions sont parfois suintantes et croûteuses5. Lorsqu’elles deviennent chroniques, une sécheresse cutanée et une lichénification peuvent apparaître5. Le grattage augmente le risque d’infections cutanées5.

Sécheresse & lésions sur la peau

Susceptibilité accrue aux infections

Prurit
Les démangeaisons c'est ce qui implique quasiment tout dans la dermatite atopique : le mal-être, l'inconfort et du coup le manque de sommeil...
Patient atteint de dermatite atopique
Cliquez-ici pour écouter son témoignage
La dermatite atopique évolue par poussées3. Lors d’une crise, elle peut avoir de lourdes répercussions sur la qualité de vie des patients3.
Découvrez en plus sur le fardeau de la dermatite atopique : quel impact au quotidien ?
Il est donc nécessaire de déterminer le plus régulièrement possible le niveau de contrôle de la maladie grâce à un outil dédié, le score ADCT qui évalue des aspects pluridimensionnels de la DA3,11.

La dermatite atopique de votre patient est-elle contrôlée ?
Vérifiez en lui faisant faire le test ADCT.
Première manifestation d’un long parcours : la marche atopique
La dermatite atopique constitue généralement la première manifestation de l’atopie7. Dans les années qui suivent, l’apparition d’autres pathologies liées à l’atopie telles que l’asthme, les allergies alimentaires et la rhinite allergique peuvent apparaître4,7. Ce phénomène est encore étudié sous le terme de « marche atopique »7.
La marche atopique
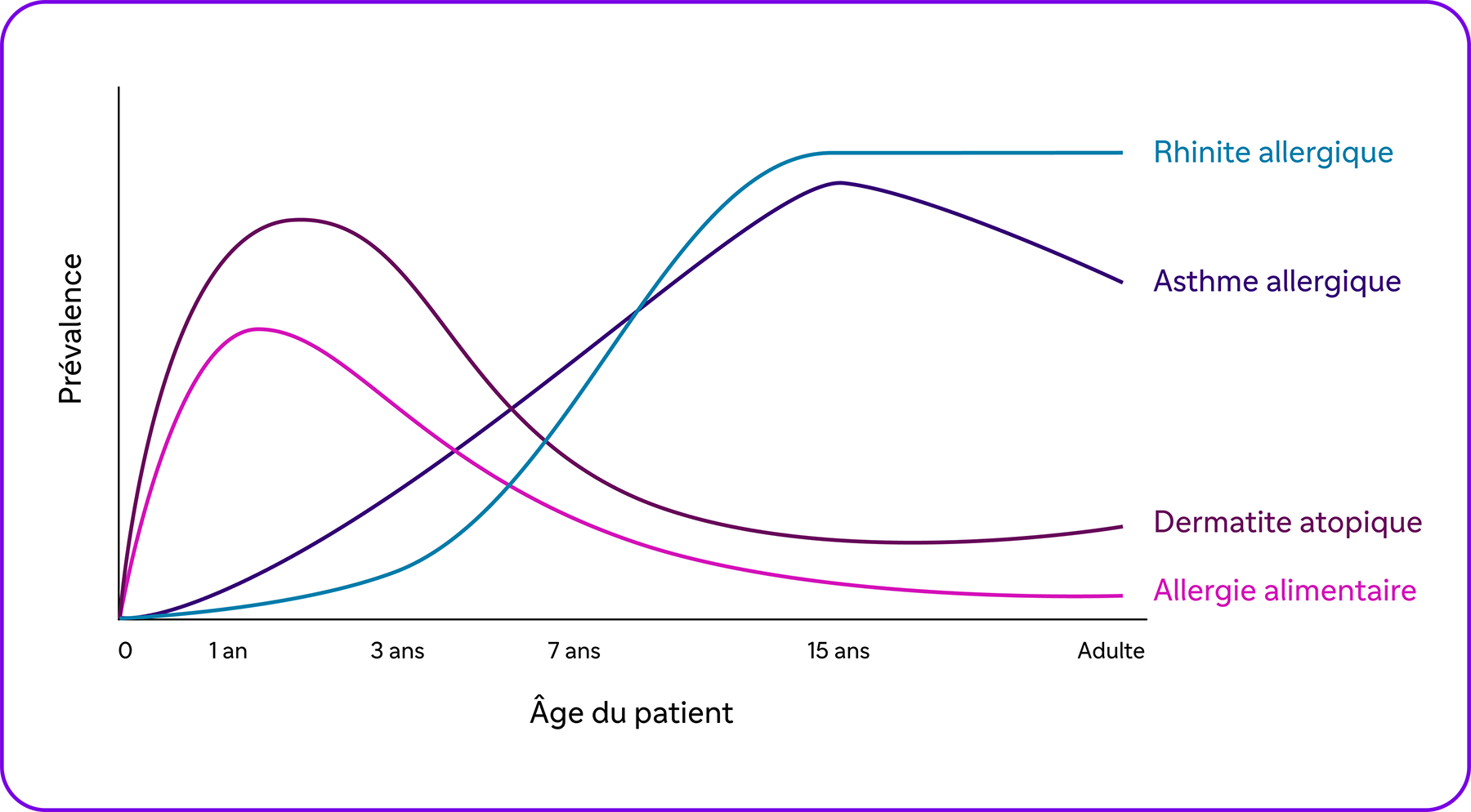
Adapté de Tsuge et al. 2021.
Le dysfonctionnement de la barrière cutanée puis de l’activation de l’inflammation de type 2 est suivi de la distribution des cellules mémoires Th2 vers les tissus comme les poumons et le nez7. Les patients pourraient alors développer les autres maladies atopiques7.
Le saviez-vous ?
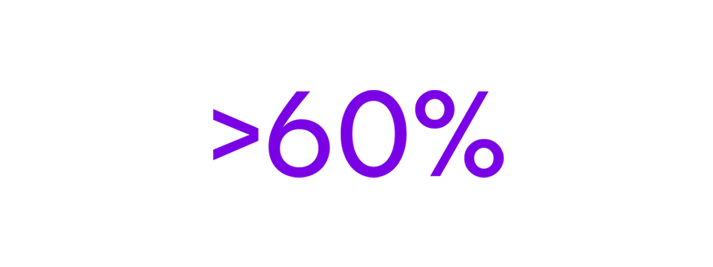
Des enfants avec une dermatite atopique sévère souffrent d'asthme7.

Des enfants avec une dermatite atopique de début précoce ont une allergie alimentaire7.
Vous souhaitez en savoir plus sur les comorbidités chez l’enfant : découvrez l’article.
Découvrez Derm’Action, le podcast d’échanges entre patients et experts.
Les Dr Ariane Nemni, cheffe de service d’allergologie adulte / enfant à l’hôpital Robert Ballanger à Aulnay-Sous-Bois et Pascale Mathelier-Fusade, dermatologue et allergologue à l’hôpital Tenon, à Paris ont échangé ensemble sur l'importance d'une collaboration pluridisciplinaire afin d'identifier et de traiter les comorbidités associées chez les patients souffrant de dermatite atopique.
7000043074 - 06/2023
ADCT : Atopic Dermatitis Control Tool ; IFN : Interféron ; IgE : Immunoglobuline E ; IL : interleukine ; ILC2 : innate lymphoid cell type 2 ; LTh : Lymphocyte T auxillaire (helper) ; NK : Cellule natural killer ; Tc : cellule cytotoxique ; TSLP : lymphopoïétine stromale thymique ; TNF : Tumor necrosis factor.

Références
- Ständer S, et al. IFSI-guideline on chronic prurigo including prurigo nodularis. Itch. 2020;5:e42.
- Misery L, et al. Prevalence and management of chronic nodular prurigo (CNPG) in Brittany (France) : estimation by matching two databases. J Eur Acad Dermatol Venereol. 2021;35:e539-e618.
- Steinke S, et al. Humanistic burden of chronic pruritus in patients with inflammatory dermatoses: Results of the European Academy of Dermatology and Venereology Network on Assessment of Severity and Burden of Pruritus (PruNet) cross-sectional trial. J Am Acad Dermatol. 2018;79(3):457-463.
- Zeidler C, et al. Chronic Prurigo of Nodular Type: a review. Acta Derm Venereol. 2018;98(2):173-179.
- Zeidler C, Yosipovitch G, Ständer S. Prurigo Nodularis and its management. Dermatologic Clinics. 2018;36(3):189-197.
- Schut C, et al. Occurrence, Chronicity, and Intensity of itch in a clinical consecutive sample of patients with skin diseases: a multi-centre study in 13 european countries. Acta Derm Venereol. 2019;99:146- 151.
- Elmariah S, et al. Practical approaches for diagnosis and management or prurigo nodularis: US expert panel consensus. J Am Acad Dermatol. 2020;S0190-9622(20)32189-7.
- Kwatra SG. Breaking the Itch-Scratch Cycle in Prurigo Nodularis. N Engl J Med. 2020;382(8):75-758.
- Williams KA, et al. Prurigo Nodularis: Pathogenesis and Management. J Am Acad Dermatol. 2020;83(6):1567-1575.
- Williams KA, et al. Pathophysiology, diagnosis, and pharmacological treatment of prurigo nodularis. Expert Rev Clin Pharmacol. 2021;14(1):67-77.
- Garcovich S, et al. Pruritus as a Distinctive Feature of Type 2 inflammation. Vaccines (Basel). 2021;9(3):303.
- Agelopoulos K, et al. Cutaneous neuroimmune crosstalk in pruritus. Trends Mol Med. 2022;28(6):452-462.
- Hashimoto T, et al. Dermatol Periostin : a New Player in Itch of Prurigo Nodularis. Acta Derm Venereol. 2021;101(1):adv00375.
- Sutaria N, et al. Cutaneous Transcriptomics Identifies Fibroproliferative and Neurovascular GeneDysregulation in Prurigo Nodularis Compared with Psoriasis and Atopic Dermatitis. J Invest Dermatol. 2022;142(9):2537-2540.
- Hughes JM, et al. Association between Prurigo Nodularis and Etiologies of Peripheral Neuropathy: Suggesting a Role for Neural Dysregulation in Pathogenesis. Medicines (Basel). 2020;7(1).
- Pereira MP, et al. Chronic nodular prurigo : clinical profile and burden. A European cross-sectional study. JEADV. 2020;34(10):2373-2383.
7000045566 – 01/2024