- Recurso
- Fuente: Campus Sanofi
- 30 abr 2024
Monografía: Leflunomida y terapias biológicas en las artropatías inflamatorias crónicas
Leflunomida frente a la terapia biológica

Formato PDF, 13 páginas
Una revisión sistemática de la evidencia y metaanálisis, realizados por la Fundación Cochrane en 2010, incluyó estudios que comparaban la LEF con terapias biológicas anti-TNF alfa (adalimumab [ADA], etanercept [ETN] e infliximab [INF]) en el tratamiento de la artritis reumatoide (AR); la mayoría de estos fueron estudios abiertos con muestras reducidas de pacientes1-3.
Según esta revisión sistemática1, en la AR, las respuestas en la escala del American College of Rheumatology (ACR) de 20, 50 y 70 en pacientes tratados con anti-TNF + MTX son marginalmente superiores a las obtenidas en sujetos tratados con LEF en monoterapia, al cabo de 24 semanas de tratamiento, y no existen entre ellas diferencias estadísticamente significativas. Sin embargo, la respuesta ACR-70 es significativamente más alta para la terapia combinada anti-TNF + MTX con respecto a los individuos que recibieron monoterapia con LEF (riesgo relativo [RR]: 3,75; intervalo de confianza [IC] del 95%: 1,35-10,43).
Después de 24 semanas de seguimiento, el recuento de articulaciones dolorosas y el de articulaciones inflamadas mejoró más en los pacientes con AR tratados con anti-TNF + MTX frente a los que recibieron solo LEF. La diferencia ponderada de las medias en el recuento de articulaciones dolorosas fue de 3,3 articulaciones (IC del 95%: 1,88-4,72) y para el de articulaciones inflamadas fue de 1,4 articulaciones (IC del 95%: 0,22-2,58).
El tratamiento combinado anti-TNF + MTX redujo la intensidad del dolor medido por la escala analógica visual con más eficiencia que la LEF sola en la semana 24 (diferencia ponderada de las medias: 11 mm; IC del 95%: 1,20-20,71).
El cambio medio desde la situación basal en el índice índice de actividad de la enfermedad con recuento de 28 articulaciones (DAS28, Disease Activity Score 28) fue significativamente mayor en los sujetos con AR tratados con anti-TNF + MTX frente a la monoterapia con LEF a las 24 semanas (diferencia ponderada de las medias: 0,80 puntos; IC del 95%: 0,43-1,179). No se observaron diferencias estadísticamente significativas en el número de pacientes que obtuvieron la remisión clínica de la enfermedad (determinada por una puntuación del DAS menor de 2,6 puntos) entre ambos grupos de terapia (RR: 1,67; IC del 95%: 0,38-7,39). Aunque la terapia combinada anti-TNF + MTX produce mayor número de casos de baja actividad de la enfermedad, según la European League Against Rheumatism (EULAR) (DAS28 <3,2), el número de pacientes tratados con LEF con actividad EULAR moderada o alta no fue diferente de los que recibieron anti-TNF + MTX. LEF se comparó también con rituximab (RTX)4 (Figura 1).
Figura 1. Leflunomida frente a rituximab (500 mg) para el tratamiento de la artritis reumatoide con respuesta inadecuada a metotrexato. Respuestas en la semana 244.
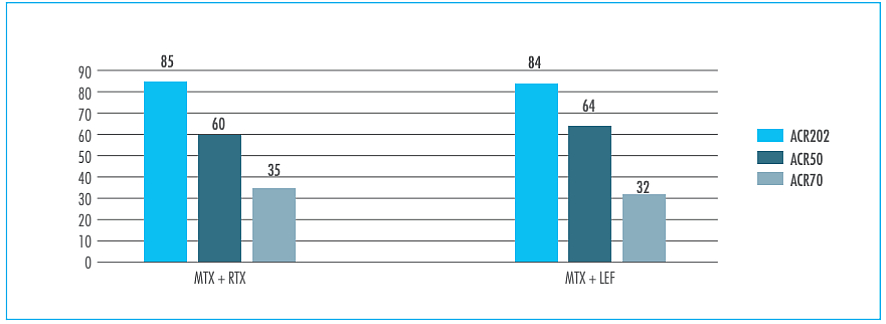
ACR: American College of Rheumatology; LEF: leflunomida (10-20 mg diarios); MTX: metotrexato; RTX: rituximab (intravenoso, 500 mg en días 1 y 15). Fuente: elaboración propia.
Leflunomida + terapia biológica frente a monoterapia con anti-TNF
Se ha analizado1 el efecto en las respuestas de eficacia de la combinación de LEF junto con un antiTNF. Así, la respuesta ACR-20 en los pacientes tratados con ADA + LEF es significativamente mejor que en los que recibieron el ADA en monoterapia. Después de 12 semanas de tratamiento (RR: 0,83; IC del 95%: 0,89-0,99), no se obtuvieron diferencias estadísticamente significativas en la respuesta ACR-50 entre ambos grupos de tratamiento en el mismo periodo de observación.
El número de pacientes que cumplieron los criterios de la EULAR de buena respuesta clínica no fueron estadísticamente diferentes entre ambas opciones de tratamiento. Menos pacientes en el grupo ADA + LEF obtuvieron respuestas EULAR moderadas con respecto al grupo que recibió ADA en monoterapia (RR: 0,83; IC 95%: 0,73-0,93). La calidad de toda esta información es de categoría plata.
Terapia combinada de leflunomida + fame biológico
Cuando MTX está contraindicado, es ineficaz o produce intolerancia, es preciso disponer de otros FAME, que, como el MTX, cuando se combinan con los tratamientos biológicos, mejoren la eficacia de estos, con un perfil similar de seguridad. Se trata de buscar la existencia de FAME clásicos sintéticos distintos del MTX que puedan usarse combinados, por ejemplo, con anti-TNF. Una de las alternativas es la LEF, por su sencilla forma de administración, buena tolerancia y eficacia demostrada en ensayos clínicos y por haber sido probablemente el FAME clásico sintético mejor y más ampliamente estudiado en combinación con terapias biológicas.
Se han publicado diferentes estudios que evalúan la eficacia de FAME distintos de MTX combinados con tratamientos biológicos anti-TNF, anti-CD20 (RTX) y antiinterleucina-6 (tocilizumab [TCZ]). La mayoría son estudios de cohortes.
Combinaciones con anti-TNF
Existe un estudio observacional longitudinal5 de una cohorte poblacional suiza de 1.218 pacientes seguidos durante 17 meses, que analiza diferentes combinaciones de tratamiento: MTX + anti-TNF (n = 842), LEF + anti-TNF (n = 260) y otros FAME + anti-TNF (n = 116). No encuentra diferencias significativas entre las combinaciones de anti-TNF con los tres grupos de FAME en cuanto a la progresión del daño radiográfico, discapacidad funcional medida por el cuestionario de discapacidad de evaluación de la salud (HAQ, Health Assessment Questionnaire) o actividad de la enfermedad medida por DAS28. El perfil de seguridad fue similar entre los tres grupos de terapia. Los autores concluyen que LEF y potencialmente otros FAME son tan eficaces y seguros como MTX en combinación con distintos anti-TNF.
Un ensayo clínico prospectivo6, con una muestra de 120 pacientes, evaluó la eficacia y tolerabilidad de la combinación de LEF o MTX con agentes anti-TNF. Los pacientes recibían primero el MTX o la LEF y se les añadió de forma aleatorizada tres terapias biológicas (ETN, ADA e INF) con valoración a las 4, 12 y 24 semanas.
Los dos grupos se dividieron a su vez en tres grupos de 20 pacientes, de acuerdo con el anti-TNF empleado. A las 24 semanas, no hubo diferencias significativas en variaciones del DAS28 entre los dos grupos y los seis subgrupos (p = 0,29): el grupo de MTX + anti-TNF alcanzó un DAS28 medio de 3,3 ± 1,4 (p = 0,0001), y el grupo LEF + anti-TNF, de 3,5 ± 1,0 (p = 0,0001). La remisión (medida por DAS28 <2,6) fue alcanzada por 13 pacientes (21,6%) en el grupo de MTX + anti-TNF y por 10 (16,6%) en el grupo LEF + anti-TNF.
Dentro de la cohorte de pacientes incluida en el registro alemán de biológicos RABBIT7, se evaluaron 1.760 pacientes tratados con anti-TNF (ADA, ETN o INF) en combinación con MTX (n = 1375) o LEF (n = 394) durante un periodo de seguimiento de 36 meses. Cuando se compararon las combinaciones de los tres anti-TNF con MTX y con LEF, las diferencias no fueron significativas (p = 0,15, ITT p = 0,08). Tampoco hubo diferencias significativas en alcanzar una buena respuesta EULAR en ambos grupos ni en la mejoría de la capacidad funcional. Las ratios de supervivencia a los tres años fueron similares para los dos FAME en tratamiento combinado.
Un estudio de cohortes del registro de biológicos de la Sociedad Británica de Reumatología8 no encontró tampoco diferencias significativas en AR de larga evolución, graves y refractarias a varios FAME, que iniciaban su primer tratamiento biológico, cuando comparó la eficacia de anti-TNF (INF o ETN) en monoterapia, frente a la combinación con MTX y con otros FAME, después de seis meses de seguimiento en el grupo de tratamiento combinado con MTX frente a tratamiento combinado con otros FAME (odds ratio o razón de probabilidades: 1,04; IC del 95%: 0,71-1,53).
Sin embargo, en un estudio de cohortes holandés9, con una muestra total de 1.933 pacientes que iniciaban su primer anti-TNF, provenientes del registro biológico DREAM, que comparó la efectividad y la supervivencia de seis grupos de tratamiento durante 12 meses, los resultados fueron: anti-TNF en monoterapia (n = 320), anti-TNF + MTX (n = 919), anti-TNF + LEF (n = 80), anti-TNF + sulfasalacina (SSZ) (n = 103), anti-TNF + otros FAME (n = 99) y anti-TNF + MTX + otros FAME (n = 412); los grupos que mostraron peor evolución del DAS28, HAQ y menor supervivencia respecto a anti-TNF + MTX fueron anti-TNF en monoterapia y anti-TNF + LEF
Combinaciones con rituximab
Existen dos estudios de cohortes10-11 que evalúan la situación en pacientes que reciben RTX. En el estudio de colaboración CERERRA10, se analiza la información agrupada de 2.265 pacientes procedentes de diez registros europeos. Se comparó la efectividad y la seguridad de RTX en monoterapia (n = 506) y en combinación con MTX (n = 1.195) y LEF (n = 177). El porcentaje de pacientes que alcanzaron una buena respuesta EULAR a los seis meses en el grupo de RTX + LEF (29,1%) fue superior comparado con RTX + MTX (21,1%) y con RTX en monoterapia (19,3%; p = 0,02 y p = 0,01, respectivamente). Resultados similares se observaron a los 12 meses. La frecuencia de acontecimientos adversos fue similar entre los tres grupos.
Una explotación de datos del registro RABBIT11 en 907 pacientes con AR que no habían recibido previamente MTX comparó tres grupos de tratamiento (RTX + MTX, RTX + LEF y RTX en monoterapia) durante un periodo mayor, de tres años duración. La frecuencia y el tiempo de retratamiento con RTX fue similar en los tres grupos (p >0,62), al igual que la mejoría en el DAS28 a lo largo del periodo de estudio (p >0,15). Los autores concluyen que los tres grupos de tratamiento parecen ser igual de efectivos, y que para los pacientes intolerantes a MTX, la combinación RTX + LEF es una buena opción también a largo plazo.
AMARA (Addition of Mabhera to Arava in the Rheumatoid Arthritis) 12 es un estudio promovido por investigadores, prospectivo, aleatorizado, doble-ciego, controlado con placebo, en el que se analizó la eficacia y seguridad de LEF + RTX comparativamente con LEF + placebo en el tratamiento de pacientes con AR activa, con respuesta inadecuada a LEF.
En la semana 24 del ensayo, la mejoría fue mayor en los pacientes que recibieron LEF + RTX. Esta mejoría fue además mayor en los pacientes que recibieron en la visita basal, como primer tratamiento, dos dosis de 1.000 mg. Una segunda fase de este estudio intentó analizar cuál era la dosis óptima de RTX para combinar con LEF en el retratamiento. Todos los pacientes fueron aleatorizados para recibir 500 x 2 o 1.000 x 2 mg de RTX en las semanas 24/26 desde la visita basal de la primera parte, combinados con la dosis estándar de LEF.
En la semana 52 de seguimiento, no se observaron diferencias significativas en la respuesta (medida por el valor del índice de actividad DAS28) entre las dos dosis de RTX en los pacientes que recibieron originalmente RTX y los que recibieron placebo. Los acontecimientos adversos fueron similares en todos los grupos analizados. Los autores concluyen que el retratamiento con dosis de 500 y 1.000 mg de RTX + LEF muestra una eficacia comparable, mientras que al comienzo de la terapia combinada RTX + LEF, la dosis de 500 mg de RTX se asocia a peor respuesta.
Combinación con tocilizumab
Por lo que respecta a TCZ, un estudio de cohortes español13 comparó su eficacia en combinación con MTX frente a la combinación con LEF. Se incluyeron 91 pacientes en los que se analizó la eficacia y la seguridad durante un seguimiento de seis meses. La puntuación DAS28 mejoró en 2,23 ± 1,38 con TCZ + MTX y en 2,17 ± 1,43 con TCZ + LEF. El porcentaje de pacientes en remisión (medido por DAS28- velocidad de sedimentación globular <2,6, índice simplificado de actividad de la enfermedad (SDAI, Simplified Disease Activity Index) ≤3,3, índice clínico de actividad de la enfermedad (CDAI, Clinical Disease Activity Index) ≤2,8 y criterios ACR-EULAR de 2010) fue similar entre los grupos. Tampoco hubo diferencias significativas en cuanto a efectos adversos.
Leflunomida frente a metotrexato en combinación con FAME biológicos o sintéticos dirigidos
Stefano et al.6 realizaron un ensayo clínico en el que incluyeron a pacientes adultos con AR activa (con alta actividad de la enfermedad) con respuesta inadecuada a MTX (15 mg semanales) o LEF (20 mg diarios). Los sujetos fueron aleatorizados para recibir terapia biológica anti-TNF: (ADL, ETN o INF) que se combinó al azar con MTX o con LEF a las dosis ya mencionadas.
Se realizó una evaluación prospectiva hasta las 24 semanas; en este momento, no se observaron diferencias estadísticamente significativas en las respuestas ACR o en la variación del índice DAS28 entre ninguno de los seis subgrupos estudiados.
Los autores concluyen que los fármacos anti-TNF alfa pueden ser usados en combinación no solo con MTX, sino también con LEF, con la misma probabilidad de alcanzar una mejoría clínica significativa y sin aumento significativo del riesgo de acontecimientos adversos.
Una revisión sistemática con un metaanálisis14 comunicada recientemente ha analizado si debemos preferir la LEF al MTX para combinar con agentes biológicos. Los autores realizan su investigación para indagar, cuando se utiliza un FAME biológico en la AR, cuál es el mejor FAME sintético con el que se debe combinar. El análisis se realiza en términos de efectividad y seguridad. También se tienen en cuenta la tasa de retención y la supervivencia de la combinación.
Para resolver el interrogante planteado, consultan diferentes bases de datos bibliográficas (PubMed-Medline, EMBASE, abstracts de los congresos del ACR y la EULAR) y recogen publicaciones en inglés, francés o español, hasta marzo de 2018. Las opciones de tratamiento que analizan son combinaciones de MTX o LEF/otro FAME sintético distinto de MTX + FAME biológico/jakinibs (cinasas Jano [JAK]).
Se identificaron 3.842 referencias, de las que finalmente se incluyeron 26 estudios, la mayoría con agentes anti-TNF y RTX. En este último caso, el RR de conseguir una respuesta EULAR buena favorece a la LEF frente al MTX (RR: 1,46; IC del 95%: 1,25-1,70; p <0,001). También se observan, para el RTX, menos acontecimientos adversos cuando se combina con LEF que con MTX (RR: 0,73; IC del 95%: 0,52-1,03; p = 0,07).
Con respecto a los sujetos que recibieron anti-TNF, la probabilidad de conseguir una respuesta EULAR buena o moderada es mayor cuando se combinan con MTX que con otros FAME sintéticos. En este caso, el RR es de 0,88, con un IC de 0,81-0,96, p = 0,004. El cambio en el DAS28 a los seis meses también favorece a los tratados con la combinación con MTX. El riesgo de interrumpir el tratamiento con un anti-TNF es similar independientemente de que se combinen con MTX o con otro FAME sintético.
Aunque existen algunas descripciones de casos clínicos tratados con la combinación de LEF y abatacept o TCZ, los datos disponibles son insuficientes para establecer conclusiones.
Los inhibidores de JAK pueden utilizarse como monoterapia para el tratamiento de la AR o en combinación con MTX. Aunque muchos estudios han demostrado una eficacia similar para estas dos alternativas terapéuticas, la experiencia clínica obliga a utilizar la terapia de inhibidores de JAK + MTX, especialmente en pacientes refractarios que han fallado con múltiples líneas previas de tratamiento. Sin embargo, al iniciar esta asociación terapéutica, entre el 18 y el 35% de los sujetos tiene que interrumpir el MTX por la aparición temprana de efectos adversos. En este contexto, y aunque todavía se dispone de poca información, la LEF podría constituir una alternativa válida por la complementariedad de mecanismos de acción15-16.
Es preciso recordar que la LEF generalmente se utiliza tras fallo o intolerancia a MTX y, después, se añade el biológico. Puede haber un sesgo de selección en los estudios, ya que muchas veces la LEF se utiliza como segunda opción tras MTX, y ello puede condicionar una mayor gravedad de la AR (Tabla 1)17. Por ello, debemos tener prudencia al extrapolar estos datos más arriba expuestos a la AR de inicio, ya que, en la mayoría de los estudios comentados, la población estudiada contiene muchos pacientes con AR de larga evolución con historia de fallo a FAME y biológicos previos.
Indudablemente son necesarios más estudios aleatorizados para definir el papel del tratamiento combinado de FAME biológicos con LEF, sobre todo, con otros FAME clásicos sintéticos/FAME sintéticos dirigidos, y también para establecer la persistencia de la eficacia en el tiempo y evaluar la progresión del daño radiológico a largo plazo. De cualquier manera, con todo lo expuesto, podríamos concluir que la adición de LEF a la terapia biológica ofrece probablemente, frente a la alternativa de MTX, la misma probabilidad de alcanzar una mejoría clínica en pacientes con AR, sin un mayor riesgo de efectos secundarios18.
|
Estudio |
Diseño/duración/ |
Intervenciones (n) |
Eficacia: respuestas ACR-20, 50, 70 (%) |
|
Fleischmann 201419 |
Datos agregados. APPEAL + Latin RA. 16 semanas. Jadad 4. |
- ETN + MTX (n = 478). - HCQ + MTX (n = 81). - SSZ + MTX (n = 95). - LEF + MTX (n = 69). |
82, 56, 24 59, 31,12 54, 20, 6 62, 38, 7 |
|
Kremer 200220 |
Doble ciego. Controlado. 24 semanas. Jadad 5. |
- MTX (15-20 mg/sem) + placebo (n = 130). - MTX + LFN 100 mg/día, dos días → LFN 10 mg/día (si hay actividad, ↑ dosis a 20 mg/día) (n = 133). |
19, 6, 2 46, 26, 10 |
|
Wijesinghe 20174 |
Doble ciego. Controlado. 24 semanas. Jadad 5. |
- RTX + MTX: RTX 500 mg intravenoso los días 0 y 14 + MTX (n = 20). - LEF + MTX: LFN 10 mg/día (hasta 20 mg/día) + MTX (n = 19). |
85, 60, 35 84, 64, 32 |
ACR: American College of Rheumatology; ETN: etanercept; HCQ: hidroxicloroquina; LEF: leflunomida; MTX: metotrexato; RTX: rituximab; sem.: semana; SSZ: salazopirina.
Conclusiones
- Muchos agentes biológicos, especialmente los agentes anti-TNF, necesitan ser combinados con un FAME sintético para obtener la mejor respuesta clínica. La mayoría de las veces, los estudios se han realizado combinando el agente biológico con MTX, pero podrían existir otras alternativas de FAME clásicos sintéticos, incluyendo fundamentalmente la LEF, que resultarán de igual o superior efectividad.
- La combinación de anti-TNF + LEF es igual de efectiva que la combinación de anti-TNF + MTX valorada por DAS285-7, discapacidad funcional HAQ5-6, respuesta ACR6, respuesta EULAR7-8 y progresión radiológica5. La combinación de LEF con ADA se muestra efectiva y segura a largo plazo21.
- La combinación de RTX + LEF resulta igual o más efectiva que la combinación de RTX + MTX valorada por DAS2812,14; y más efectiva valorada por HAQ y respuesta EULAR14.
- La combinación de TCZ + LEF resulta igual de efectiva que la combinación de TCZ + MTX en términos de DAS28, discapacidad funcional y reactantes de fase aguda13.
Autor

Dr. Jesús Tornero
Servicio de Reumatología. Hospital General Universitario de Guadalajara Departamento de Medicina y Especialidades Médicas. Universidad de Alcalá. Madrid
Contenido mínimo de AravaTM
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
Arava 10 mg comprimidos recubiertos con película. Envase de 30 comprimidos (CN: 848093.7); P.V.P: 25,92€. P.V.P IVA: 26,96€. Medicamento sujeto a prescripción médica. Diagnóstico hospitalario. Financiado por el SNS. Aportación reducida. Con visado de inspección.
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
Arava 20 mg comprimidos recubiertos con película. Envase de 30 comprimidos (CN: 8481354); P.V.P:
51,85€. P.V.P IVA: 53,92€. Envase de 100 comprimidos (CN: 7274797); P.V.P: 161,04€. P.V.P IVA: 167,48€. Medicamento sujeto a prescripción médica. Diagnóstico hospitalario. Financiado por el SNS. Aportación reducida. Con visado de inspección.

Referencias
- Osiri M, Shea B, Robinson V, Suárez-Almazor M, Strand V, Tugwell P, et al. Leflunomide for treating rheumatoid arthritis. Cochrane Database Syst Rev. 2003;2002(1):CD002047.
- Mariette X, Bijlsma JWJ, Herold M, Eiselstein J, Spencer-Green GT, Kupper H. Eficacy evaluation of adalimumab (Humira®) in combination with single and multiple disease modifying antirheumatic drugs in the REACT trial. [Póster FRI0099]. Ann Rheum Dis. 2004;63 Supl 1:278.
- Wislowska M, Jakubicz D. Preliminary evaluation in rheumatoid arthritis activity in patients treated with TNF-alpha blocker plus methotrexate versus methotrexate or leflunomide alone. Rheumatol Int. 2007;27(7):641-7.
- Wijesinghe H, Galappatthy P, De Silva R, Seneviratne SL, Saravanamuttu U, Udagama P, et al. Leflunomide is equally efficacious and safe compared to low doce rituximab in refractory rheumatoid arthritis given in combination with methotrexate: results from a randomized double blind controlled clinical trial. BMC Musculoskelet Disord. 2017;18(1):310.
- Finckh A, Dehler S, Gabay C. The effectiveness of leflunomide as a co-therapy of tumour necrosis factor inhibitors in rheumatoid arthritis: a population-based study. Ann Rheum Dis. 2009;68(1):33-9.
- De Stefano R, Frati E, Nargi F, Baldi C, Menza L, Hammoud M, et al. Comparison of combination therapies in the treatment of rheumatoid arthritis: leflunomide-anti-TNF-alpha versus methotrexate-antiTNF-alpha. Clin Rheumatol. 2010;29(5):517-24.
- Strangfeld A, Hierse F, Kekow J, Von Hinueber U, Tony HP, Dockhorn R, et al. Comparative effectiveness of tumour necrosis factor alpha inhibitors in combination with either methotrexate or leflunomide. Ann Rheum Dis. 2009;68(12):1856-62.
- Hyrich KL, Symmons DP, Watson KD, Silman AJ; British Society for Rheumatology Biologics Register. Comparison of the response to infliximab or etanercept monotherapy with the response to cotherapy with methotrexate or another disease-modifying antirheumatic drug in patients with rheumatoid arthritis: results from the British Society for Rheumatology Biologics Register. Arthritis Rheum. 2006;54(6):1786-94.
- Manders SH, Kievit W, Jansen TL, Stolk JN, Visser H, Schilder AM, et al. Effectiveness of tumor necrosis factor inhibitors in combination with various csDMARD in the Treatment of Rheumatoid Arthritis: Data from the DREAM Registry. J Rheumatol. 2016;43(10):1787-94.
- Chatzidionysiou K, Lie E, Nasonov E, Lukina G, Hetland ML, Tarp U, et al. Effectiveness of diseasemodifying antirheumatic drug co-therapy with methotrexate and leflunomide in rituximab-treated rheumatoid arthritis patients: results of a 1-year follow-up study from the CERERRA collaboration. Ann Rheum Dis. 2012;71(3):374-7.
- Richter A, Strangfeld A, Herzer P, Wilden E, Bussmann A, Listing J, et al. Sustainability of rituximab therapy in different treatment strategies: results of a 3-year followup of a German biologics register. Arthritis Care Res. 2014;66(11):1627-33.
- Koehm M, Foldenauer AC, Rossmanith T, Alten R, Aringer M, Backhaus M, et al. Effectiveness of Different Rituximab Doses Combined with Leflunomide in the Treatment or Retreatment of Rheumatoid Arthritis: Part 2 of a Randomized, Placebo-Controlled, Investigator-Initiated Clinical Trial (AMARA). J Clin Med. 2022;11(24):7316.
- Narváez J, Díaz-Torne C, Magallares B, Hernández MV, Reina D, Corominas H, et al. Comparative effectiveness of tocilizumab with either methotrexate or leflunomide in the treatment of rheumatoid arthritis. PLoS One. 2015;10(4):e0123392.
- Decarriere G, Barnetche T, Lukas C, Gaujoux-Viala C, Combe B, Morel J, et al. Should We Prefer Leflunomide to Methotrexate in Combination with Biologics? a Systematic Review and a Meta-Analysis. [Abstract 2822]. Arthritis Rheumatol. 2018;70 Supl 9.
- Zhang X, Zhang M, Wang Z, Liu Y, Wang Y, Liu J, et al. Comparative efficacy and safety of JAK inhibitors and leflunomide in rheumatoid arthritis. A protocol for systematic review and meta-analysis. Medicine. 2022;101(49):e32154.
- Kvacskay P, Blank N, Lorenz HM, Merkt W. Leflunomide in combination with JAK inhibitors in the treatment of rheumatoid arthritis: a case series. Rheumatology. 2022;61:e280-1.
- Calvo Alén J, Pérez T, Romero Yuste S, Ferraz-Amarod I, Alegre Sancho JJ, Pinto Tasende JA, et al. Eficacia y seguridad de la terapia combinada con fármacos modificadores de la enfermedad sintéticos en la artritis reumatoide: revisión sistemática de la literatura. Reumatol Clin. 2020;16(5 Pt 1):324-32.
- Grupo de trabajo de la Guipcar. Guía de Práctica Clínica para el manejo de pacientes con artritis reumatoide: Guipcar´17. Madrid: Sociedad Española de Reumatología; 2019.
- Fleischmann R, Koenig AS, Szumski A, Nab HW, Marshall L, Bananis E. Short-term efficacy of etanercept plus methotrexate vs. combinations of disease-modifying anti-rheumatic drugs with methotrexate in established rheumatoid arthritis. Rheumatology. 2014;53(11):1984-93.
- Kremer J, Genovese M, Cannon GW, Caldwell J, Cush J, Furst DE, et al. Combination leflunomide and methotrexate therapy for patients with active rheumatoid arthritis failing MTX monotherapy: open-label extension of a randomized, double-blind, placebo controlled trial. J Rheumatol. 2004;31(8):1521-31.
- Burmester GR, Matucci-Cerinic M, Mariette X, Navarro-Blasco F, Kary S Unnebrink K, Kupper H. Safety and effectiveness of adalimumab in patients with rheumatoid arthritis over 5 years of therapy in a phase 3b and subsequent postmarketing observational study. Arthritis Res Ther. 2014;16(1):R24.
MAT-ES-2400133-V.1-Enero 2024
