
Indicación y posología
El tratamiento con Timoglobulina está indicado en la prevención y tratamiento de episodios de rechazo en el trasplante renal. La posología depende de la indicación, del régimen de administración y de la posible combinación con otros inmunosupresores. Se podrían usar las siguientes recomendaciones posológicas como referencia:1
|
Indicación | Prevención del rechazo en el trasplante | Tratamiento del rechazo en trasplante renal |
| Dosis | 1 a 1,5 mg/kg/día | 1,5 mg/kg/día |
| Duración | De 3 a 9 días desde el trasplante renal | De 7 a 14 días |
| Dosis acumulada | 3 a 13,5 mg/kg | 10,5 a 21 mg/kg |
Posología
Guía práctica sobre la administración de Timoglobulina®: reconstitución, perfusión y medidas de seguridad esenciales.

Profilaxis del rechazo agudo
En un estudio internacional, aleatorizado y abierto, se compararon ciclos cortos de Timoglobulina y basiliximab en pacientes con alto riesgo de rechazo agudo o función retrasada del injerto que recibieron un trasplante de donante fallecido.2
Paciente con trasplante renal de donante fallecido con elevado riesgo de rechazo agudo o de función retrasada del injerto (N=278)

Endpoint principal
Endpoint compuesto por: rechazo agudo comprobado por biopsia (BPAR) (grado I-III), pérdida del injerto, muerte o seguimiento hasta la pérdida (considerado como fallo de tratamiento).
El primer tratamiento de inducción se inició previo a la repercusión del trasplante. Todos los pacientes recibieron triple terapia de inmunosupresión de mantenimiento (ciclosporina, micofenolato de mofetilo y corticoesteroides).
La timoglobulina (n=141) se asoció con una incidencia reducida (15,6 % frente a 25,5 %, P=0,02) y gravedad (1,4 % que requirió tratamiento con anticuerpos frente a 8,0 %, P=0,005) de rechazo renal agudo frente a basiliximab (n=137) en pacientes con alto riesgo de rechazo agudo o retraso en la función del injerto que recibieron un trasplante renal de un donante fallecido.2
Resultados de eficacia tras 12 meses del trasplante renal
|
Endpoint |
ATG (n=141) |
Basiliximab (n=137) |
P |
|
Compuesto de: rechazo agudo, función retrasada del injerto, pérdida del injerto, muerte, n (%). |
71 (50,4) |
77 (56,2) |
0,34 |
|
Rechazo agudo comprobado por biopsia, n (%) |
22 (15.6) |
35 (25,5) |
0,02 |
|
Rechazo agudo tratado con anticuerpos, n (%) |
2 (1,4) |
11 (8) |
0,005 |
|
Función retrasada del injerto, n (%) |
57 (40,4) |
61 (44,5) |
0,54 |
|
Pérdida del injerto, n (%) |
13 (9,2) |
14 (10,2) |
0,68 |
|
Muerte, n (%) |
6 (4,3) |
6 (4,4) |
0,9 |
Tabla extraída de Brennan DC, et al.2
Variables de eficacia a 12 meses del trasplante
|
Variable |
Globulina antitimocítica (N=141) |
Basiliximab (N=137) |
P |
|
Compuesta de rechazo agudo, función retrasada del injerto, pérdida del injerto y muerte |
71 (50,4) |
77 (56,2) |
0,34 |
|
Rechazo agudo comprobado por biopsia |
22 (15.6) |
35 (25,5) |
0,02 |
| - No. de recepetores de raza negra/No. total de dichos recipientes | 8/41 (19.5) | 13/39 (33,3) | 0,14 |
| - No. de receptores sin ser de raza negra/No. total de dichos recipientes | 14/100 (14,0) | 22/98 (22,4) | 0,07 |
| - No. de receptores en Estados Unidos/No. total de dichos recipientes | 13/91 (14,3) | 21/92 (22,8) | 0,07 |
| - No. de receptores en Europa/No. total de dichos recipientes | 9/50 (18,0) | 14/45 (31,1) | 0,12 |
|
Rechazo agudo mediado por anticuerpos, n (%) |
2 (1,4) |
11 (8) |
0,005 |
|
Función retrasada del injerto, n (%) |
57 (40,4) |
61 (44,5) |
0,54 |
|
Pérdida del injerto, n (%) |
13 (9,2) |
14 (10,2) |
0,68 |
|
- Por muerte | 4 (2,8) | 3 (2,2) | |
| - Por rechazo agudo | 1 (0,7) | 1 (0,7) | |
| - Por malfunción primaria | 1 (0,7) | 4 (2,9) | |
| - Por trombosis del injerto | 0 | 4 (2,9) | |
| - Por rechazo crónico | 2 (1,4) | 1 (0,7) | |
| - Por infección | 1 (0,7) | 1 (0,7) | |
| - Por efecto tóxico de la ciclosporina | 1 (0,7) | 0 | |
| - Por enfermedad recurrente | 1 (0,7) | 0 | |
| - Por hipertensión | 1 (0,7) | 0 | |
| - Por fístula urinaria | 1 (0,7) | 0 | |
|
Muerte, n (%) |
6 (4,3) |
6 (4,4) |
0,90 |
|
- Por enfermedad cardiovascular | 2 (1,4) | 5 (3,6) | |
| - Por enfermedad pulmonar | 1 (0,7) | 1 (0,7) | |
| - Por enfermedad gastrointestinal | 2 (1,4) | 0 | |
| - Por causa desconocida | 1 (0,7) | 0 |
Tabla extraída de Brennan DC, et al.2
Ambos tratamientos se asociaron con una incidencia similar de eventos adversos y eventos adversos graves.2
Frecuencia de eventos adversos a los 12 meses*
|
Evento adverso |
Globulina antitimocítica (N=141) |
Basiliximab (N=137) |
P valor |
|
Eventos totales |
140 (99.3) |
135 (98.5) |
0,62 |
|
Eventos serios |
103 (73.0) |
99 (72.3) |
0,89 |
| Leucopenia | 47 (33.3) | 20 (14.6) | <0.001 |
| Trombocitopenia | 15 (10.6) | 8 (5.8) | 0,19 |
| Cualquier infección | 121 (85.8) | 103 (75.2) | 0,03 |
| - Tracto urinario | 55 (39.0) | 37 (27.0) | 0,04 |
|
- Probablemente bacteriana u otra |
87 (61,7) |
70 (51.1) |
0,09 |
|
- Confirmada bacteriana |
74 (52.5) |
51 (37.2) |
0,01 |
|
- Citomegalovirus |
11 (7.8) |
24 (17.5) |
0.02 |
|
- Viral diferente a citomegalovirus | 30 (21.3) | 16 (11.7) | 0.04 |
| - Fúngica | 20 (14.2) | 20 (14.6) | 1.00 |
| - Protozoaria | 0 | 1 (0.7) | 0.49 |
| Cáncer | 5 (3.5) | 1 (0.7) | 0.21 |
| - Enfermedad linfoproliferativa post-trasplante | 3 (2.1) | 0 | 0.13 |
| - Carcinoma de células renales en riñón nativo | 1 (0.7) | 1 (0.7) | 1.00 |
| - Carcinoma cutáneo de células escamosas | 1 (0,7) | 0 | 1.00 |
* La leucopenia se definió como un recuento de glóbulos blancos de menos de 2500 por milímetro cúbico. La trombocitopenia se definió como un recuento de plaquetas inferior a 80.000 por milímetro cúbico. Los valores para cada tipo de infección no suman el número total de infecciones porque algunos pacientes tenían más de un tipo de infección.
Tabla extraída de Brennan DC, et al.2
En un ensayo clínico intervencionista, aleatorizado, abierto, de un solo centro, de 12 meses de duración se comparó Timoglobulina vs. basiliximab como terapia de inducción en pacientes de bajo riesgo que recibieron un trasplante de donante vivo.3
Paciente con trasplante renal de donante vivo con bajo riesgo inmunológico (N=100)

Endpoint principal
Rechazo agudo comprobado por biopsia (BPAR), descrito según la clasificación de Banff 2015
El primer tratamiento de inducción se inició previo al procedimiento quirúrgico. Todos los pacientes recibieron triple terapia de inmunosupresión de mantenimiento (tacrolimus, micofenolato de mofetilo y corticoesteroides).
Los resultados del estudio muestran que timoglobulina a dosis bajas tiene una eficacia y seguridad similares en comparación con la inducción de basiliximab en receptores de trasplante renal de bajo riesgo que reciben tacrolimus, MMF y esteroides.3
Resultados de eficacia tras 12 meses del trasplante renal
|
Endpoint | Grupo A: Basiliximab |
Grupo B: Timoglobulina |
Valor P |
|
BPAR a los 12 meses (%) |
2 (3.8) |
3 (6.4) |
0.4 |
|
Clasificación Banff de BPAR |
IB (n = 1) |
IA (n = 1) | |
|
Función retrasada del |
2(3.8) |
2 (4.3) |
0.6 |
|
Función lenta del injerto (%) |
3 (5.7) |
2 (4.3) |
0.5 |
|
Leucopenia |
0 (0) |
3 (6.4) |
0.1 |
|
Trombocitopenia post-operación (%) |
5 (9.5) |
10 (21.3) |
0.09 |
|
Leucopenia a los 12 |
6 (11.3) |
10 (21.3) |
0.1 |
|
CMV |
1 (1.9) |
0 (0) |
0.5 |
|
DNAPT |
1 (1.9) |
2 (4.3) |
0.4 |
|
Cáncer |
0 (0) |
1 (2.1) |
0.4 |
|
Eventos adversos (número) por paciente |
1.3 ± 1.3 |
1.5 ± 1.2 |
0.4 |
|
Hospitalizaciones (número) por paciente |
0.7 ± 0.9 |
0.8 ± 0.8 |
0.6 |
|
TFGe (mL/min/1.73m2) a los 3 meses |
70.9 ± 24.1 |
73.5 ± 43.2 |
0.7 |
|
TFGe (mL/min/1.73m2) a los 6 meses |
73 ± 19.7 |
74.6 ± 27.5 |
0.7 |
|
TFGe (mL/min/1.73m2) a los 12 meses |
69.6 ± 21.3 |
71.4 ± 20.05 |
0.7 |
|
Supervivencia del injerto (%) |
92.5 |
93.6 |
0.5 |
|
Supervivencia (%) |
98.1 |
100 |
0.5 |
Abreviaturas: BPAR, rechazo agudo comprobado por biopsia; CMV, citomegalovirus; DNAPT, diabetes de nueva aparición post-trasplante; TFGe, tafa de filtrado glomerular estimada.
Tampoco hubo diferencias en el número y tipo de eventos adversos relacionados con la terapia de inducción.3
Eventos adversos en los grupos de estudio
|
Eventos |
Grupo A (Basiliximab) |
Grupo B (Timoglobulina) |
|
Infecciones del tracto urinario |
12 |
11 |
| Diarrea | 4 | 4 |
| Quirúrgicas (hernia, colelitiasis, obstrucción del intestino delgado) | 3 | 3 |
| Urológicas (fístula, obstrucción ureteral) | 2 | 3 |
| Gastritis | 2 | 3 |
| Infección superficial en el lugar de incisión | 2 | 3 |
|
Linfocele |
4 |
0 |
|
Infección profunda en el lugar de incisión |
3 |
1 |
|
Neumonía |
2 |
1 |
|
Alteración en test de función hepática | 2 | 1 |
| Dislipemia | 2 | 1 |
| Depresión | 0 | 2 |
| Afección ginecológica | 1 | 1 |
| Caratas | 1 | 0 |
| Estenosis de la arteria renal del trasplante | 1 | 0 |
Tabla extraída de Martínez-Mier G, et al.3
En un estudio internacional, aleatorizado y abierto, se compararon ciclos cortos de Timoglobulina y basiliximab en pacientes con alto riesgo de rechazo agudo o función retrasada del injerto que recibieron un trasplante de donante fallecido.2
Paciente con trasplante renal de donante fallecido con elevado riesgo de rechazo agudo o de función retrasada del injerto (N=278)

Endpoint principal
Endpoint compuesto por: rechazo agudo comprobado por biopsia (BPAR) (grado I-III), pérdida del injerto, muerte o seguimiento hasta la pérdida (considerado como fallo de tratamiento).
El primer tratamiento de inducción se inició previo a la repercusión del trasplante. Todos los pacientes recibieron triple terapia de inmunosupresión de mantenimiento (ciclosporina, micofenolato de mofetilo y corticoesteroides).
La timoglobulina (n=141) se asoció con una incidencia reducida (15,6 % frente a 25,5 %, P=0,02) y gravedad (1,4 % que requirió tratamiento con anticuerpos frente a 8,0 %, P=0,005) de rechazo renal agudo frente a basiliximab (n=137) en pacientes con alto riesgo de rechazo agudo o retraso en la función del injerto que recibieron un trasplante renal de un donante fallecido.2
Resultados de eficacia tras 12 meses del trasplante renal
|
Endpoint |
ATG (n=141) |
Basiliximab (n=137) |
P |
|
Compuesto de: rechazo agudo, función retrasada del injerto, pérdida del injerto, muerte, n (%). |
71 (50,4) |
77 (56,2) |
0,34 |
|
Rechazo agudo comprobado por biopsia, n (%) |
22 (15.6) |
35 (25,5) |
0,02 |
|
Rechazo agudo tratado con anticuerpos, n (%) |
2 (1,4) |
11 (8) |
0,005 |
|
Función retrasada del injerto, n (%) |
57 (40,4) |
61 (44,5) |
0,54 |
|
Pérdida del injerto, n (%) |
13 (9,2) |
14 (10,2) |
0,68 |
|
Muerte, n (%) |
6 (4,3) |
6 (4,4) |
0,9 |
Tabla extraída de Brennan DC, et al.2
Variables de eficacia a 12 meses del trasplante
|
Variable |
Globulina antitimocítica (N=141) |
Basiliximab (N=137) |
P |
|
Compuesta de rechazo agudo, función retrasada del injerto, pérdida del injerto y muerte |
71 (50,4) |
77 (56,2) |
0,34 |
|
Rechazo agudo comprobado por biopsia |
22 (15.6) |
35 (25,5) |
0,02 |
| - No. de recepetores de raza negra/No. total de dichos recipientes | 8/41 (19.5) | 13/39 (33,3) | 0,14 |
| - No. de receptores sin ser de raza negra/No. total de dichos recipientes | 14/100 (14,0) | 22/98 (22,4) | 0,07 |
| - No. de receptores en Estados Unidos/No. total de dichos recipientes | 13/91 (14,3) | 21/92 (22,8) | 0,07 |
| - No. de receptores en Europa/No. total de dichos recipientes | 9/50 (18,0) | 14/45 (31,1) | 0,12 |
|
Rechazo agudo mediado por anticuerpos, n (%) |
2 (1,4) |
11 (8) |
0,005 |
|
Función retrasada del injerto, n (%) |
57 (40,4) |
61 (44,5) |
0,54 |
|
Pérdida del injerto, n (%) |
13 (9,2) |
14 (10,2) |
0,68 |
|
- Por muerte | 4 (2,8) | 3 (2,2) | |
| - Por rechazo agudo | 1 (0,7) | 1 (0,7) | |
| - Por malfunción primaria | 1 (0,7) | 4 (2,9) | |
| - Por trombosis del injerto | 0 | 4 (2,9) | |
| - Por rechazo crónico | 2 (1,4) | 1 (0,7) | |
| - Por infección | 1 (0,7) | 1 (0,7) | |
| - Por efecto tóxico de la ciclosporina | 1 (0,7) | 0 | |
| - Por enfermedad recurrente | 1 (0,7) | 0 | |
| - Por hipertensión | 1 (0,7) | 0 | |
| - Por fístula urinaria | 1 (0,7) | 0 | |
|
Muerte, n (%) |
6 (4,3) |
6 (4,4) |
0,90 |
|
- Por enfermedad cardiovascular | 2 (1,4) | 5 (3,6) | |
| - Por enfermedad pulmonar | 1 (0,7) | 1 (0,7) | |
| - Por enfermedad gastrointestinal | 2 (1,4) | 0 | |
| - Por causa desconocida | 1 (0,7) | 0 |
Tabla extraída de Brennan DC, et al.2
Ambos tratamientos se asociaron con una incidencia similar de eventos adversos y eventos adversos graves.2
Frecuencia de eventos adversos a los 12 meses*
|
Evento adverso |
Globulina antitimocítica (N=141) |
Basiliximab (N=137) |
P valor |
|
Eventos totales |
140 (99.3) |
135 (98.5) |
0,62 |
|
Eventos serios |
103 (73.0) |
99 (72.3) |
0,89 |
| Leucopenia | 47 (33.3) | 20 (14.6) | <0.001 |
| Trombocitopenia | 15 (10.6) | 8 (5.8) | 0,19 |
| Cualquier infección | 121 (85.8) | 103 (75.2) | 0,03 |
| - Tracto urinario | 55 (39.0) | 37 (27.0) | 0,04 |
|
- Probablemente bacteriana u otra |
87 (61,7) |
70 (51.1) |
0,09 |
|
- Confirmada bacteriana |
74 (52.5) |
51 (37.2) |
0,01 |
|
- Citomegalovirus |
11 (7.8) |
24 (17.5) |
0.02 |
|
- Viral diferente a citomegalovirus | 30 (21.3) | 16 (11.7) | 0.04 |
| - Fúngica | 20 (14.2) | 20 (14.6) | 1.00 |
| - Protozoaria | 0 | 1 (0.7) | 0.49 |
| Cáncer | 5 (3.5) | 1 (0.7) | 0.21 |
| - Enfermedad linfoproliferativa post-trasplante | 3 (2.1) | 0 | 0.13 |
| - Carcinoma de células renales en riñón nativo | 1 (0.7) | 1 (0.7) | 1.00 |
| - Carcinoma cutáneo de células escamosas | 1 (0,7) | 0 | 1.00 |
* La leucopenia se definió como un recuento de glóbulos blancos de menos de 2500 por milímetro cúbico. La trombocitopenia se definió como un recuento de plaquetas inferior a 80.000 por milímetro cúbico. Los valores para cada tipo de infección no suman el número total de infecciones porque algunos pacientes tenían más de un tipo de infección.
Tabla extraída de Brennan DC, et al.2
En un ensayo clínico intervencionista, aleatorizado, abierto, de un solo centro, de 12 meses de duración se comparó Timoglobulina vs. basiliximab como terapia de inducción en pacientes de bajo riesgo que recibieron un trasplante de donante vivo.3
Paciente con trasplante renal de donante vivo con bajo riesgo inmunológico (N=100)

Endpoint principal
Rechazo agudo comprobado por biopsia (BPAR), descrito según la clasificación de Banff 2015
El primer tratamiento de inducción se inició previo al procedimiento quirúrgico. Todos los pacientes recibieron triple terapia de inmunosupresión de mantenimiento (tacrolimus, micofenolato de mofetilo y corticoesteroides).
Los resultados del estudio muestran que timoglobulina a dosis bajas tiene una eficacia y seguridad similares en comparación con la inducción de basiliximab en receptores de trasplante renal de bajo riesgo que reciben tacrolimus, MMF y esteroides.3
Resultados de eficacia tras 12 meses del trasplante renal
|
Endpoint | Grupo A: Basiliximab |
Grupo B: Timoglobulina |
Valor P |
|
BPAR a los 12 meses (%) |
2 (3.8) |
3 (6.4) |
0.4 |
|
Clasificación Banff de BPAR |
IB (n = 1) |
IA (n = 1) | |
|
Función retrasada del |
2(3.8) |
2 (4.3) |
0.6 |
|
Función lenta del injerto (%) |
3 (5.7) |
2 (4.3) |
0.5 |
|
Leucopenia |
0 (0) |
3 (6.4) |
0.1 |
|
Trombocitopenia post-operación (%) |
5 (9.5) |
10 (21.3) |
0.09 |
|
Leucopenia a los 12 |
6 (11.3) |
10 (21.3) |
0.1 |
|
CMV |
1 (1.9) |
0 (0) |
0.5 |
|
DNAPT |
1 (1.9) |
2 (4.3) |
0.4 |
|
Cáncer |
0 (0) |
1 (2.1) |
0.4 |
|
Eventos adversos (número) por paciente |
1.3 ± 1.3 |
1.5 ± 1.2 |
0.4 |
|
Hospitalizaciones (número) por paciente |
0.7 ± 0.9 |
0.8 ± 0.8 |
0.6 |
|
TFGe (mL/min/1.73m2) a los 3 meses |
70.9 ± 24.1 |
73.5 ± 43.2 |
0.7 |
|
TFGe (mL/min/1.73m2) a los 6 meses |
73 ± 19.7 |
74.6 ± 27.5 |
0.7 |
|
TFGe (mL/min/1.73m2) a los 12 meses |
69.6 ± 21.3 |
71.4 ± 20.05 |
0.7 |
|
Supervivencia del injerto (%) |
92.5 |
93.6 |
0.5 |
|
Supervivencia (%) |
98.1 |
100 |
0.5 |
Abreviaturas: BPAR, rechazo agudo comprobado por biopsia; CMV, citomegalovirus; DNAPT, diabetes de nueva aparición post-trasplante; TFGe, tafa de filtrado glomerular estimada.
Tampoco hubo diferencias en el número y tipo de eventos adversos relacionados con la terapia de inducción.3
Eventos adversos en los grupos de estudio
|
Eventos |
Grupo A (Basiliximab) |
Grupo B (Timoglobulina) |
|
Infecciones del tracto urinario |
12 |
11 |
| Diarrea | 4 | 4 |
| Quirúrgicas (hernia, colelitiasis, obstrucción del intestino delgado) | 3 | 3 |
| Urológicas (fístula, obstrucción ureteral) | 2 | 3 |
| Gastritis | 2 | 3 |
| Infección superficial en el lugar de incisión | 2 | 3 |
|
Linfocele |
4 |
0 |
|
Infección profunda en el lugar de incisión |
3 |
1 |
|
Neumonía |
2 |
1 |
|
Alteración en test de función hepática | 2 | 1 |
| Dislipemia | 2 | 1 |
| Depresión | 0 | 2 |
| Afección ginecológica | 1 | 1 |
| Caratas | 1 | 0 |
| Estenosis de la arteria renal del trasplante | 1 | 0 |
Tabla extraída de Martínez-Mier G, et al.3
Tratamiento del rechazo agudo
En un estudio doble ciego, aleatorizado, multicéntrico, fase 3 se comparó la seguridad y eficacia de Timoglobulina con ATG de caballo (Atgam®) para el tratamiento de episodios de rechazo agudo tras el trasplante renal. Los episodios de rechazo se categorizaron como grado I (leve corticorresistente), grado II (moderado) o grado III (grave).4 Tampoco hubo diferencias en el número y tipo de eventos adversos relacionados con la terapia de inducción.4
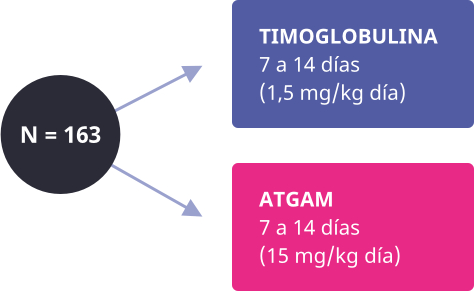
Respuesta positiva (porcentaje de pacientes que respondieron) de Timoglobulina versus Atgam en el tratamiento del rechazo agudo (p=0,027).4
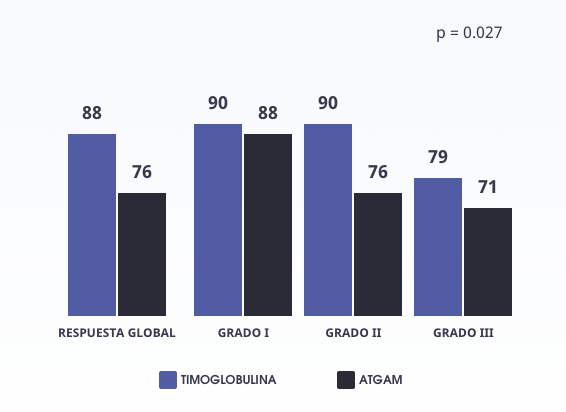
Según la estratificación de la gravedad del rechazo, Timoglobulina se asoció con una tasa de respuesta más alta que la Atgam. En todas las categorías de gravedad del rechazo, hubo una tendencia hacia una mejor respuesta en el grupo tratado con Timoglobulina en comparación con el grupo tratado con Atgam.4 Se observaron eventos adversos por igual en ambos grupos de tratamiento, pero en general no limitaron la dosis y no implicaron la suspensión del tratamiento.4
Evidencia científica de Timoglobulina® en Trasplante Renal

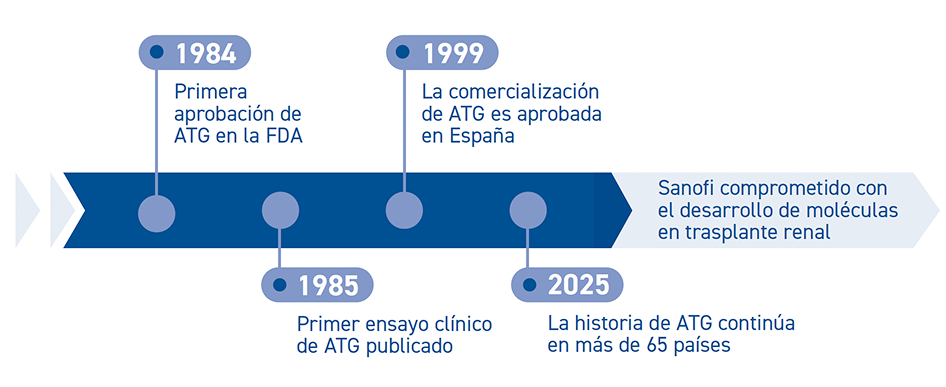
ATG: globulina antitimocítica de conejo; FDA: Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés).
* Desde 1999, año de autorización de ATG en España según ficha técnica.1
a Criterios de búsqueda en Pubmed: ((thymoglobulin[Title] OR ATG[Title])) AND ((kidney transplant OR renal transplant OR kidney rejection OR renal rejection))
b Criterios de búsqueda en Pubmed: ((thymoglobulin[Title] OR ATG[Title]) NOT (grafalon OR ATLG OR ATG-fresenius)) AND (kidney transplant OR renal transplant OR kidney rejection OR renal rejection)
c Criterios de búsqueda en Pubmed: ((thymoglobulin induction[Title] OR ATG induction[Title]) NOT (grafalon OR ATLG OR ATG-fresenius)) AND (kidney transplant OR renal transplant)

Descarga la evidencia científica de Timoglobulina® en Trasplante Renal
Accede a la evidencia científica sobre Timoglobulina® en trasplante renal, con más de 40 años de investigación, publicaciones en PubMed y ensayos clínicos que respaldan su uso.
Descarga el material y obtén la información completa.

INFOGRAFÍA
Manejo del riesgo inmunológico en trasplante renal
Descubre cómo Timoglobulina® se adapta a diferentes perfiles de pacientes, proporcionando una inmunosupresión eficaz y ajustable. Basado en evidencia científica y estudios comparativos, este material analiza los factores de riesgo clave y los beneficios clínicos de Timoglobulina® en el trasplante renal.
Descarga el documento completo y accede a la evidencia científica.
Casos clínicos

Timoglobulina en un trasplante renal de donante en asistolia controlada
.jpg)
Timoglobulina en el Trasplante Renal de donante con criterios expandidos
.jpg)
Timoglobulina en el Trasplante Renal de donante vivo AB0-i
.jpg)
Timoglobulina en el trasplante de paciente hipersensibilizado
.jpg)
Timoglobulina en el tratamiento del rechazo agudo

Timoglobulina en un trasplante renal de donante en asistolia controlada
.jpg)
Timoglobulina en el Trasplante Renal de donante con criterios expandidos
.jpg)
Timoglobulina en el Trasplante Renal de donante vivo AB0-i
.jpg)
Timoglobulina en el trasplante de paciente hipersensibilizado
.jpg)
Timoglobulina en el tratamiento del rechazo agudo
Publicaciones

Dosis muy bajas de globulinas antitimocitos versus basiliximab en receptores de trasplante renal no inmunizados

Resultados del ensayo clínico fase III, doble ciego, aleatorizado, multicéntrico, de Timoglobulina frente a Atgam

inducción con dosis bajas de timoglobulina frente a basiliximab en receptores de trasplante renal de donante vivo de bajo riesgo

Globulina anti-timocito de conejo vs. basiliximab en trasplante renal

Dosis muy bajas de globulinas antitimocitos versus basiliximab en receptores de trasplante renal no inmunizados

Resultados del ensayo clínico fase III, doble ciego, aleatorizado, multicéntrico, de Timoglobulina frente a Atgam

inducción con dosis bajas de timoglobulina frente a basiliximab en receptores de trasplante renal de donante vivo de bajo riesgo

Globulina anti-timocito de conejo vs. basiliximab en trasplante renal
Contenido mínimo Timoglobulina®
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
Envase con 1 vial de polvo (CN 800425.6): PVP: 550,91 €. PVP IVA: 572,95 €. Medicamento sujeto a prescripción médica. Uso hospitalario. Financiado por el SNS.
1. Nombre del medicamento
TIMOGLOBULINA 5 mg/ml, polvo para solución para perfusión.
2. Composición cualitativa y cuantitativa
Un vial contiene 25 mg de inmunoglobulina de conejo antitimocitos humanos. Después de la reconstitución con 5 ml de agua para preparaciones inyectables, la solución contiene 5 mg/ml de inmunoglobulina de conejo antitimocitos humanos (concentrado). Excipientes con efecto conocido: Cada vial de 10 ml contiene 0,171 mmol de sodio que son 4 mg de sodio.
3. Forma farmacéutica
Polvo para solución para perfusión. Timoglobulina es un polvo liofilizado de color blanco-crema.
Referencias
- Ficha técnica de Timoglobulina.
- Brennan DC, Daller JA, Lake KD, Cibrik D, Del Castillo D; Thymoglobulin Induction Study Group. Rabbit antithymocyte globulin versus basiliximab in renal transplantation. N Engl J Med. 2006;355(19):1967-1977.
- Martinez-Mier G, Moreno-Ley PI, Budar-Fernández LF, et al. Low-dose Thymoglobulin vs Basiliximab Induction Therapy in Low-Risk Living Related Kidney Transplant Recipients: A Prospective Randomized Trial. Transplant Proc. 2021;53(3):1005-1009.
- Gaber AO, First MR, Tesi RJ, et al. Results of the double-blind, randomized, multicenter, phase III clinical trial of Thymoglobulin versus Atgam in the treatment of acute graft rejection episodes after renal transplantation. Transplantation. 1998;66(1):29-37.
MAT-ES-2203511-V3-09/2025
