Sobre Beyfortus® Nirsevimab

Anticuerpo de acción prolongada*1

Protege frente a la infección del tracto respiratorio inferior (ITRI) por VRS en lactantes durante su primera temporada de VRS1

Evaluado en tres estudios clínicos robustos,** en >5.400 lactantes de 31 países1-4

Desarrollado para una amplia población de lactantes,† incluidos los nacidos:1
- Sanos o con problemas de salud subyacentes
- A término o prematuros
- Durante o antes de la temporada de VRS
* Beyfortus® (nirsevimab) es un anticuerpo monoclonal humano1.
** Dos estudios de eficacia en lactantes sanos (un estudio de fase IIb en lactantes prematuros 29-35 semanas y el estudio fase III MELODY en lactantes prematuros tardíos y a término) y un estudio de seguridad y farmacocinética en lactantes con mayor riesgo de sufrir enfermedad grave por VRS (estudio de fase II/III MEDLEY realizado en dos cohortes: recién nacidos prematuros ≤35 semanas de edad gestacional ([EG]) y lactantes con enfermedad pulmonar crónica o cardiopatía congénita)1.
Las conclusiones de MEDLEY no se detallan en este documento.
† Beyfortus® (nirsevimab) está indicado para la prevención de la enfermedad de las vías respiratorias inferiores causada por el virus respiratorio sincitial (VRS) en neonatos y lactantes durante su primera temporada del VRS.
Beyfortus® es el primer anticuerpo monoclonal frente al VRS con una vida media extendida por la tecnología YTE1
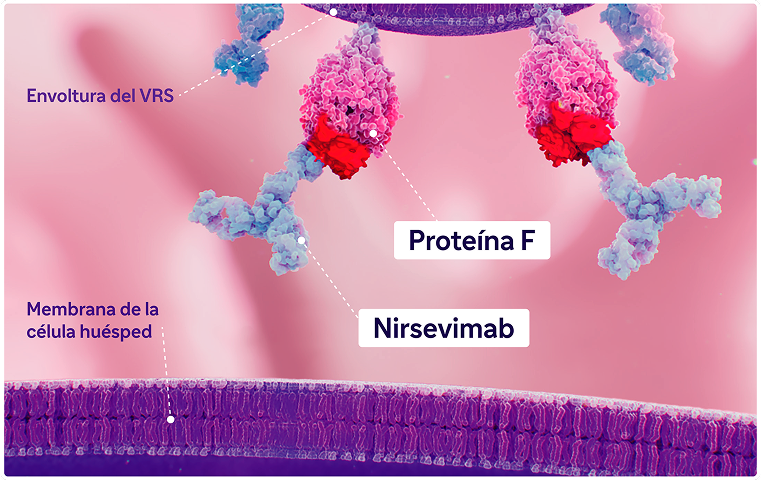
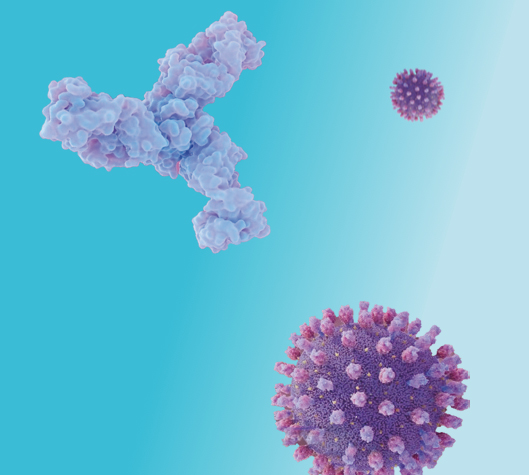
Beyfortus® es un anticuerpo monoclonal IgG1 humano recombinante que bloquea la fusión entre la envoltura vírica del virus respiratorio sincitial (VRS) y de la célula del epitelio respiratorio. Esta inhibición sucede mediante su unión sobre un epítopo altamente conservado en el sitio antigénico Ø de la proteína F del VRS en su conformación pre-fusión.1
Diseñado con una sustitución triple de aminoácidos (YTE) en la región Fc que prolonga su semivida hasta 69 días.1
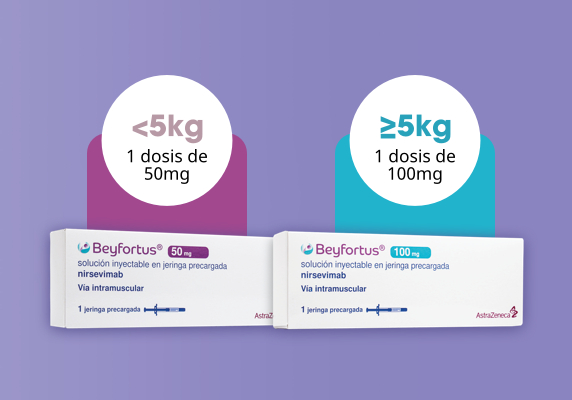
Beyfortus® (nirsevimab) permite una implementación flexible
Una única administración según el peso del lactante en el momento de recibir Beyfortus® (nirsevimab)*,1
Presentación lista para usar en una jeringa precargada1. Inyección intramuscular, preferiblemente en la cara anterolateral del muslo**,1.
Si es necesario, Beyfortus® (nirsevimab) puede administrarse concomitantemente con vacunas pediátricas†,1.
* A los lactantes sometidos a cirugía cardíaca con circulación extracorpórea puede administrárseles una dosis adicional en cuanto el lactante se encuentre estable tras la cirugía para garantizar unos niveles séricos de nirsevimab adecuados1.
Consulte la ficha técnica del producto para obtener información completa sobre la dosificación en esta circunstancia.
** No debe utilizarse el músculo glúteo de forma rutinaria para la inyección ya que se puede dañar el nervio ciático1.
† Beyfortus® (Nirsevimab) no debe mezclarse con ninguna vacuna en la misma jeringa o vial. Cuando se administre simultáneamente con vacunas inyectables, deben administrarse con jeringas separadas e inyectarse en lugares diferentes1.

Anticuerpo de acción prolongada*1

Protege frente a la infección del tracto respiratorio inferior (ITRI) por VRS en lactantes durante su primera temporada de VRS1

Evaluado en tres estudios clínicos robustos,** en >5.400 lactantes de 31 países1-4

Desarrollado para una amplia población de lactantes,† incluidos los nacidos:1
- Sanos o con problemas de salud subyacentes
- A término o prematuros
- Durante o antes de la temporada de VRS

* Beyfortus® (nirsevimab) es un anticuerpo monoclonal humano1.
** Dos estudios de eficacia en lactantes sanos (un estudio de fase IIb en lactantes prematuros 29-35 semanas y el estudio fase III MELODY en lactantes prematuros tardíos y a término) y un estudio de seguridad y farmacocinética en lactantes con mayor riesgo de sufrir enfermedad grave por VRS (estudio de fase II/III MEDLEY realizado en dos cohortes: recién nacidos prematuros ≤35 semanas de edad gestacional ([EG]) y lactantes con enfermedad pulmonar crónica o cardiopatía congénita)1.
Las conclusiones de MEDLEY no se detallan en este documento.
† Beyfortus® (nirsevimab) está indicado para la prevención de la enfermedad de las vías respiratorias inferiores causada por el virus respiratorio sincitial (VRS) en neonatos y lactantes durante su primera temporada del VRS.
Beyfortus® es el primer anticuerpo monoclonal frente al VRS con una vida media extendida por la tecnología YTE1

Beyfortus® es un anticuerpo monoclonal IgG1 humano recombinante que bloquea la fusión entre la envoltura vírica del virus respiratorio sincitial (VRS) y de la célula del epitelio respiratorio. Esta inhibición sucede mediante su unión sobre un epítopo altamente conservado en el sitio antigénico Ø de la proteína F del VRS en su conformación pre-fusión.1
Diseñado con una sustitución triple de aminoácidos (YTE) en la región Fc que prolonga su semivida hasta 69 días.1

Beyfortus® (nirsevimab) permite una implementación flexible
Una única administración según el peso del lactante en el momento de recibir Beyfortus® (nirsevimab)*,1
Presentación lista para usar en una jeringa precargada1. Inyección intramuscular, preferiblemente en la cara anterolateral del muslo**,1.
Si es necesario, Beyfortus® (nirsevimab) puede administrarse concomitantemente con vacunas pediátricas†,1.
* A los lactantes sometidos a cirugía cardíaca con circulación extracorpórea puede administrárseles una dosis adicional en cuanto el lactante se encuentre estable tras la cirugía para garantizar unos niveles séricos de nirsevimab adecuados1.
Consulte la ficha técnica del producto para obtener información completa sobre la dosificación en esta circunstancia.
** No debe utilizarse el músculo glúteo de forma rutinaria para la inyección ya que se puede dañar el nervio ciático1.
† Beyfortus® (Nirsevimab) no debe mezclarse con ninguna vacuna en la misma jeringa o vial. Cuando se administre simultáneamente con vacunas inyectables, deben administrarse con jeringas separadas e inyectarse en lugares diferentes1.
Mecanismo de acción
Beyfortus® es capaz de inhibir la fusión con la célula huésped independientemente de la cepa del subtipo A y B del VRS.1
La inhibición de esta fusión se produce a través de la unión del anticuerpo sobre un epítopo altamente conservado de la conformación pre-fusión en la proteína F. A diferencia de la conformación post-fusión, esta última es la única activa e infecciosa capaz de evitar el proceso de entrada viral.5
Evidencia Clínica de Beyfortus® (nirsevimab)
Consulta en este apartado los estudios que apoyan los datos de eficacia de Beyfortus® (nirsevimab).

Beyfortus® se toleró bien en los ensayos clínicos1-4
Las reacciones adversas notificadas en lactantes a término y prematuros (≥29 semanas de EG) en los ensayos clínicos incluyeron erupción cutánea, reacción en el lugar de la inyección y pirexia, y fueron poco frecuentes (≥1/1.000 a <1/100)1.
La seguridad se ha estudiado en una amplia población de lactantes que inician su primera temporada de VRS, incluidos bebés sanos prematuros y nacidos a término, así como lactantes con mayor riesgo de sufrir enfermedad grave por VRS1.
Perfil de seguridad similar vs. placebo en lactantes prematuros y a término (≥29 semanas de EG)2,3.
En el estudio de lactantes con mayor riesgo de sufrir enfermedad grave por VRS, el perfil de seguridad de Beyfortus fue similar vs. palivizumab y consistente con el observado en estudios en lactantes sanos a término y prematuros (≥29 semanas de EG)1,4 observado en estudios en lactantes sanos a término y prematuros (≥29).
EG, edad gestacional; VRS, virus respiratorio sincitial

Beyfortus® se toleró bien en los ensayos clínicos1-4
Las reacciones adversas notificadas en lactantes a término y prematuros (≥29 semanas de EG) en los ensayos clínicos incluyeron erupción cutánea, reacción en el lugar de la inyección y pirexia, y fueron poco frecuentes (≥1/1.000 a <1/100)1.
La seguridad se ha estudiado en una amplia población de lactantes que inician su primera temporada de VRS, incluidos bebés sanos prematuros y nacidos a término, así como lactantes con mayor riesgo de sufrir enfermedad grave por VRS1.
Perfil de seguridad similar vs. placebo en lactantes prematuros y a término (≥29 semanas de EG)2,3.
En el estudio de lactantes con mayor riesgo de sufrir enfermedad grave por VRS, el perfil de seguridad de Beyfortus fue similar vs. palivizumab y consistente con el observado en estudios en lactantes sanos a término y prematuros (≥29 semanas de EG)1,4 observado en estudios en lactantes sanos a término y prematuros (≥29).
EG, edad gestacional; VRS, virus respiratorio sincitial
Resultados en vida real
Seguridad
En los ensayos clínicos pivotales, el perfil de seguridad de nirsevimab fue favorable. La reacción adversa más frecuente fue erupción cutánea (0,7 %), que se produjo en los 14 días posteriores a la dosis. Se notificaron pirexia y reacciones en el lugar de la inyección con una frecuencia del 0,5% y del 0,3% en los 7 días posteriores a la dosis, respectivamente.1

Hasta septiembre de 2024, se ha demostrado un buen perfil de seguridad tras la administración de>277,000 dosis de Beyfortus®, ya que hasta el momento no se han identificado nuevos eventos a los descritos en la ficha técnica.26
Seguridad
En los ensayos clínicos pivotales, el perfil de seguridad de nirsevimab fue favorable. La reacción adversa más frecuente fue erupción cutánea (0,7 %), que se produjo en los 14 días posteriores a la dosis. Se notificaron pirexia y reacciones en el lugar de la inyección con una frecuencia del 0,5% y del 0,3% en los 7 días posteriores a la dosis, respectivamente.1

Hasta septiembre de 2024, se ha demostrado un buen perfil de seguridad tras la administración de>277,000 dosis de Beyfortus®, ya que hasta el momento no se han identificado nuevos eventos a los descritos en la ficha técnica.26
El Virus respiratorio sincitial
*En la mayoría de los casos, el VRS provoca síntomas similares a los del resfriado, pero también puede evolucionar hacia infecciones pulmonares (bronquiolitis y neumonía)8.
¿Qué es el VRS?
El VRS es un microorganismo patógeno estacional común y contagioso que puede causar una enfermedad respiratoria a lo largo de toda la vida aunque, la infección grave es más probable durante la infancia y en edades avanzadas5-7.
El VRS es la causa más común de bronquiolitis y neumonía en lactantes dando lugar a epidemias estacionales en todo el mundo*8.
* Según un estudio de 9 años en España en lactantes menores de 12 meses.10
¿Por qué inmunizar?
La enfermedad grave por el VRS es impredecible y es la principal causa de hospitalización en todos los lactantes < 1 año*, produciéndose, la mayor parte de las hospitalizaciones, en lactantes sanos nacidos a término9,10.
3 de cada 4 ingresos por VRS en UCIP son de lactantes previamente sanos11.
En España, entre los lactantes hospitalizados por VRS: 98% estaban previamente sanos y eran nacidos a término10. 54% Nacieron en los meses típicos fuera de la temporada del VRS12.
El impacto potencial del VRS en lactantes
Dr. Harish Nair, Cátedra de Enfermedades Infecciosas Pediátricas y Salud Global. Edimburgo.
El VRS representa hasta un 80% de todas las hospitalizaciones por bronquiolitis en lactantes en el pico de la temporada de VRS27.
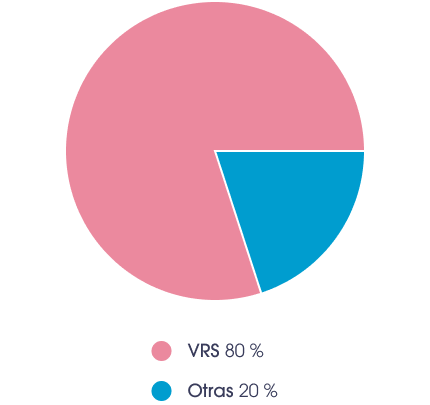
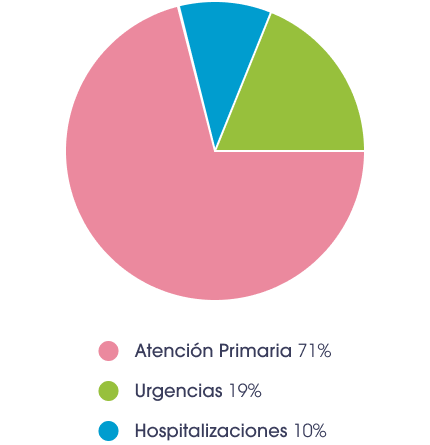
Uso de recursos sanitarios por parte de los lactantes por VRS**2
.
*En la mayoría de los casos, el VRS provoca síntomas similares a los del resfriado, pero también puede evolucionar hacia infecciones pulmonares (bronquiolitis y neumonía)8.
¿Qué es el VRS?
El VRS es un microorganismo patógeno estacional común y contagioso que puede causar una enfermedad respiratoria a lo largo de toda la vida aunque, la infección grave es más probable durante la infancia y en edades avanzadas5-7.
El VRS es la causa más común de bronquiolitis y neumonía en lactantes dando lugar a epidemias estacionales en todo el mundo*8.
* Según un estudio de 9 años en España en lactantes menores de 12 meses.10
¿Por qué inmunizar?
La enfermedad grave por el VRS es impredecible y es la principal causa de hospitalización en todos los lactantes < 1 año*, produciéndose, la mayor parte de las hospitalizaciones, en lactantes sanos nacidos a término9,10.
3 de cada 4 ingresos por VRS en UCIP son de lactantes previamente sanos11.
En España, entre los lactantes hospitalizados por VRS: 98% estaban previamente sanos y eran nacidos a término10. 54% Nacieron en los meses típicos fuera de la temporada del VRS12.
El impacto potencial del VRS en lactantes
Dr. Harish Nair, Cátedra de Enfermedades Infecciosas Pediátricas y Salud Global. Edimburgo.
El VRS representa hasta un 80% de todas las hospitalizaciones por bronquiolitis en lactantes en el pico de la temporada de VRS27.

Uso de recursos sanitarios por parte de los lactantes por VRS**2
.

.
Contenido mínimo de Beyfortus®
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y PRESENTACIÓN
BEYFORTUS® 50 mg SOLUCION INYECTABLE EN JERINGA PRECARGADA, 1 jeringa precargada (CN: 762403) y BEYFORTUS® 100 mg SOLUCION INYECTABLE EN JERINGA PRECARGADA, 1 jeringa precargada (CN: 762405) PVP notificado: 812,67 € PVP IVA notificado: 845,18 €. Financiada por el SNS. Con receta.
Ficha Técnica Beyfortus® 50mg Ficha Técnica Beyfortus® 100 mg
▼«Este medicamento está sujeto a seguimiento adicional, es prioritaria la notificación de sospechas de reacciones adversas asociadas a este medicamento.»
1. Nombre del medicamento
Beyfortus® 50 mg solución inyectable en jeringa precargada.
Beyfortus® 100 mg solución inyectable en jeringa precargada.
2. Composición cualitativa y cuantitativa
Beyfortus 50 mg solución inyectable en jeringa precargada
Cada jeringa precargada contiene 50 mg de nirsevimab en 0,5 ml (100 mg/ml).
Beyfortus 100 mg solución inyectable en jeringa precargada
Cada jeringa precargada contiene 100 mg de nirsevimab en 1 ml (100 mg/ml).
Nirsevimab es un anticuerpo monoclonal humano de inmunoglobulina G1 kappa (IgG1κ) producido en células de ovario de hamster chino (CHO) mediante tecnología de AD recombinante.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. Forma Farmacéutica
Solución inyectable (inyectable).
Solución transparente a opalescente, incolora a amarilla, pH 6.0.
Referencias
- Ficha técnica Beyfortus. https://cima.aemps.es/cima/dochtml/ft/1221689004/FT_1221689004.html Acceso Junio 2023
- Griffin MP et al. N Engl J Med 2020; 383(5): 415–425.
- Muller WJ, et al. N Engl J Med. 2023 Apr 20;388(16):1533-1534
- Domachowske JB et al. N Engl J Med 2022; 386(9): 892–894.
- Ruckwardt TJ, et al. Immunity. 2019;51:429-42
- Drysdale S.B, et al. N Engl J Med 2023;389:2425-35
- Afonso A, et al. Impacto da Imunizacao com Nirsevimab na Hospitalizacao por Infecao a Virus Sincicial Respiratorio na Regiao Autonoma da Madeira. Presented at 24th Congresso Nacional de Pediatria 2024, Vilamoura, Portugal. CO-047-(24SPP-13570).
- Ezpeleta G, et al. Vaccines 2024;12:383
- Ares-Gómez S et al. Lancet Infectious Diseases; 2024
- Barbas Del Buey JF, et al. Frontiers in Public Health. 2024
- López-Lacort M. et al Euro Surveill. 2024;29(6):pii=2400046
- López-Lacort M, et al. Pediatrics. 2024;155: :e2024066393
- Estrella-Porter P, et al. Vaccine. 2024:S0264-410X(24)00657-1
- Agüera M, et al, Pediatr Allergy Immunol. 2024;35:e14175
- Coma E, et al. Arch Dis Child 2024;0:1–6
- Mazagatos C, et al. Influenza Other Respir Viruses. 2024;18:e13294
- Ernst C et al. Euro Surveill. 2024;29(4):pii=2400033
- Carbajal, R et al. Lancet Child Adolesc Health [Internet]. 2024;8(10):730–9
- Assad Z, et al. N Engl J Med 2024;391:144-54.
- Lassoued Y, et al. Lancet Regional Health. 2024;44:101007
- Paireau J et al. Influenza and Other Respiratory Viruses, 2024; 18:e13311
- Payne A. ACIP presentation, June 28, 2024. Available at: https://www.cdc.gov/acip/downloads/slides-2024-06-26-28/04-RSV-Mat-Peds-Payne-508.pdf (Accessed July 2024)
- Blyth CC, et al. Evaluating the Nirsevimab RSV prevention program in Western Australia - early insights into program impact. Options XII for the control of Influenza Conference, October 2024, Brisbane.
- Hsiao A, et al. Annals of Allergy, Asthma & Immunology. 2024; 133(6):S2–S3
- Campaña de Invierno 2024, Universidad de Chile. Available at: https://uchile.cl/noticias/220229/nirsevimab-redujo-a-cero-las-muertes-de-menores-de-un-ano-por-vrs [Accessed 20 Sept 2024]
- Recomendaciones de inmunización pasiva para prevención de enfermedad grave por VRS en la población infantil. Consejo Interterritorial del Sistema Nacional de Salud. Disponible en:: https://www.sanidad.gob.es/areas/promocionPrevencion/vacunaciones/comoTrabajamos/docs/VRS_infantil.pdf [último acceso el 13 de marzo de 2025]
- Carvajal JJ et al. Front Immunol 2019; 10: 2152.
- Openshaw PJM et al. Annu Rev Immunol 2017; 35: 501-532
- Shi T et al. Lancet 2017; 390(10098): 946–958.
- Meissner HC. N Engl J Med 2016; 374(18): 1793–1794
- Bianchini S, et al. Microorganisms. 2020;8(12):2048.
- Sánchez-Luna M, et al. Curr Med Res Opin. 2016;32(4):693-8.
- Flores-González JC, et al. Biomed Res Int. 2017;2017:2565397.
- Mira-Iglesias A, et al. Influenza Other Respir Viruses. 2022 Mar;16(2):328-339.
MAT-ES-2303237 V3 Abril 2025