
Kevzara es el primer y único tratamiento aprobado para el tratamiento de la PMR*1,2
En la PMR, la IL-6 es un mediador clave de la respuesta de fase aguda y de la inflamación sistémica3,4
Concentraciones elevadas de IL-6
Dolor muscular y rigidez5
Aumento del riesgo de recaída3,6
Necesidad más alta de CS7-9
KEVZARA® ayuda a inhibir los efectos derivados de la elevación sostenida de IL-61,10
KEVZARA® es un inhibidor del IL-6R totalmente humano, con alta afinidad tanto en su forma soluble como de membrana1,10
Mecanismo de acción de sarilumab
KEVZARA® es un inhibidor de la IL-6R completamente humano que se dirige y se une con gran afinidad a los receptores de la IL-6, tanto solubles como de membrana1,10
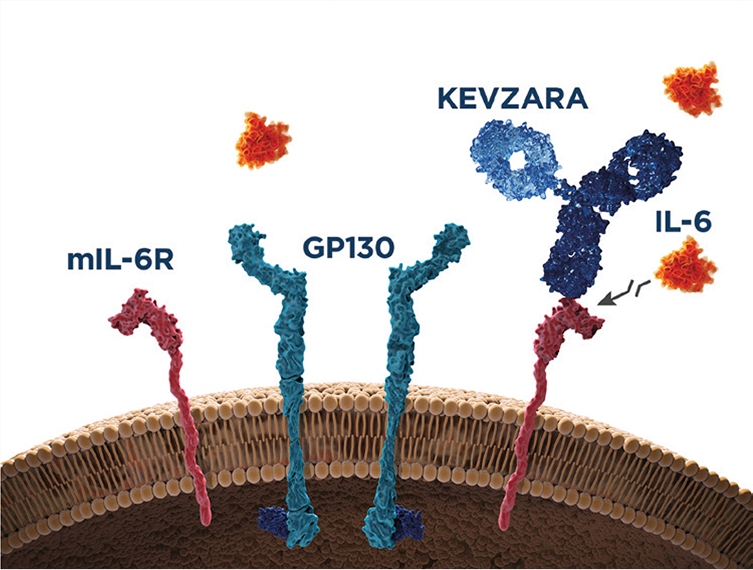
Señalización a través del receptor soluble
Inhibe la señalización intracelular en las células que expresan la gp130 ubicua (osteoclastos, sinoviocitos similares a los fibroblastos (FLS), etc.)
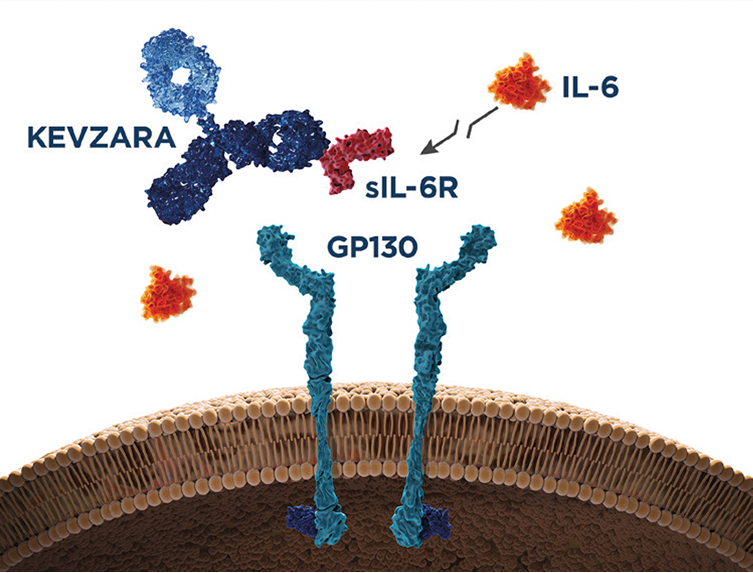
Señalización a través del receptor de membrana
Inhibe la señalización intracelular en las células que expresan mIL-6R (células hematopoyéticas, hepatocitos)
Eficacia y seguridad de Kevzara®
KEVZARA® demostró una remisión de la enfermedad* sostenida estadísticamente significativa en la semana 521,11
28% KEVZARA vs. 10% placebo
Diferencia de 18 puntos porcentuales; (IC 95%: 4-32; p = 0,02)
Criterio de valoración principal: proporción de pacientes que lograron una remisión sostenida en la semana 521,11

Con la remisión sostenida, los pacientes alcanzaron la remisión de la enfermedad como máximo en la semana 12 y la mantuvieron hasta la semana 52.
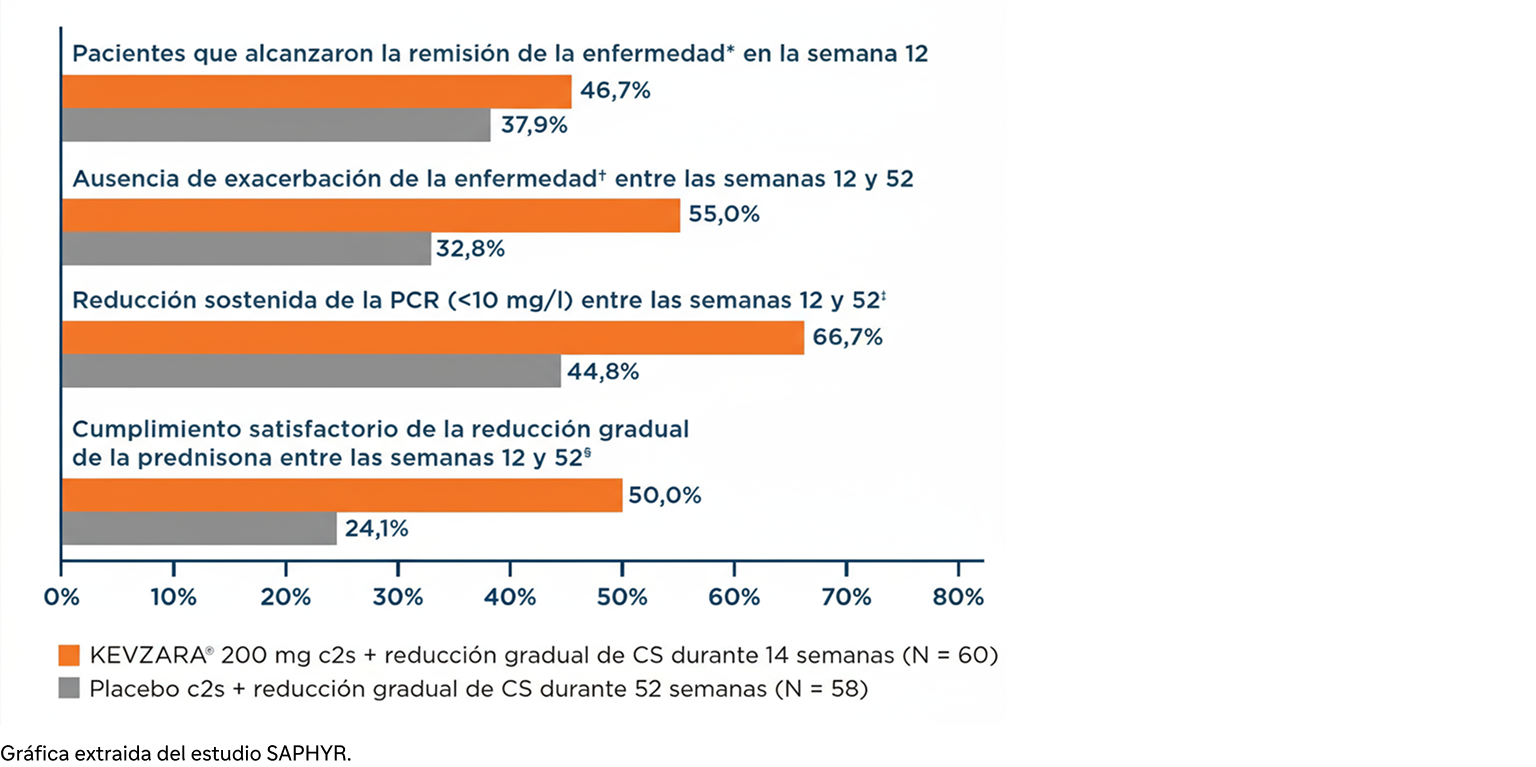
Al llegar a la semana 12, los pacientes del grupo de KEVZARA® recibían 3 mg diarios de CS, mientras que los pacientes del grupo controlado con placebo recibían 9 mg diarios de CS (excluyendo los CS de rescate, según el protocolo del estudio).12
A la semana 52, el 64% de los pacientes evaluables† alcanzó la resolución sin CS, frente al 22% del comparador
En la PMR, el perfil de seguridad global observado en el grupo de tratamiento con KEVZARA® estuvo, en términos generales, en consonancia con el perfil de seguridad conocido de KEVZARA®2,11,13
La PMR tiene un gran impacto en la calidad de vida de los pacientes14
La enfermedad puede cursar de diferentes formas:14
Sin recaídas
Respuesta rápida sin recaídas significativas
Tratamiento prolongado
Respuesta rápida que requiere un tratamiento prolongado
Sin resolución de síntomas
Resolución incompleta de los síntomas, que requiere tratamiento prolongado con corticoides
Calidad de Vida relacionada con la salud:14

Fatiga diurna
El dolor interfiere con el sueño por la noche, lo que resulta en una fatiga diurna significativa

Rigidez
La rigidez matutina causa dificultad para levantarse de la cama y realizar las actividades diarias

Calidad de vida física y mental
Los niveles más altos de marcadores de actividad de la enfermedad se correlacionan con una menor calidad de vida física y mental
Dosis y administración
Kevzara se administra en inyección subcutánea autoadministrable cada 2 semanas en una dosis de 200 mg.
Contenido mínimo de Kevzara®
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
KEVZARA® 200 mg solución inyectable en jeringa precargada, envase de 2 jeringas precargadas (CN 716173).
KEVZARA® 200 mg solución inyectable en pluma precargada, envase de 2 plumas precargadas (CN 716176).
PVP notificado: 1.033,06 € PVP IVA notificado: 1.074,38 €
Medicamento sujeto a prescripción médica. Uso hospitalario.
CONSULTE LA FICHA TÉCNICA COMPLETA ANTES DE PRESCRIBIR ESTE MEDICAMENTO.
Kevzara está financiado en España de acuerdo con los criterios establecidos por el SNS.
Abreviaturas:
CS: corticoesteroides; PCR: proteína C reactiva; PMR: polimialgia reumática.
Notas:
*La remisión de la enfermedad se define como la resolución de los signos y síntomas de PMR y la normalización de los valores de PCR (<10 mg/l).2
†Los casos observados se basan en pacientes con evaluaciones de PMR en cada visita (no se incluyeron las evaluaciones de PMR tras la suspensión del tratamiento); la primera evaluación planificada se realizó una vez completada la reducción gradual predefinida de los CS en la semana 16 en el grupo de KEVZARA® y en la semana 52 en el grupo comparador.12
Referencias
- Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica de Kevzara; [consultado 25 sep 2025]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/1171196003/FT_1171196003.html
- Agencia Española de Medicamentos y Productos Sanitarios. Boletín del Comité de Medicamentos de Uso Humano. Octubre de 2024 [Internet]. Madrid: AEMPS; 2024 [consultado 25 sep 2025]. Disponible en: https://www.aemps.gob.es/informa/boletin-del-comite-de-medicamentos-de-uso-humano-octubre-de-2024
- González-Gay MA, Matteson EL, Castañeda S. Polymyalgia rheumatica. Lancet. 2017; 390:1700-1712
- Salvarani C, Cantini F, Niccoli L, et al. Acute-phase reactants and the risk of relapse/ recurrence in polymyalgia rheumatica: a prospective follow up study. Arthritis Rheum. 2005 Feb 15;53(1):33-8
- Roche NE, Fulbright JW, Wagner AD, et al. Correlation of interleukin-6 production and disease activity in polymyalgia rheumatica and giant cell arteritis. Arthritis & Rheumatism. 1993;36(9):1286-1294
- Buttgereit F, Dejaco C, Matteson EL, et al. Polymyalgia rheumatica and giant cell arteritis: a systematic review. JAMA. 2016;315(22):2442-2458
- Agencia Española de Medicamentos y Productos Sanitarios. Boletín del Comité de Medicamentos de Uso Humano. Octubre de 2024 [Internet]. Madrid: AEMPS; 2024. Disponible en: https://www.aemps.gob.es/informa/boletin-del-comite-de-medicamentos-de-uso-humano-octubre-de-2025/. Último acceso: noviembre 2025
- Dasgupta B, et al. Br J Rheumatol. 1990; 29(6):456-458
- Pulsatelli L, et al. Arthritis Rheum. 2008; 59(8):1147-1154
- Genovese MC, Fleischmann R, Kivitz AJ, et al. Sarilumab plus methotrexate in patients with active rheumatoid arthritis and inadequate response to methotrexate: results of a nedospasov SA. Modern anti-cytokine therapy of autoimmune diseases. Biochemistry (Moscow). 2014;79(12):1308-1321.
- Spiera RF, Unizony S, Warrington KJ, et al. Sarilumab for relapse of polymyalgia rheumatica during glucocorticoid taper. N Engl J Med. 2023;389(14):1263-1272.
- Spiera RF, Unizony S, Warrington KJ, et al. Sarilumab for relapse of polymyalgia rheumatica during glucocorticoid taper. N Engl J Med. 2023;389(14):1263-1272. Supplementary appendix disponible en: https://www.nejm.org/doi/suppl/10.1056/NEJMoa2303452/suppl_file/nejmoa2303452_appendix.pdf. Último acceso: noviembre 2025
- Fleischmann R, Genovese MC, Lin Y, et al. Long-term safety of sarilumab in rheumatoid arthritis: an integratedanalysis with up to 7 years’ follow-up. Rheumatology. 2020;59(2):292-302.
- Hutchings A, et al. Arthritis Rheum (Artritis reumatoide). 2007; 57(5):803-809.
MAT-ES-2503570 - V1 - Noviembre 2025
