
Descripción de Cerdelga®
Único tratamiento oral de 1ª línea para adultos con la Enfermedad de Gaucher tipo 1.1-4
Cerdelga® (eliglustat) está indicado para el tratamiento a largo plazo de pacientes adultos con Enfermedad de Gaucher tipo 1, que sean metabolizadores lentos (ML), metabolizadores intermedios (MI) o metabolizadores rápidos (MR) del CYP2D6.
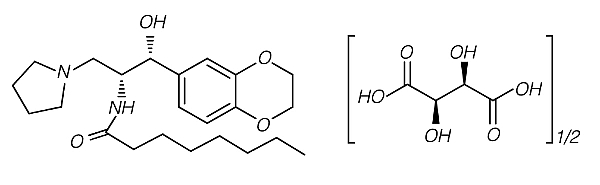
Figura 1. Estructura química de Cerdelga7
Inhibidor de la glucosilceramida sintasa
Cerdelga® (eliglustat ) es un análogo de la ceramida que disminuye la tasa de producción de GL-1 mediante la inhibición de la enzima glucosilceramida sintasa. El objetivo es restablecer el equilibrio entre la síntesis y la degradación de GL-1, lo que resulta en una menor acumulación de GL-1 en bazo, hígado, médula ósea y pulmones.1,5,6 En los ensayos clínicos, el tratamiento con Cerdelga redujo significativamente los elevados niveles plasmáticos de GL-1 en pacientes no tratados previamente. En pacientes estabilizados previamente con TSE, la GL-1 plasmática disminuyó durante el tratamiento y se mantuvo en el rango normal.1,3,5
Como análogo de la ceramida, Cerdelga es un inhibidor potente y específico de la glucosilceramida sintasa. No inhibe a las enzimas disacaridasas intestinales, lo cual es la causa probable de los efectos secundarios gastrointestinales observados con el inhibidor de la glucosilceramida sintasa, miglustat.1,5,7
Mecanismo de acción
Cerdelga® Eliglustat es un potente inhibidor específico de la glucosilceramida sintasa que actúa como tratamiento reductor de sustrato (TRS) para la EG1. El objetivo del TRS es reducir la velocidad de síntesis del principal sustrato glucosilceramida (GL-1) para adecuarlo a la velocidad alterada del catabolismo en los pacientes con EG1 y prevenir así la acumulación de glucosilceramida y aliviar las manifestaciones clínicas.1
Calidad de Vida
El Dr. Timothy M. Cox presenta los resultados del estudio ENCORE. A lo largo de cuatro años de estudio, la estabilidad en parámetros como hemoglobina, plaquetas, volumen del bazo y del hígado se mantuvo, y la seguridad del tratamiento fue buena con pocos efectos adversos relacionados con el mismo. Además, se evaluó la calidad de vida de los pacientes utilizando diferentes escalas y se observaron mejoras en varios dominios de salud.3
Seguridad
Puesto que Cerdelga es metabolizado rápidamente sobre todo por las vías metabólicas del CYP2D6 y, en un menor grado, las del CYP3A4, debe utilizarse solamente en pacientes que sean metabolizadores lentos, intermedios o rápidos del CYP2D6.1
Cerdelga está contraindicado para pacientes que sean metabolizadores intermedios (MI) o metabolizadores rápidos (MR) del CYP2D6 y que estén recibiendo un inhibidor potente o moderado del CYP2D6 junto con un inhibidor potente o moderado del CYP3A, así como para pacientes que sean metabolizadores lentos (ML) del CYP2D6 y que estén recibiendo un inhibidor potente del CYP3A. El uso de Cerdelga en tales condiciones da lugar a unas concentraciones plasmáticas elevadas de eliglustat (consulte la Información de seguridad de Cerdelga).1
No es recomendable la coadministración de Cerdelga con los inductores potentes del CYP3A (p. ej., rifampicina, carbamazepina, fenobarbital, fenitoína y Hierba de San Juan), ya que dicha coadministración disminuye substancialmente la exposición del paciente a Cerdelga, lo cual puede reducir su eficacia terapéutica. Debe informar inmediatamente los efectos adversos a su oficina local de Genzyme/Sanofi (Farmacovigilancia).1
Estudios clínicos con Cerdelga®
La eficacia y la seguridad de Cerdelga se han evaluado en el programa clínico más grande llevado a cabo hasta la fecha sobre la Enfermedad de Gaucher, involucrando a casi 400 pacientes adultos con Enfermedad de Gaucher tipo 1, y 3 estudios clínicos de fase III (Tabla 1).1-3,7-10
En pacientes con Enfermedad de Gaucher tipo 1 no tratados previamente, Cerdelga demostró mejoras clínicamente significativas de los niveles de plaquetas y hemoglobina, de los volúmenes de bazo e hígado y en resultados óseos.1,2,8
En los pacientes que habían sido estabilizados previamente con TSE, Cerdelga mantuvo la estabilidad de estos parámetros de la enfermedad.1,3
|
Nombre del Estudio |
N (número de pacientes tratados) |
Descripción del estudio |
| ESTUDIO CON PACIENTES SIN TRATAMIENTO PREVIO (ENGAGE)2 |
40 |
|
| ESTUDIO A LARGO PLAZO CON PACIENTES SIN TRATAMIENTO PREVIO8,9 | 26 |
|
| ESTUDIO DE CAMBIO DE TRATAMIENTO (ENCORE)3 | 159 |
|
| ESTUDIO EN CURSO (EDGE)10 | 170 |
|
Tabla 1. Descripción general de los estudios clínicos de Cerdelga1-3,8,10-11
Monografía de Cerdelga®
Esta monografía proporciona a los profesionales sanitarios que atienden a pacientes con la Enfermedad de Gaucher un recurso informativo y completo sobre el uso de Cerdelga para el tratamiento de la Enfermedad de Gaucher tipo 1.
Se incluye una breve descripción de la genética, patología, historia natural, diagnóstico y pautas de tratamiento de la Enfermedad de Gaucher, seguida por información sobre el tratamiento con Cerdelga.

Contenido mínimo de Cerdelga®
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
Cerdelga 84 mg cápsulas duras – 56 cápsulas duras (CN 709844.7): PVP notificado: 20.767,91 €, PVP IVA notificado: 21.598,63 €. Medicamento sujeto a prescripción médica. Financiado por el SNS. Uso hospitalario.
1. Nombre del medicamento
Cerdelga 84 mg cápsulas duras
2. Composición cualititva y cuantitativa
Cada cápsula contiene 84,4 mg de eliglustat (como tartrato).
Excipiente(s) con efecto conocido:
Cada cápsula contiene 106 mg de lactosa (como monohidrato). Para consultar la lista completa de excipientes, ver sección 6.1.
3. Forma farmacéutica
Cápsula dura.
Cápsula con tapa opaca de color azul verdoso nacarado y cuerpo opaco de color blanco nacarado. En el cuerpo de la cápsula se ha impreso la inscripción “GZ02” en negro. La cápsula es de tamaño 2 (dimensiones 18,0 x 6,4 mm).
▼«Este medicamento está sujeto a seguimiento adicional, es prioritaria la notificación de sospechas de reacciones adversas asociadas a este medicamento.»
Referencias
- Ficha técnica Cerdelga®.
- Mistry PK, Lukina E, Ben Turkia H, et al. Effect of oral eliglustat on splenomegaly in patients with Gaucher disease type 1: the ENGAGE randomized clinical trial. JAMA. 2015;313(7):695-706.
- Cox TM, Drelichman G, Cravo R, et al. Eliglustat compared with imiglucerase in patients with Gaucher's disease type 1 stabilised on enzyme replacement therapy: A phase 3, randomised, open-label, non-inferiority trial. Lancet. 2015;385(9985):2355-2362.
- Agencia Espafiola de Medicamentos y Productos Sanitarios. Centro de Informacion online de Medicamentos de la AEMPS - CIMA [en linea). [Consulta: Julio 2023].
- McEachern KA, Fung J, Komarnitsky S, et al. A specific and potent inhibitor of glucosylceramide synthase for substrate inhibition therapy of Gaucher disease. Mol Genet Metab. 2007;91(3):259-267.
- Peterschmitt MJ, Burke A, Blankstein L, et al. Safety, tolerability, and pharmacokinetics of eliglustat tartrate (Genz112638) after single doses, multiple doses, and food in healthy volunteers. J Clin Pharmacol. 2011;51(5):695-705.
- Cerdelga (eliglustat) European Assessment Report EMA/57549/2015. European Medicines Agency.
- Lukina E, Watman N, Dragosky M, et al. Eliglustat, an investigational oral therapy for Gaucher disease type 1: Phase 2 trial results after 4 years of treatment. Blood Cells Mol Dis. 2014;53(4):10-12.
- Lukina E, Watman N, Arreguin EA, et al. A phase 2 study of eliglustat tartrate (Genz-112638), an oral substrate reduction therapy for Gaucher disease type 1. Blood. 2010;116(6):893-899.
- Charrow J, Ida H, Hollak C, et al. EDGE: A Phase 3 study evaluating once versus twice daily dosing of eliglustat in patients with Gaucher disease type 1: interim results from the lead-in-period. Mol Genet Metab. 2014;111(2):530.
- Ross L, Peterschmitt J, Puga AC, et al. Eliglustat safety profile based on a pooled analysis of data from four trials in Gaucher disease type I. Mol Genet Metab. 2014;111(2):590.
MAT-ES-2301495 V2 Septiembre 2025
.jpg)