
Indicación
Dupixent®, el primer y único biológico1 aprobado para el tratamiento del prurigo nodular (PN) en Europa.
DUPIXENT está indicado para el tratamiento de adultos con prurigo nodular (PN) moderado a grave que son candidatos para terapia sistémica2.
Resumen
Una Diana, doble acción en DA y PN2
Comparado con placebo, con Dupixent® significativamente más pacientes experimentaron:
- Alivio del prurito después de la primera dosis, alcanzando en el ensayo clínico diferencias estadisticamente significativas de p<0,01 a la semana 24-11
- Aclaramiento de la piel3,4
- Mejora en la calidad de vida3,6
El carácter crónico del PN resulta debilitante12
Prurito grave12,13
- 2 de cada 3 pacientes comunican prurito crónico tanto en los nódulos como en la piel lesionada...
- Los pacientes con PN experimentan prurito de mayor gravedad en comparación con otras condiciones dermatológicas.
Disminución de la calidad de vida12,14,15
- Más del 60% de los pacientes informan que su sueño se ve significativamente afectado por su prurito crónico.
- Aproximadamente 1 de cada 2 pacientes tiene ansiedad diagnosticada por un médico.
Nódulos persistentes y cicatrices duraderas16,17
- Los nódulos dolorosos y ardientes a menudo pueden sangrar debido al rascado repetido, lo que resulta en erosión e hiperpigmentación.
- Aproximadamente el 50% reporta dolor, ardor, sangrado y la apariencia de las lesiones como aspectos secundarios asociados.
Carga de la enfermedad12
- Alta frecuencia de consulta al médico, con alrededor del 40% que lo visitan 10 o más veces al año.
- 1 de cada 7 pacientes ha necesitado atención de emergencia debido al PN.

Eficacia demostrada en múltiples endpoints
Más pacientes tratados con Dupixent® lograron una mejora significativa en prurito vs. placebo18.
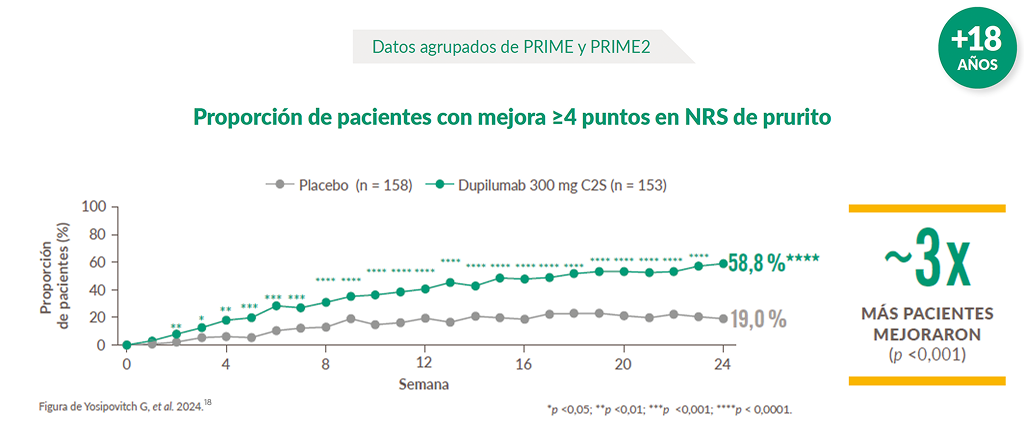

IC: intervalo de confianza; NRS: escala de calificación numérica; OR: odds ratio.
Dupixent® mostró mejoras clínica y estadísticamente significativas en las lesiones cutáneas vs placebo a 24 semanas3
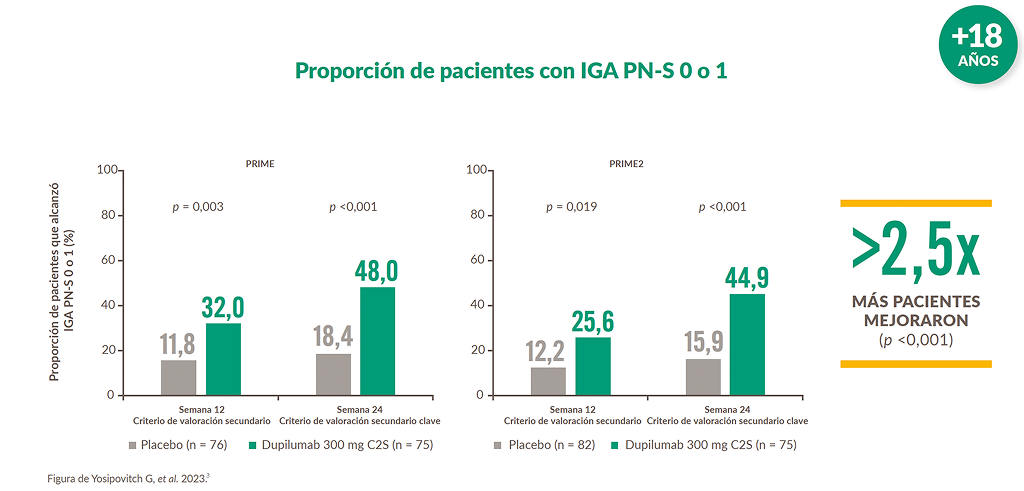
C2S: cada 2 semanas; IGA PN-S: evaluación global del investigador para la valoración del prurigo nodular.
Más pacientes tratados con Dupixent® lograron una mejora significativa en dolor en la piel vs placebo11
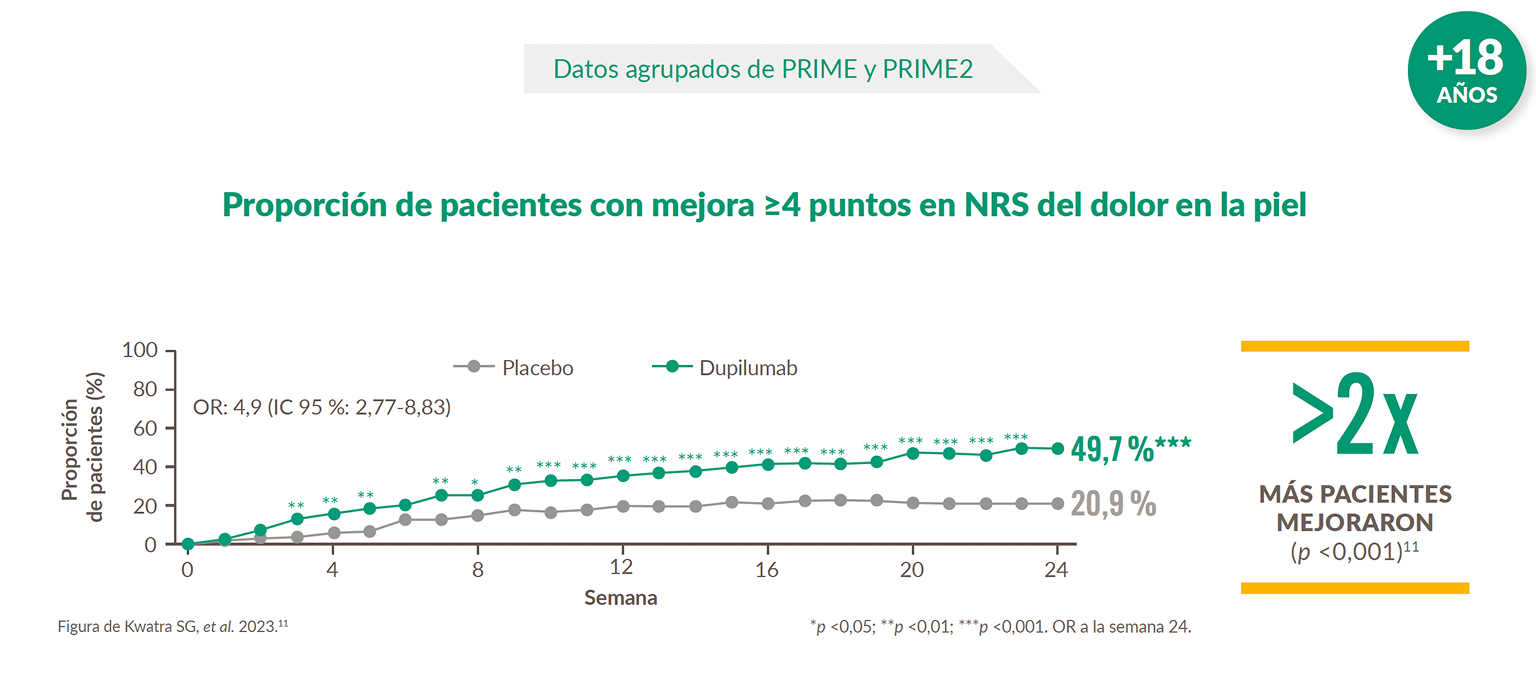
IC: intervalo de confianza; NRS: escala de calificación numérica; OR: odds ratio.
Con Dupixent®, los pacientes experimentaron una mejora significativa en la calidad de vida*3
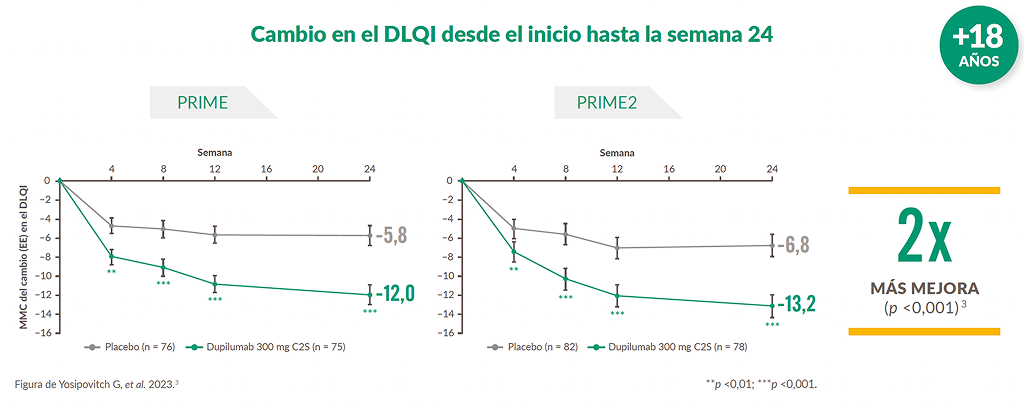
Con DUPIXENT®, los pacientes experimentaron una mejora significativa† en el DLQI a partir de la semana 4 y alcanzaron al final del tratamiento puntuaciones medias en el umbral entre el impacto "pequeño" y "moderado" del PN en su vida, mientras con placebo el gran impacto del PN en la calidad de vida al inicio se mantuvo hasta la semana 243
*Puntuaciones basales medias del DLQI (0-30): 17,8 (DE 7,1) en el grupo de DUPIXENT® y 15,7 (DE 7,3) en el grupo de placebo (estudio PRIME) y 18,2 (DE 6,5) en el grupo de DUPIXENT® y 18,2 (DE 7,0) en el grupo de placebo (estudio PRIME 2). †No controlada por multiplicidad. C2S: cada 2 semanas; DE: desviación estándar; DLQI: índice de calidad de vida en dermatología; EE: error estándar; MMC: media de mínimos cuadrados; PN: prurigo nodular.
Proporción de pacientes que alcanzaron una puntuación IGA PN-S de 0 o 1 en la Semana 12 y Semana 24 según la gravedad de la enfermedad18
En la Semana 24, la proporción de pacientes que alcanzaron una puntuación IGA PN-S de 0 o 1 fue significativamente mayor en el grupo de dupilumab frente al placebo, independientemente de la gravedad de la enfermedad.
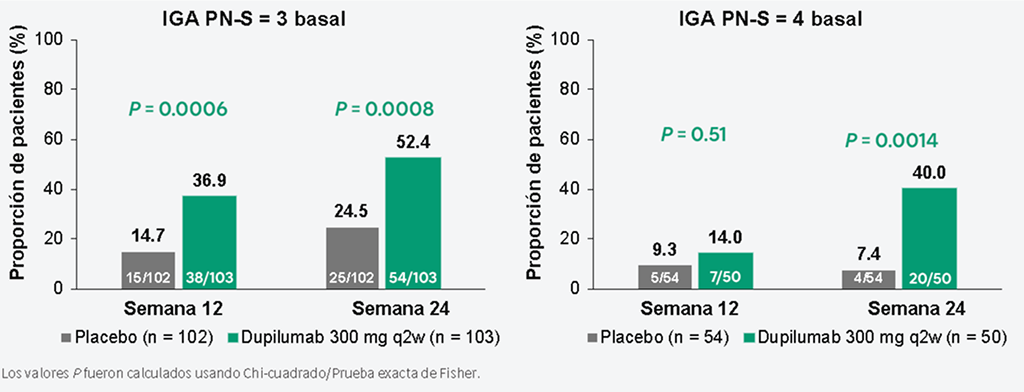
IGA PN-S varía de 0 (claro) a 1 (casi claro), 2 (leve), 3 (moderado) y 4 (severo).
IGA PN-S, Evaluación Global del Investigador Etapa PN.
Diseño del estudio
PRIME fue un ensayo aleatorizado, de fase 3, doble ciego y controlado con placebo que evaluó la eficacia y seguridad de DUPIXENT® en 151 adultos con PN inadecuadamente controlado con terapias tópicas o para quienes esas terapias no eran aconsejables. Durante el periodo de tratamiento de 24 semanas, los participantes recibieron aleatoriamente DUPIXENT® o placebo C2S con o sin tratamientos tópicos (si los participantes usaban TCS en dosis bajas o medias o inhibidores tópicos de la calcineurina seguían con el tratamiento). El criterio principal de valoración fue la proporción de pacientes con mejora clínicamente significativa en el prurito a las 24 semanas, medida por una reducción ≥4 puntos en WI-NRS (0-10). Un criterio de valoración secundario clave fue la proporción de pacientes con piel clara o casi clara a las 24 semanas, medida por una puntuación de 0 o 1 en la escala IGA PN-S (0-4).3
PRIME2 fue un ensayo aleatorizado, de fase 3, doble ciego y controlado con placebo que evaluó la eficacia y seguridad de DUPIXENT® en 160 adultos con PN inadecuadamente controlado con terapias tópicas o para quienes esas terapias no eran aconsejables. Durante el periodo de tratamiento de 24 semanas, los participantes recibieron aleatoriamente DUPIXENT® o placebo C2S con o sin tratamientos tópicos (si los participantes usaban TCS en dosis bajas o medias o inhibidores tópicos de la calcineurina seguían con el tratamiento). El criterio principal de valoración fue la proporción de pacientes con mejora clínicamente significativa en el prurito a las 12 semanas, medida por una reducción ≥4 puntos en el WI-NRS (0-10). Los criterios de valoración secundarios clave incluyeron la proporción de pacientes con mejora clínicamente significativa en el prurito a las 24 semanas y la proporción de participantes con piel clara o casi clara a las 24 semanas, medida por una puntuación de 0 o 1 en la escala IGA PN-S (0-4).3
Características demográficas y clínicas de la población de pacientes al inicio del estudio18
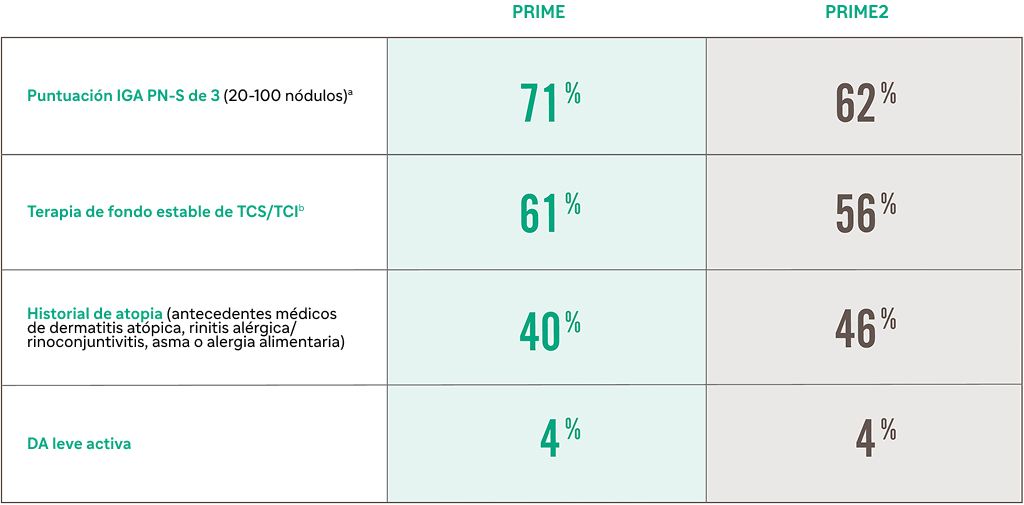
Tabla construida a partir de Yosipovitch, Gil et al,202418
aEl resto de los participantes tenía una puntuación IGA PN-S de 4 (≥100 nódulos).
bTCS era de potencia media o menor.
IGA PN-S, Evaluación Global del Investigador PN-Estadio.
Más pacientes tratados con Dupixent® lograron una mejora significativa en prurito vs. placebo18.


IC: intervalo de confianza; NRS: escala de calificación numérica; OR: odds ratio.
Dupixent® mostró mejoras clínica y estadísticamente significativas en las lesiones cutáneas vs placebo a 24 semanas3

C2S: cada 2 semanas; IGA PN-S: evaluación global del investigador para la valoración del prurigo nodular.
Más pacientes tratados con Dupixent® lograron una mejora significativa en dolor en la piel vs placebo11

IC: intervalo de confianza; NRS: escala de calificación numérica; OR: odds ratio.
Con Dupixent®, los pacientes experimentaron una mejora significativa en la calidad de vida*3

Con DUPIXENT®, los pacientes experimentaron una mejora significativa† en el DLQI a partir de la semana 4 y alcanzaron al final del tratamiento puntuaciones medias en el umbral entre el impacto "pequeño" y "moderado" del PN en su vida, mientras con placebo el gran impacto del PN en la calidad de vida al inicio se mantuvo hasta la semana 243
*Puntuaciones basales medias del DLQI (0-30): 17,8 (DE 7,1) en el grupo de DUPIXENT® y 15,7 (DE 7,3) en el grupo de placebo (estudio PRIME) y 18,2 (DE 6,5) en el grupo de DUPIXENT® y 18,2 (DE 7,0) en el grupo de placebo (estudio PRIME 2). †No controlada por multiplicidad. C2S: cada 2 semanas; DE: desviación estándar; DLQI: índice de calidad de vida en dermatología; EE: error estándar; MMC: media de mínimos cuadrados; PN: prurigo nodular.
Proporción de pacientes que alcanzaron una puntuación IGA PN-S de 0 o 1 en la Semana 12 y Semana 24 según la gravedad de la enfermedad18
En la Semana 24, la proporción de pacientes que alcanzaron una puntuación IGA PN-S de 0 o 1 fue significativamente mayor en el grupo de dupilumab frente al placebo, independientemente de la gravedad de la enfermedad.

IGA PN-S varía de 0 (claro) a 1 (casi claro), 2 (leve), 3 (moderado) y 4 (severo).
IGA PN-S, Evaluación Global del Investigador Etapa PN.
Diseño del estudio
PRIME fue un ensayo aleatorizado, de fase 3, doble ciego y controlado con placebo que evaluó la eficacia y seguridad de DUPIXENT® en 151 adultos con PN inadecuadamente controlado con terapias tópicas o para quienes esas terapias no eran aconsejables. Durante el periodo de tratamiento de 24 semanas, los participantes recibieron aleatoriamente DUPIXENT® o placebo C2S con o sin tratamientos tópicos (si los participantes usaban TCS en dosis bajas o medias o inhibidores tópicos de la calcineurina seguían con el tratamiento). El criterio principal de valoración fue la proporción de pacientes con mejora clínicamente significativa en el prurito a las 24 semanas, medida por una reducción ≥4 puntos en WI-NRS (0-10). Un criterio de valoración secundario clave fue la proporción de pacientes con piel clara o casi clara a las 24 semanas, medida por una puntuación de 0 o 1 en la escala IGA PN-S (0-4).3
PRIME2 fue un ensayo aleatorizado, de fase 3, doble ciego y controlado con placebo que evaluó la eficacia y seguridad de DUPIXENT® en 160 adultos con PN inadecuadamente controlado con terapias tópicas o para quienes esas terapias no eran aconsejables. Durante el periodo de tratamiento de 24 semanas, los participantes recibieron aleatoriamente DUPIXENT® o placebo C2S con o sin tratamientos tópicos (si los participantes usaban TCS en dosis bajas o medias o inhibidores tópicos de la calcineurina seguían con el tratamiento). El criterio principal de valoración fue la proporción de pacientes con mejora clínicamente significativa en el prurito a las 12 semanas, medida por una reducción ≥4 puntos en el WI-NRS (0-10). Los criterios de valoración secundarios clave incluyeron la proporción de pacientes con mejora clínicamente significativa en el prurito a las 24 semanas y la proporción de participantes con piel clara o casi clara a las 24 semanas, medida por una puntuación de 0 o 1 en la escala IGA PN-S (0-4).3
Características demográficas y clínicas de la población de pacientes al inicio del estudio18

Tabla construida a partir de Yosipovitch, Gil et al,202418
aEl resto de los participantes tenía una puntuación IGA PN-S de 4 (≥100 nódulos).
bTCS era de potencia media o menor.
IGA PN-S, Evaluación Global del Investigador PN-Estadio.
Perfil de seguridad
Perfil de seguridad demostrado en PN hasta la semana 243
Eventos adversos emergentes del tratamiento
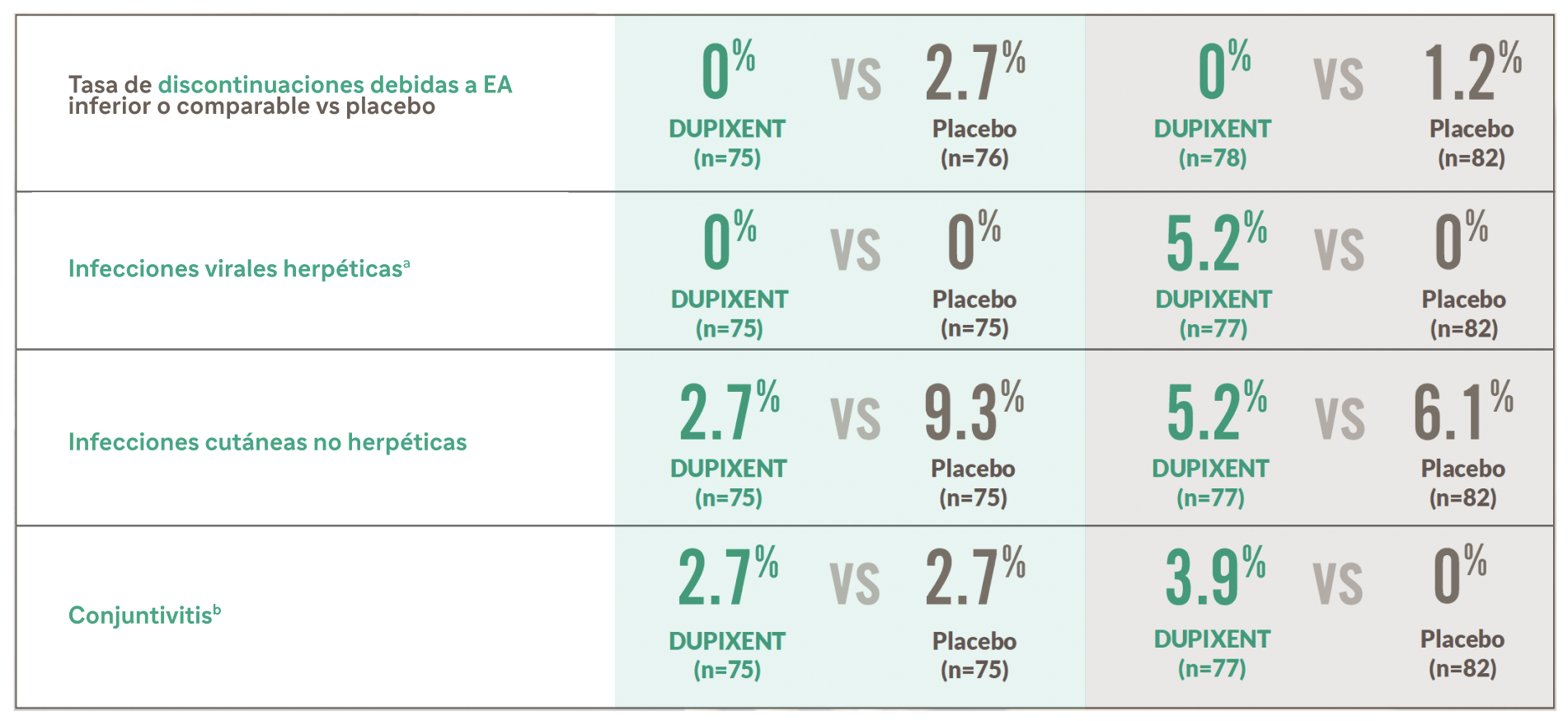
a Las infecciones virales herpéticas (término de alto nivel) incluyen los PT de MedDRA herpes oral, herpes zóster, herpes zóster oftálmico, herpes genital.
b La conjuntivitis (término específico) incluye los PT de MedDRA conjuntivitis, conjuntivitis bacteriana, conjuntivitis viral, conjuntivitis adenoviral, conjuntivitis alérgica y queratoconjuntivitis atópica.
Ver ficha técnica de DUPIXENT para obtener información adicional sobre seguridad.
EA, evento adverso; MedDRA, Diccionario Médico para Actividades Reguladoras; PT, término preferido.
Seguridad consistente en todas las indicaciones2
Reacciones adversas para Dupixent en estudios clínicos2
|
Clase de órgano del sistema |
Frecuencia |
Reacción adversa |
|
Infecciones e infestaciones |
Común |
Conjuntivitis³, Herpes oralª |
|
Trastornos del sistema sanguíneo y linfático |
Común |
Eosinofilia |
|
Trastornos del sistema inmunológico |
Poco común, Raro |
Angioedemaª, Reacción anafiláctica, Reacciones de enfermedad del suero, Reacciones similares a la enfermedad del suero |
|
Trastornos oculares |
Común, Poco común, Raro |
Conjuntivitis alérgicaª, Queratitisª,ᶜ, Blefaritisᶜ, Prurito ocularᶜ, Ojo secoᶜ, Queratitis ulcerativaᶜ |
|
Trastornos de la piel y del tejido subcutáneo |
Poco común |
Erupción facialᵇ |
|
Trastornos del sistema musculoesquelético y del tejido conectivo |
Común |
Artralgiaᵇ |
|
Trastornos generales y condiciones en el sitio de administración |
Común |
Reacciones en el sitio de inyección (incluye eritema, edema, prurito, dolor e hinchazón) |
Si ocurre una reacción de hipersensibilidad sistémica (inmediata o retardada), se debe suspender DUPIXENT de inmediato e iniciar la terapia adecuada².
Los pacientes que desarrollen conjuntivitis que no se resuelva después del tratamiento estándar deben someterse a un examen oftalmológico².
Los pacientes con dermatitis atópica moderada a severa y asma concomitante no deben ajustar o suspender sus tratamientos para el asma sin consultar a sus médicos. Monitoree a los pacientes con asma concomitante cuidadosamente después de la discontinuación de DUPIXENT².
La mayoría de los pacientes que experimentaron conjuntivitis se recuperaron o estaban en proceso de recuperación durante el período de tratamiento².
Trate cualquier infección helmíntica preexistente antes de iniciar el tratamiento con DUPIXENT. Si los pacientes se infectan mientras reciben tratamiento y no responden al tratamiento antihelmíntico, suspenda el tratamiento hasta que la infección se resuelva².
ᵃ Los trastornos oculares y el herpes oral ocurrieron predominantemente en estudios de dermatitis atópica.
ᵇ Reportado en la postcomercialización.
ᶜ Las frecuencias de prurito ocular, blefaritis y ojo seco fueron comunes, y la queratitis ulcerativa fue poco común en estudios de dermatitis atópica.
Administración
Dupixent ofrece a sus pacientes opciones convenientes de administración²
Dosificación en prurigo nodular²
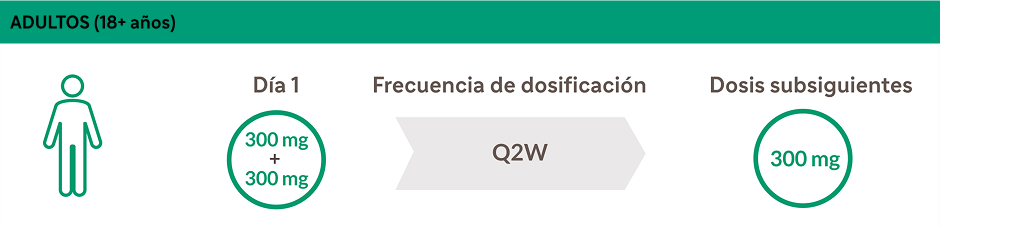
Q2W: cada 2 semanas.
DUPIXENT ofrece a sus pacientes la opción de administración en casa o en la consulta médica².

Mecanismo de acción
Los roles del de IL-4 e IL-13 en el prurigo nodular
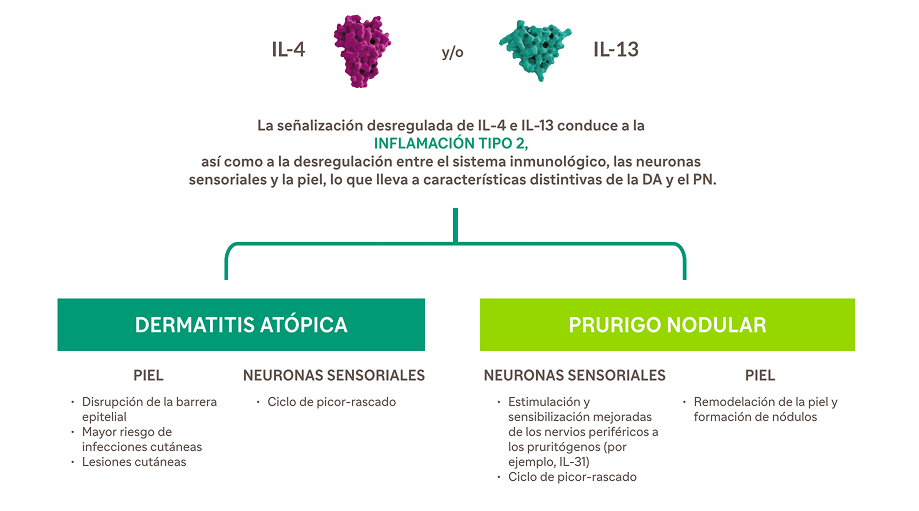
La señalización desregulada de IL-4 e IL-13 —dos impulsores clave de la inflamación tipo 2— desempeña un papel importante en la patogénesis de la dermatitis atópica (DA) y el prurigo nodular (PN)12,19-28,a
IL-4 tiene un papel único en la inflamación tipo 2 como modulador clave de la respuesta Th22,19-28,a
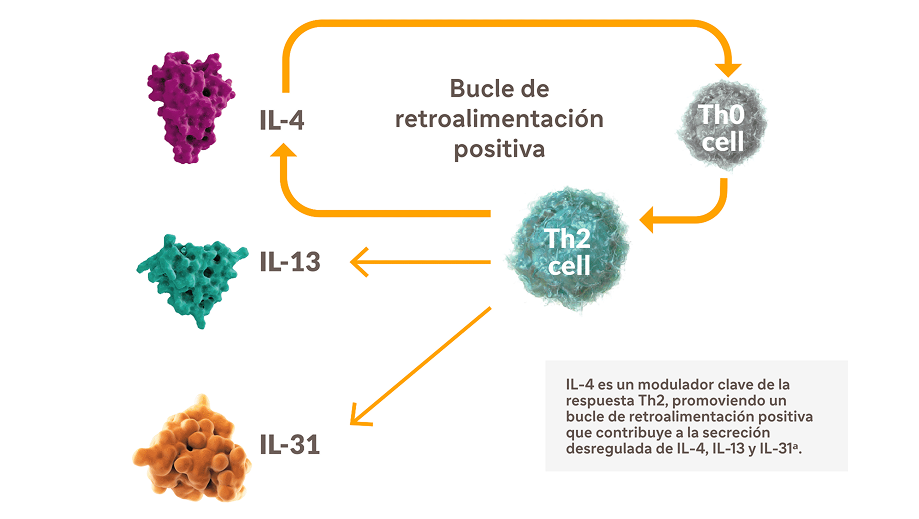
IL-4 media la señalización del picor promoviendo la liberación de IL-31.
ᵃ Los citocinas tipo 2 también pueden ser producidas por otras células inmunes, como las ILC2.
IL-4 e IL-13 tienen roles superpuestos en la inflamación tipo 22,19-28
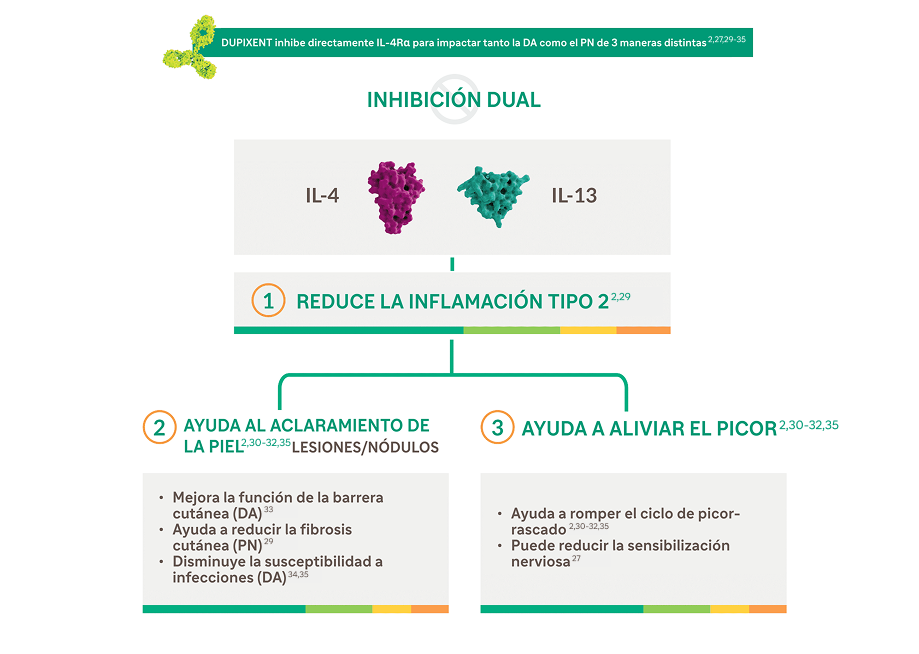
Dupixent® es el primer y único inmunomodulador dirigido que apunta específicamente a dos mediadores clave de la inflamación tipo 2 responsables de la DA y el PN—IL-4 e IL-132
Contenido mínimo de Dupixent®
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
-
Dupixent 300 mg solución inyectable en jeringa precargada – 2 jeringas precargadas de 2 ml con protector de aguja (CN 718735.6).
-
Dupixent 300 mg solución inyectable en pluma precargada – 2 plumas precargadas de 2 ml (CN 758028.7).
-
Dupixent 200 mg solución inyectable en jeringa precargada – 2 jeringas precargadas de 1,14 ml (CN 727309.7).
-
Dupixent 200 mg solución inyectable en pluma precargada – 2 plumas precargadas de 1,14 ml (CN 758027.0).
PVP notificado: 1.267,45 €, PVP IVA notificado: 1.318,15 €.
Medicamento sujeto a prescripción médica. Diagnóstico hospitalario. Financiado por SNS. Dispensación hospitalaria sin cupón precinto.
CONSULTE LA FICHA TÉCNICA COMPLETA ANTES DE PRESCRIBIR ESTE MEDICAMENTO.
Ver ficha técnica DUPIXENT® 200 mg solución inyectable en jeringa precargada
Ver ficha técnica DUPIXENT® 200 mg solución inyectable en pluma precargada
Ver ficha técnica DUPIXENT® 300 mg solución inyectable en jeringa precargada
Ver ficha técnica DUPIXENT® 300 mg solución inyectable en pluma precargada
Dupixent está financiado en España de acuerdo con los criterios establecidos por el SNS.
1. NOMBRE DEL MEDICAMENTO
Dupixent 300 mg solución inyectable en jeringa precargada
Dupixent 300 mg solución inyectable en pluma precargada
Dupixent 200 mg solución inyectable en jeringa precargada
Dupixent 200 mg solución inyectable en pluma precargada
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Dupilumab 300 mg solución inyectable en jeringa precargada
Cada jeringa precargada de un solo uso contiene 300 mg de dupilumab en 2 ml de solución (150 mg/ml).
Dupilumab 300 mg solución inyectable en pluma precargada
Cada pluma precargada de un solo uso contiene 300 mg de dupilumab en 2 ml de solución (150 mg/ml).
Dupilumab 200 mg solución inyectable en jeringa precargada
Cada jeringa precargada de un solo uso contiene 200 mg de dupilumab en 1,14 ml de solución (175 mg/ml).
Dupilumab 200 mg solución inyectable en pluma precargada
Cada pluma precargada de un solo uso contiene 200 mg de dupilumab en 1,14 ml de solución (175 mg/ml).
Dupilumab es un anticuerpo monoclonal completamente humano producido por tecnología de ADN recombinante en las células de Ovario de Hámster Chino (OHC).
Para consultar la lista completa de excipientes, ver sección Lista de excipientes.
3. FORMA FARMACÉUTICA
Solución inyectable (inyectable).
Solución estéril transparente a ligeramente opalescente, de incolora a amarillo pálido, sin partículas visibles, con un pH de aproximadamente 5,9.

Referencias
- European Medicines Agency (EMA) [en línea]. Disponible en: https://www.ema.europa.eu/en/medicines. Último acceso: marzo 2025.
- Ficha técnica de DUPIXENT® (dupilumab).
- Yosipovitch G, et al. Nat Med. 2023;29(5):1180-1190.
- Blauvelt A, et al. Lancet. 2017;389(10086):2287-2303.
- Canonica GW, et al. Allergy Clin Immunol Pract. 2022:10(6):1515-1526.
- Cork MJ, et al. J Dermatolog Treat. 2020;31(6):606-614.
- Thaçi D, et al. J Dermatol Sci. 2019:94(2):266-275.
- Simpson E, et al. JAMA Dermatol. 2020;156(1):44-56.
- Paller A, et al. J Am Acad Dermatol. 2020;83(5):1282-1293.
- Paller AS, et al. Adv Ther. 2024;41(3):1046-1061.
- Kwatra SG, et al. Póster presentado en: 81st Annual Meeting of the American Academy of Dermatology (AAD 2023); 17-21 de marzo, 2023. Nueva Orleans, LA. EE. UU.
- Aggarwal P et al. Clin Exp Dermatol 2021;46(7):1277-1284.
- Mollanazar NK et al. J Am Acad Dermatol 2016;75(4):842-844.
- Gwillim EC et al. Acta Derm Venereol 2021;101(3):adv00424.
- Pereira MP et al. Acta Derm Venereol 2021;101(2):adv00403.
- Pereira MP et al. J Eur Acad Dermatol Venereol 2018;32(12):2224-2229.
- Ständer HF et al. J Am Acad Dermatol 2020;82(2):460-468.
- Yosipovitch, Gil et al. “Dupilumab improves pruritus and skin lesions in patients with prurigo nodularis: Pooled results from 2 phase 3 trials (LIBERTY-PN PRIME and PRIME2).” JAAD international vol. 16 163-174. 10 Apr. 2024, doi:10.1016/j.jdin.2024.03.025
- Serezani APM et al. J Allergy Clin Immunol 2017;139(1):142-151.e5.
- Silverberg JI et al. Dermatol Clin 2017;35(3):327-334.
- Nguyen JK et al. Arch Dermatol Res 2020;312(2):81-92.
- Weigelt N et al. J Cutan Pathol 2010;37(5):578-586.
- Satoh T et al. J Dermatol 2021;48(9):e414-e431.
- Belzberg M et al. J Invest Dermatol 2021;141(9):2208-2218.e14.
- Weidinger S et al. Nat Rev Dis Primers 2018;4(1):1.
- Haddad E-B et al. Dermatol Ther (Heidelb) 2022;12(7):1501-1533.
- Oetjen LK et al. Cell 2017;171(1):217-228.e13.
- Williams KA et al. J Am Acad Dermatol 2020;83(6):1567-1575.
- Hamilton JD et al. Clin Exp Allergy 2021;51:915-931.
- Blauvelt A et al. Lancet 2017;389(10086):2287-2303.
- Simpson EL et al. JAMA Dermatol 2020;156(1):44-56.
- Paller AS et al. J Am Acad Dermatol 2020;83(5):1282-1293.
- Berdyshev E et al. Allergy 2022;77:3388-3397.
- Eichenfield LF et al. Am J Clin Dermatol 2019;20(3):443-456.
- Paller AS et al. Pediatr Dermatol 2022;39(2):187-196.
MAT-ES-2402847- V1- MARZO 2025