
Indicación
Dupixent®, el primer y único3 biológico dirigido a la inflamación de tipo 2, una causa desencadenante de la EEo1,4,5
Dupixent® está indicado para el tratamiento de la EEo en adultos y adolescentes a partir de 12 años, con un peso mínimo de 40 kg, que no están adecuadamente controlados, son intolerantes o no son candidatos a la terapia con medicamentos convencionales.1
Carga de la enfermedad
La EEo es una enfermedad crónica y progresiva del esófago impulsada por la inflamación de tipo 25-7
Muchos pacientes con EEo siguen sin control con el tratamiento estándar actual, lo que conlleva una alta carga de la enfermedad y un mayor riesgo de progresión.8-11

~1 de cada 4000 personas en el mundo tiene EEo12
El 75 % de los pacientes con EEo tiene al menos una enfermedad inflamatoria de tipo 2 comórbida4

50% de los pacientes no logra remisión clinicohistológica con IBP13
La mayoría de los pacientes con EEo tiene síntomas recurrentes y muchos repiten el tratamiento con corticosteroides tópicos deglitudos11,a
Signos y síntomas
Los pacientes con EEo experimentan:6,9,14,15

Disfagia
Impactación y posterior extracción del bolo alimentario

Dolor torácico no cardiaco
Regurgitación

a. El 61 % de los pacientes adultos repitió el tratamiento con corticosteroides tópicos deglutidos al menos una vez.
Inflamación Tipo 2
Dupixent®, el primer y único3 biológico dirigido a la inflamación de tipo 2 en la EEo1
La inflamación de tipo 2 es la causa subyacente en la mayoría de los pacientes con EEo.4,5
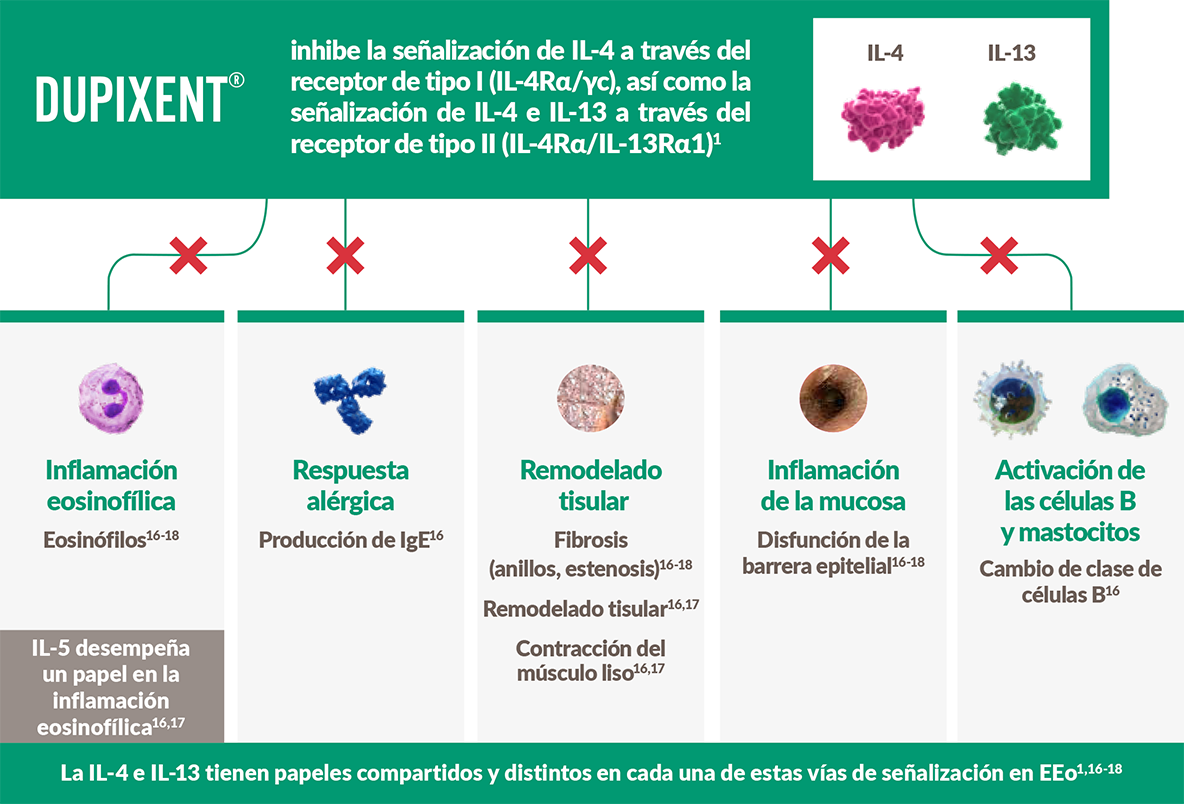
Figura adaptada de Bredenoord AJ, et al. 2022,16 O’Shea KM, et al. 2018,17 y Hill DA, et al. 2016.18

Calidad de vida
Mejora mantenida de los síntomas2,19
Dupixent® proporciona resultados en medidas clínicas clave de la enfermedad con una mejora significativa de la calidad de vida2,19
Reducción mantenida de la disfagia2,19
Hasta un 81% de reducción de la disfagia en la semana 52 a,b,19
Mejora significativa de la disfagia en comparación con placebo ya en la semana 41
Mejora en el recuento máximo de eosinófilos intraepiteliales esofágicos19
Hasta un 85% de los pacientes alcanzó la remisión histológica (≤6 EOS/HPF) en la semana 52 a,b,19
100 % de los pacientes alcanzó respuesta histológica (<15 EOS/HPF) en la semana 52d,19
a. 80,7 % de reducción en la puntuación DSQ en los pacientes que recibieron Dupixent® desde el inicio (n = 54), y el 78,1 % de reducción en los pacientes que cambiaron de placebo a Dupixent® en la semana 24 (n = 24).19
b. 64,3 % de reducción en la puntuación DSQ con Dupixent® en la semana 24 (variable coprimaria) (n = 63) vs. 41,4 % con placebo (n = 59) (p <0,001).20
d. El 100 % de los pacientes que recibió Dupixent® desde el inicio (n = 65), y el 78 % de los pacientes que cambió de placebo a Dupixent® en la semana 24 (n = 37) alcanzó la respuesta histológica (<15 EOS/HPF) en la semana 52.19
Mejora de la calidad de vida2


e. Medida según la EoE-SQ-Frecuencia, la puntuación en la semana 24 con Dupixent® fue de -3,9 vs. -2,6 con placebo.2
f. Medida según la EoE-IQ, la puntuación en la semana 24 con Dupixent® fue de -0,89 vs. -0,58 con placebo.2
Mejora en la gravedad de los signos endoscópicos2,19
Dupixent® mejoró en los hallazgos endoscópicos (EREFS) vs. placebo en la semana 24a, con una mejora mantenida hasta la semana 5219
Reducción de los signos endoscópicos de inflamación1,19
Hasta un 85% de mejora de la puntuación total de EREFS en la semana 52b,19
Resultados con Dupixent®
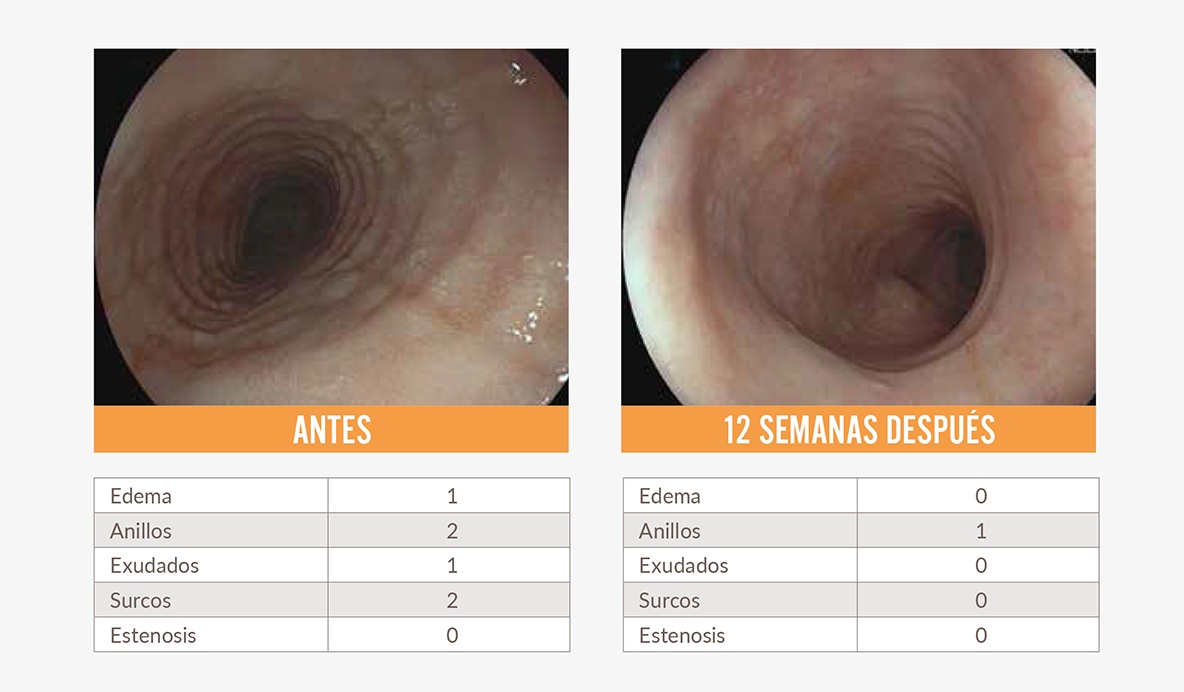
Imágenes endoscópicas de un paciente real tratado con Dupixent® usadas con consentimiento. Los resultados individuales pueden variar.
Puntuación de referencia endoscópica de EEo (EoE-Endoscopic Reference Score, EoE-EREFS): mide edema, anillos, exudados, surcos y estenosis para evaluar la gravedad de las características endoscópicas. Las puntuaciones varían de 0 a 18, siendo puntuaciones más altas indicativas de mayor gravedad. Las puntuaciones EREFS se midieron a partir de endoscopias de las regiones esofágicas proximal y distal.2
a. 66 % de reducción en la semana 24 con Dupixent® (reducción de 4,6 puntos desde un valor basal de 7,0; n = 80) vs. 8 % con placebo (reducción de 0,6 desde un valor basal de 7,0; n = 79).19
b. 77 % de reducción en los pacientes que recibieron Dupixent desde el inicio (reducción de 5,4 puntos desde un valor basal de 7,0 n = 80) y 87 % de reducción en los pacientes que cambiaron de placebo a Dupixent® en la semana 24 (reducción de 6,1 puntos desde un valor basal de 7,0 al inicio del estudio; n = 37).19
Mejora mantenida de los síntomas2,19
Dupixent® proporciona resultados en medidas clínicas clave de la enfermedad con una mejora significativa de la calidad de vida2,19
Reducción mantenida de la disfagia2,19

Hasta un 81% de reducción de la disfagia en la semana 52 a,b,19
Mejora significativa de la disfagia en comparación con placebo ya en la semana 41
Mejora en el recuento máximo de eosinófilos intraepiteliales esofágicos19

Hasta un 85% de los pacientes alcanzó la remisión histológica (≤6 EOS/HPF) en la semana 52 a,b,19
100 % de los pacientes alcanzó respuesta histológica (<15 EOS/HPF) en la semana 52d,19
a. 80,7 % de reducción en la puntuación DSQ en los pacientes que recibieron Dupixent® desde el inicio (n = 54), y el 78,1 % de reducción en los pacientes que cambiaron de placebo a Dupixent® en la semana 24 (n = 24).19
b. 64,3 % de reducción en la puntuación DSQ con Dupixent® en la semana 24 (variable coprimaria) (n = 63) vs. 41,4 % con placebo (n = 59) (p <0,001).20
d. El 100 % de los pacientes que recibió Dupixent® desde el inicio (n = 65), y el 78 % de los pacientes que cambió de placebo a Dupixent® en la semana 24 (n = 37) alcanzó la respuesta histológica (<15 EOS/HPF) en la semana 52.19
Mejora de la calidad de vida2


e. Medida según la EoE-SQ-Frecuencia, la puntuación en la semana 24 con Dupixent® fue de -3,9 vs. -2,6 con placebo.2
f. Medida según la EoE-IQ, la puntuación en la semana 24 con Dupixent® fue de -0,89 vs. -0,58 con placebo.2
Mejora en la gravedad de los signos endoscópicos2,19
Dupixent® mejoró en los hallazgos endoscópicos (EREFS) vs. placebo en la semana 24a, con una mejora mantenida hasta la semana 5219
Reducción de los signos endoscópicos de inflamación1,19

Hasta un 85% de mejora de la puntuación total de EREFS en la semana 52b,19
Resultados con Dupixent®

Imágenes endoscópicas de un paciente real tratado con Dupixent® usadas con consentimiento. Los resultados individuales pueden variar.
Puntuación de referencia endoscópica de EEo (EoE-Endoscopic Reference Score, EoE-EREFS): mide edema, anillos, exudados, surcos y estenosis para evaluar la gravedad de las características endoscópicas. Las puntuaciones varían de 0 a 18, siendo puntuaciones más altas indicativas de mayor gravedad. Las puntuaciones EREFS se midieron a partir de endoscopias de las regiones esofágicas proximal y distal.2
a. 66 % de reducción en la semana 24 con Dupixent® (reducción de 4,6 puntos desde un valor basal de 7,0; n = 80) vs. 8 % con placebo (reducción de 0,6 desde un valor basal de 7,0; n = 79).19
b. 77 % de reducción en los pacientes que recibieron Dupixent desde el inicio (reducción de 5,4 puntos desde un valor basal de 7,0 n = 80) y 87 % de reducción en los pacientes que cambiaron de placebo a Dupixent® en la semana 24 (reducción de 6,1 puntos desde un valor basal de 7,0 al inicio del estudio; n = 37).19
Perfil de Seguridad
Dupixent® es un anticuerpo monoclonal completamente humano que tiene una seguridad y una tolerabilidad favorables en pacientes ≥12 años con EEo1,20
Las reacciones adversas más frecuentes en dermatitis atópica, asma y rinosinusitis crónica con poliposis nasal son reacciones en el lugar de la inyección (incluye eritema, edema, prurito, dolor e hinchazón), conjuntivitis, conjuntivitis alérgica, artralgia, herpes oral y eosinofilia. Se notificó una reacción adversa adicional de hematomas en el lugar de la inyección en EEo.1
Dupixent® 300 mg cada semana ha demostrado un perfil de seguridad aceptable y similar a placebo en las semanas 24 y 5220
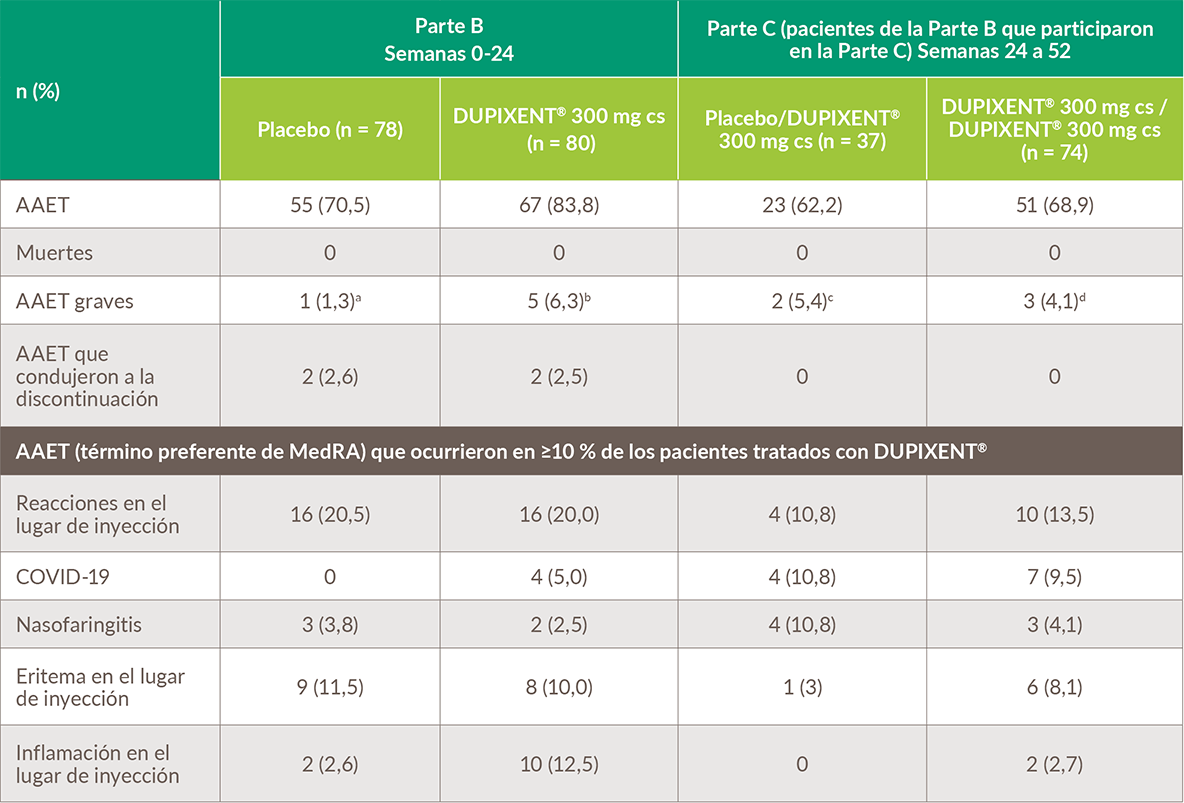
a. Cambios en el estado mental. b. Depresión suicida, colitis por Campylobacter, creatina fosfoquinasa en sangre anormal, cáncer de mama, neumonía por aspiración. c. Vómitos, celulitis. d. Diarrea, tenesmo rectal, enterocolitis infecciosa, dolor en el pecho.
Tabla de Dellon ES, et al. 2022.20

Dupixent® no es un inmunosupresor1

No requiere monitorización inicial ni de seguimiento1,21

No tiene interacciones conocidas con otros farmacos1
Administración
Dosis recomendada para pacientes con EEo1

Diseño del estudio TREET1,2,19
El estudio TREET en EEo incluyó un protocolo de tres partes que consta de dos estudios aleatorizados por separado, doble ciego, de grupos paralelos, multicéntricos, controlados con placebo, de 24 semanas de tratamiento (TREET Parte A y TREET Parte B) en adultos y pacientes pediátricos de 12 a 17 años, excluyendo a los pacientes <40 kg. En TREET Partes A y B, todos los pacientes inscritos habían fracasado a la terapia con medicamentos convencionales (IBP), el 74 % fue tratado con otra terapia convencional (corticosteroides tópicos deglutidos) antes de la inclusión. En TREET Parte B, el 49 % de los pacientes no estaba adecuadamente controlado, era intolerante o tenía contraindicación al tratamiento con corticosteroides tópicos deglutidos. En ambas partes, los pacientes debían tener ≥15 eosinófilos intraepiteliales por campo de gran aumento después de un tratamiento de al menos 8 semanas con un IBP en dosis altas, ya sea antes o durante el periodo de selección y una puntuación del DSQ ≥10 en una escala de 0 a 84. Los pacientes se estratificaron según la edad en el momento de la visita de selección (12 a 17 años frente a 18 años y mayores) y el uso de IBP en la aleatorización. Primero se llevó a cabo el TREET Parte A. El TREET Parte B se inició después de que se completó la inscripción en el TREET Parte A. Los pacientes que completaron las 24 semanas del periodo de tratamiento doble ciego en las Partes A o B tuvieron la opción de ser incluidos en un estudio de extensión de tratamiento activo de 28 semanas (TREET Parte C).
Las variables coprimarias de eficacia en ambos ensayos fueron la proporción de pacientes que alcanzó la remisión histológica definida como el recuento máximo de eosinófilos intraepiteliales esofágicos ≤6 EOS/HPF en la semana 24 y el cambio absoluto en la puntuación del DSQ comunicada por el paciente desde el momento basal hasta la semana 24. Las variables secundarias incluyeron, desde el momento basal: cambio porcentual en el recuento máximo de EOS/HPF, cambio absoluto en la puntuación media de grado del sistema de puntuación histológica de EEo (Mean Grade Score from the Histology Scoring System, EoEHSS), cambio absoluto en la puntuación media de estadio del EoEHSS (Mean Stage Score from the EoEHSS), cambio absoluto en la puntuación de referencia endoscópica de EEo (EoE-Endoscopic Reference Score, EoE-EREFS) y proporción de pacientes que alcanzó un recuento máximo de eosinófilos intraepiteliales esofágicos <15 EOS/HPF.
Contenido mínimo de Dupixent®
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
-
Dupixent 300 mg solución inyectable en jeringa precargada – 2 jeringas precargadas de 2 ml con protector de aguja (CN 718735.6).
-
Dupixent 300 mg solución inyectable en pluma precargada – 2 plumas precargadas de 2 ml (CN 758028.7).
-
Dupixent 200 mg solución inyectable en jeringa precargada – 2 jeringas precargadas de 1,14 ml (CN 727309.7).
-
Dupixent 200 mg solución inyectable en pluma precargada – 2 plumas precargadas de 1,14 ml (CN 758027.0).
PVP notificado: 1.267,45 €, PVP IVA notificado: 1.318,15 €.
Medicamento sujeto a prescripción médica. Diagnóstico hospitalario. Financiado por SNS. Dispensación hospitalaria sin cupón precinto.
CONSULTE LA FICHA TÉCNICA COMPLETA ANTES DE PRESCRIBIR ESTE MEDICAMENTO.
Ver ficha técnica DUPIXENT® 200 mg solución inyectable en jeringa precargada
Ver ficha técnica DUPIXENT® 200 mg solución inyectable en pluma precargada
Ver ficha técnica DUPIXENT® 300 mg solución inyectable en jeringa precargada
Ver ficha técnica DUPIXENT® 300 mg solución inyectable en pluma precargada
Dupixent está financiado en España de acuerdo con los criterios establecidos por el SNS.
AAET: acontecimientos adversos emergentes con el tratamiento; DSQ: cuestionario de Síntomas de Disfagia (Dysphagia Symptom Questionnaire); EEo: esofagitis eosinofílica; EoE-IQ: puntuación de la calidad de vida relacionada con la salud; EoE-SQ: puntuación de la frecuencia de otros síntomas distintos de la disfagia; EOS/HPF: eosinófilos intraepiteliales por campo de gran aumento; IBP: inhibidores de la bomba de protones; Ig: inmunoglobulina; IL: interleucina; MedRA: diccionario médico para actividades reguladoras.
- CIMA - Centro de información online de medicamentos de la AEMPS. Dupixent® (dupilumab). Ficha técnica [en línea] [consulta: 30 abril 2024]. Disponible en: https://cima.aemps. es/cima/pdfs/es/ft/1171229006/FT_1171229006.pdf.
- Dellon ES, et al. Dupilumab in adults and adolescents with eosinophilic esophagitis. N Engl J Med. 2022;387(25):2317-2330.
- Agencia Española de Medicamentos y Productos Sanitarios. Centro de Información online de Medicamentos de la AEMPS – CIMA [en línea]. Disponible en: https://cima.aemps.es/cima/publico/home.html. Último acceso: abril 2024.
- van Rhijn BD, Bredenoord AJ. Management of eosinophilic esophagitis based on pathophysiological evidence. J Clin Gastroenterol.2017;51(8):659-668.
- Gandhi NA, et al. Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov. 2016;15(1):35-50.
- Mukkada V, et al. Health-related quality of life and costs associated with eosinophilic esophagitis: a systematic review. Clin Gastroenterol Hepatol. 2018;16(4):495-503.e8.
- Chehade M, et al. Phenotypic characterization of eosinophilic esophagitis in a large multicenter patient population from the Consortium for Food Allergy Research. J Allergy Clin Immunol Pract. 2018;6(5):1534-1544.e5.
- Wolf WA, Dellon ES. Eosinophilic esophagitis and proton pump inhibitors: controversies and implications for clinical practice. Gastroenterol Hepatol (NY). 2014;10(7):427-432.
- D’Alessandro A, et al. Eosinophilic esophagitis: from pathophysiology to treatment. World J Gastrointest Pathophysiol. 2015;6(4):150-158.
- Gomez Torrijos E, et al. Eosinophilic esophagitis: review and update. Front Med (Lausanne). 2018;5:247.
- Lucendo AJ, et al. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management in children and adults. United European Gastroenterol J. 2017;5(3):335-358.
- Dellon ES, Hirano I. Epidemiology and natural history of eosinophilic esophagitis. Gastroenterology. 2018;154(2):319-332.
- Lucendo AJ, et al. Efficacy of proton pump inhibitor drugs for inducing clinical and histologic remission in patients with symptomatic esophageal eosinophilia: a systematic review and meta-analysis. Clin Gastroenterol Hepatol. 2016;14(1):13-22.
- Li-Kim-Moy JP, et al. Esophageal subepithelial fibrosis and hyalinization are features of eosinophilic esophagitis. J Pediatr Gastroenterol Nutr. 2011;52(2):147-153.
- Straumann A, et al. Eosinophilic esophagitis: analysis of food impaction and perforation in 251 adolescent and adult patients. Clin Gastroenterol Hepatol. 2008;6(5):598-600.
- Bredenoord AJ, et al. Disease Burden and Unmet Need in Eosinophilic Esophagitis. Am J Gastroenterol. 2022;117(8):1231-1241.
- O’Shea KM, et al. Pathophysiology of eosinophilic esophagitis. Gastroenterology. 2018;154(2):333-345.
- Hill DA, Spergel JM. The immunologic mechanisms of eosinophilic esophagitis. Curr Allergy Asthma Rep. 2016;16(2):9.
- Rothenberg ME, Dellon ES, Collins MH, et al. Efficacy and safety of dupilumab up to 52 weeks in adults and adolescents with eosinophilic oesophagitis (LIBERTY EoE TREET study): a multicentre, double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Gastroenterol Hepatol. 2023; 8(11):990- 1004.
- Dellon ES, et al. Dupilumab efficacy and safety up to 52 weeks in adult and adolescent patients with eosinophilic esophagitis: results from parts B and C of the randomized, placebo-controlled, three-part, Phase 3 LIBERTY EoE TREET Study. Presentado en: American College of Gastroenterology 2022. 21-26 de octubre, 2022. Charlotte, NC.
- Wollenberg A, et al. Br J Dermatol. 2020;182(5):1120-1135.
MAT-ES-2401811 V1 Junio 2024