
¿Qué es Cablivi®?
El Dr. David Valcárcel, jefe de servicio de Hematología Intensiva en el Hospital Vall d’Hebron (Barcelona), nos detalla toda la información sobre Cablivi® (caplacizumab).
Mecanismo de acción1,2
Cablivi® es un nanoanticuerpo bivalente humanizado (≈28 kD) producido en E. coli mediante tecnología de ADN recombinante. Diseñado para ser pequeño y robusto, consta de 2 estructuras anti-FvW idénticas que se unen con facilidad a los objetivos, incluyendo los de difícil anclaje y bloqueo.1,2
En la PTTa, a pesar del tratamiento estándar con recambio plasmático y terapia inmunosupresora, los pacientes mantienen un riesgo de mortalidad del 20%. Además, el riesgo de trombosis microvascular puede tener consecuencias agudas y a largo plazo si no se aborda.3-6 Cablivi® neutraliza rápidamente el FvW dentro de las 24 horas, suprimiendo la adhesión plaquetaria desde el día 1 y durante todo el tratamiento.1,7-8
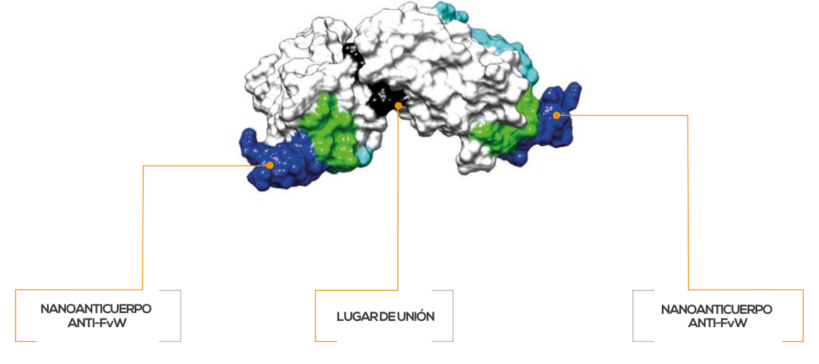
"Figura adaptada".
Eficacia clínica y seguridad
La eficacia y seguridad de Cablivi® se evaluó en adultos que presentaban un episodio de PTTa en 3 estudios aleatorizados y controlados.1,20
Ensayo clínico HERCULES: Los pacientes alcanzaron una normalización en el recuento de plaquetas significativamente más rápido con Cablivi®1, 20*
El objetivo primario fue el tiempo hasta la confirmación de normalización en el recuento de plaquetas. †
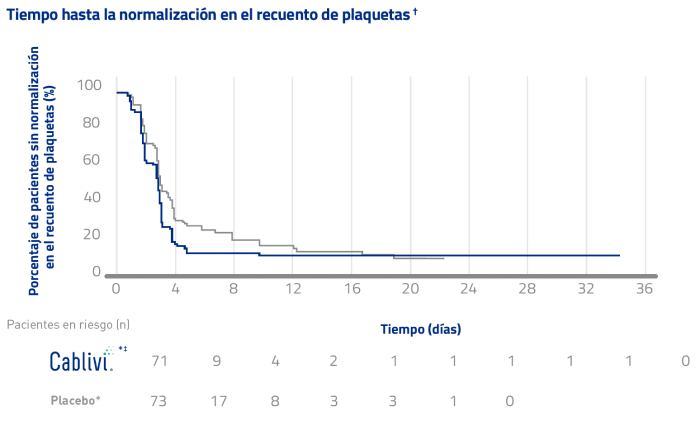
* En combinación con PEX e inmunosupresión.
† La normalización del recuento de plaquetas se definió con un recuento de plaquetas inicial ≥150 × 109/L con la interrupción subsiguiente de la PEX diaria dentro de los 5 días.1
‡ 71 pacientes recibieron al menos 1 dosis del fármaco de estudio.
HR= hazard ratio (factor de riesgo); PEX=recambio plasmático.
SIGNIFICATIVAMENTE MÁS RÁPIDO
tiempo de normalización en de plaquetas†
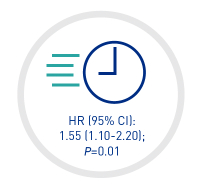
55% MÁS RÁPIDA LA NORMALIZACIÓN EN EL RECUENTO DE PLAQUETAS†
Ensayo clínico HERCULES: Cablivi®* redujo significativamente los eventos potencialmente mortales o graves relacionados con PTTa1, 20
Se definió un objetivo secundario clave la combinación de eventos relacionados con la PTTa durante el período de estudio del fármaco: muerte relacionada con la PTTa, recurrencia† o un TE mayor.
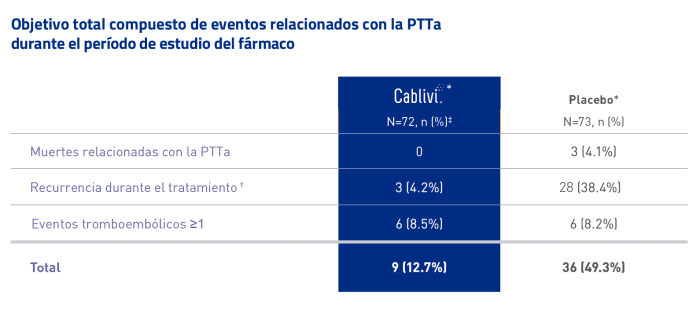
Se produjeron 4 muertes relacionadas con la PTTa durante el ensayo, incluida 1 muerte no relacionada con el tratamiento en el grupo Cablivi® durante el período de seguimiento sin tratamiento, y 3 muertes en el grupo placebo durante el período de tratamiento.1,20

Cablivi® redujo la incidencia de la PTTa refractaria (P =0.06) 1,2

Ensayo clínico HERCULES: Cablivi®*tuvo significativamente menos recurrencias que requirieron reinicio de PEX1, 20
Un objetivo secundario de valoración fue la recurrencia de la PTTa en cualquier momento durante el período de estudio.
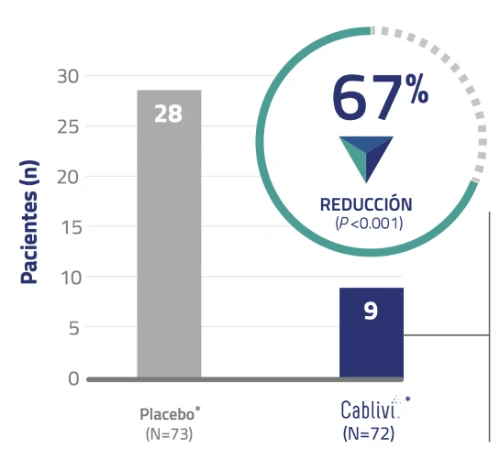
6 pacientes requirieron reinicio de PEX después de suspender el tratamiento con Cablivi®1,20
• Estos pacientes tenían niveles de actividad de ADAMTS13 <10 %, lo que indica que la enfermedad subyacente todavía estaba activa cuando se interrumpió el tratamiento.
• La actividad ADAMTS13 suprimida puede requerir la necesidad de ampliar el período de tratamiento con CABLIVI® 9
*Junto con PEX e inmunosupresión.
PEX= recambio plasmático
Ensayo clínico HERCULES: Días de PEX, en UCI, hospitalización y volumen de plasma durante el tratamiento1, 20*
Cablivi® junto con PEX e inmunosupresión proporciona reducción de costes al sistema sanitario al reducir el tiempo de normalización de las plaquetas y minimizar el riesgo de TEs y daño a órganos, cuyo manejo supone un alto coste.9,20
En el estudio HERCULES, Cablivi®†redujo el volumen y la duración del PEX, el tiempo de permanencia en el hospital y UCI frente a PEX e inmunosupresión solos1,20
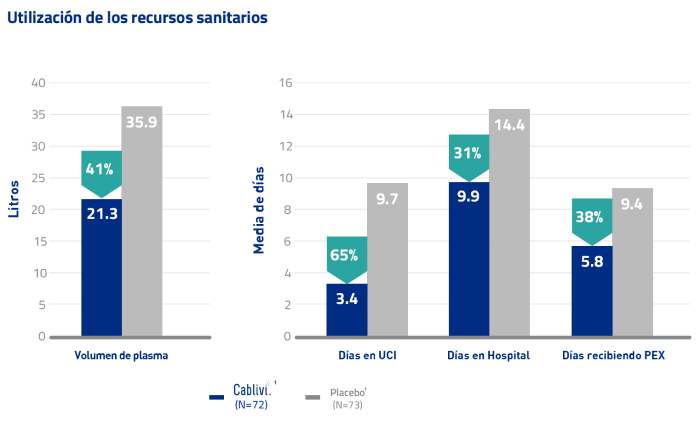
* Estos datos se recogieron de forma prospectiva. Se realizaron estadísticas descriptivas, pero no se probaron para determinar su significación. Se desconoce el significado clínico de estos datos.
† Junto con PEX e inmunosupresión.
UCI = Unidad de cuidados intensivos; PEX = recambio plasmático.
ENSAYO CLÍNICO HERCULES: Cablivi® fue bien tolerado1, 20
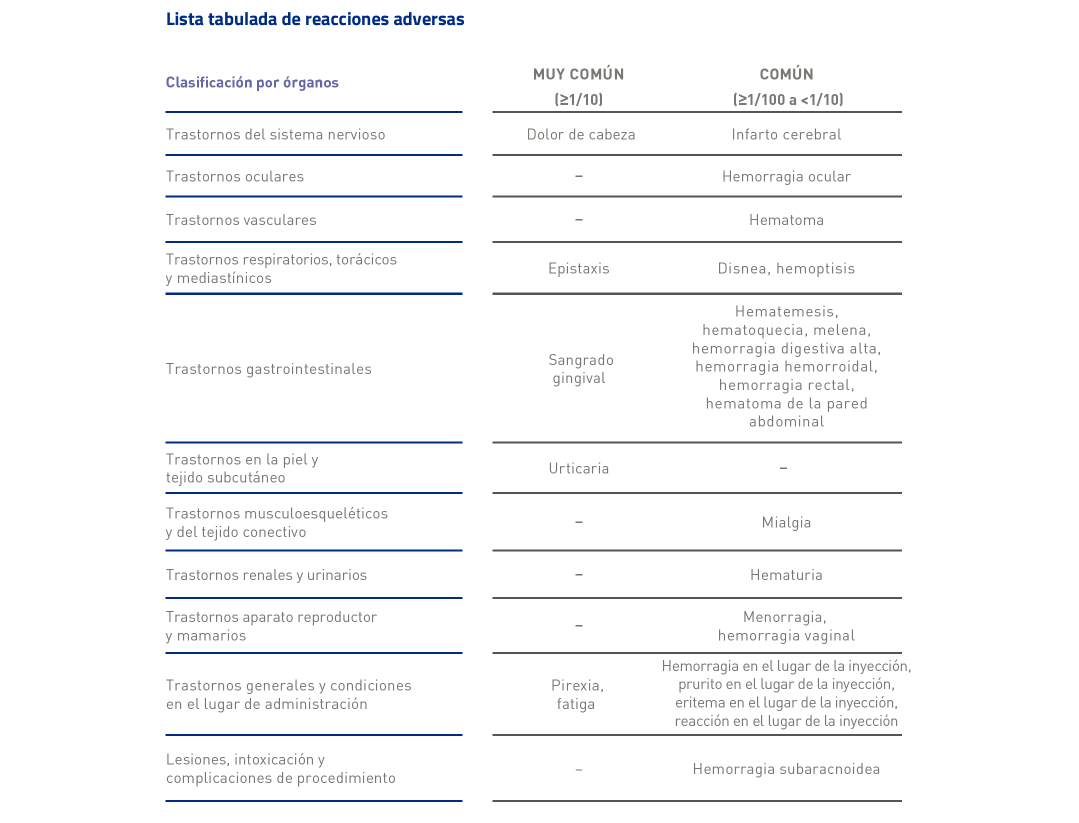
Cablivi®* tiene un perfil de seguridad favorable, con sangrado mucocutáneo (epistaxis y sangrado gingival) como el EA reportado con mayor frecuencia relacionado con sangrado y sin muertes relacionadas con el tratamiento.2
El EA más frecuente fue la hemorragia mucocutánea, que se notificó en el 65% de los pacientes del grupo de Cablivi®y en el 48% del grupo placebo1,20

* En combinación con PEX e inmunosupresión.
† 1 paciente falleció en el grupo Cablivi® durante el período de seguimiento sin tratamiento. La causa de la muerte fue isquem ia cerebral y fue asignado como relacionado con PTT pero evaluado por el investigador como no relacionado con el tratamiento.1
EA = evento adverso; SAE = evento adverso grave; TEAE = evento adverso emergente del tratamiento; PEX = Recambio plasmático
Ensayo clínico HERCULES: Los pacientes alcanzaron una normalización en el recuento de plaquetas significativamente más rápido con Cablivi®1, 20*
El objetivo primario fue el tiempo hasta la confirmación de normalización en el recuento de plaquetas. †

* En combinación con PEX e inmunosupresión.
† La normalización del recuento de plaquetas se definió con un recuento de plaquetas inicial ≥150 × 109/L con la interrupción subsiguiente de la PEX diaria dentro de los 5 días.1
‡ 71 pacientes recibieron al menos 1 dosis del fármaco de estudio.
HR= hazard ratio (factor de riesgo); PEX=recambio plasmático.
SIGNIFICATIVAMENTE MÁS RÁPIDO
tiempo de normalización en de plaquetas†

55% MÁS RÁPIDA LA NORMALIZACIÓN EN EL RECUENTO DE PLAQUETAS†
Ensayo clínico HERCULES: Cablivi®* redujo significativamente los eventos potencialmente mortales o graves relacionados con PTTa1, 20
Se definió un objetivo secundario clave la combinación de eventos relacionados con la PTTa durante el período de estudio del fármaco: muerte relacionada con la PTTa, recurrencia† o un TE mayor.

Se produjeron 4 muertes relacionadas con la PTTa durante el ensayo, incluida 1 muerte no relacionada con el tratamiento en el grupo Cablivi® durante el período de seguimiento sin tratamiento, y 3 muertes en el grupo placebo durante el período de tratamiento.1,20

Cablivi® redujo la incidencia de la PTTa refractaria (P =0.06) 1,2

Ensayo clínico HERCULES: Cablivi®*tuvo significativamente menos recurrencias que requirieron reinicio de PEX1, 20
Un objetivo secundario de valoración fue la recurrencia de la PTTa en cualquier momento durante el período de estudio.

6 pacientes requirieron reinicio de PEX después de suspender el tratamiento con Cablivi®1,20
• Estos pacientes tenían niveles de actividad de ADAMTS13 <10 %, lo que indica que la enfermedad subyacente todavía estaba activa cuando se interrumpió el tratamiento.
• La actividad ADAMTS13 suprimida puede requerir la necesidad de ampliar el período de tratamiento con CABLIVI® 9
*Junto con PEX e inmunosupresión.
PEX= recambio plasmático
Ensayo clínico HERCULES: Días de PEX, en UCI, hospitalización y volumen de plasma durante el tratamiento1, 20*
Cablivi® junto con PEX e inmunosupresión proporciona reducción de costes al sistema sanitario al reducir el tiempo de normalización de las plaquetas y minimizar el riesgo de TEs y daño a órganos, cuyo manejo supone un alto coste.9,20
En el estudio HERCULES, Cablivi®†redujo el volumen y la duración del PEX, el tiempo de permanencia en el hospital y UCI frente a PEX e inmunosupresión solos1,20

* Estos datos se recogieron de forma prospectiva. Se realizaron estadísticas descriptivas, pero no se probaron para determinar su significación. Se desconoce el significado clínico de estos datos.
† Junto con PEX e inmunosupresión.
UCI = Unidad de cuidados intensivos; PEX = recambio plasmático.
ENSAYO CLÍNICO HERCULES: Cablivi® fue bien tolerado1, 20
Cablivi®* tiene un perfil de seguridad favorable, con sangrado mucocutáneo (epistaxis y sangrado gingival) como el EA reportado con mayor frecuencia relacionado con sangrado y sin muertes relacionadas con el tratamiento.2
El EA más frecuente fue la hemorragia mucocutánea, que se notificó en el 65% de los pacientes del grupo de Cablivi®y en el 48% del grupo placebo1,20

* En combinación con PEX e inmunosupresión.
† 1 paciente falleció en el grupo Cablivi® durante el período de seguimiento sin tratamiento. La causa de la muerte fue isquem ia cerebral y fue asignado como relacionado con PTT pero evaluado por el investigador como no relacionado con el tratamiento.1
EA = evento adverso; SAE = evento adverso grave; TEAE = evento adverso emergente del tratamiento; PEX = Recambio plasmático
Evidencia en vida real: Proyecto Capla 1000+
Resultados clínicos clave11

La mortalidad se reduce del 6% al 1,5%

Tiempo hasta la respuesta clínica: 5 días vs 6 en el grupo control.

Menos plasmaféresis: mediana 5 vs 7 sesiones.

NNT para evitar una muerte = 22; para prevenir recaída = 4.
Diseño del estudio11: El proyecto Capla 1000+
Un estudio de cohorte retrospectivo sin precedentes que informa sobre la mayor serie internacional de pacientes tratados con CABLIVI
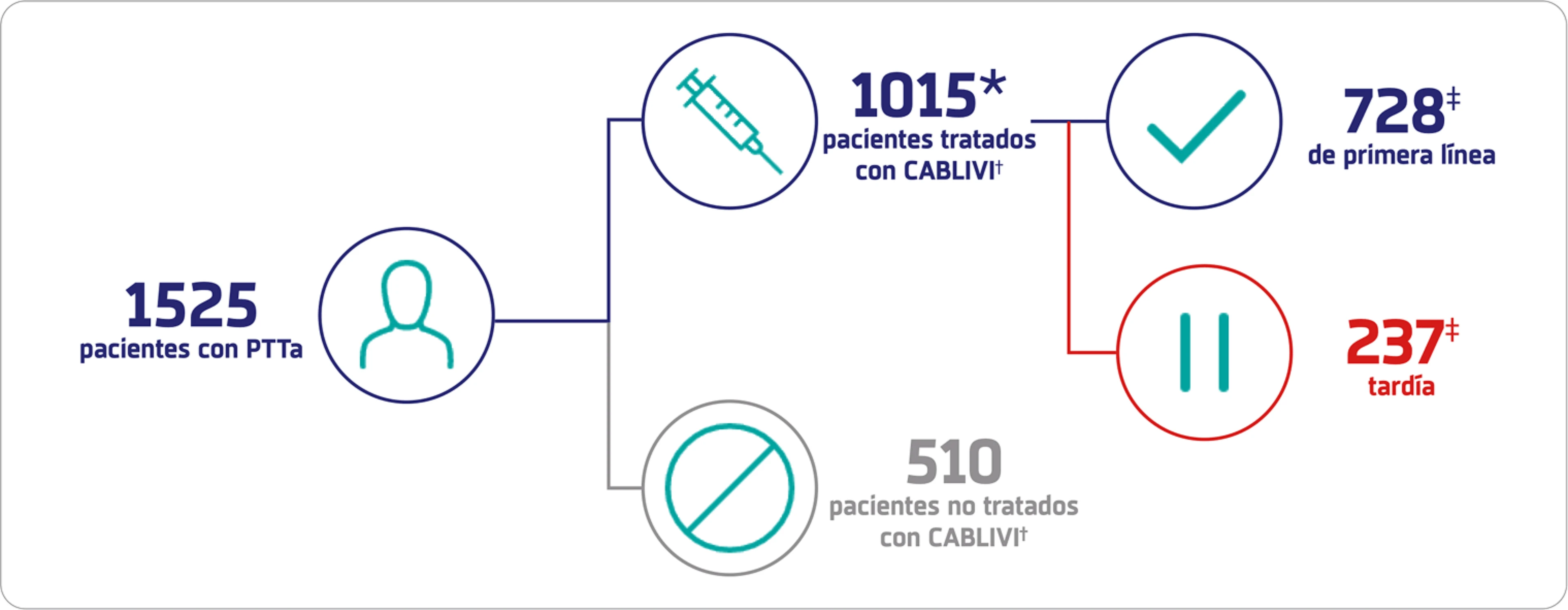
*Entre enero y junio de 2023, se recopilaron 1067 historias clínicas consecutivas de pacientes con PTTa tratados con CABLIVI en 12 países; Posteriormente se excluyeron 52 pacientes. Criterios de exclusión: actividad de la ADAMTS13 al inicio del estudio ≥20 % (n=4); criterio principal de valoración no disponible (n=4); otros datos clave no disponibles (n=2); CABLIVI utilizado sin PEX (n=34); CABLIVI añadido tras la respuesta clínica (n=8).
†Los pacientes fueron tratados con PEX e inmunosupresión con corticoides ± rituximab.
‡El inicio de CABLIVI se clasificó como temprano (en los 3 días; 76 % de los casos) o tardío (≥4 días desde la primera PEX). Se desconocía la fecha de inicio de CABLIVI en 50 pacientes.
Reducción de la mortalidad11
CRITERIO PRINCIPAL DE VALORACIÓN:
La tasa de supervivencia a los 3 meses en el grupo de CABLIVI fue del 98,5 % frente al 94 % en el grupo de control (p<0,0001), independientemente del uso de rituximab*.
La tasa de mortalidad a los 3 meses fue 4,2 veces mayor en el grupo de control que en el grupo de CABLIVI (IC 95 %: 2,22-7,7, p<0,0001), independientemente del uso de rituximab.
El número estimado de pacientes que se necesita tratar (NNT, Number Need to Treat) con Caplacizumab para prevenir 1 caso de muerte fue de 22.
Casi todas las muertes observadas en el grupo de control se produjeron en las primeras fases del tratamiento, por lo general, a los pocos días del diagnóstico y en un contexto de PTTa no controlada.
Aunque la función del rituximab en la fase aguda de la PTTa es restaurar la actividad de la ADAMTS13, lo que suele ocurrir en un plazo de 2 a 3 semanas, este estudio evaluó si el rituximab tenía algún efecto sobre la mortalidad.
La supervivencia a los tres meses fue similar entre los pacientes que recibieron rituximab y los que no, lo que sugiere que CABLIVI, a través de su función inmediata en el bloqueo de la formación de microtrombos, mejora la supervivencia en la PTTa independientemente del uso de rituximab.
*Rituximab no está aprobado por la mayoría de las agencias reguladoras de todo el mundo para el tratamiento de PTTa (aprobado para la refractariedad en Japón, 2020).13,14
Adopción temprana frente a tardía de CABLIVI11
El uso temprano de CABLIVI alivió sustancialmente la carga asistencial, con una disminución del tiempo hasta la respuesta clínica y del número de sesiones de PEX necesarias en comparación con el grupo de control.
La introducción tardía de CABLIVI puede exponer a los pacientes a un mayor riesgo de refractariedad y exacerbación impredecibles, que pueden preceder a la muerte.
| El inicio de CABLIVI se clasificó como temprano (dentro de los 3 días*; 76 % de los casos) o tardío (≥4 días desde la primera PEX) |
*Según las directrices de la ISTH, CABLIVI debe considerarse en las primeras fases del tratamiento de la PTTa (dentro de las 72 horas). Una recomendación condicional, definida como aquella cuyos efectos deseables probablemente superan los efectos indeseables. Supone una alta probabilidad de PTTa (basada en la evaluación clínica o en una herramienta formal de evaluación del riesgo clínico) y un acceso oportuno a las pruebas de ADAMTS13.12
Mejora del pronóstico11
Criterios secundarios de valoración clave:
Menor frecuencia de refractariedad con CABLIVI frente al grupo de control (1 % frente a 10,1 %; p<0,0001)*.
Las exacerbaciones se redujeron con CABLIVI frente al grupo de control (4 %† frente al 32 %; p<0,0001)‡.
El tiempo hasta la respuesta clínica en el grupo de CABLIVI fue más rápido que en el grupo de control (5 días frente a 6 días; p<0,0001) y aún más rápido en pacientes que iniciaron el tratamiento con CABLIVI de forma temprana (p<0,0001).§
No se observaron diferencias significativas en el tiempo hasta la mejora de ADAMTS13 entre el grupo tratado con CABLIVI y el grupo de control.
*La refractariedad se definió como trombocitopenia persistente (considerada grave si no se duplicaba el recuento plaquetario basal o el recuento plaquetario era <30x109/L; generalmente requiere tratamiento de rescate) a los 4 días de tratamiento habitual, junto con niveles de LDH persistentemente elevados.
†Mientras se administraba CABLIVI. El valor de p se consideró significativo cuando era <0,05.
‡La exacerbación se definió como la reaparición de trombocitopenia, con o sin evidencia clínica de nueva lesión isquémica en algún órgano dentro de los 30 días posteriores a la interrupción de la PEX o CABLIVI, con necesidad de reiniciar el tratamiento.
§El tiempo hasta la respuesta clínica se definió como la resolución completa de las manifestaciones neurológicas (o la estabilización de las alteraciones neurológicas en pacientes considerados con secuelas permanentes) y la insuficiencia renal y la recuperación sostenida del recuento plaquetario normal (>150x109/L), lo que permitió interrumpir la PEX.
Valor económico11
El grupo de CABLIVI requirió menos sesiones de PEX para alcanzar la respuesta clínica (5 frente a 7; p<0,0001).
El número estimado de pacientes que debían recibir tratamiento con CABLIVI para prevenir un caso de refractariedad o exacerbación fue de 11 y 3,6, respectivamente.
Acontecimientos adversos manejables11
Se observaron acontecimientos adversos relacionados con CABLIVI en el 21 % de los pacientes, con hemorragias graves en el 2,4 %, que fueron más frecuentes en pacientes de edad avanzada (>60 años).
| Los acontecimientos relacionados con el tratamiento fueron coherentes con estudios previos sobre CABLIVI. No se identificaron nuevas señales de seguridad en este estudio. |
Conclusiones11
Los hallazgos de este estudio respaldan firmemente el uso sistemático de CABLIVI en las primeras fases del tratamiento de la PTTa, para prevenir la formación de microtrombos perjudiciales y evitar resultados desfavorables.
CABLIVI, añadido a PEX e inmunosupresión, reduce 4,2 veces el riesgo de mortalidad a los 3 meses y mejora la tasa de supervivencia a los 3 meses hasta el 98,5%.
El inicio temprano con CABLIVI alivió sustancialmente la carga asistencial y ayudó a prevenir resultados desfavorables.
Los pacientes del grupo de CABLIVI mostraron un mejor pronóstico en comparación con el grupo de control: menor refractariedad y menos exacerbaciones.
Los eventos adversos relacionados con CABLIVI se consideraron manejables y en línea con los de estudios anteriores.
| Los datos confirman la eficacia y la seguridad de CABLIVI como tratamiento de primera línea en un entorno real. |
Diseño del estudio11: El proyecto Capla 1000+
Un estudio de cohorte retrospectivo sin precedentes que informa sobre la mayor serie internacional de pacientes tratados con CABLIVI

*Entre enero y junio de 2023, se recopilaron 1067 historias clínicas consecutivas de pacientes con PTTa tratados con CABLIVI en 12 países; Posteriormente se excluyeron 52 pacientes. Criterios de exclusión: actividad de la ADAMTS13 al inicio del estudio ≥20 % (n=4); criterio principal de valoración no disponible (n=4); otros datos clave no disponibles (n=2); CABLIVI utilizado sin PEX (n=34); CABLIVI añadido tras la respuesta clínica (n=8).
†Los pacientes fueron tratados con PEX e inmunosupresión con corticoides ± rituximab.
‡El inicio de CABLIVI se clasificó como temprano (en los 3 días; 76 % de los casos) o tardío (≥4 días desde la primera PEX). Se desconocía la fecha de inicio de CABLIVI en 50 pacientes.
Reducción de la mortalidad11
CRITERIO PRINCIPAL DE VALORACIÓN:
La tasa de supervivencia a los 3 meses en el grupo de CABLIVI fue del 98,5 % frente al 94 % en el grupo de control (p<0,0001), independientemente del uso de rituximab*.
La tasa de mortalidad a los 3 meses fue 4,2 veces mayor en el grupo de control que en el grupo de CABLIVI (IC 95 %: 2,22-7,7, p<0,0001), independientemente del uso de rituximab.
El número estimado de pacientes que se necesita tratar (NNT, Number Need to Treat) con Caplacizumab para prevenir 1 caso de muerte fue de 22.
Casi todas las muertes observadas en el grupo de control se produjeron en las primeras fases del tratamiento, por lo general, a los pocos días del diagnóstico y en un contexto de PTTa no controlada.
Aunque la función del rituximab en la fase aguda de la PTTa es restaurar la actividad de la ADAMTS13, lo que suele ocurrir en un plazo de 2 a 3 semanas, este estudio evaluó si el rituximab tenía algún efecto sobre la mortalidad.
La supervivencia a los tres meses fue similar entre los pacientes que recibieron rituximab y los que no, lo que sugiere que CABLIVI, a través de su función inmediata en el bloqueo de la formación de microtrombos, mejora la supervivencia en la PTTa independientemente del uso de rituximab.
*Rituximab no está aprobado por la mayoría de las agencias reguladoras de todo el mundo para el tratamiento de PTTa (aprobado para la refractariedad en Japón, 2020).13,14
Adopción temprana frente a tardía de CABLIVI11
El uso temprano de CABLIVI alivió sustancialmente la carga asistencial, con una disminución del tiempo hasta la respuesta clínica y del número de sesiones de PEX necesarias en comparación con el grupo de control.
La introducción tardía de CABLIVI puede exponer a los pacientes a un mayor riesgo de refractariedad y exacerbación impredecibles, que pueden preceder a la muerte.
| El inicio de CABLIVI se clasificó como temprano (dentro de los 3 días*; 76 % de los casos) o tardío (≥4 días desde la primera PEX) |
*Según las directrices de la ISTH, CABLIVI debe considerarse en las primeras fases del tratamiento de la PTTa (dentro de las 72 horas). Una recomendación condicional, definida como aquella cuyos efectos deseables probablemente superan los efectos indeseables. Supone una alta probabilidad de PTTa (basada en la evaluación clínica o en una herramienta formal de evaluación del riesgo clínico) y un acceso oportuno a las pruebas de ADAMTS13.12
Mejora del pronóstico11
Criterios secundarios de valoración clave:
Menor frecuencia de refractariedad con CABLIVI frente al grupo de control (1 % frente a 10,1 %; p<0,0001)*.
Las exacerbaciones se redujeron con CABLIVI frente al grupo de control (4 %† frente al 32 %; p<0,0001)‡.
El tiempo hasta la respuesta clínica en el grupo de CABLIVI fue más rápido que en el grupo de control (5 días frente a 6 días; p<0,0001) y aún más rápido en pacientes que iniciaron el tratamiento con CABLIVI de forma temprana (p<0,0001).§
No se observaron diferencias significativas en el tiempo hasta la mejora de ADAMTS13 entre el grupo tratado con CABLIVI y el grupo de control.
*La refractariedad se definió como trombocitopenia persistente (considerada grave si no se duplicaba el recuento plaquetario basal o el recuento plaquetario era <30x109/L; generalmente requiere tratamiento de rescate) a los 4 días de tratamiento habitual, junto con niveles de LDH persistentemente elevados.
†Mientras se administraba CABLIVI. El valor de p se consideró significativo cuando era <0,05.
‡La exacerbación se definió como la reaparición de trombocitopenia, con o sin evidencia clínica de nueva lesión isquémica en algún órgano dentro de los 30 días posteriores a la interrupción de la PEX o CABLIVI, con necesidad de reiniciar el tratamiento.
§El tiempo hasta la respuesta clínica se definió como la resolución completa de las manifestaciones neurológicas (o la estabilización de las alteraciones neurológicas en pacientes considerados con secuelas permanentes) y la insuficiencia renal y la recuperación sostenida del recuento plaquetario normal (>150x109/L), lo que permitió interrumpir la PEX.
Valor económico11
El grupo de CABLIVI requirió menos sesiones de PEX para alcanzar la respuesta clínica (5 frente a 7; p<0,0001).
El número estimado de pacientes que debían recibir tratamiento con CABLIVI para prevenir un caso de refractariedad o exacerbación fue de 11 y 3,6, respectivamente.
Acontecimientos adversos manejables11
Se observaron acontecimientos adversos relacionados con CABLIVI en el 21 % de los pacientes, con hemorragias graves en el 2,4 %, que fueron más frecuentes en pacientes de edad avanzada (>60 años).
| Los acontecimientos relacionados con el tratamiento fueron coherentes con estudios previos sobre CABLIVI. No se identificaron nuevas señales de seguridad en este estudio. |
Conclusiones11
Los hallazgos de este estudio respaldan firmemente el uso sistemático de CABLIVI en las primeras fases del tratamiento de la PTTa, para prevenir la formación de microtrombos perjudiciales y evitar resultados desfavorables.
CABLIVI, añadido a PEX e inmunosupresión, reduce 4,2 veces el riesgo de mortalidad a los 3 meses y mejora la tasa de supervivencia a los 3 meses hasta el 98,5%.
El inicio temprano con CABLIVI alivió sustancialmente la carga asistencial y ayudó a prevenir resultados desfavorables.
Los pacientes del grupo de CABLIVI mostraron un mejor pronóstico en comparación con el grupo de control: menor refractariedad y menos exacerbaciones.
Los eventos adversos relacionados con CABLIVI se consideraron manejables y en línea con los de estudios anteriores.
| Los datos confirman la eficacia y la seguridad de CABLIVI como tratamiento de primera línea en un entorno real. |
Real World Evidence
El registro del estudio de Real World Evidence Francés CNR-MAT refuerza los datos obtenidos en el Ensayo Clínico HERCULES.
El registro del estudio CNR-MAT refuerza la recuperación rápida de plaquetas con Cablivi®15*
Un objetivo secundario se describió como el tiempo hasta la recuperación duradera del recuento de plaquetas§
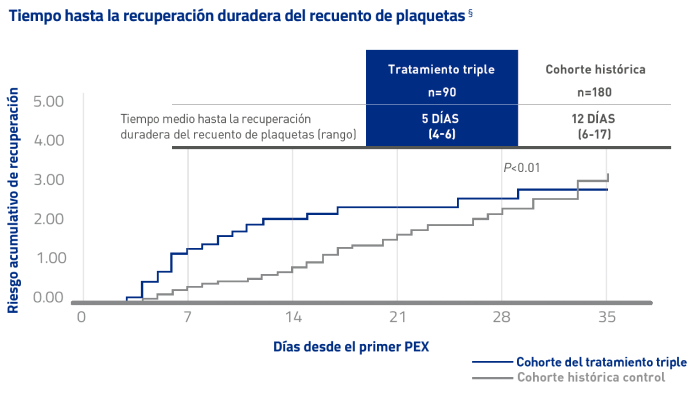
RECUPERACIÓN MÁS RÁPIDA de un recuento duradero de plaquetas§
1,8 VECES MÁS RÁPIDO CON EL TRATAMIENTO TRIPLE QUE CON HR (95% CI): LA COHORTE HISTÓRICA
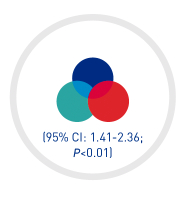
* En combinación con PEX e inmunosupresión.
§ La recuperación duradera del recuento de plaquetas se definió como la recuperación del recuento normal de plaquetas (≥150 × 10³/mm³) durante al menos 2 días.15
PEX=recambio plasmático.
El registro del estudio CNR-MAT muestra que Cablivi®* redujo las muertes relacionadas con la PTTa y la refractariedad15§
El objetivo principal en el registro CNR-MAT fue la combinación de refractariedad§ y muerte dentro de los 30 días posteriores al diagnóstico15

1 fallecimiento en el grupo de Cablivi® por embolismo pulmonar masivo a los 83 años.
El tratamiento temprano con Cablivi® previene significativamente los efectos desfavorables durante la fase muy aguda de la PTTa.
Cablivi®reduce significativamente el riesgo de refractariedad en comparación con PEX e inmunosupresión solos, mejorando el pronóstico general del paciente.1-2,10-15-17
* En combinación con PEX e inmunosupresión.
† Exacerbación definida como trombocitopenia después de la recuperación inicial del recuento plaquetas (recuento de plaquetas ≥150,000/ L con la interrupción subsiguiente de la PEX diaria dentro de los 5 días) que requirió el reinicio de la PEX diaria durante los 30 días posteriores al período de PEX diaria.1
‡ Basado en 71 pacientes que recibieron al menos 1 dosis del fármaco de estudio.
§ Refractariedad definida como recuento de plaquetas después de 4 días de tratamiento intensivo estándar inferior al doble del inicial, junto con niveles de LDH persistentemente elevados.17
PEX=recambio plasmático.
Confirmación en la reducción de exacerbaciones y recaídas en el estudio del Registro CNR-MAT de Cablivi®17*
Los objetivos secundarios incluyeron exacerbaciones y recaídas de PTTa
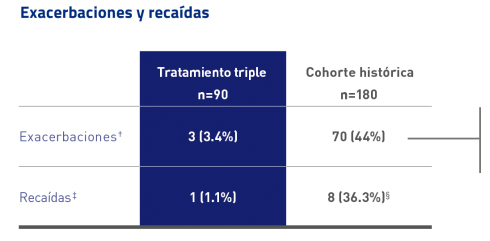
Las exacerbaciones fueron 13 veces más frecuentes en el grupo de la cohorte histórica que en la cohorte del régimen triple 16
En general, los pacientes que experimentaron una recaída aún tenían la actividad de ADAMTS13 severamente suprimida (<10 %) cuando se interrumpió el tratamiento con Cablivi®, lo que sugiere la importancia de continuar el tratamiento con Cablivi® hasta la resolución de la enfermedad autoinmune1,9
* En combinación con PEX e inmunosupresión.
† Definido como respuesta inicial al tratamiento pero con reaparición de manifestaciones clínicas y/o trombocitopenia (recuento de plaquetas <100 × 103/mm3 durante al menos 2 días) antes de una remisión duradera (respuesta completa sin trombocitopenia o empeoramiento clínico durante >30 días de recuperación en el recuento de plaquetas).2
‡ Definido como reaparición de manifestaciones clínicas de PTTa (trombocitopenia [recuento de plaquetas <100 × 103/mm3 durante al menos 2 días], asociada o no con afectación de órganos) (ej, un nuevo episodio de PTTa) después de haber alcanzado una remisión duradera.16
§ Basado en 22 pacientes con PTTa no tratados con Cablivi®.
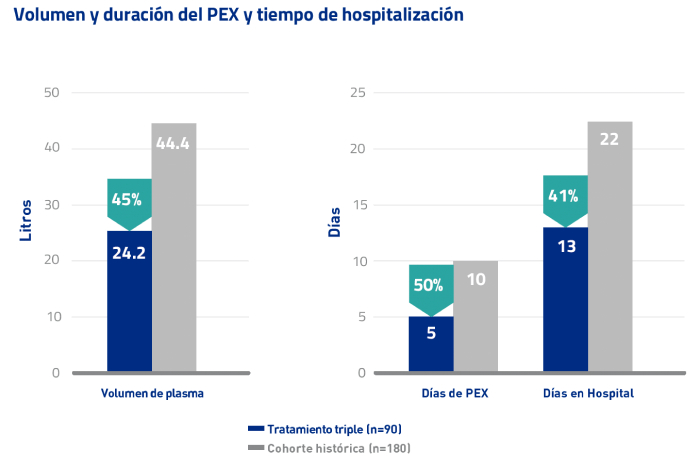
El registro del estudio CNR-MAT confirma que los pacientes que reciben Cablivi® necesitan menos PEX y menor estancia en el hospital15
Los objetivos secundarios del estudio incluyeron el volumen de plasma hasta la remisión, el número de sesiones diarias de PEX hasta la remisión y el tiempo de hospitalización15
El grupo con tratamiento triple tuvo menos sesiones de PEX, volúmenes de plasma más bajos y menos cantidad de días de hospitalización en comparación con la cohorte histórica15
ENSAYO CLÍNICO HERCULES: Perfil de seguridad de Cablivi®1, 20
El registro del estudio CNR-MAT refuerza la recuperación rápida de plaquetas con Cablivi®15*
Un objetivo secundario se describió como el tiempo hasta la recuperación duradera del recuento de plaquetas§

RECUPERACIÓN MÁS RÁPIDA de un recuento duradero de plaquetas§
1,8 VECES MÁS RÁPIDO CON EL TRATAMIENTO TRIPLE QUE CON HR (95% CI): LA COHORTE HISTÓRICA

* En combinación con PEX e inmunosupresión.
§ La recuperación duradera del recuento de plaquetas se definió como la recuperación del recuento normal de plaquetas (≥150 × 10³/mm³) durante al menos 2 días.15
PEX=recambio plasmático.
El registro del estudio CNR-MAT muestra que Cablivi®* redujo las muertes relacionadas con la PTTa y la refractariedad15§
El objetivo principal en el registro CNR-MAT fue la combinación de refractariedad§ y muerte dentro de los 30 días posteriores al diagnóstico15

1 fallecimiento en el grupo de Cablivi® por embolismo pulmonar masivo a los 83 años.
El tratamiento temprano con Cablivi® previene significativamente los efectos desfavorables durante la fase muy aguda de la PTTa.
Cablivi®reduce significativamente el riesgo de refractariedad en comparación con PEX e inmunosupresión solos, mejorando el pronóstico general del paciente.1-2,10-15-17
* En combinación con PEX e inmunosupresión.
† Exacerbación definida como trombocitopenia después de la recuperación inicial del recuento plaquetas (recuento de plaquetas ≥150,000/ L con la interrupción subsiguiente de la PEX diaria dentro de los 5 días) que requirió el reinicio de la PEX diaria durante los 30 días posteriores al período de PEX diaria.1
‡ Basado en 71 pacientes que recibieron al menos 1 dosis del fármaco de estudio.
§ Refractariedad definida como recuento de plaquetas después de 4 días de tratamiento intensivo estándar inferior al doble del inicial, junto con niveles de LDH persistentemente elevados.17
PEX=recambio plasmático.
Confirmación en la reducción de exacerbaciones y recaídas en el estudio del Registro CNR-MAT de Cablivi®17*
Los objetivos secundarios incluyeron exacerbaciones y recaídas de PTTa

Las exacerbaciones fueron 13 veces más frecuentes en el grupo de la cohorte histórica que en la cohorte del régimen triple 16
En general, los pacientes que experimentaron una recaída aún tenían la actividad de ADAMTS13 severamente suprimida (<10 %) cuando se interrumpió el tratamiento con Cablivi®, lo que sugiere la importancia de continuar el tratamiento con Cablivi® hasta la resolución de la enfermedad autoinmune1,9
* En combinación con PEX e inmunosupresión.
† Definido como respuesta inicial al tratamiento pero con reaparición de manifestaciones clínicas y/o trombocitopenia (recuento de plaquetas <100 × 103/mm3 durante al menos 2 días) antes de una remisión duradera (respuesta completa sin trombocitopenia o empeoramiento clínico durante >30 días de recuperación en el recuento de plaquetas).2
‡ Definido como reaparición de manifestaciones clínicas de PTTa (trombocitopenia [recuento de plaquetas <100 × 103/mm3 durante al menos 2 días], asociada o no con afectación de órganos) (ej, un nuevo episodio de PTTa) después de haber alcanzado una remisión duradera.16
§ Basado en 22 pacientes con PTTa no tratados con Cablivi®.
El registro del estudio CNR-MAT confirma que los pacientes que reciben Cablivi® necesitan menos PEX y menor estancia en el hospital15
Los objetivos secundarios del estudio incluyeron el volumen de plasma hasta la remisión, el número de sesiones diarias de PEX hasta la remisión y el tiempo de hospitalización15
El grupo con tratamiento triple tuvo menos sesiones de PEX, volúmenes de plasma más bajos y menos cantidad de días de hospitalización en comparación con la cohorte histórica15

ENSAYO CLÍNICO HERCULES: Perfil de seguridad de Cablivi®1, 20

Experiencia Caplacizumab en vida real
El Dr. Javier de la Rubia, jefe de servicio de Hematolgía del Hospital La Fe (Valencia),comparte las principales conclusiones de la experiencia en vida real de Alemania, Francia, Inglaterra y España.
Guías españolas PTTa
La Dra. Eva Mingot, Hematóloga del Hospital Universitario Virgen del Rocío (Sevilla), nos hace una revisión de las Guías Españolas de la PTTa.
Descarga a continuación las recomendaciones para el abordaje clínico de pacientes con púrpura trombocitopénica trombótica en las Guías Españolas.
¿Por qué debes incluir Cablivi en el tratamiento de la PTTa?

Bloqueo de la formación de microtrombos11

Reducción demostrada de la mortalidad11

Reducción demostrada de la refractariedad y las exacerbaciones11

Menos sesiones de PEX11

Menos días de hospitalización20-22
Casos clínicos

Manejo de la PTTa: importancia del diagnóstico precoz

PTT, diagnóstico diferencial de ictus

Secundigesta con PTTa y niveles ADAMTS13 del 0%

PTT inmune pediátrica: un reto diagnóstico y terapéutico
.jpg)
PTT autoinmune: diagnóstico, tratamiento, evolución y primera recaída
.jpg)
PTT autoinmune con miocarditis al debut

Manejo de la PTTa: importancia del diagnóstico precoz

PTT, diagnóstico diferencial de ictus

Secundigesta con PTTa y niveles ADAMTS13 del 0%

PTT inmune pediátrica: un reto diagnóstico y terapéutico
.jpg)
PTT autoinmune: diagnóstico, tratamiento, evolución y primera recaída
.jpg)
PTT autoinmune con miocarditis al debut
Cómo reconstituir y administrar Cablivi®
Las siguientes son instrucciones abreviadas para reconstituir y administrar Cablivi®.
Las instrucciones completas de reconstitución y administración se pueden encontrar en la ficha técnica1 autorizada del producto y en el prospecto de información para el paciente.
Recursos científicos sobre la PTTa

Seguimiento de la PTTa

Tratamiento de la PTTa

Seguimiento de la PTTa

Tratamiento de la PTTa
Enlaces de interés

Caplacizumab disminuye por 4 la mortalidad en PTTa: Estudio internacional Capla 1000+

Seguimiento de pacientes tratados con caplacizumab, seguridad y eficacia

Caplacizumab, inmunosupresión e intercambio plasmático previene resultados desfavorables en la PTTa

Epidemiología, esquemas de tratamiento, resultados y carga de morbilidad entre pacientes con PTTa en EEUU
.jpg)
Caplacizumab previene la refractariedad y la mortalidad en la PTTa

Guías de la ISTH para el diagnóstico y tratamiento de la PTTa

Tratamiento con caplacizumab para la PTTa

Impacto del uso de caplacizumab en primera línea en los resultados del tratamiento de la PTTa

Eficacia en vida real de caplacizumab frente al tratamiento estándar en la PTTa

Caplacizumab disminuye por 4 la mortalidad en PTTa: Estudio internacional Capla 1000+

Seguimiento de pacientes tratados con caplacizumab, seguridad y eficacia

Caplacizumab, inmunosupresión e intercambio plasmático previene resultados desfavorables en la PTTa

Epidemiología, esquemas de tratamiento, resultados y carga de morbilidad entre pacientes con PTTa en EEUU
.jpg)
Caplacizumab previene la refractariedad y la mortalidad en la PTTa

Guías de la ISTH para el diagnóstico y tratamiento de la PTTa

Tratamiento con caplacizumab para la PTTa

Impacto del uso de caplacizumab en primera línea en los resultados del tratamiento de la PTTa

Eficacia en vida real de caplacizumab frente al tratamiento estándar en la PTTa
Contenido mínimo de Cablivi®
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
Cablivi 10 mg polvo y disolvente para solución inyectable – Envase individual que contiene 1 vial con polvo, 1 jeringa precargada con disolvente y pack de administración (CN 723568.2): PVP notificado: 4.515,37 €, PVP IVA notificado: 4.695,98 €. Medicamento sujeto a prescripción médica. Financiado por el SNS. Uso hospitalario.
1. Nombre del medicamento
Cablivi 10 mg polvo y disolvente para solución inyectable
2. Composición cualititva y cuantitativa
Cada vial de polvo contiene 10 mg de caplacizumab*.
Cada jeringa precargada de disolvente contiene 1 ml de agua para preparaciones inyectables.
* Caplacizumab es un nanoanticuerpo bivalente humanizado producido en Escherichia coli mediante tecnología de ADN recombinante.
Para consultar la lista completa de excipientes, ver sección 5.1.
3. Forma farmacéutica
Polvo y disolvente para solución inyectable.
Polvo blanco liofilizado.
El disolvente es un líquido transparente e incoloro.
ADAMTS13= desintegrina (también conocida como proteasa de escisión del factor de von Willebrand) y metaloproteinasa (enzima con zinc), que escinde el enlace de Tyr1605-Met1606 del dominio A2 del factor de von Willebrand, una gran proteína involucrada en el proceso de coagulación.
PTTa=purpura trombocitopénica trombótica adquirida; ISTH=Sociedad Internacional de Trombosis y Hemostasia; MAHA=anemia hemolítica microangiopática; PEX=recambio plasmático.
Referencias
- Ficha técnica Cablivi®
- Cromie KD, Van Heeke G, Boutton C. Nanobodies and their use in GPCR drug discovery. Curr Top Med Chem. 2015;15(24):2543-2557. doi:10.2174/1568026615666150701113549
- Kremer Hovinga JA, Coppo P, Lämmle B, Moake JL, Miyata T, Vanhoorelbeke K. Thrombotic thrombocytopenic purpura. Nat Rev Dis Primers. 2017;3:17020. doi:10.1038/nrdp.2017.20
- Goel R, King KE, Takemoto CM, Ness PM, Tobian AAR. Prognostic risk-stratified score for predicting mortality in hospitalized patients with thrombotic thrombocytopenic purpura: nationally representative data from 2007 to 2012. Transfusion. 2016;56(6):1451-1458. doi:10.1111/trf.13586
- Benhamou Y, Assié C, Boelle P-Y, et al. Development and validation of a predictive model for death in acquired severe ADAMTS13 deficiency-associated idiopathic thrombotic thrombocytopenic purpura: the French TMA Reference Center experience. Haematologica. 2012;97(8):1181-1186. doi:10.3324/haematol.2011.049676
- Sargentini-Maier ML, De Decker P, Tersteeg C, et al. Clinical pharmacology of caplacizumab for the treatment of patients with acquired thrombotic thrombocytopenic purpura. Expert Rev Clin Pharmacol. 2019;12(6):537-545. doi:10.1080/17512433.2019.1607293
- Ulrichts H, Silence K, Schoolmeester A, et al. Antithrombotic drug candidate ALX-0081 shows superior preclinical efficacy and safety compared with currently marketed antiplatelet drugs. Blood. 2011;118(3):757-765. doi:10.1182/blood-2010-11-317859
- Peyvandi F, Scully M, Kremer Hovinga JA, et al; TITAN Investigators. Caplacizumab for acquired thrombotic thrombocytopenic purpura. N Engl J Med. 2016;374(6):511-522. doi:10.1056/NEJMoa1505533
- Peyvandi F, Cataland S, Scully M, et al. Caplacizumab prevents refractoriness and mortality in acquired thrombotic thrombocytopenic purpura: integrated analysis. Blood Adv. 2021;5(8):2137-2141. doi:10.1182/ bloodadvances.2020001834
- Zheng XL, Vesely SK, Cataland SR, et al. ISTH guidelines for treatment of thrombotic thrombocytopenic purpura. J Thromb Haemost. 2020;18(10):2496-2502. doi:10.1111/jth.15010
- Coppo P, Bubenheim M, Benhamou Y, et al. Caplacizumab use in immune-mediated thrombotic thrombocytopenic purpura: an international multicentre retrospective cohort study (the Capla 1000+ project). Lancet. 2025;82: 1-13 and suppl.doi.org/10.1016/j.eclinm.2025.103168
- Zheng XL, Vesely SK, Cataland SR, et al. ISTH guidelines for the diagnosis of thrombotic thrombocytopenic purpura. J Thromb Haemost. 2020;18(10):2486-2495. doi:10.1111/jth.15006
- Comité de Medicamentos de Uso Humano (CHMP). Informe de evaluación: MabThera. Agencia Europea de Medicamentos. 2014.
- Anti-CD20 monoclonal antibody “Rituxan®,” [rituximab], approved for additional indication of acquired thrombotic thrombocytopenic purpura. News release. Zenyaku Kogyo Co., Ltd, Chugai Pharmaceutical Co., Ltd. Published February 21, 2020. Consultado el 17 de abril de 2025. https://www.chugai-pharm.co.jp/english/news/detail/20200221160000_705.html
- Coppo P, Bubenheim M, Azoulay E, et al. A regimen with caplacizumab, immunosuppression, and plasma exchange prevents unfavorable outcomes in immune-mediated TTP. Blood. 2021;137(6):733-742 and suppl. doi:10.1182/blood.2020008021
- Scully M, Hunt BJ, Benjamin S, et al; British Committee for Standards in Haematology. Guidelines on the diagnosis and management of thrombotic thrombocytopenic purpura and other thrombotic microangiopathies. Br J Haematol. 2012;158(3):323-335. doi:10.1111/j.1365-2141.2012.09167.x
- Peyvandi F, Scully M, Kremer Hovinga JA, et al. Caplacizumab reduces the frequency of major thromboembolic events, exacerbations and death in patients with acquired thrombotic thrombocytopenic purpura. J Thromb Haemost. 2017;15(7):1448-1452. doi:10.1111/jth.13716
- Joly BS, Coppo P, Veyradier A. Thrombotic thrombocytopenic purpura. Blood. 2017;129(21):2836-2846. doi:10.1182/blood-2016-10-709857
- Goel R, King KE, Takemoto CM, Ness PM, Tobian AAR. Prognostic risk-stratified score for predicting mortality in hospitalized patients with thrombotic thrombocytopenic purpura: nationally representative data from 2007 to 2012. Transfusion. 2016;56(6):1451-1458. doi:10.1111/trf.13586
- Scully M, Cataland SR, Peyvandi F, et al; HERCULES Investigators. Caplacizumab treatment for acquired thrombotic thrombocytopenic purpura. N Engl J Med. 2019;380(4):335-346. doi:10.1056/NEJMoa1806311
- Völker LA, Kaufeld J, Balduin G, et al. Impact of first-line use of caplacizumab on treatment outcomes in immune thrombotic thrombocytopenic purpura. J Thromb Haemost. 2023;21(3):559-572. doi:10.1016/j.jtha.2022.11.010
- Pascual Izquierdo C, Mingot-Castellano ME, Kerguelen Fuentes AE, et al. Real-world effectiveness of caplacizumab vs the standard of care in immune thrombotic thrombocytopenic purpura. Blood Adv. 2022;6(24):6219-6227. doi:10.1182/bloodadvances.2022008028
MAT-ES-2503800 V1 Diciembre 2025

.jpg)