
Mecanismo de acción
DUPIXENT es la primera y única7 terapia dirigida específicamente a IL-4Rα que inhibe la señalización de IL-4 e IL-13 y reduce la inflamación de tipo 2 1,8,9
Eficacia y seguridad
Dupixent es el primer biológico7 aprobado para tratar la dermatitis atópica moderada a grave no controlada, ofreciendo una solución innovadora para pacientes de todas las edades, desde los 6 meses hasta la edad adulta.1
En adultos y adolescentes, Dupixent está indicado para tratar la dermatitis atópica moderada a grave cuando se requiere un tratamiento sistémico.1
Es el único biológico aprobado para niños de 6 meses a 11 años, especialmente indicado para aquellos con dermatitis atópica grave que son candidatos a un manejo sistémico.1
En dermatitis atópica, se observó una mejora clínicamente significativa en la semana 16 en combinación con CTS en adultos y niños1,2,6,25,a,b
| ADULTOS (+18 años) CHRONOSc | DUPIXENT + TCS (n=106) | Placebo + TCS (n=315) |
| Primary endpoint IGA 0 o 1, y en adultos ≥2 puntos de mejoría (% de pacientes) | 39% (P<0.0001) | 12% (P<0.0001) |
| Secondary endpoints EASI-75: ≥75 % de mejora en el % afectado y gravedad de la lesión (% de pacientes) | 69% (P<0.0001) | 23% (P<0.0001) |
| Mejoría de ≥4 puntos en la escala de Prurito NRS, en el peor momento de prurito (en adultos y niños) o peor rascado/picazón (en bebés, preescolares y niños) (% de pacientes) | 59% (P<0.0001) | 20% (P<0.0001) |
| NIÑOS (6 a 11 años de 15 kg a <60 kg) AD-1652 | 300 mg Q4Wd | DUPIXENT + TCS (n=61) | Placebo + TCS (n=61) |
| Primary endpoint IGA 0 o 1 ≥2 puntos de mejoría (% de pacientes) | 30% (P<0.0001) | 13% (P<0.0001) |
| Co-Primary endpoint EASI-75: ≥75 % de mejora en el % afectado y gravedad de la lesión (% de pacientes) | 75% (P<0.0001) | 28% (P<0.0001) |
| Mejoría de ≥4 puntos en la escala de Prurito NRS, en el peor momento de prurito (en adultos y niños) o peor rascado/picazón (en bebés, preescolares y niños) (% de pacientes) | 54% (P<0.0001) | 12% (P<0.0001) |
| BEBÉS Y PREESCOLARES (6 meses) AD-1539e | DUPIXENT + TCS (n=62) | Placebo + TCS (n=63) |
| Primary endpoint25 IGA ≤ 1 puntos de mejoría (% de pacientes) | 14,3% (P<0.0001) | 1,6% (P<0.0001) |
| Co-Primary endpoint EASI-75: ≥75 % de mejora en el % afectado y gravedad de la lesión (% de pacientes) | 46% (P<0.0001) | 6,6% (P<0.0001) |
| Mejoría de ≥4 puntos en la escala de Prurito NRS, en el peor momento de prurito (en adultos y niños) o peor rascado/picazón (en bebés, preescolares y niños) (% de pacientes) | 42,3% (P<0.0001) | 8,8% (P<0.0001) |
En dermatitis atópica, se observó una mejora en la semana 16 en ensayos de monoterapia en adultos y adolescentes1,4,10,a,b
| ADULTOS (+18 años) SOLO 1 | DUPIXENT (n=224) | Placebo (n=224) |
| Primary endpoint IGA 0 o 1, y en adultos ≥2 puntos de mejoría (% de pacientes)f | 38% (P<0.001) | 10% (P<0.001) |
| Secondary endpoints EASI-75: ≥75 % de mejora en el % afectado y gravedad de la lesión (% de pacientes) | 51% (P<0.001) | 15% (P<0.001) |
| Mejoría de ≥4 puntos en la escala de Prurito NRS, en el peor momento de prurito en adultos y adolescentes | 41% (P<0.001) | 12% (P<0.001) |
| ADULTOS (+18 años) SOLO 2 | DUPIXENT (n=233) | Placebo (n=236) |
| Primary endpoint IGA 0 o 1, y en adultos ≥2 puntos de mejoría (% de pacientes)f | 36% (P<0.001) | 9% (P<0.001) |
| Secondary endpoints EASI-75: ≥75 % de mejora en el % afectado y gravedad de la lesión (% de pacientes) | 44% (P<0.001) | 12% (P<0.001) |
| Mejoría de ≥4 puntos en la escala de Prurito NRS, en el peor momento de prurito en adultos y adolescentes | 36% (P<0.001) | 10% (P<0.001) |
| ADOLESCENTES (12 a 17 años)g AD-1526 | DUPIXENT (n=82) | Placebo (n=85) |
| Primary endpoint IGA 0 o 1, y en adolescentes ≥2 puntos de mejoría (% de pacientes)f | 24% (P<0.001) | 2% (P<0.001) |
| Secondary endpoints EASI-75: ≥75 % de mejora en el % afectado y gravedad de la lesión (% de pacientes) | 42% (P<0.001) | 8% (P<0.001) |
| Mejoría de ≥4 puntos en la escala de Prurito NRS, en el peor momento de prurito en adultos y adolescentes | 37% (P<0.001) | 5% (P<0.001) |
LIBERTY AD CHRONOS
LIBERTY AD CHRONOS fue un ensayo aleatorizado, doble ciego, controlado con placebo en adultos con DA de moderada a grave (N = 740), aleatorizados a DUPIXENT® 300 mg C2S + TCS (n = 106) o placebo + TCS (n = 315) durante 52 semanas2
LIBERTY AD PEDS de 6 a 11 años
LIBERTY AD PEDS fue un ensayo aleatorizado, doble ciego, controlado con placebo, en niños de 6 a 11 años de edad con dermatitis atópica grave (N=367 ) con un control insuficiente de la enfermedad con tratamiento tópico, aleatorizado a DUPIXENT® 300 mg C4S + TCS, 100 /200 mg C2S + TCS o placebo + TCS durante 16 semanas
6 MESES
LIBERTY AD PRESCHOOL fue un ensayo de fase 2/3 de 2 partes. El ensayo de fase 3 aleatorizado, doble ciego, controlado con placebo de 16 semanas (parte B) se realizó en niños de 6 meses a <6 años con DA de moderada a grave no controlada (n = 162), aleatorizados a dupilumab 200 mg (para niños de 5 a <15 kg) o 300 mg (para niños de 15 a <30 kg) C4S (n = 83) o placebo (n = 79), más TCS de baja potencia. Los criterios de valoración coprimarios fueron la proporción de pacientes que logró EASI-75 (población general: 53 % con DUPIXENT® + TCS vs. 11 % con placebo + TCS), y la proporción de pacientes que alcanzó IGA de 0 o 1 (población general: 28 % con DUPIXENT® + TCS vs. 4 % con placebo + TCS) a la semana 16.25 Los datos presentados corresponden al análisis de los datos de los pacientes con DA grave (IGA = 4) al inicio del estudio (n = 125).25
En dermatitis atópica, se observó una mejora clínicamente significativa en la semana 16 en combinación con CTS en adultos y niños1,2,6,25,a,b
| ADULTOS (+18 años) CHRONOSc | DUPIXENT + TCS (n=106) | Placebo + TCS (n=315) |
| Primary endpoint IGA 0 o 1, y en adultos ≥2 puntos de mejoría (% de pacientes) | 39% (P<0.0001) | 12% (P<0.0001) |
| Secondary endpoints EASI-75: ≥75 % de mejora en el % afectado y gravedad de la lesión (% de pacientes) | 69% (P<0.0001) | 23% (P<0.0001) |
| Mejoría de ≥4 puntos en la escala de Prurito NRS, en el peor momento de prurito (en adultos y niños) o peor rascado/picazón (en bebés, preescolares y niños) (% de pacientes) | 59% (P<0.0001) | 20% (P<0.0001) |
| NIÑOS (6 a 11 años de 15 kg a <60 kg) AD-1652 | 300 mg Q4Wd | DUPIXENT + TCS (n=61) | Placebo + TCS (n=61) |
| Primary endpoint IGA 0 o 1 ≥2 puntos de mejoría (% de pacientes) | 30% (P<0.0001) | 13% (P<0.0001) |
| Co-Primary endpoint EASI-75: ≥75 % de mejora en el % afectado y gravedad de la lesión (% de pacientes) | 75% (P<0.0001) | 28% (P<0.0001) |
| Mejoría de ≥4 puntos en la escala de Prurito NRS, en el peor momento de prurito (en adultos y niños) o peor rascado/picazón (en bebés, preescolares y niños) (% de pacientes) | 54% (P<0.0001) | 12% (P<0.0001) |
| BEBÉS Y PREESCOLARES (6 meses) AD-1539e | DUPIXENT + TCS (n=62) | Placebo + TCS (n=63) |
| Primary endpoint25 IGA ≤ 1 puntos de mejoría (% de pacientes) | 14,3% (P<0.0001) | 1,6% (P<0.0001) |
| Co-Primary endpoint EASI-75: ≥75 % de mejora en el % afectado y gravedad de la lesión (% de pacientes) | 46% (P<0.0001) | 6,6% (P<0.0001) |
| Mejoría de ≥4 puntos en la escala de Prurito NRS, en el peor momento de prurito (en adultos y niños) o peor rascado/picazón (en bebés, preescolares y niños) (% de pacientes) | 42,3% (P<0.0001) | 8,8% (P<0.0001) |
En dermatitis atópica, se observó una mejora en la semana 16 en ensayos de monoterapia en adultos y adolescentes1,4,10,a,b
| ADULTOS (+18 años) SOLO 1 | DUPIXENT (n=224) | Placebo (n=224) |
| Primary endpoint IGA 0 o 1, y en adultos ≥2 puntos de mejoría (% de pacientes)f | 38% (P<0.001) | 10% (P<0.001) |
| Secondary endpoints EASI-75: ≥75 % de mejora en el % afectado y gravedad de la lesión (% de pacientes) | 51% (P<0.001) | 15% (P<0.001) |
| Mejoría de ≥4 puntos en la escala de Prurito NRS, en el peor momento de prurito en adultos y adolescentes | 41% (P<0.001) | 12% (P<0.001) |
| ADULTOS (+18 años) SOLO 2 | DUPIXENT (n=233) | Placebo (n=236) |
| Primary endpoint IGA 0 o 1, y en adultos ≥2 puntos de mejoría (% de pacientes)f | 36% (P<0.001) | 9% (P<0.001) |
| Secondary endpoints EASI-75: ≥75 % de mejora en el % afectado y gravedad de la lesión (% de pacientes) | 44% (P<0.001) | 12% (P<0.001) |
| Mejoría de ≥4 puntos en la escala de Prurito NRS, en el peor momento de prurito en adultos y adolescentes | 36% (P<0.001) | 10% (P<0.001) |
| ADOLESCENTES (12 a 17 años)g AD-1526 | DUPIXENT (n=82) | Placebo (n=85) |
| Primary endpoint IGA 0 o 1, y en adolescentes ≥2 puntos de mejoría (% de pacientes)f | 24% (P<0.001) | 2% (P<0.001) |
| Secondary endpoints EASI-75: ≥75 % de mejora en el % afectado y gravedad de la lesión (% de pacientes) | 42% (P<0.001) | 8% (P<0.001) |
| Mejoría de ≥4 puntos en la escala de Prurito NRS, en el peor momento de prurito en adultos y adolescentes | 37% (P<0.001) | 5% (P<0.001) |
LIBERTY AD CHRONOS
LIBERTY AD CHRONOS fue un ensayo aleatorizado, doble ciego, controlado con placebo en adultos con DA de moderada a grave (N = 740), aleatorizados a DUPIXENT® 300 mg C2S + TCS (n = 106) o placebo + TCS (n = 315) durante 52 semanas2
LIBERTY AD PEDS de 6 a 11 años
LIBERTY AD PEDS fue un ensayo aleatorizado, doble ciego, controlado con placebo, en niños de 6 a 11 años de edad con dermatitis atópica grave (N=367 ) con un control insuficiente de la enfermedad con tratamiento tópico, aleatorizado a DUPIXENT® 300 mg C4S + TCS, 100 /200 mg C2S + TCS o placebo + TCS durante 16 semanas
6 MESES
LIBERTY AD PRESCHOOL fue un ensayo de fase 2/3 de 2 partes. El ensayo de fase 3 aleatorizado, doble ciego, controlado con placebo de 16 semanas (parte B) se realizó en niños de 6 meses a <6 años con DA de moderada a grave no controlada (n = 162), aleatorizados a dupilumab 200 mg (para niños de 5 a <15 kg) o 300 mg (para niños de 15 a <30 kg) C4S (n = 83) o placebo (n = 79), más TCS de baja potencia. Los criterios de valoración coprimarios fueron la proporción de pacientes que logró EASI-75 (población general: 53 % con DUPIXENT® + TCS vs. 11 % con placebo + TCS), y la proporción de pacientes que alcanzó IGA de 0 o 1 (población general: 28 % con DUPIXENT® + TCS vs. 4 % con placebo + TCS) a la semana 16.25 Los datos presentados corresponden al análisis de los datos de los pacientes con DA grave (IGA = 4) al inicio del estudio (n = 125).25

Los resultados presentados no pretenden ser comparativos entre los ensayos DUPIXENT para niños, adolescentes y adultos.
EASI, Índice de Área y Severidad del Eczema; IGA, Evaluación Global del Investigador; NRS, escala de calificación numérica; Q2W, una vez cada 2 semanas; Q4W, una vez cada 4 semanas; CTS, corticoides tópicos.
a. Análisis completo incluyendo todos los sujetos aleatorizados.1
b. En los análisis primarios de los criterios de valoración de eficacia, los sujetos que recibieron un tratamiento de rescate o con datos faltantes se consideraron no respondedores.1
c. En CHRONOS, según sea necesario, los sujetos recibieron inhibidores de calcineurina tópicos solo para las áreas problemáticas, como la cara, el cuello y las áreas intertriginosas y genitales.1
d. En el día 1, los sujetos (peso inicial <30 kg) recibieron 600 mg de DUPIXENT.1
e. Los bebés y preescolares de entre 15 kg y 30 kg recibieron 300 mg cada 4 semanas, y lactantes a preescolares de 5 kg a 15 kg recibieron 200 mg cada 4 semanas.1
f. La escala IGA se definió como 0=clara, 1=casi clara, 2=leve, 3=moderada y 4=grave.1
g. Brazo que recibía dupilumab 200/300mg c2s.
Perfiles de pacientes
Dupixent® está aprobado para el control rápido y sostenido en niños de 6 meses a 11 años con DA grave, adolescentes de 12 a 17 años y adultos mayores de 18 años, con DA moderada-grave.1

Adultos
+18 años

Adolescentes
12-17 años

Niños
6-11 años

Bebés
6 meses - 5 años
Paciente Adulto (+18 años)

*LIBERTY AD OLE (NCT01949311) Estudio fase III, en curso, de extensión abierta que evalúa la seguridad y la eficacia a largo plazo de dupilumab en adultos con DA de moderada a grave que han participado previamente en ensayos clínicos con dupilumab (estudios parentales) incluidos los del grupo de placebo. Los pacientes fueron tratados inicialmente con 300 mg cada semana, pero se pasó a 300 mg cada 2 semanas en 2019 para alinearse con el régimen de dosis aprobado en ficha técnica. Se permitieron los tratamientos concomitantes para la EA, incluidos los corticosteroides tópicos (TCS) y los inhibidores tópicos de la calcineurina (TCI)
Control rápido y sostenido en el alivio del prurito, aclaramiento de la piel y calidad de vida desde la primera dosis 1,2,13
Disminución del prurito12
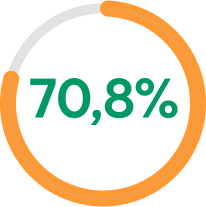
MEJORÍA ≥ 4 NRS
EN SEMANA 204
La proporción de pacientes que lograron una mejoría de ≥3 puntos en la puntuación promedio semanal del NRS de prurito desde el inicio hasta la semana 204 fue del 78,7 %
Mientras que los pacientes que lograron una mejoría de ≥4 puntos fue del 70,8 %
Aclaramiento de la piel12
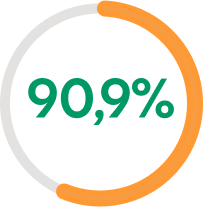
EASI-75
A LA SEMANA 204
La mejoría de los signos y síntomas persistió durante casi 4 años
(204 semanas) de tratamiento, alcanzando un EASI-75 del 90,9 %
Paciente Adolescente (12-17 años)

Disminución de la extensión y la gravedad de las lesiones en adolescentes14

EASI-75
A LA SEMANA 52
80% de los pacientes
lograron EASI-75
a la semana 5214
Mejora rápida de medidas de calidad de vida en adolescentes5
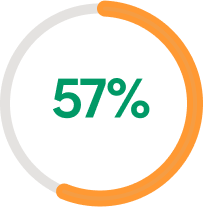
MEJORÍA DEL CDLQI
A LA SEMANA 52
57% de los pacientes lograron
una mejora clínicamente significativa
del CDLQI* a la semana 165
Comorbilidad
el porcentaje de los pacientes adolescentes*,15-20 diagnosticados
con DA y otras comorbilidades
*Al menos 1 comorbilidad atópica.
Paciente Niño (6‑11 años)

Reducción de la extensión y gravedad de las lesiones en niños de 6-11 años22

EASI-75
A LA SEMANA 52
~90% de mejora porcentual media de la puntuación EASI-75 desde el valor basal hasta la semana 5222-24
Mejora las medidas de calidad de vida en niños 6-11 años23
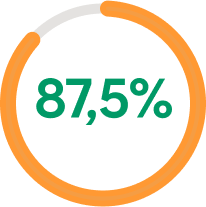
MEJORÍA DEL CDLQI
A LA SEMANA 52
87,5% de los pacientes mejoran ≥6 puntos en CDLQI a la semana 5222
Comorbilidades alérgicas atópicas

Todos los pacientes tenían una o más comórbilidades atópicas al inicio
Paciente Bebé (6 meses a 5 años)

Reducción de la extensión y gravedad de las lesiones
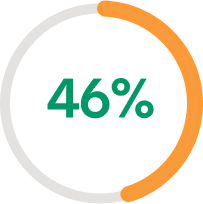
EASI-75
A LA SEMANA 1625
Con DUPIXENT®, el 46 % de los pacientes logró un EASI-75 a la semana 16.
Siete veces más pacientes mejoraon respecto a placebo25
Reducción de la intensidad del prurito
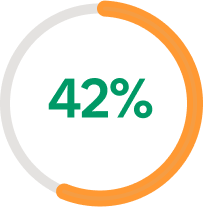
NRS
A LA SEMANA 1625
Con DUPIXENT®, el 42 % de los pacientes logró una mejora ≥4 puntos en la escala NRS de prurito a la semana 1625
Mejora de los signos de DA
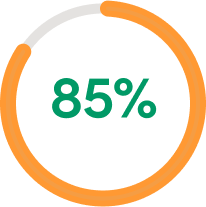
EASI-75
A LA SEMANA 2826
El 85% de los pacientes logró un EASI-75 a la semana 28 del LIBERTY AD OLE26
Paciente Adulto (+18 años)

*LIBERTY AD OLE (NCT01949311) Estudio fase III, en curso, de extensión abierta que evalúa la seguridad y la eficacia a largo plazo de dupilumab en adultos con DA de moderada a grave que han participado previamente en ensayos clínicos con dupilumab (estudios parentales) incluidos los del grupo de placebo. Los pacientes fueron tratados inicialmente con 300 mg cada semana, pero se pasó a 300 mg cada 2 semanas en 2019 para alinearse con el régimen de dosis aprobado en ficha técnica. Se permitieron los tratamientos concomitantes para la EA, incluidos los corticosteroides tópicos (TCS) y los inhibidores tópicos de la calcineurina (TCI)
Control rápido y sostenido en el alivio del prurito, aclaramiento de la piel y calidad de vida desde la primera dosis 1,2,13
Disminución del prurito12

MEJORÍA ≥ 4 NRS
EN SEMANA 204
La proporción de pacientes que lograron una mejoría de ≥3 puntos en la puntuación promedio semanal del NRS de prurito desde el inicio hasta la semana 204 fue del 78,7 %
Mientras que los pacientes que lograron una mejoría de ≥4 puntos fue del 70,8 %
Aclaramiento de la piel12

EASI-75
A LA SEMANA 204
La mejoría de los signos y síntomas persistió durante casi 4 años
(204 semanas) de tratamiento, alcanzando un EASI-75 del 90,9 %
Paciente Adolescente (12-17 años)

Disminución de la extensión y la gravedad de las lesiones en adolescentes14

EASI-75
A LA SEMANA 52
80% de los pacientes
lograron EASI-75
a la semana 5214
Mejora rápida de medidas de calidad de vida en adolescentes5

MEJORÍA DEL CDLQI
A LA SEMANA 52
57% de los pacientes lograron
una mejora clínicamente significativa
del CDLQI* a la semana 165
Comorbilidad

el porcentaje de los pacientes adolescentes*,15-20 diagnosticados
con DA y otras comorbilidades
*Al menos 1 comorbilidad atópica.
Paciente Niño (6‑11 años)

Reducción de la extensión y gravedad de las lesiones en niños de 6-11 años22

EASI-75
A LA SEMANA 52
~90% de mejora porcentual media de la puntuación EASI-75 desde el valor basal hasta la semana 5222-24
Mejora las medidas de calidad de vida en niños 6-11 años23

MEJORÍA DEL CDLQI
A LA SEMANA 52
87,5% de los pacientes mejoran ≥6 puntos en CDLQI a la semana 5222
Comorbilidades alérgicas atópicas

Todos los pacientes tenían una o más comórbilidades atópicas al inicio
Paciente Bebé (6 meses a 5 años)

Reducción de la extensión y gravedad de las lesiones

EASI-75
A LA SEMANA 1625
Con DUPIXENT®, el 46 % de los pacientes logró un EASI-75 a la semana 16.
Siete veces más pacientes mejoraon respecto a placebo25
Reducción de la intensidad del prurito

NRS
A LA SEMANA 1625
Con DUPIXENT®, el 42 % de los pacientes logró una mejora ≥4 puntos en la escala NRS de prurito a la semana 1625
Mejora de los signos de DA

EASI-75
A LA SEMANA 2826
El 85% de los pacientes logró un EASI-75 a la semana 28 del LIBERTY AD OLE26
Perfil de Seguridad
El perfil de seguridad de la semana 52 de DUPIXENT + CTS en adultos fue generalmente consistente con la semana 16 en adultos.1
Las reacciones adversas más frecuentes (incidencia ≥1 %) en pacientes con dermatitis atópica fueron: reacciones en el lugar de la inyección, conjuntivitis, blefaritis, herpes oral, queratitis, prurito ocular, otras infecciones por el virus del herpes simple, ojo seco y eosinofilia.1
El perfil de seguridad en pacientes pediátricos durante la semana 16 (en ensayos pivotales no fundamentales) y la semana 52 (en un ensayo de extensión abierto, AD-1434) fue consistente con el de adultos con dermatitis atópica. En AD-1434, se notificaron enfermedad manos, pies y boca y papiloma cutáneo (incidencia ≥2%) en pacientes de 6 meses a 5 años de edad. Estos casos no dieron lugar a la suspensión del fármaco del estudio.1
| Clasificación por Órganos y Sistemas de MedDRA | Frecuencia | Reacción Adversa |
| Infecciones e infestaciones | Frecuentes | Conjuntivitis* Herpes oral* |
| Trastornos de la sangre y del sistema linfático | Frecuentes | Eosinofilia |
| Trastornos del sistema inmunológico | Poco frecuentes Raras | Angioedema# Reacción anafiláctica Enfermedad del suero Reacción tipo enfermedad del suero |
| Trastornos oculares | Frecuentes Poco frecuentes Raras | Conjuntivitis alérgica* Queratitis*# Blefaritis*† Prurito ocular*† Ojo seco*† Queratitis ulcerosa*†# |
| Trastornos de la piel y del tejido subcutáneo | Poco frecuentes | Erupción facial# |
| Trastornos musculoesqueléticos y del tejido conjuntivo | Frecuentes | Artralgia# |
| Trastornos generales y alteraciones en el lugar de administración | Frecuentes | Reacciones en el lugar de la inyección (incluye eritema, edema, prurito, dolor, hinchazón y hematomas) |
* los trastornos oculares y el herpes oral se produjeron predominantemente en los estudios de dermatitis atópica.
† las frecuencias para prurito ocular, blefaritis y ojo seco fueron frecuentes y la queratitis ulcerosa fue poco frecuente en los estudios de dermatitis atópica.
# a partir de informes de poscomercialización.
Descripción de las reacciones adversas seleccionadas
Fácil Administración, Mayor Adherencia
DUPIXENT® OFRECE A SUS PACIENTES CÓMODAS Y DIVERSAS OPCIONES DE ADMINISTRACIÓN1
Dupixent® ofrece una cómoda administración:
- cada dos semanas para adultos, adolescentes y niños que pesen 30kg o más, y cada cuatro semanas en niños que pesen entre 15 y < 60 kg1.
- cada 4 semanas, EN PACIENTES A PARTIR DE LOS 6 MESES CON DA GRAVE1
Ahora, DUPIXENT® les ofrece a usted y a sus pacientes la opción de elegir entre una pluma o una jeringa precargadas para la autoinyección1.
DUPIXENT® ofrece a sus pacientes la opción de administración en su domicilio o en la consulta1.
* La pluma precargada de dupilumab es para uso en adultos y pacientes pediátricos a partir de 2 años de edad. La jeringa precargada de dupilumab es para uso en adultos y pacientes pediátricos a partir de 6 meses de edad. La pluma precargada de dupilumab no está diseñada para su uso en niños menores de 2 años de edad.

Contenido mínimo de Dupixent®
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
-
Dupixent 300 mg solución inyectable en jeringa precargada – 2 jeringas precargadas de 2 ml con protector de aguja (CN 718735.6).
-
Dupixent 300 mg solución inyectable en pluma precargada – 2 plumas precargadas de 2 ml (CN 758028.7).
-
Dupixent 200 mg solución inyectable en jeringa precargada – 2 jeringas precargadas de 1,14 ml (CN 727309.7).
-
Dupixent 200 mg solución inyectable en pluma precargada – 2 plumas precargadas de 1,14 ml (CN 758027.0).
PVP notificado: 1.267,45 €, PVP IVA notificado: 1.318,15 €.
Medicamento sujeto a prescripción médica. Diagnóstico hospitalario. Financiado por SNS. Dispensación hospitalaria sin cupón precinto.
CONSULTE LA FICHA TÉCNICA COMPLETA ANTES DE PRESCRIBIR ESTE MEDICAMENTO.
Ver ficha técnica DUPIXENT® 200 mg solución inyectable en jeringa precargada
Ver ficha técnica DUPIXENT® 200 mg solución inyectable en pluma precargada
Ver ficha técnica DUPIXENT® 300 mg solución inyectable en jeringa precargada
Ver ficha técnica DUPIXENT® 300 mg solución inyectable en pluma precargada
Dupixent está financiado en España de acuerdo con los criterios establecidos por el SNS.
1. NOMBRE DEL MEDICAMENTO
Dupixent 300 mg solución inyectable en jeringa precargada
Dupixent 300 mg solución inyectable en pluma precargada
Dupixent 200 mg solución inyectable en jeringa precargada
Dupixent 200 mg solución inyectable en pluma precargada
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Dupilumab 300 mg solución inyectable en jeringa precargada
Cada jeringa precargada de un solo uso contiene 300 mg de dupilumab en 2 ml de solución (150 mg/ml).
Dupilumab 300 mg solución inyectable en pluma precargada
Cada pluma precargada de un solo uso contiene 300 mg de dupilumab en 2 ml de solución (150 mg/ml).
Dupilumab 200 mg solución inyectable en jeringa precargada
Cada jeringa precargada de un solo uso contiene 200 mg de dupilumab en 1,14 ml de solución (175 mg/ml).
Dupilumab 200 mg solución inyectable en pluma precargada
Cada pluma precargada de un solo uso contiene 200 mg de dupilumab en 1,14 ml de solución (175 mg/ml).
Dupilumab es un anticuerpo monoclonal completamente humano producido por tecnología de ADN recombinante en las células de Ovario de Hámster Chino (OHC).
Para consultar la lista completa de excipientes, ver sección Lista de excipientes.
3. FORMA FARMACÉUTICA
Solución inyectable (inyectable).
Solución estéril transparente a ligeramente opalescente, de incolora a amarillo pálido, sin partículas visibles, con un pH de aproximadamente 5,9.

Referencias
- Ficha técnica de DUPIXENT®
- Blauvelt A, de Bruin-Weller M, Gooderham M, et al. Long-term management of moderate-to-severe atopic dermatitis with dupilumab and concomitant topical corticosteroids (LIBERTY AD CHRONOS): a 1-year, randomised, double-blinded, placebo-controlled, phase 3 trial. Lancet. 2017; 389 (10086): 2287-2303.
- Silverberg Jl, et al. Acta Derm Venereol. 2021;101(11):adv00585.
- Simpson EL, Paller AS, Siegfried EC, et al. Efficacy and safety of dupilumab in adolescents with uncontrolled moderate to severe atopic dermatitis: a phase 3 randomized clinical trial. JAMA Dermatol. 2020;156(1):44-56.
- Paller AS, et al. Am J Clin Dermatol. 2020;21:119-131.
- Paller AS, Siegfried EC, Thaçi D, et al. Efficacy and safety of dupilumab with concomitant topical corticosteroids in children 6 to 11 years old with severe atopic dermatitis: a randomized, double-blinded, placebo-controlled phase 3 trial. J Am Acad Dermatol. 2020;83(5):1282-1293.
- Agencia Española de Medicamentos y Productos Sanitarios. Centro de Información online de Medicamentos de la AEMPS – CIMA [en línea]. Disponible en: https://cima.aemps.es/cima/publico/home.html. Último acceso: abril 2024.
- Gandhi NA, Bennett BL, Graham NMH, Pirozzi G, Stahl N, Yancopoulos GD. Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov. 2016;15(1):35-50.
- Weidinger S, Beck LA, Bieber T, Kabashima K, Irvine AD. Atopic dermatitis. Nat Rev Dis Primers. 2018;4(1):1. doi:10.1038/s41572-018-0001-z
- Simpson EL, Bieber T, Guttman-Yassky E, et al; SOLO 1 and SOLO 2 Investigators. Two phase 3 trials of dupilumab versus placebo in atopic dermatitis. N Engl J Med. 2016;375(24):2335-2348.
- Violeta Zaragoza et al. Eficacia de Dupilumab a Largo Plazo en Adultos con Dermatitis Atópica de Moderada a Grave: Resultados de un Estudio de Extensión Abierto de 5 Años. 68.ª Reunión del Grupo Español en Investigación de Dermatitis de Contacto y Alergia Cutánea (GEIDAC); Valencia, España; 29-30 de septiembre de 2023
- Beck LA, et al. Am J Clin Dermatol. 2022;23(3):393-408.
- Blauvelt A, et al. Lancet. 2017;389(10086):2287-2303.[suppl].
- IQVIA Sanofi Integrated DUPIXENT Platform, data through September 2023.
- Silverberg JI, Simpson EL. Pediatr Allergy Immunol. 2013;24(5):476-86.
- Goksör E, et al. Acta Paediatr. 2016;105(12):1472-9.
- Gough H, et al. Pediatr Allergy Immunol. 2015;26(5):431-7.
- Ledford DK, Lockey RF. Curr Opin Allergy Clin Immunol. 2013;13(1):78-86.
- Silverberg JI, Simpson EL. Dermatitis. 2014;25(4):172-81.
- Hammer-Helmich L, et al. BMJ Open. 2016;6(10):e012637.
- Blauvelt A, et al. Am J Clin Dermatol. 2022;23(3):365-383.
- Paller A, et al. J Am Acad Dermatol. 2020;83(5):1282-1293.
- Cork MJ, et al. Br J Dermatol. 2021;184(5):857-70.
- Cork MJ, et al. J Dermatolog Treat. 2020;31(6):606-614.
- Paller AS, et al. Adv Ther. 2024;41(3):1046-1061.
- Paller AS, et al. Póster presentado en: 31st Congress of the European Academy of Dermatology and Venereology (EADV); 11-14 de octubre, 2023. Berlín, Alemania.
MAT-ES-2401232 v1.0 Marzo 2025