Praluent® en Pediatría: Innovación en el Tratamiento de la Hipercolesterolemia Familiar Heterocigótica (HFHe)
Amplia Aprobación y Cobertura
- Nueva Indicación para Niños: Praluent® (alirocumab) es ahora el único tratamiento autorizado en Europa para niños desde los 8 años con Hipercolesterolemia Familiar Heterocigótica, ampliando el acceso a tratamientos efectivos a edades más tempranas.
- Aprobación Europea y Nacional: Aprobado por la Comisión Europea y respaldado por el Ministerio de Sanidad en España, asegurando su disponibilidad y financiación.
Beneficios Clínicos Comprobados1,2
- Reducción Efectiva del Colesterol LDL: En un ensayo clínico de fase III, Praluent® demostró una reducción del 38.2% en los niveles de colesterol LDL en niños de 8 a 17 años, mostrando resultados significativos a las 24 semanas.
- Seguridad Consistente: La seguridad del tratamiento en la población pediátrica coincide con el perfil ya establecido en adultos, garantizando confianza en su uso.
Impacto Positivo en la Salud Infantil
- Prevención Temprana de Riesgos Cardiovasculares: Al tratar la HFHe desde la infancia, Praluent® ayuda a prevenir la acumulación prolongada de colesterol que puede conducir a enfermedades cardiovasculares en el futuro.
- Aumento de la Esperanza de Vida: La intervención temprana con Praluent® puede mejorar significativamente la calidad y la esperanza de vida de los niños afectados por esta condición genética.
Fácil Integración en el Tratamiento
- Flexibilidad en el Tratamiento: Puede ser utilizado en combinación con estatinas u otros tratamientos hipolipemiantes, o solo en casos de intolerancia a las estatinas, adaptándose a las necesidades individuales de cada paciente.
- Compatibilidad con la Dieta y Estilo de Vida: Actúa como complemento eficaz a las recomendaciones de dieta y estilo de vida saludable, ofreciendo un enfoque integral para el manejo de la hipercolesterolemia.
Innovación Farmacéutica1
- Desarrollo Global Colaborativo: Praluent® es el resultado de una colaboración entre Regeneron y Sanofi, subrayando la innovación en el cuidado de la salud a nivel mundial.
- Amplia Disponibilidad Internacional: Praluent® está aprobado en más de 60 países, reflejando su aceptación y eficacia a nivel global.
Indicación terapéutica pediátrica Alirocumab
Hipercolesterolemia primaria y dislipemia mixta1
Praluent® está indicado en adultos con hipercolesterolemia primaria (familiar heterocigótica y no familiar) o dislipidemia mixta y en pacientes pediátricos de 8 años y mayores con hipercolesterolemia familiar heterocigótica (HFHe), como tratamiento complementario a la dieta:
- en combinación con una estatina o una estatina con otros tratamientos hipolipemiantes en pacientes que no consiguen alcanzar sus objetivos de C-LDL con la dosis máxima tolerada de una estatina,
- o en monoterapia o en combinación con otros tratamientos hipolipemiantes en pacientes con intolerancia a las estatinas, o en los que se contraindique el uso de una estatina.
Enfermedad cardiovascular aterosclerótica establecida1
Praluent® está indicado en adultos con enfermedad cardiovascular aterosclerótica establecida para reducir el riesgo cardiovascular, disminuyendo los niveles de C-LDL, como tratamiento adyuvante a la corrección de otros factores de riesgo:
- en combinación con la dosis máxima tolerada de una estatina con o sin otros tratamientos hipolipemiantes,
- o solo o en combinación con otros tratamientos hipolipemiantes en pacientes que son intolerantes a estatinas o a los que se les ha contraindicado una estatina.
Posología pediátrica Alirocumab
Optimización de la eficacia/seguridad con una dosis dependiente del peso corporal1
La pauta posológica depende del peso corporal de los pacientes pediátricos con HFHe:
-
<50 kg a 150 mg cada 4 semanas, si se necesita una reducción adicional del c-LDL, 75 mg cada 2 semanas.
-
≥50 kg a 300 mg cada 4 semanas, si se necesita una reducción adicional del c-LDL, 150 mg cada 2 semanas.
Forma de administración: Pacientes pediátricos de 8 años y mayores1
- En adolescentes a partir de 12 años, se recomienda que Praluent® sea administrado por un adulto o bajo su supervisión.
- En niños menores de 12 años, Praluent® se debe administrar por un cuidador.
ODYSSEY KIDS Estudio de fase 2
- ODYSSEY KIDS, un estudio de búsqueda de dosis evaluó alirocumab en pacientes pediátricos con HFHe controlados inadecuadamente con estatinas.3
- En este estudio, alirocumab fue bien tolerado y redujo el c-LDL con dosis superiores (−46.1% en la semana 8 con 40 mg/75 mg Q2W si <50 kg/≥50 kg).3
Estos resultados coinciden con las reducciones observadas en adultos, lo que indica la necesidad de seguir investigando en la HFHe pediátrica3.
Objetivo del estudio4
- Evaluar la eficacia, seguridad y selección de la dosis de alirocumab, en pacientes pediátricos con HFHe.
Metodología4
- Pacientes con HFHe (n=42) de 8 a 17 años, con peso corporal de ≥25 kg y C-LDL ≥130 mg/dL a pesar de la terapia óptima con estatinas y otras terapias hipolipemiantes, se randomizaron en 4 cohortes según el peso corporal:
Tabla 2: Regímenes de dosificación por cohorte basados en el peso corporal
|
Cohorte |
<50 kg |
≥50 kg |
|
Cohorte 1 |
30 mg Q2W |
50 mg Q2W |
|
Cohorte 2 |
40 mg Q2W |
75 mg Q2W |
|
Cohorte 3 |
75 mg Q4W |
150 mg Q4W |
|
Cohorte 4 |
150 mg Q4W |
300 mg Q4W |
El criterio principal de valoración fue el cambio porcentual de C-LDL desde el inicio hasta la semana 8.
Resultados4
- La edad media fue de 12,4 años y 95% de los pacientes tomaban estatinas.
- Los niveles basales de c-LDL fueron 160,0-188,9 mg/dl y PCSK9 libre fue de 186,4-201,7 ng/ml en todas las cohortes.
- En la semana 8, la dosis más alta en las cohortes (2 y 4) demostró las mayores reducciones en el c-LDL (-46% y -45%, respectivamente).
- Los niveles de PCSK9 fueron más bajos en la semana 8 en las cohortes 2 y 4 (42,2 ng/ml y 8,6 ng/ml, respectivamente).
Conclusiones4
- En los pacientes pediátricos con HFHe, las reducciones de C-LDL fueron mayores en las cohortes de dosis más altas.
- En general, alirocumab fue bien tolerado en todas las dosis.

Objetivo estudio fase 3
- Evaluar la eficacia y seguridad de alirocumab en pacientesa pediátricosa con HFHe inadecuadamente controlada con estatinas.2
a Los pacientes que participaron en el estudio ODYSSEY KIDS fueron elegibles en el estudio de fase 3.
Objetivo del estudio4
- Evaluar la eficacia, seguridad y selección de la dosis de alirocumab, en pacientes pediátricos con HFHe.
Metodología4
- Pacientes con HFHe (n=42) de 8 a 17 años, con peso corporal de ≥25 kg y C-LDL ≥130 mg/dL a pesar de la terapia óptima con estatinas y otras terapias hipolipemiantes, se randomizaron en 4 cohortes según el peso corporal:
Tabla 2: Regímenes de dosificación por cohorte basados en el peso corporal
|
Cohorte |
<50 kg |
≥50 kg |
|
Cohorte 1 |
30 mg Q2W |
50 mg Q2W |
|
Cohorte 2 |
40 mg Q2W |
75 mg Q2W |
|
Cohorte 3 |
75 mg Q4W |
150 mg Q4W |
|
Cohorte 4 |
150 mg Q4W |
300 mg Q4W |
El criterio principal de valoración fue el cambio porcentual de C-LDL desde el inicio hasta la semana 8.
Resultados4
- La edad media fue de 12,4 años y 95% de los pacientes tomaban estatinas.
- Los niveles basales de c-LDL fueron 160,0-188,9 mg/dl y PCSK9 libre fue de 186,4-201,7 ng/ml en todas las cohortes.
- En la semana 8, la dosis más alta en las cohortes (2 y 4) demostró las mayores reducciones en el c-LDL (-46% y -45%, respectivamente).
- Los niveles de PCSK9 fueron más bajos en la semana 8 en las cohortes 2 y 4 (42,2 ng/ml y 8,6 ng/ml, respectivamente).
Conclusiones4
- En los pacientes pediátricos con HFHe, las reducciones de C-LDL fueron mayores en las cohortes de dosis más altas.
- En general, alirocumab fue bien tolerado en todas las dosis.

Objetivo estudio fase 3
- Evaluar la eficacia y seguridad de alirocumab en pacientesa pediátricosa con HFHe inadecuadamente controlada con estatinas.2
a Los pacientes que participaron en el estudio ODYSSEY KIDS fueron elegibles en el estudio de fase 3.
Diseño del estudio de fase 3
Aleatorizado, doble ciego, controlado con placebo y multicéntrico (NCT03510884)2
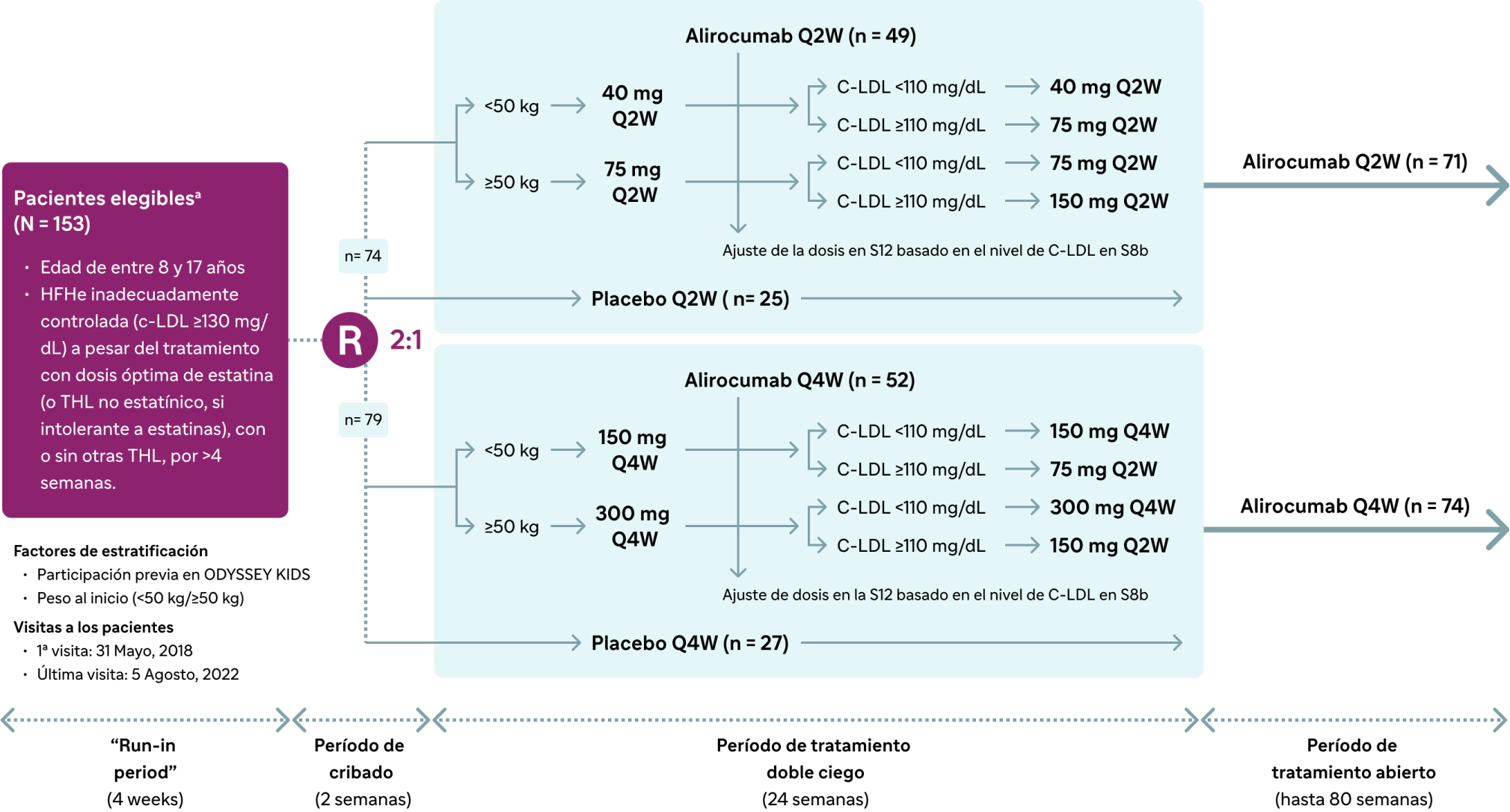
a Los pacientes se sometieron a pruebas de detección en 43 centros de 24 países (Argentina, Austria, Brasil, Bulgaria, Canadá, Dinamarca, Eslovenia, España, Estados Unidos, Finlandia, Francia, Hungría, Italia, Líbano, México, Noruega, Países Bajos, Polonia, República Checa, Rusia, Sudáfrica, Suecia, Taiwán y Turquía), y 40 centros asignaron al azar a los pacientes.
b En la semana 12, se aumentaron las dosis de alirocumab en 22 y 15 pacientes en cohortes Q2W y Q4W, respectivamente.
Variable principal2
- Cambio porcentual de c-LDL desde el inicio hasta la semana 24, entre alirocumab y placebo.
Variables secundarias clave2
- Cambio porcentual de c-LDL en la semana 12
- Cambios de otros parámetros lipídicos en las semanas 12 y 24 (Apo B, c-no-HDL, CT, c-HDL, Lp(a), TG y apolipoproteína A-1).
- Seguridad, tolerabilidad y desarrollo de Ac anti-alirocumab a la semana 24.
Características basales2
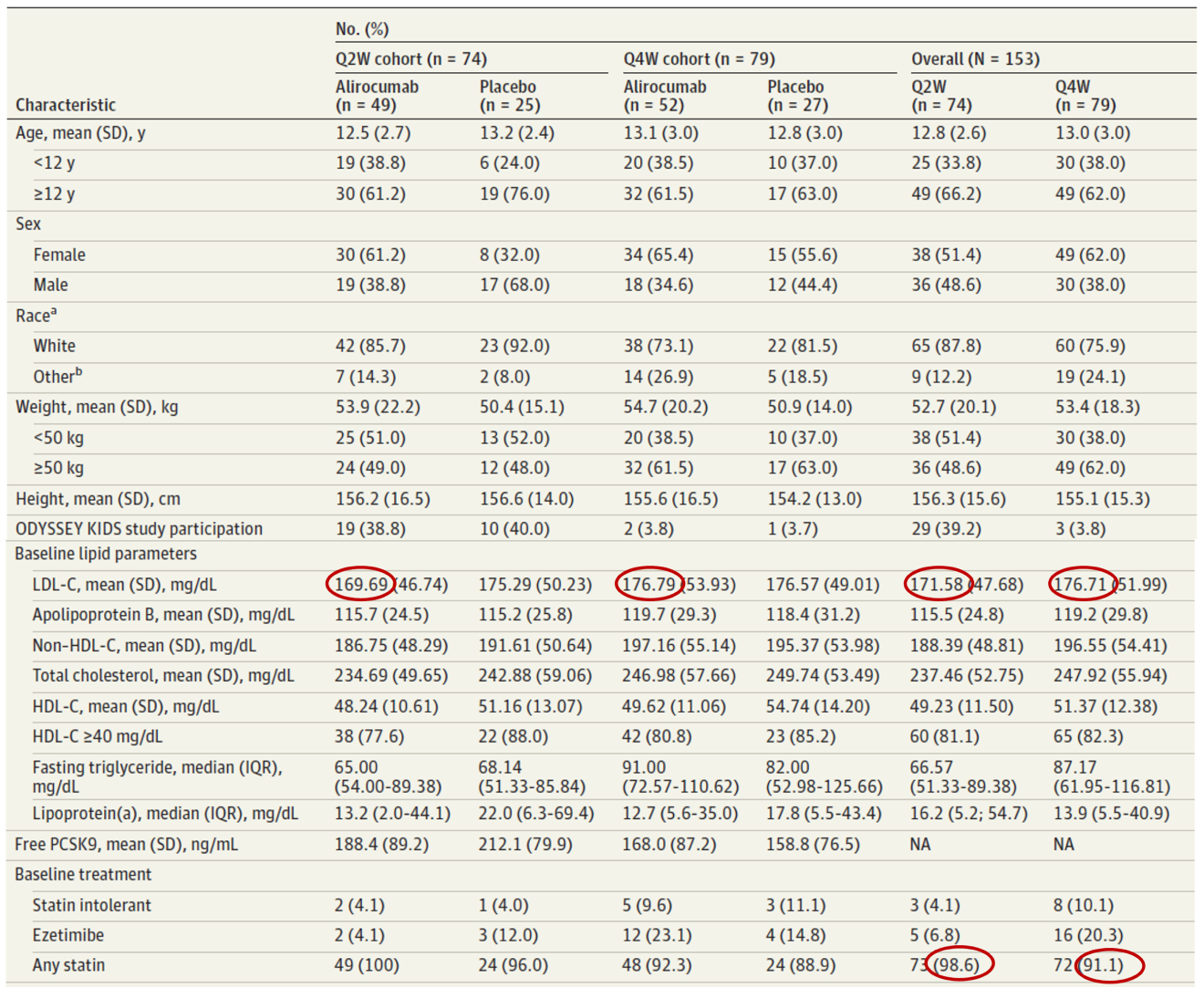
Variable Principal2
Cambio en el c-LDL desde el inicio hasta la semana 24
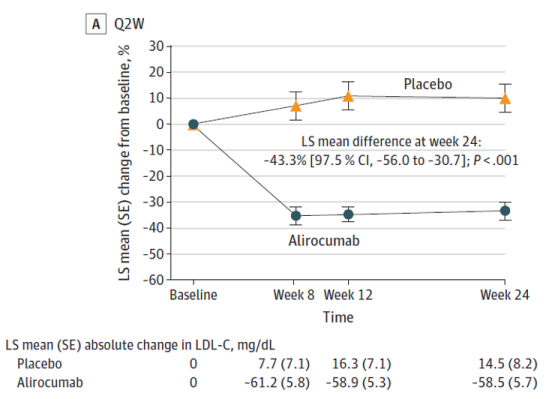
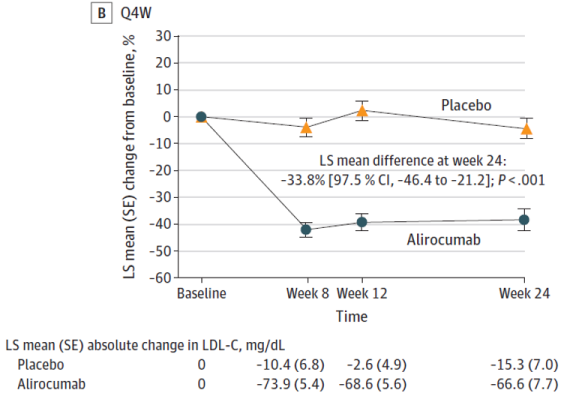
Figura 2. Cambio en el colesterol de lipoproteínas de baja densidad (C-LDL) desde el inicio en la población por intención de tratar.
En la semana 24, alirocumab redujo significativamente el c-LDL en comparación con placebo en ambas cohortes de dosificación, con una diferencia media de −43,3% (97,5% IC: −56,0, −30,7; P<0,001) en alirocumab Q2W y −33,8% (97,5% IC: −46,4, −21,2; P<0,001) en alirocumab Q4W.
Variables secundarias de eficacia2
|
Variables secundarias clavea |
Diferencia de medias en el cambio desde el inicio: alirocumab vs placebo, % (97.5% IC) | |||
|
Cohorte Q2W (n = 74) |
P valor |
Cohorte Q4W (n = 79) |
P valor | |
|
C-LDL en la semana 12 |
−45.5 (−56.3 to −34.7) |
<.001 |
−41.5 (−52.7 to −30.2) |
<.001 |
|
Apo B en la semana 24 |
−37.8 (−47.5 to −28.2) |
<.001 |
−30.7 (−42.0 to −19.4) |
<.001 |
|
C-No-HDL en la semana 24 |
−40.7 (−52.2 to −29.1) |
<.001 |
−31.9 (−44.1 to −19.7) |
<.001 |
|
Colesterol Total en la semana 24 |
−30.8 (−39.8 to −21.9) |
<.001 |
−23.3 (−33.5 to −13.1) |
<.001 |
|
Apo B en la semana 12 |
−38.9 (−48.2 to −29.6) |
<.001 |
−32.8 (−42.8 to −22.7) |
<.001 |
|
C-No-HDL en la semana 12 |
−42.8 (−53.8 to −31.8) |
<.001 |
−37.5 (−47.9 to −27.0) |
<.001 |
|
Colesterol Total en la semana 12 |
−32.7 (−41.3 to −24.2) |
<.001 |
−27.9 (−35.6 to −20.2) |
<.001 |
|
Diferencia de medias ajustada (IC del 97,5%) en el cambio desde el inicio: alirocumab frente a placebo, % | ||||
|
Lp(a) en la semana 24 |
−15.2 (−30.3 to −0.1) |
.02 |
−24.9 (−44.4 to −5.4) |
.004 |
|
Lp(a) en la semana 12b |
−5.6 (−21.7 to 10.4) |
.43 |
−13.5 (−32.7 to 5.7) |
.11 |
Los primeros 12 criterios de valoración secundarios de la eficacia en la jerarquía de pruebas mostraron diferencias significativas en el tratamiento a favor de alirocumab para ambos regímenes de dosificación.
a. En cuanto a los objetivos secundarios, la proporción de pacientes que alcanzaron una reducción del ≥50% en el C-LDL en la semana 24 fue del 21,6% en la cohorte de alirocumab Q2W (frente al 0% en placebo) y del 32,4% en la cohorte de alirocumab Q4W (frente al 9,1% en placebo). En la semana 12, la proporción de pacientes que alcanzaron una reducción del ≥50% en C-LDL fue del 25,2% en la cohorte de alirocumab Q2W (frente al 0% en placebo) y del 31,9% en la cohorte de alirocumab Q4W (frente al 0,1% en placebo). b. En el momento en que se inició este estudio, la recomendación de C-LDL pediátrica era de <130 mg/dL. Los criterios de valoración secundarios continuos de eficacia que se anticipaba que tenían una distribución normal se analizaron utilizando el mismo enfoque que el criterio de valoración primario; los que se anticipaba que tenían una distribución no normal se analizaron utilizando un enfoque de imputación múltiple seguido de un modelo de regresión robusto utilizando la estimación M con el grupo de tratamiento y los estratos de aleatorización como efectos principales y el valor basal correspondiente como co-variable. Los criterios de valoración categóricos de la eficacia secundaria se analizaron utilizando un enfoque de imputación múltiple seguido de un modelo de regresión logística ajustado por el grupo de tratamiento como efecto principal y el valor basal correspondiente como co-variable, estratificado por factores de aleatorización.
Variable principal2
- Cambio porcentual de c-LDL desde el inicio hasta la semana 24, entre alirocumab y placebo.
Variables secundarias clave2
- Cambio porcentual de c-LDL en la semana 12
- Cambios de otros parámetros lipídicos en las semanas 12 y 24 (Apo B, c-no-HDL, CT, c-HDL, Lp(a), TG y apolipoproteína A-1).
- Seguridad, tolerabilidad y desarrollo de Ac anti-alirocumab a la semana 24.
Características basales2

Variable Principal2
Cambio en el c-LDL desde el inicio hasta la semana 24


Figura 2. Cambio en el colesterol de lipoproteínas de baja densidad (C-LDL) desde el inicio en la población por intención de tratar.
En la semana 24, alirocumab redujo significativamente el c-LDL en comparación con placebo en ambas cohortes de dosificación, con una diferencia media de −43,3% (97,5% IC: −56,0, −30,7; P<0,001) en alirocumab Q2W y −33,8% (97,5% IC: −46,4, −21,2; P<0,001) en alirocumab Q4W.
Variables secundarias de eficacia2
|
Variables secundarias clavea |
Diferencia de medias en el cambio desde el inicio: alirocumab vs placebo, % (97.5% IC) | |||
|
Cohorte Q2W (n = 74) |
P valor |
Cohorte Q4W (n = 79) |
P valor | |
|
C-LDL en la semana 12 |
−45.5 (−56.3 to −34.7) |
<.001 |
−41.5 (−52.7 to −30.2) |
<.001 |
|
Apo B en la semana 24 |
−37.8 (−47.5 to −28.2) |
<.001 |
−30.7 (−42.0 to −19.4) |
<.001 |
|
C-No-HDL en la semana 24 |
−40.7 (−52.2 to −29.1) |
<.001 |
−31.9 (−44.1 to −19.7) |
<.001 |
|
Colesterol Total en la semana 24 |
−30.8 (−39.8 to −21.9) |
<.001 |
−23.3 (−33.5 to −13.1) |
<.001 |
|
Apo B en la semana 12 |
−38.9 (−48.2 to −29.6) |
<.001 |
−32.8 (−42.8 to −22.7) |
<.001 |
|
C-No-HDL en la semana 12 |
−42.8 (−53.8 to −31.8) |
<.001 |
−37.5 (−47.9 to −27.0) |
<.001 |
|
Colesterol Total en la semana 12 |
−32.7 (−41.3 to −24.2) |
<.001 |
−27.9 (−35.6 to −20.2) |
<.001 |
|
Diferencia de medias ajustada (IC del 97,5%) en el cambio desde el inicio: alirocumab frente a placebo, % | ||||
|
Lp(a) en la semana 24 |
−15.2 (−30.3 to −0.1) |
.02 |
−24.9 (−44.4 to −5.4) |
.004 |
|
Lp(a) en la semana 12b |
−5.6 (−21.7 to 10.4) |
.43 |
−13.5 (−32.7 to 5.7) |
.11 |
Los primeros 12 criterios de valoración secundarios de la eficacia en la jerarquía de pruebas mostraron diferencias significativas en el tratamiento a favor de alirocumab para ambos regímenes de dosificación.
a. En cuanto a los objetivos secundarios, la proporción de pacientes que alcanzaron una reducción del ≥50% en el C-LDL en la semana 24 fue del 21,6% en la cohorte de alirocumab Q2W (frente al 0% en placebo) y del 32,4% en la cohorte de alirocumab Q4W (frente al 9,1% en placebo). En la semana 12, la proporción de pacientes que alcanzaron una reducción del ≥50% en C-LDL fue del 25,2% en la cohorte de alirocumab Q2W (frente al 0% en placebo) y del 31,9% en la cohorte de alirocumab Q4W (frente al 0,1% en placebo). b. En el momento en que se inició este estudio, la recomendación de C-LDL pediátrica era de <130 mg/dL. Los criterios de valoración secundarios continuos de eficacia que se anticipaba que tenían una distribución normal se analizaron utilizando el mismo enfoque que el criterio de valoración primario; los que se anticipaba que tenían una distribución no normal se analizaron utilizando un enfoque de imputación múltiple seguido de un modelo de regresión robusto utilizando la estimación M con el grupo de tratamiento y los estratos de aleatorización como efectos principales y el valor basal correspondiente como co-variable. Los criterios de valoración categóricos de la eficacia secundaria se analizaron utilizando un enfoque de imputación múltiple seguido de un modelo de regresión logística ajustado por el grupo de tratamiento como efecto principal y el valor basal correspondiente como co-variable, estratificado por factores de aleatorización.
Seguridad y eficacia
No se observaron diferencias clínicamente significativas en los EA entre los grupos de tratamiento en el período doble ciego o abierto.
Durante el período doble ciego, ningún paciente interrumpió el tratamiento en la cohorte Q2W; solo dos pacientes presentaron EAS (síncope) que llevó a la interrupción del tratamiento en la cohorte de alirocumab Q4W.
No se reportaron muertes.2
Población pediátrica1
Se ha demostrado la seguridad y eficacia de Praluent® en niños y adolescentes con hipercolesterolemia familiar heterocigótica (HFHe). Se realizó un estudio clínico para evaluar los efectos de Praluent® en 153 pacientes de 8 a 17 años de edad con HFHe. No se identificaron nuevos hallazgos de seguridad y los datos de seguridad en esta población fueron coherentes con el perfil de seguridad conocido del producto en adultos con HFHe.
La experiencia de alirocumab en pacientes pediátricos con hipercolesterolemia familiar homocigótica (HFHo) está limitada a 18 pacientes de edades comprendidas entre los 8 y 17 años. No se observaron nuevos hallazgos sobre seguridad en comparación con el perfil de seguridad conocido en adultos.
Puntos fuertes del estudio
Diseño del estudio
Los puntos fuertes de este estudio radican en su diseño de ensayo aleatorizado doble ciego con restricciones mínimas de elegibilidad.2
Potencia estadística adecuada
A pesar de un tamaño de muestra relativamente pequeño, hubo suficiente poder estadístico para el análisis estadístico, comparable con otros estudios de THL para la HF pediátrica.3,4,5
La raza como co-variable
Si bien la mayoría de los pacientes eran blancos, un análisis previo de la eficacia de alirocumab mostró que la raza no era una co-variable significativa en los adultos5, lo que sugiere que la raza no afectaría la eficacia en los pacientes pediátricos.
Relevancia para los pacientes pediátricos con HFHe
La seguridad es crucial para la adherencia al tratamiento con estatinas en los niños, y aunque muchos no tomaban dosis máximas de estatinas ni usaban ezetimibe, el estudio refleja escenarios del mundo real en el tratamiento de la HFHe pediátrica.3,4,7
Limitaciones del estudio2
Tamaño de la muestra y generalizabilidad
El tamaño de la muestra era relativamente pequeño, y la mayoría de los pacientes eran blancos, lo que podría limitar la generalización a poblaciones más amplias.
Inscripción secuencial de cohortes de dosificación
La diferencia observada entre la disminución del c-LDL con alirocumab en relación con placebo en las dos cohortes puede estar influenciada por el aumento del c-LDL para placebo en Q2W frente a una disminución en Q4W en la semana 24, pero las comparaciones directas entre las dos cohortes se ven obstaculizadas por la inscripción secuencial.
Adherencia y variabilidad del protocolo
A pesar de una modesta reducción del c-LDL durante el periodo abierto, esto podría deberse a ajustes de dosis dirigidos por el investigador más que a los requisitos del protocolo.
La variabilidad en el cumplimiento o las desviaciones del protocolo es inherente a los estudios realizados en múltiples centros.
Conclusiones2
- Alirocumab Q2W y Q4W reduce significativamente las concentraciones de C-LDL y otros parámetros lipídicos proaterogénicos (reducción por primera vez de la Lp(a) proaterogénica) en pacientes pediátricos con HFHe a partir de los 8 años.
- Las mejoras en el C-LDL se mantuvieron hasta la semana 104, con un buen perfil de seguridad y tolerabilidad en pacientes pediátricos.
- Praluent® es el único tratamiento modificador de lípidos sin estatinas con una indicación pediátrica HFHe aprobada para el rango de edad (>8 años).
Alirocumab presenta una opción complementaria adecuada y segura a la THL estable en pacientes pediátricos a partir de 8 años con HeFH.
Población pediátrica1
Se ha demostrado la seguridad y eficacia de Praluent® en niños y adolescentes con hipercolesterolemia familiar heterocigótica (HFHe). Se realizó un estudio clínico para evaluar los efectos de Praluent® en 153 pacientes de 8 a 17 años de edad con HFHe. No se identificaron nuevos hallazgos de seguridad y los datos de seguridad en esta población fueron coherentes con el perfil de seguridad conocido del producto en adultos con HFHe.
La experiencia de alirocumab en pacientes pediátricos con hipercolesterolemia familiar homocigótica (HFHo) está limitada a 18 pacientes de edades comprendidas entre los 8 y 17 años. No se observaron nuevos hallazgos sobre seguridad en comparación con el perfil de seguridad conocido en adultos.
Puntos fuertes del estudio
Diseño del estudio
Los puntos fuertes de este estudio radican en su diseño de ensayo aleatorizado doble ciego con restricciones mínimas de elegibilidad.2
Potencia estadística adecuada
A pesar de un tamaño de muestra relativamente pequeño, hubo suficiente poder estadístico para el análisis estadístico, comparable con otros estudios de THL para la HF pediátrica.3,4,5
La raza como co-variable
Si bien la mayoría de los pacientes eran blancos, un análisis previo de la eficacia de alirocumab mostró que la raza no era una co-variable significativa en los adultos5, lo que sugiere que la raza no afectaría la eficacia en los pacientes pediátricos.
Relevancia para los pacientes pediátricos con HFHe
La seguridad es crucial para la adherencia al tratamiento con estatinas en los niños, y aunque muchos no tomaban dosis máximas de estatinas ni usaban ezetimibe, el estudio refleja escenarios del mundo real en el tratamiento de la HFHe pediátrica.3,4,7
Limitaciones del estudio2
Tamaño de la muestra y generalizabilidad
El tamaño de la muestra era relativamente pequeño, y la mayoría de los pacientes eran blancos, lo que podría limitar la generalización a poblaciones más amplias.
Inscripción secuencial de cohortes de dosificación
La diferencia observada entre la disminución del c-LDL con alirocumab en relación con placebo en las dos cohortes puede estar influenciada por el aumento del c-LDL para placebo en Q2W frente a una disminución en Q4W en la semana 24, pero las comparaciones directas entre las dos cohortes se ven obstaculizadas por la inscripción secuencial.
Adherencia y variabilidad del protocolo
A pesar de una modesta reducción del c-LDL durante el periodo abierto, esto podría deberse a ajustes de dosis dirigidos por el investigador más que a los requisitos del protocolo.
La variabilidad en el cumplimiento o las desviaciones del protocolo es inherente a los estudios realizados en múltiples centros.
Conclusiones2
- Alirocumab Q2W y Q4W reduce significativamente las concentraciones de C-LDL y otros parámetros lipídicos proaterogénicos (reducción por primera vez de la Lp(a) proaterogénica) en pacientes pediátricos con HFHe a partir de los 8 años.
- Las mejoras en el C-LDL se mantuvieron hasta la semana 104, con un buen perfil de seguridad y tolerabilidad en pacientes pediátricos.
- Praluent® es el único tratamiento modificador de lípidos sin estatinas con una indicación pediátrica HFHe aprobada para el rango de edad (>8 años).
Alirocumab presenta una opción complementaria adecuada y segura a la THL estable en pacientes pediátricos a partir de 8 años con HeFH.
Contenido mínimo de Praluent®
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
Praluent® 75 mg pluma precargada, envase de 2 plumas precargadas (CN: 708030.5) P.V.P.: 463,06 €. Medicamento sujeto a prescripción médica.Dispensación hospitalaria.
Praluent® 150 mg pluma precargada, envase de 2 plumas precargadas (CN: 708035.0) P.V.P.: 463,06 €. Medicamento sujeto a prescripción médica. Dispensación hospitalaria.
Praluent® 300 mg pluma precargada, envase de 1 pluma precargada (CN: 729267.8) P.V.P.: 463,06 €. Medicamento sujeto a prescripción médica. Dispensación hospitalaria.
Ver ficha técnica Praluent 75mg
Ver ficha técnica Praluent 150mg
Ver ficha técnica Praluent 300mg
Praluent® está financiado en España de acuerdo con los criterios establecidos por el SNS.
1. Nombre del medicamento
Praluent 75 mg pluma precargada, envase de 2 plumas precargadas (CN: 708030.5) P.V.P.: 463,06 €. Medicamento sujeto a prescripción médica.Dispensación hospitalaria.
Praluent 150 mg pluma precargada, envase de 2 plumas precargadas (CN: 708035.0) P.V.P.: 463,06 €. Medicamento sujeto a prescripción médica.
Dispensación hospitalaria.
Praluent 300 mg pluma precargada, envase de 1 pluma precargada (CN: 729267.8) P.V.P.: 463,06 €. Medicamento sujeto a prescripción médica.
Dispensación hospitalaria.
2. Composición cualitativa y cuantitativa
Praluent 75 mg solución inyectable en pluma precargada: Cada pluma precargada de un solo uso contiene 75 mg de alirocumab en 1 ml de solución. Praluent 150 mg solución inyectable en pluma precargada: Cada pluma precargada de un solo uso contiene 150 mg de alirocumab en 1 ml de solución. Praluent 300 mg solución inyectable en pluma precargada: Cada pluma precargada de un solo uso contiene 300 mg de alirocumab en 2 ml solución. Alirocumab es un anticuerpo monoclonal IgG1 humano producido en células de ovario de hámster chino mediante tecnología de ADN recombinante.
3. Forma farmacéutica
Solución inyectable (inyectable). Solución transparente, de incolora a amarillo pálido. pH: 5,7 - 6,3. Osmolaridad: Praluent 75 mg solución inyectable, 293 - 439 mOsm/kg. Praluent 150 mg solución inyectable, 383 - 434 mOsm/kg. Praluent 300 mg solución inyectable, 383 – 434 mOsm/kg.
C-LDL: colesterol de lipoproteínas de baja densidad (low-density lipoprotein cholesterol). FH: hipercolesterolemia familiar (familial hypercholesterolemia).
HeFH: hipercolesterolemia familiar heterocigota (heterozygous familial hypercholesterolemia). LLT: tratamiento hipolipemiante (lipid-lowering therapy). Q2W, cada 2 semanas (every two weeks).
Referencias
- Sanofi, Resumen de las características del producto: Praluent. Disponible en https://ec.europa.eu/health/documents/community-register/2023/20231115160914/anx_160914_en.pdf [consultado en Agosto de 2024].
- Santos RD et al. JAMA Pediatr. 2024;178(3):283–293.
- Santos RD et al. N Engl J Med. 2020;383(14):1317-1327.
- Santos RD et al. J Am Coll Cardiol. 2020;75(6):565-574.
- Luirink IK et al. N Engl J Med. 2019;381(16):1547-1556.
- Robinson JG et al. N Engl J Med. 2015;372(16):1489-1499.
- Ramaswami U et al. Atherosclerosis. 2020;292:178-187.

