Sobre SARCLISA® (isatuximab)
SARCLISA® diferente1 anti-CD38, como backbone en combinación con Kd o Pd, es un nuevo estándar de tratamiento para los pacientes refractarios a lenalidomida.2-5
Mecanismos de Acción
SARCLISA® es un anticuerpo monoclonal anti-CD38 que produce efectos multimodales.
Isatuximab se une a un epítopo del CD38 diferente al de otros anticuerpos anti-CD38 y actúa a través de mecanismos efectores directos (independientes de Fc) diferentes.1,2,5-10


SARCLISA® + Kd2

En combinación con Kd (carfilzomib y dexametasona), para el tratamiento de pacientes adultos con mieloma múltiple que han recibido al menos un tratamiento previo.2
Kd, carfilzomib y dexametasona.

Datos extraídos de Moreau P, et al. Lancet. 2021;397(10292):2361-2371.
SARCLISA® + Kd: Primer y único*11,12 anti-CD38 financiado con Kd2,14
SARCLISA® + Kd para pacientes con MMRR (IKEMA): un estudio fase III multicéntrico, abierto y aleatorizado2
*Estado P&R en la página web del Ministerio de Sanidad, Consumo y Bienestar Social (https://www.mscbs.gob.es/ profesionales/medicamentos.do):disponible en nomenclator desde el 1 de mayo 2022.
Kd, carfilzomib y dexametasona; MMRR, mieloma múltiple resistente al tratamiento o recidivante
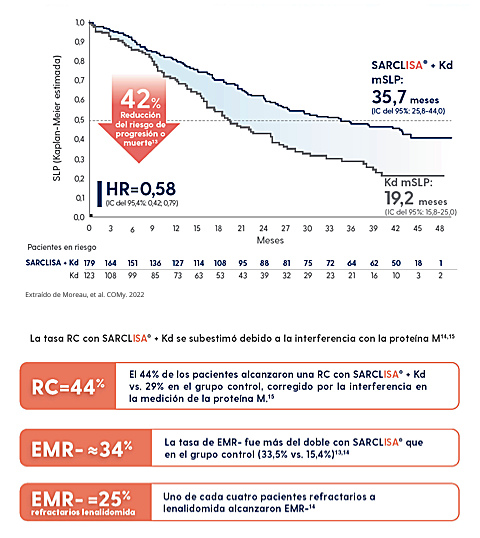
- La mediana de SLP de SARCLISA. + Kd aún no se ha alcanzado.*2,14
- A los 2 años, la mSLP estimada fue del 68,9% con SARCLISA. + Kd.**14
- Uno de cada tres pacientes alcanzaron EMR- con IsaKd (EMR-=30%).
- Uno de cada cuatro pacientes refractarios a lenalidomida alcanzaron EMR-.14
*Mediana de seguimiento de 24 meses.2,14 **vs. 45,7% con Kd.14 † Los resultados de espectrometría sugieren que la tasa de RC ajustada potencial podría alcanzarse en 45,8%. Sin tener en cuenta la interferencia con la proteína M, el 40% de los pacientes con SARCLISA + Kd alcanzaron una RC.14 ‡Evaluación citogenética del laboratorio central; con un punto de corte del 50% para del (17p) y del 30% para t(4;14), t(14;16) y ganancia(1q21).2,14
EMR-, enfermedad mínima residual negativa; HR, hazard ratio; IC, intervalo de confianza; Kd, carfilzomib y dexametasona; NA, no alcanzado; RC, respuesta completa; SLP, supervivencia libre de progresión.
Datos extraídos de Moreau P, et al. Lancet. 2021;397(10292):2361-2371.
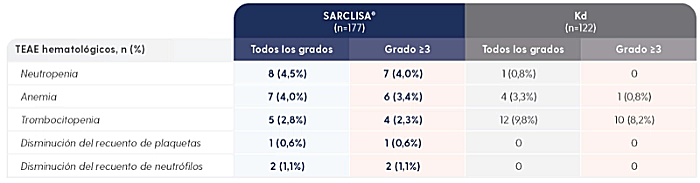
Datos extraídos de Moreau P, et al. Lancet. 2021;397(10292):2361-2371. Material suplementario.
EA, eventos adversos; TEAE, evento adverso durante el tratamiento; Kd, carfilzomib y dexametasona

En combinación con Kd (carfilzomib y dexametasona), para el tratamiento de pacientes adultos con mieloma múltiple que han recibido al menos un tratamiento previo.2
Kd, carfilzomib y dexametasona.

Datos extraídos de Moreau P, et al. Lancet. 2021;397(10292):2361-2371.
SARCLISA® + Kd: Primer y único*11,12 anti-CD38 financiado con Kd2,14
SARCLISA® + Kd para pacientes con MMRR (IKEMA): un estudio fase III multicéntrico, abierto y aleatorizado2
*Estado P&R en la página web del Ministerio de Sanidad, Consumo y Bienestar Social (https://www.mscbs.gob.es/ profesionales/medicamentos.do):disponible en nomenclator desde el 1 de mayo 2022.
Kd, carfilzomib y dexametasona; MMRR, mieloma múltiple resistente al tratamiento o recidivante

- La mediana de SLP de SARCLISA. + Kd aún no se ha alcanzado.*2,14
- A los 2 años, la mSLP estimada fue del 68,9% con SARCLISA. + Kd.**14
- Uno de cada tres pacientes alcanzaron EMR- con IsaKd (EMR-=30%).
- Uno de cada cuatro pacientes refractarios a lenalidomida alcanzaron EMR-.14
*Mediana de seguimiento de 24 meses.2,14 **vs. 45,7% con Kd.14 † Los resultados de espectrometría sugieren que la tasa de RC ajustada potencial podría alcanzarse en 45,8%. Sin tener en cuenta la interferencia con la proteína M, el 40% de los pacientes con SARCLISA + Kd alcanzaron una RC.14 ‡Evaluación citogenética del laboratorio central; con un punto de corte del 50% para del (17p) y del 30% para t(4;14), t(14;16) y ganancia(1q21).2,14
EMR-, enfermedad mínima residual negativa; HR, hazard ratio; IC, intervalo de confianza; Kd, carfilzomib y dexametasona; NA, no alcanzado; RC, respuesta completa; SLP, supervivencia libre de progresión.

Datos extraídos de Moreau P, et al. Lancet. 2021;397(10292):2361-2371.

Datos extraídos de Moreau P, et al. Lancet. 2021;397(10292):2361-2371. Material suplementario.
EA, eventos adversos; TEAE, evento adverso durante el tratamiento; Kd, carfilzomib y dexametasona
SARCLISA® + Pd2

En combinación con Pd (pomalidomida y dexametasona), para el tratamiento de pacientes adultos con MMRR que han recibido al menos dos tratamientos previos, incluyendo lenalidomida y un IP y han demostrado progresión de la enfermedad en el último tratamiento.2
Kd, carfilzomib y dexametasona; MMRR, mieloma múltiple resistente al tratamiento o recidivante; Pd, pomalidomida y dexametasona.
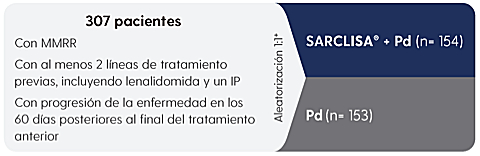
Datos extraídos a partir de Attal M, et al. Lancet. 2019;394(10214):2096–2107.
Primer y único*11,12anti-CD38 financiado con Pd2,3
SARCLISA® + Pd** vs. Pd** en pacientes con MMRR (ICARIA): un estudio fase III, multicéntrico, abierto y aleatorizado3.
*Estado P&R en la página web del Ministerio de Sanidad, Consumo y Bienestar Social (https://www.mscbs.gob.es/ profesionales/medicamentos.do): disponible en nomenclátor desde el 1 de mayo 2022.
**A bajas dosis.2
Kd, carfilzomib y dexametasona; MMRR, mieloma múltiple resistente al tratamiento o recidivante; Pd, pomalidomida y dexametasona;
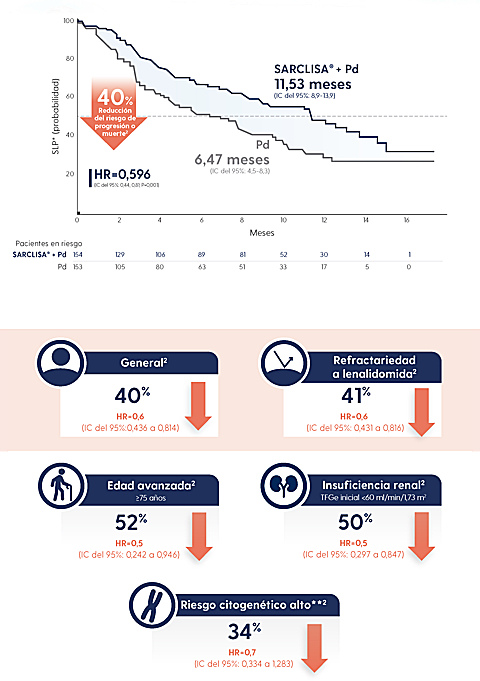
SARCLISA® + Pd es el triplete financiado que incluye mayor número de pacientes refractarios a lenalidomida (94%) y refractarios a un IP (77%) en su estudio fase III5
SARCLISA® + Pd mantuvo la SLP independientemente de la refractariedad a lenalidomida y/o bortezomib4,5 (SLP ITT= 11,5 meses; y SLP en refractarios a lenalidomida= 11,4 meses)
HR, hazard ratio; IC, intervalo de confianza; Pd, pomalidomida y dexametasona; RC, respuesta completa; SLP, supervivencia libre de progresión
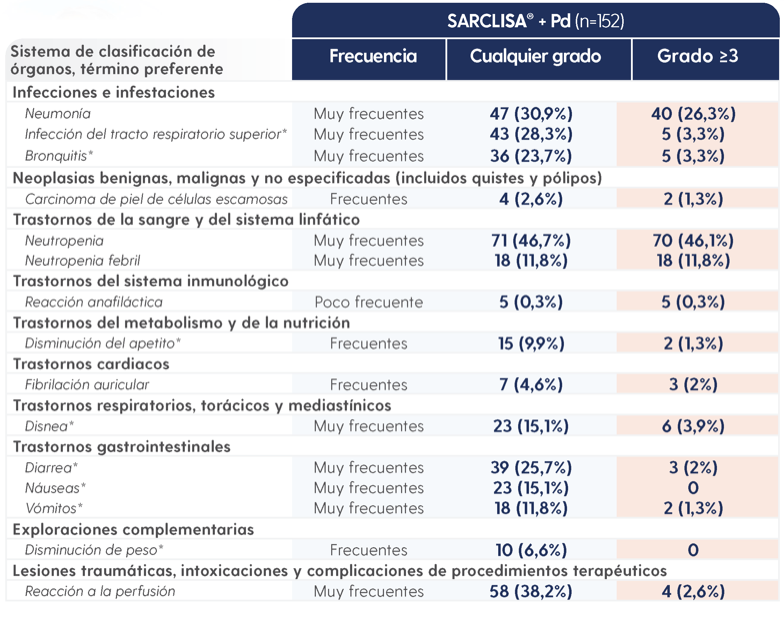
SARCLISA® + Pd se toleró bien y no aumentó las discontinuaciones o los eventos adversos fatales3.
EA notificados en pacientes tratados con SARCLISA® + Pd2.
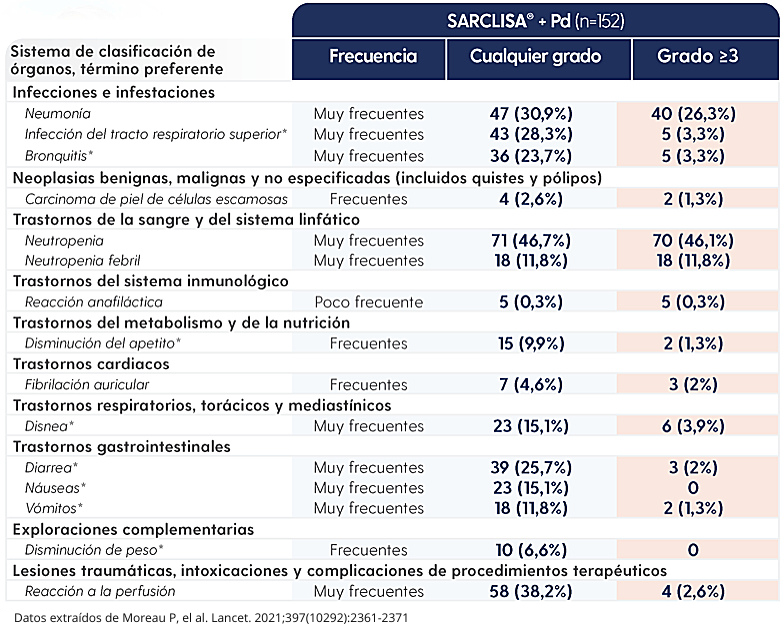
EA, evento adverso; Pd, pomalidomida y dexametasona.

En combinación con Pd (pomalidomida y dexametasona), para el tratamiento de pacientes adultos con MMRR que han recibido al menos dos tratamientos previos, incluyendo lenalidomida y un IP y han demostrado progresión de la enfermedad en el último tratamiento.2
Kd, carfilzomib y dexametasona; MMRR, mieloma múltiple resistente al tratamiento o recidivante; Pd, pomalidomida y dexametasona.

Datos extraídos a partir de Attal M, et al. Lancet. 2019;394(10214):2096–2107.
Primer y único*11,12anti-CD38 financiado con Pd2,3
SARCLISA® + Pd** vs. Pd** en pacientes con MMRR (ICARIA): un estudio fase III, multicéntrico, abierto y aleatorizado3.
*Estado P&R en la página web del Ministerio de Sanidad, Consumo y Bienestar Social (https://www.mscbs.gob.es/ profesionales/medicamentos.do): disponible en nomenclátor desde el 1 de mayo 2022.
**A bajas dosis.2
Kd, carfilzomib y dexametasona; MMRR, mieloma múltiple resistente al tratamiento o recidivante; Pd, pomalidomida y dexametasona;

SARCLISA® + Pd es el triplete financiado que incluye mayor número de pacientes refractarios a lenalidomida (94%) y refractarios a un IP (77%) en su estudio fase III5
SARCLISA® + Pd mantuvo la SLP independientemente de la refractariedad a lenalidomida y/o bortezomib4,5 (SLP ITT= 11,5 meses; y SLP en refractarios a lenalidomida= 11,4 meses)
HR, hazard ratio; IC, intervalo de confianza; Pd, pomalidomida y dexametasona; RC, respuesta completa; SLP, supervivencia libre de progresión
SARCLISA® + Pd se toleró bien y no aumentó las discontinuaciones o los eventos adversos fatales3.
EA notificados en pacientes tratados con SARCLISA® + Pd2.

EA, evento adverso; Pd, pomalidomida y dexametasona.

Casos clínicos en Mieloma Múltiple
Consulta en esta sección casos clínicos en mieloma múltiple: experiencias IKEMA en segunda línea

Mieloma de cadenas ligeras con deterioro brusco de la función renal

Eficacia del esquema isa-kd en un paciente con recaída precoz tras la 1L

Pancitopenia posterior al auto-TPH en paciente con MM

Paciente frágil con mieloma múltiple en recaída precoz tras primera línea de tratamiento

Consiguiendo respuesta tras la segunda línea

Tratamiento con isatuximab carfilzomib dexametasona en paciente refractario a lenalidomida

Eficacia de tratamiento con isatuximab-carfilzomib- dexametasona en segunda línea en paciente intolerante a lenalidomida

Paciente candidato a trasplante tratado con VRD + TASP + R mantenimiento

Isatuximab-carfilzomib-dexametasona como estrategia de profundización de respuesta en una paciente anciana con mieloma múltiple con buen perfil de tolerabilidad

Eficacia de isatuximab-carfilzomibdexametasona en una paciente con mieloma múltiple

Mieloma de cadenas ligeras con deterioro brusco de la función renal

Eficacia del esquema isa-kd en un paciente con recaída precoz tras la 1L

Pancitopenia posterior al auto-TPH en paciente con MM

Paciente frágil con mieloma múltiple en recaída precoz tras primera línea de tratamiento

Consiguiendo respuesta tras la segunda línea

Tratamiento con isatuximab carfilzomib dexametasona en paciente refractario a lenalidomida

Eficacia de tratamiento con isatuximab-carfilzomib- dexametasona en segunda línea en paciente intolerante a lenalidomida

Paciente candidato a trasplante tratado con VRD + TASP + R mantenimiento

Isatuximab-carfilzomib-dexametasona como estrategia de profundización de respuesta en una paciente anciana con mieloma múltiple con buen perfil de tolerabilidad

Eficacia de isatuximab-carfilzomibdexametasona en una paciente con mieloma múltiple
Recursos de interés
En este apartado encontrarás todo los recursos necesarios para conocer a fondo la eficacia y seguridad de SARCLISA, así como su manejo.
.jpg)
Guía de manejo clínico de SARCLISA® en el tratamiento del Mieloma Múltiple
.jpg)
SARCLISA®: Guía de dosificación y administración
.jpg)
IKEMA Carrier
.jpg)
Estudio IKEMA
.jpg)
ICARIA Carrier
.jpg)
Estudio ICARIA
.jpg)
Guía de manejo clínico de SARCLISA® en el tratamiento del Mieloma Múltiple
.jpg)
SARCLISA®: Guía de dosificación y administración
.jpg)
IKEMA Carrier
.jpg)
Estudio IKEMA
.jpg)
ICARIA Carrier
.jpg)
Estudio ICARIA
Congresos
Descarga los pósteres de congresos y explora los resultados de estudios de vida real y ensayos clínicos

Novedades del Congreso IMS 2024

Pósteres: Congreso EHA 2023

Novedades del congreso ASH 2023

Novedades del Congreso IMS 2024

Pósteres: Congreso EHA 2023

Novedades del congreso ASH 2023
Contenido mínimo de Sarclisa®
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
|
MEDICAMENTO |
INDICACIONES |
¿FINANCIADO POR SNS? |
PRECIO / REGIMEN DE PRESCRIPCIÓN Y DISPENSACIÓN / CONDICIONES DE FINANCIACIÓN |
|---|---|---|---|
|
SARCLISA 20 mg/ml concentrado para solución para perfusión – 1 vial de 5 ml (CN: 728802.2) |
1. En combinación con pomalidomida y dexametasona, para el tratamiento de pacientes adultos con mieloma múltiple resistente al tratamiento o recidivante que han recibido al menos dos tratamientos previos, incluyendo lenalidomida y un inhibidor del proteosoma y han demostrado progresión de la enfermedad en el último tratamiento. |
SÍ |
(CN: 728802.2): PVP notificado: 894,02€. PVP IVA notificado: 929,78€. |
|
2. En combinación con carfilzomib y dexametasona, para el tratamiento de pacientes adultos con mieloma múltiple que han recibido al menos un tratamiento previo. | |||
|
3. En combinación con bortezomib, lenalidomida y dexametasona, para el tratamiento de pacientes adultos con mieloma múltiple de nuevo diagnóstico que no son elegibles para trasplante autólogo de células madre. | |||
|
4. En combinación con bortezomib, lenalidomida y dexametasona, para el tratamiento de inducción de pacientes adultos con mieloma múltiple de nuevo diagnóstico que son elegibles para trasplante autólogo de células madre. |
NO |
(CN: 728802.2): PVP notificado: 894,02€. PVP IVA notificado: 929,78€. |
CONSULTE LA FICHA TÉCNICA COMPLETA ANTES DE PRESCRIBIR ESTE MEDICAMENTO.
1. Nombre del medicamento
SARCLISA 20 mg/ml concentradopara solución para perfusión.
2. Composición cualitativa y cuantitativa
Un ml de concentrado para solución para perfusión contiene 20 mg de isatuximab. Cada vial contiene 100 mg de isatuximab en 5 ml deconcentrado (100 mg/5 ml). Cada vial contiene 500 mg de isatuximab en 25ml de concentrado (500 mg/25 ml). Isatuximab es un anticuerpo monoclonal (mAb) derivado de la inmunoglobulina G1 (IgG1) producido a partir de unalínea celular de mamífero (Ovario de Hámster Chino, CHO).
3. Forma farmacéutica
Concentrado para solución para perfusión. Solución incolora a ligeramenteamarilla, esencialmente libre de partículas visibles.
Referencias
- Block GA, Spiegel DM, Ehrlich J, et al. Effects of sevelamer and calcium on coronary artery calcification in patients new to hemodialysis. Kidney Int. 2005;68(4):1815-24.
- Delmez J, Block G, Robertson J, et al. A randomized, double-blind, crossover design study of sevelamer hydrochloride and sevelamer carbonate in patients on hemodialysis. Clin Nephrol. 2007;68(6):386-91.
- Navarro-González JF, Mora-Fernández C, Muros de Fuentes M, et al. Effect of Phosphate Binders on Serum Inflammatory Profile, Soluble CD14, and Endotoxin Levels in Hemodialysis Patients. Clin J Am Soc Nephrol. 2011;6(9):2272–9.
- Rastogi A. Sevelamer revisited: pleiotropic effects on endothelial and cardiovascular risk factors in chronic kidney disease and end-stage renal disease. Ther Adv Cardiovasc Dis. 2013;7(6):322–42.
- Vlassara H, Uribarri J, Cai W, et al. Effects of sevelamer on HbA1c, inflammation, and advanced glycation end products in diabetic kidney disease. Clin J Am Soc Nephrol. 2012;7(6):934-42.
- Floege J, Covic A, Ketteler M, et al. A phase III study of the efficacy and safety of a novel iron-based phosphate binder in dialysis patients. Kidney Int. 2014;86(3):638-47.
- Chiu YW, Teitelbaum I, Misra M, de Leon EM, Adzize T, Mehrotra R. Pill burden, adherence, hyperphosphatemia, and quality of life in maintenance dialysis patients. Clin J Am Soc Nephrol. 2009;4(6):1089–1096.
- Álvarez R, Berni A, Moragrega B, Moreno R, Blasco A, Pérez J. Experiencia con carbonato de sevelámero (sobres) en las unidades de diálisis [Experience with sevelamer carbonate (sachets) in dialysis units]. Diálisis y Trasplante. 2013;34(1):7-13.
- Plone MA, Petersen JS, Rosenbaum DP, et al. Sevelamer, a phosphate-binding polymer, isa non-absorbed compound. Clin Pharmacokinet. 2002;41(7):517-23.
- Frazão JM, Adragão T. Non-calcium-containing phosphate binders: comparing efficacy, safety, and other clinical effects. Nephron Clin Pract. 2012;120 (2):c108-19.
- Ketteler M, Rix M, Fan S, Pritchard N, et al. Efficacy and tolerability of sevelamer carbonate in hyperphosphatemic patients who have chronic kidney disease and are not on dialysis. Clin J Am Soc Nephrol. 2008;3(4):1125-30.
- Ficha técnica OSVAREN®. Marzo 2017.
- Di Iorio B, BellasiA, Russo D. Mortality in kidney disease patients treated with phosphate binders: a randomized study. Clin J Am Soc Nephrol. 2012;7(3):487-93. 14. Di Iorio B, Molony D, Bell C, et al. Sevelamer versus calcium carbonate in incident hemodialysis patients: results of an open-label 24-month randomized clinical trial. Am J Kidney Dis. 2013;62(4):771-8. 15. Ficha técnica de RENVELA®. Enero 2020.


