SARCLISA® + VRd para pacientes MMND no elegibles para trasplante:1
El primer tratamiento anti-CD38 + VRd en MMND no elegibles para trasplante.1,2
SARCLISA está indicado en combinación con bortezomib, lenalidomida y dexametasona, para el tratamiento de pacientes adultos con mieloma múltiple activo de diagnóstico reciente no elegibles a trasplante (TAMO).3
Diseño del Estudio IMROZ
SARCLISA: estudio de fase 3, abierto, aleatorizado, multicéntrico y evaluado en 446 pacientes con anti-CD38 + VRd3
IMROZ comparó SARCLISA + VRd frente a VRd, solo en pacientes con MMND no elegibles para trasplante
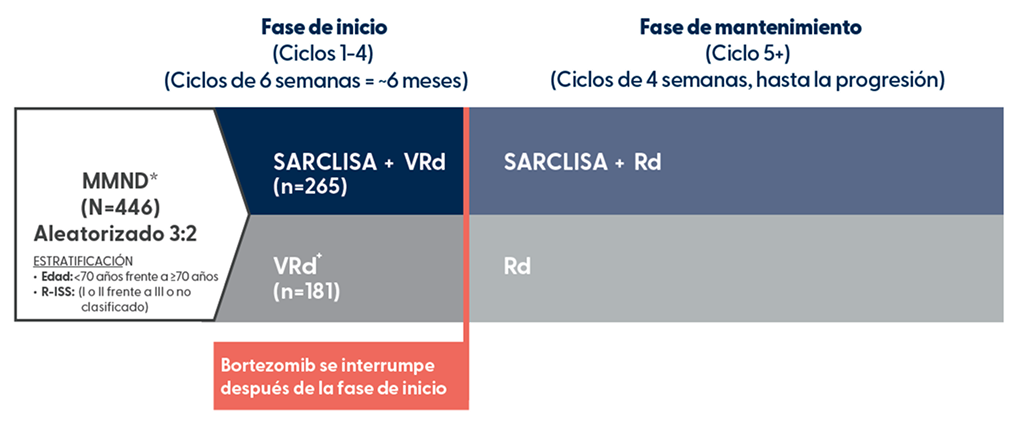
Criterio de valoración principal: SLP3
Criterios de valoración secundarios clave: RC, EMR en MBRP y SG
Características clave de los pacientes:
- En el grupo de SARCLISA + VRd, la mediana de la edad fue de 72 años.
- El 3 % de los pacientes eran <65 años, el 71 % tenía entre 65 y 74 años y el 26 % tenía ≥75 años.
- El estado funcional según el ECOG fue de 0 o 1 para el 89 % de los pacientes >1 para el 11 % de los pacientes.
- Al inicio del estudio, la composición de los pacientes por R-ISS fue la siguiente: 88% para las etapas I y II, 11% para la etapa III y el 1% no clasificado. El 15% de los pacientes tuvo un alto riesgo citogenético y el 7% tuvo un riesgo cromosómico alto y 1q21+, mientras que el 78 % fueron de riesgo estándar.
Las características de los pacientes fueron similares entre los 2 grupos de tratamiento.
* El análisis intermedio de SLP se realizó después de que ocurrieron 162 eventos de progresión de la enfermedad o muerte (73 % de los 222 eventos planificados para el análisis final).3
+En la fase de mantenimiento, los pacientes aleatorizados al grupo VRd que experimentaron progresión durante el período de tratamiento con Rd puede cruzarse para recibir SARCLISA + Rd.3
Eficacia de SARCLISA + VRd
SARCLISA+VRd: un nuevo punto de referencia para la eficacia
Supervivencia libre de progresión superior — la adición de SARCLISA al esquema VRd redujo significativamente el riesgo de progresión o muerte en un 40,4 % en comparación con VRd solo3-6
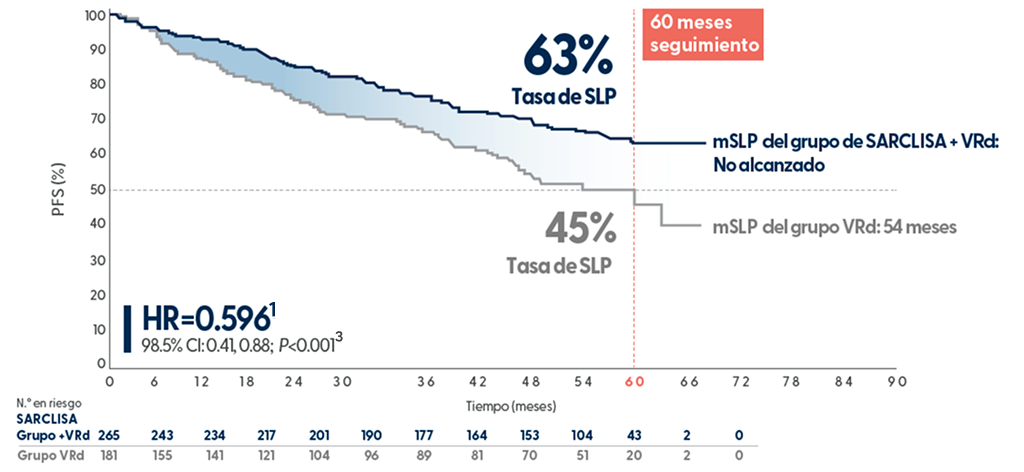
Extraído de N Engl J Med. 2024 Oct 31;391(17):1597-1609
Se observó una tasa de supervivencia libre de progresión (SLP) a 5 años más alta con SARCLISA + VRd frente a VRd solo, en pacientes con mieloma múltiple recién diagnosticado no candidatos a trasplante, con un seguimiento medio de 60 meses3.
Con esta tendencia, la mSLP estimada para la combinación SARCLISA® + VRd es de ~90 meses (7,5 años)5
Los pacientes lograron altas tasas de respuestas profundas con SARCLISA + VRd
Con SARCLISA + VRd, la tasa de respuesta completa (RC) fue del 75 %, siendo superior a la obtenida con VRd solo.3
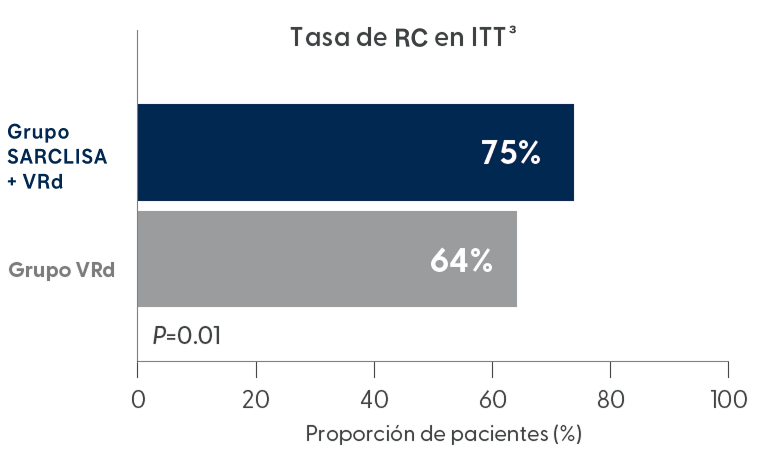
Extraído de N Engl J Med. 2024 Oct 31;391(17):1597-1609
3 de cada 4 pacientes lograron respuesta completa (RC) con SARCLISA + VRd3
- TRO: 91 % con SARCLISA + VRd vs 92 % con VRd3
- ≥RPMB: 89 % con SARCLISA + VRd vs 83 % con VRd3
- La diferencia en ≥RPMG no fue estadísticamente significativa3
Respuestas rápidas, profundas y sostenidas en el tiempo con SARCLISA+VRd
Altas tasas de negatividad y negatividad sostenida de EMR observadas en pacientes con mieloma múltiple recién diagnosticado no candidatos a trasplante en primera línea (1L)1
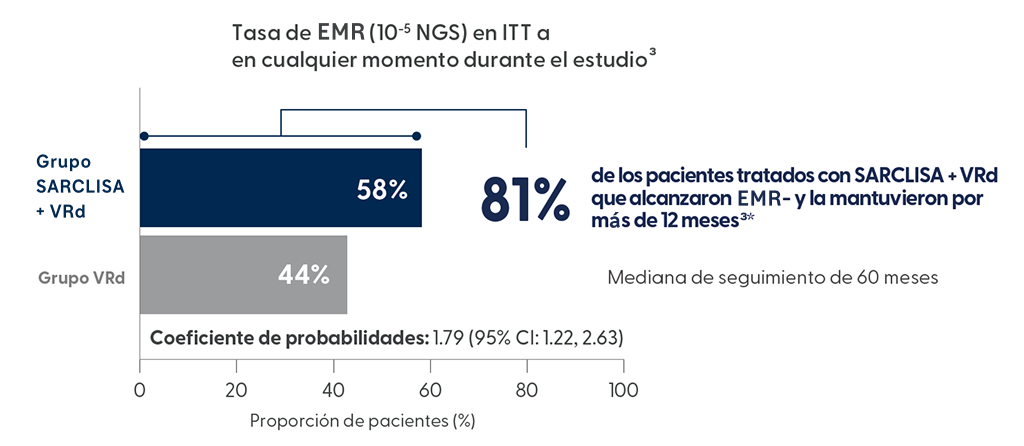
Extraído de N Engl J Med. 2024 Oct 31;391(17):1597-1609
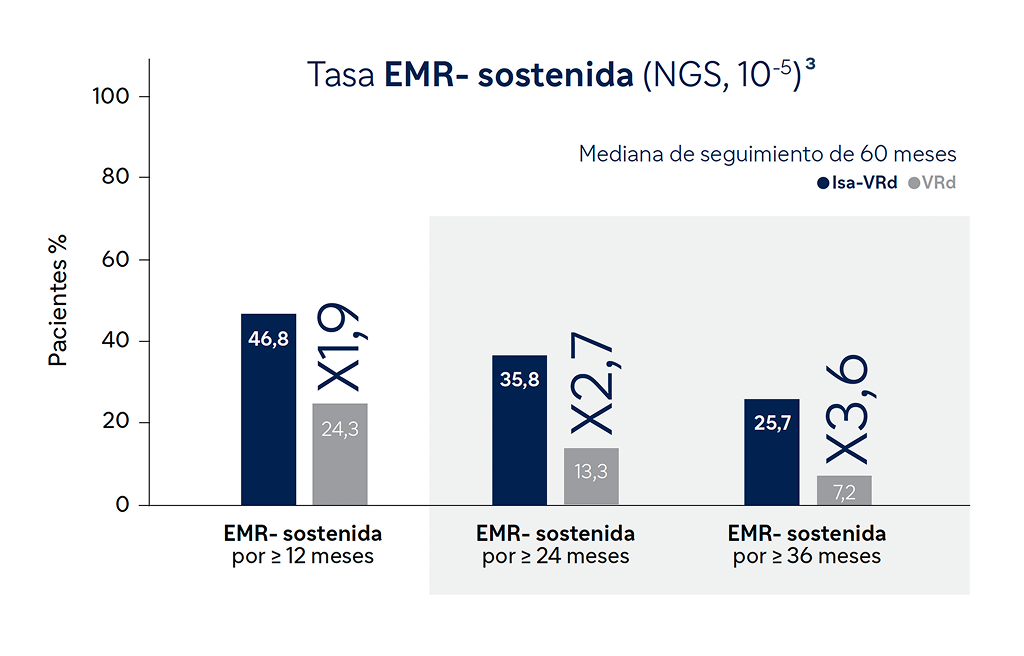
Extraído de Orlowski RZ, et al. ASH 2024; Abstract 770

El 58% de los pacientes alcanzaron la EMR- con SARCLISA + VRd3
En el seguimiento medio de 60 meses
Con SARCLISA+VRd la mediana de EMR- se alcanzó en la mitad de tiempo que con VRd (14,7 vs 32,8 meses) y la proporción de pacientes que mantuvieron tasas de negatividad sostenida durante ≥36 meses fue hasta 3,6 veces superior (25,7% Isa-VRd vs 7,2% VRd)7
Supervivencia global
Se observó una tendencia favorable en la supervivencia global (SG) para SARCLISA + VRd, con una reducción del riesgo del 22 % frente a VRd solo3
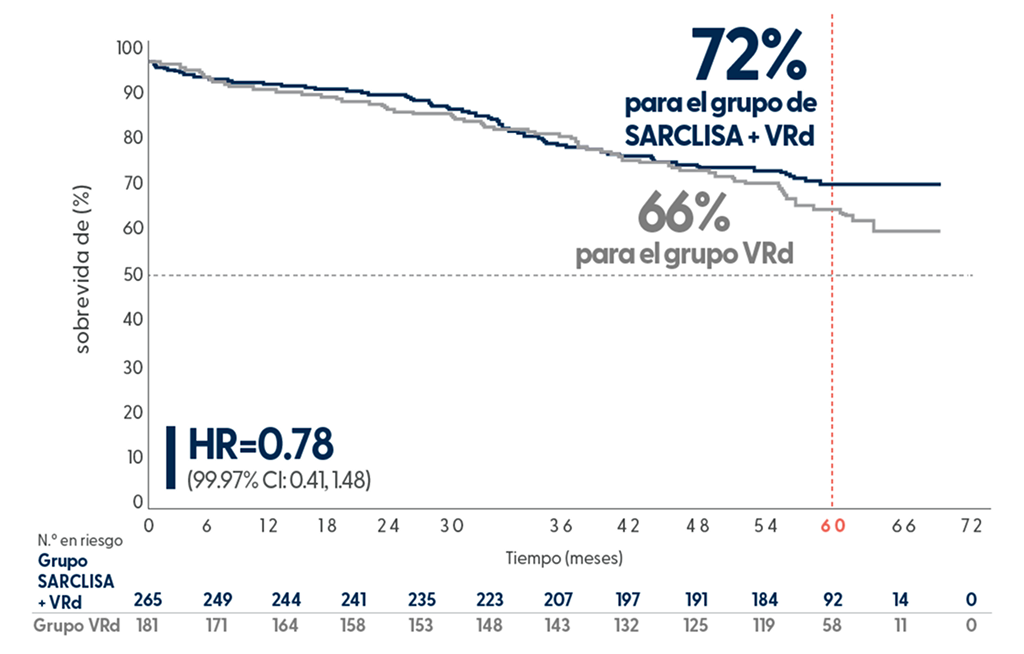
Extraído de N Engl J Med. 2024 Oct 31;391(17):1597-1609
En el seguimiento medio de 60 meses, la supervivencia global estimada fue del 72 % en los pacientes tratados con SARCLISA + VRd, frente al 66 % en el grupo control.3
Los resultados de supervivencia global (SG) provienen de un análisis intermedio, aún no están maduros y no han alcanzado significación estadística en este momento.3
En la fase de mantenimiento, los pacientes asignados aleatoriamente al grupo VRd que presentaron progresión de la enfermedad durante el periodo de tratamiento con Rd pueden pasar al grupo SARCLISA + Rd.3
SARCLISA+VRd: un nuevo punto de referencia para la eficacia
Supervivencia libre de progresión superior — la adición de SARCLISA al esquema VRd redujo significativamente el riesgo de progresión o muerte en un 40,4 % en comparación con VRd solo3-6

Extraído de N Engl J Med. 2024 Oct 31;391(17):1597-1609
Se observó una tasa de supervivencia libre de progresión (SLP) a 5 años más alta con SARCLISA + VRd frente a VRd solo, en pacientes con mieloma múltiple recién diagnosticado no candidatos a trasplante, con un seguimiento medio de 60 meses3.
Con esta tendencia, la mSLP estimada para la combinación SARCLISA® + VRd es de ~90 meses (7,5 años)5
Los pacientes lograron altas tasas de respuestas profundas con SARCLISA + VRd
Con SARCLISA + VRd, la tasa de respuesta completa (RC) fue del 75 %, siendo superior a la obtenida con VRd solo.3

Extraído de N Engl J Med. 2024 Oct 31;391(17):1597-1609
3 de cada 4 pacientes lograron respuesta completa (RC) con SARCLISA + VRd3
- TRO: 91 % con SARCLISA + VRd vs 92 % con VRd3
- ≥RPMB: 89 % con SARCLISA + VRd vs 83 % con VRd3
- La diferencia en ≥RPMG no fue estadísticamente significativa3
Respuestas rápidas, profundas y sostenidas en el tiempo con SARCLISA+VRd
Altas tasas de negatividad y negatividad sostenida de EMR observadas en pacientes con mieloma múltiple recién diagnosticado no candidatos a trasplante en primera línea (1L)1

Extraído de N Engl J Med. 2024 Oct 31;391(17):1597-1609

Extraído de Orlowski RZ, et al. ASH 2024; Abstract 770

El 58% de los pacientes alcanzaron la EMR- con SARCLISA + VRd3
En el seguimiento medio de 60 meses
Con SARCLISA+VRd la mediana de EMR- se alcanzó en la mitad de tiempo que con VRd (14,7 vs 32,8 meses) y la proporción de pacientes que mantuvieron tasas de negatividad sostenida durante ≥36 meses fue hasta 3,6 veces superior (25,7% Isa-VRd vs 7,2% VRd)7
Supervivencia global
Se observó una tendencia favorable en la supervivencia global (SG) para SARCLISA + VRd, con una reducción del riesgo del 22 % frente a VRd solo3

Extraído de N Engl J Med. 2024 Oct 31;391(17):1597-1609
En el seguimiento medio de 60 meses, la supervivencia global estimada fue del 72 % en los pacientes tratados con SARCLISA + VRd, frente al 66 % en el grupo control.3
Los resultados de supervivencia global (SG) provienen de un análisis intermedio, aún no están maduros y no han alcanzado significación estadística en este momento.3
En la fase de mantenimiento, los pacientes asignados aleatoriamente al grupo VRd que presentaron progresión de la enfermedad durante el periodo de tratamiento con Rd pueden pasar al grupo SARCLISA + Rd.3
Seguridad de SARCLISA + VRd
SARCLISA + VRd: mostró un perfil de seguridad en general manejable y acorde con el perfil de seguridad de cada uno de los fármacos del esquema de manera individual.3,6
Mediana de la duración del tratamiento:3

Dado que la mediana de la duración de la exposición fue más prolongada en el grupo de SARCLISA + VRd (53,2 meses)
que en el grupo de VRd (31,3 meses), la incidencia de AAET se evaluó en función de la duración de la exposición.
Descripción general de seguridad: tasa de eventos por paciente por año:3,6
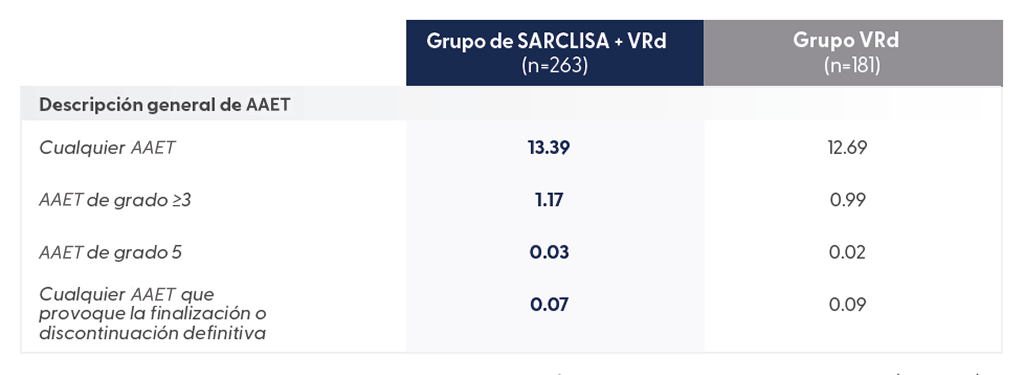
Extraído de N Engl J Med. 2024 Oct 31;391(17):1597-1609
Las tasas de incidencia ajustadas por exposición sugieren la diferencia en la incidencia de AAET serios (grado≥3)
y los AAET de grado 5 entre los grupos se debieron en gran medida a la diferencia en la exposición al tratamiento.
SARCLISA: no se encontraron nuevas señales de seguridad cuando se agregó a VRd3
Eventos adversos derivados del tratamiento que ocurrieron en ≥20 % de los pacientes en el grupo de SARCLISA + VRd3
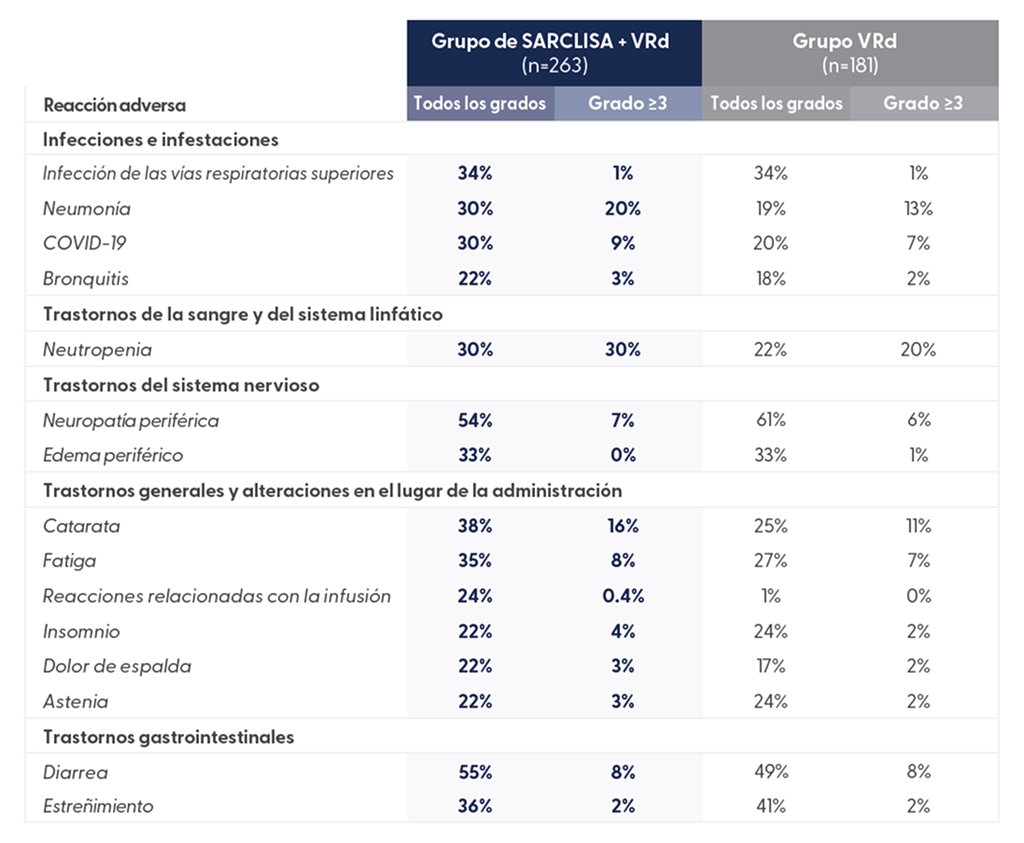
Extraído de N Engl J Med. 2024 Oct 31;391(17):1597-1609
Los AAET listados bajo neumonía excluyen la neumonía relacionada con COVID-19. Los AAET listados bajo COVID-19 combinan infección por COVID-19 más neumonía por COVID-19.
- Se observaron acontecimientos adversos adicionales, incluyendo neutropenia (30,0 %) como reacción adversa en el brazo activo del estudio IMROZ1.
- Los AAET de grado 5 fueron del 11 % para SARCLISA + VRd vs 5,5 % para VRd solo3
- Estos AAET de grado 5 se debieron principalmente a infecciones (7 % en pacientes con SARCLISA + VRd, 4 % con VRd), incluyendo COVID-19 (3 % para SARCLISA + VRd y 1 % para VRd)3
- La neuropatía periférica de grado 3 o 4 fue comparable entre ambos brazos3
- Las interrupciones del tratamiento debidas a acontecimientos adversos fueron similares entre grupos: 23 % para SARCLISA + VRd y 26 % para VRd3
SARCLISA + VRd fue bien tolerado y el perfil de seguridad se mantiene consistente con la seguridad conocida de cada uno de los fármacos del esquema de manera individual.3
Posología y pauta de administración de SARCLISA + VRd
La dosis recomendada de SARCLISA es de 10 mg/kg, administrada mediante perfusión intravenosa (IV) en combinación con VRd. SARCLISA se administra con un volumen de dilución fijo de 250 mL, en combinación con bortezomib, lenalidomida y dexametasona (VRd).1
Detalles del ciclo para SARCLISA® + VRd
En combinación con bortezomib, lenalidomida, y dexametasona1

Los ciclos 2 a 4 son de 6 semanas; los ciclos 5 y posteriores son de 4 semanas cada uno.
SARCLISA: 10mg/kg
Pauta de administración de VRd1
Inicio: ciclos de 42 días
- V 1,3 mg/m² (SC): días 1, 4, 8, 11, 22, 25, 29, 32
- R 25 mg (VO): días 1-14 y 22-35
- d 20 mg (VO o IV): días 1, 2, 4, 5, 8, 9, 11, 12, 15, 22, 23, 25, 26, 29, 30, 32, 33*
Periodo de tratamiento de mantenimiento: ciclos de 28 días
- R 25 mg (VO): días 1-21
- d 20 mg (VO o IV): días 1, 8, 15 y 22*
Nota: La escalada de dosis debe realizarse solo si no se presentan reacciones a la perfusión. Se recomienda realizar premedicación* antes de la perfusión de SARCLISA con los siguientes medicamentos para reducir el riesgo y la gravedad de las reacciones a la perfusión:
- Dexametasona 40 mg por vía oral o IV (o 20 mg por vía oral o IV para pacientes ≥75 años)
- Paracetamol (acetaminofén) 650 a 1000 mg por vía oral (o equivalente)
- Difenhidramina 25 a 50 mg IV o por vía oral (o equivalente [por ejemplo, cetirizina, prometazina, dexbromfeniramina])
Se prefiere la vía IV para la difenhidramina al menos en las primeras 4 perfusiones.
SARCLISA se debe administrar por un profesional sanitario, en un entorno donde se disponga de instalaciones para la reanimación.
*Premedicación: Prevención de las reacciones a la perfusión
Se debe administrar premedicación antes de la perfusión de SARCLISA con los siguientes medicamentos para reducir el riesgo y la gravedad de las reacciones a la perfusión:1
- Dexametasona 40 mg oral o intravenosa (o 20 mg oral o intravenosa para pacientes ≥75 años): cuando se administra en combinación con isatuximab y pomalidomida. Dexametasona 20 mg (vía intravenosa los días de perfusiones de isatuximab y/o carfilzomib, y oral los demás días): cuando se administra en combinación con isatuximab y carfilzomib.
- Dexametasona 20 mg (vía intravenosa los días de perfusión de isatuximab y oral los demás días): cuando se administra en combinación con isatuximab, bortezomib y lenalidomida.
- Montelukast 10 mg oral (o equivalente), al menos en el ciclo 1.

Contenido mínimo de Sarclisa®
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
|
MEDICAMENTO |
INDICACIONES |
¿FINANCIADO POR SNS? |
PRECIO / REGIMEN DE PRESCRIPCIÓN Y DISPENSACIÓN / CONDICIONES DE FINANCIACIÓN |
|---|---|---|---|
|
SARCLISA 20 mg/ml concentrado para solución para perfusión – 1 vial de 5 ml (CN: 728802.2) |
1. En combinación con pomalidomida y dexametasona, para el tratamiento de pacientes adultos con mieloma múltiple resistente al tratamiento o recidivante que han recibido al menos dos tratamientos previos, incluyendo lenalidomida y un inhibidor del proteosoma y han demostrado progresión de la enfermedad en el último tratamiento. |
SÍ |
(CN: 728802.2): PVP notificado: 894,02€. PVP IVA notificado: 929,78€. |
|
2. En combinación con carfilzomib y dexametasona, para el tratamiento de pacientes adultos con mieloma múltiple que han recibido al menos un tratamiento previo. | |||
|
3. En combinación con bortezomib, lenalidomida y dexametasona, para el tratamiento de pacientes adultos con mieloma múltiple de nuevo diagnóstico que no son elegibles para trasplante autólogo de células madre. | |||
|
4. En combinación con bortezomib, lenalidomida y dexametasona, para el tratamiento de inducción de pacientes adultos con mieloma múltiple de nuevo diagnóstico que son elegibles para trasplante autólogo de células madre. |
NO |
(CN: 728802.2): PVP notificado: 894,02€. PVP IVA notificado: 929,78€. |
CONSULTE LA FICHA TÉCNICA COMPLETA ANTES DE PRESCRIBIR ESTE MEDICAMENTO.
Abreviaturas
1L = primera línea; AAET = acontecimiento adverso emergente del tratamiento; CI = intervalo de confianza; d = dexametasona; EMR = enfermedad mínima residual; EMR- = enfermedad mínima residual negativa; ITT = intención de tratar; IV = intravenosa; MBRP = muy buena respuesta parcial; MMND = mieloma múltiple nuevo diagnóstico; MMRD = mieloma múltiple recién diagnosticado; NGS = secuenciación de nueva generación; RC = respuesta completa; R = lenalidomida; SC = subcutánea; SG = supervivencia global; SLP = supervivencia libre de progresión; TAMO = Trasplante autólogo de médula ósea; TRO = tasa de respuesta objetiva; V = bortezomib; VO = vía oral; VRd = bortezomib, lenalidomida y dexametasona; ≥RPMG = respuesta parcial muy buena o superior; mSLP = mediana de supervivencia libre de progresión.
Referencias
- Ficha técnica de SARCLISA, Junio 2025 https://cima.aemps.es/cima/publico/detalle.html?nregistro=1201435001
- Ficha técnica DARZALEX®, Junio 2025 https://cima.aemps.es/cima/publico/detalle.html?nregistro=1161101001
- Facon T, Dimopoulos MA, Leleu XP, et al. Isatuximab, bortezomib, lenalidomide, and dexamethasone for multiple myeloma. N Engl J Med. Published online June 3, 2024. doi:10.1056/NEJMoa2400712
- Killmurray C. Daratumumab shifts approach in newly diagnosed multiple myeloma. Peers Perspectives Oncol. 2023;1(3):91-94.
- REVLIMID, Julio 2025 https://cima.aemps.es/cima/publico/detalle.html?nregistro=07391002
- VELCADE, Julio 2025 https://cima.aemps.es/cima/publico/detalle.html?nregistro=04274001
- Orlowski RZ, et al. ASH 2024; Abstract 770


