
Ofrece a los pacientes resultados que pueden sentir con Dupixent®
La única terapia biológica que actúa directamente sobre la señalización de IL-4 e IL-13 para reducir la inflamación de tipo 2 en la rinosinusitis crónica con pólipos nasales.1-3
Dupixent® está indicado como terapia complementaria con corticoesteroides intranasales para el tratamiento de adultos con rinosinusitis crónica con pólipos nasales grave para quienes la terapia con corticoesteroides sistémicos y/o cirugía no ofrece un control adecuado de la enfermedad.1
Poliposis nasal e inflamación tipo 2
La rinosinusitis crónica con pólipos nasales no es solo una enfermedad obstructiva, es una enfermedad inflamatoria crónica de tipo 2.31
Aproximadamente 9 de cada 10 pacientes con rinosinusitis crónica con pólipos nasales tienen inflamación de tipo 2, un factor subyacente que impulsa complicaciones como la formación de pólipos.4-9
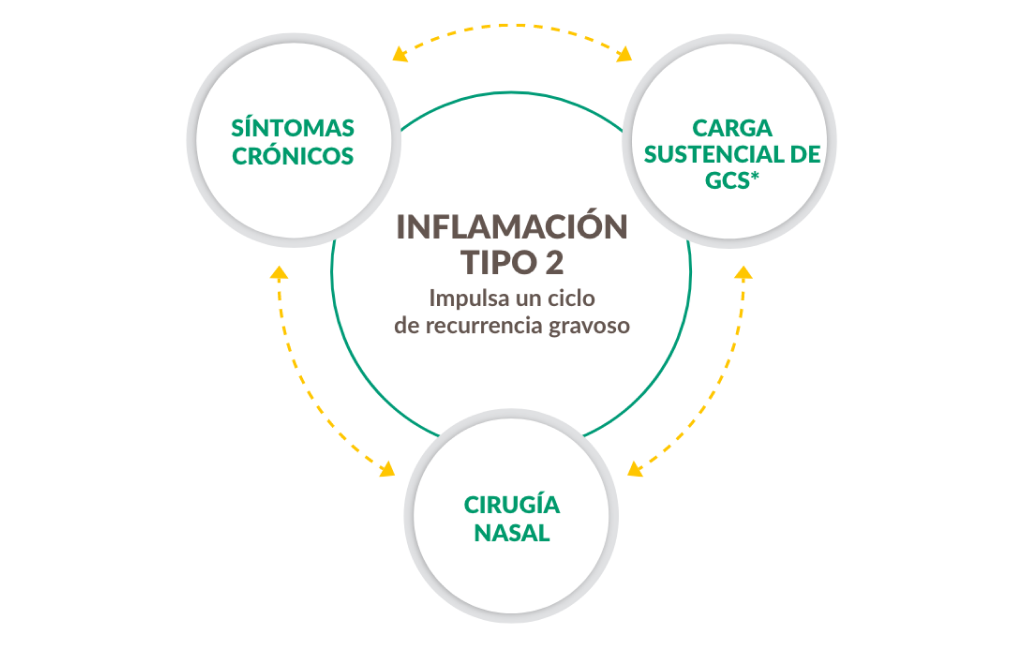
Figura construida con las referencias 4-9.
*Glucocorticoides
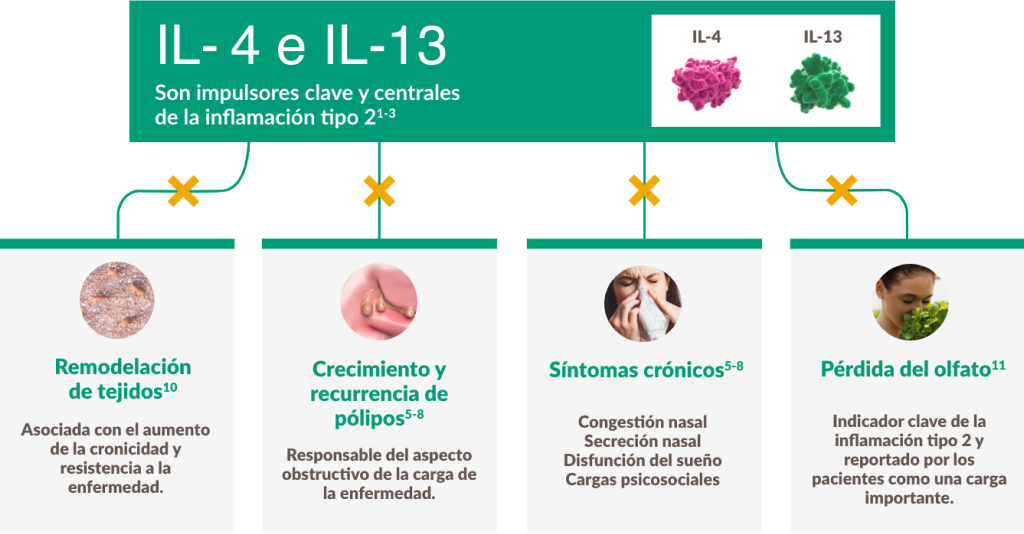
Mecanismo de acción
La rinosinusitis crónica con pólipos nasales no es solo una enfermedad obstructiva, es una enfermedad inflamatoria crónica de tipo 2.31
Dupixent® tiene como objetivo central la inflamación subyacente de tipo 2 en la rinosinusitis crónica con pólipos nasales.
Dupixent® ofrece una mejora constante en los síntomas, independientemente del nivel de eosinófilos en la sangre.32
Datos de Eficacia y Carga de la Enfermedad
Los pacientes recuperaron el olfato a partir del tercer día
Dupixent mejoró la pérdida de olfato (LoS) a partir del Día 3, con una proporción significativamente mayor de pacientes que recuperaron el sentido del olfato (puntuación UPSIT >18) en comparación con placebo en la Semana 24, y sostenido hasta la Semana 52 en pacientes que recibían INCS.1,12-14
Cambio en la puntuación UPSIT hasta la Semana 52 en SINUS-52 (endpoint secundario):
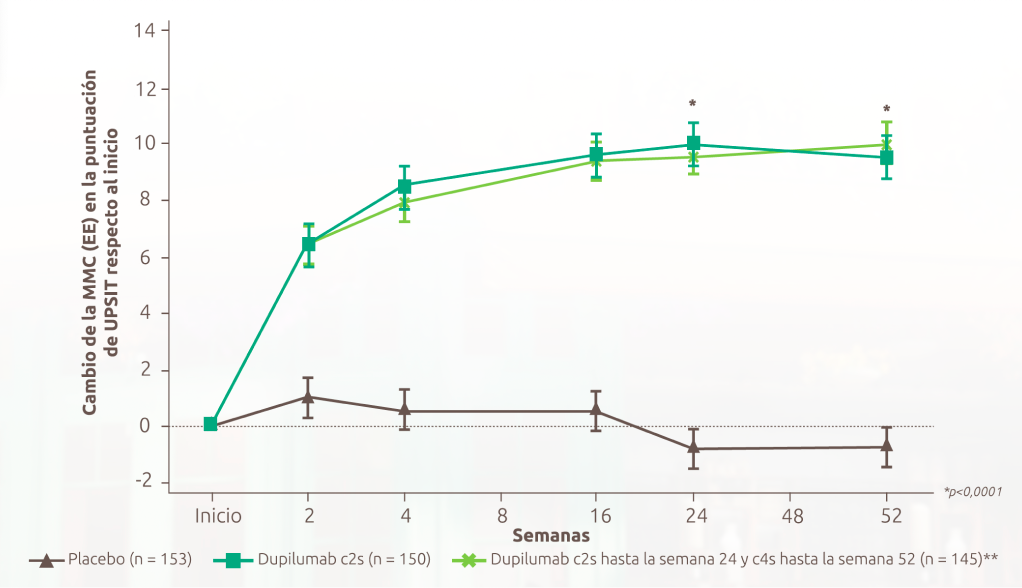
Figura de Bachert C, et al. 2019.13
**La dosis recomendada de dupilumab para pacientes adultos es una dosis inicial de 300 mg seguida de 300 mg c2s.1

2 DE CADA 3 PACIENTES PUDIERON VOLVER A OLER EN LA SEMANA 521,13,b
Mejoras significativas en la puntuación de UPSIT comparado con placebo en la semana 2
Mejoría de 9,53 en la puntuación de UPSIT, en la semana 52 con Dupixent ®14 frente a un empeoramiento de -0,77 con placebo (diferencia de MMC: -10,30 [IC 95 %: 8,50, 12,10])1
La pérdida del olfato es uno de los síntomas más importantes para los pacientes
Aproximadamente 9 de cada 10 pacientes con rinosinusitis crónica con pólipos nasales experimentan pérdida del olfato, lo cual está correlacionado con una mayor gravedad de la enfermedad y puede ser el primer signo en el ciclo de recurrencia de la enfermedad.15-18
Los pacientes recuperaron el olfato a partir del tercer día
Dupixent mejoró la pérdida de olfato (LoS) a partir del Día 3, con una proporción significativamente mayor de pacientes que recuperaron el sentido del olfato (puntuación UPSIT >18) en comparación con placebo en la Semana 24, y sostenido hasta la Semana 52 en pacientes que recibían INCS.1,12-14
La pérdida del olfato está fuertemente asociada con la inflamación tipo 211
La inflamación tipo 2 impacta la diferenciación de las células basales horizontales a las neuronas sensoriales olfativas (OSNs):
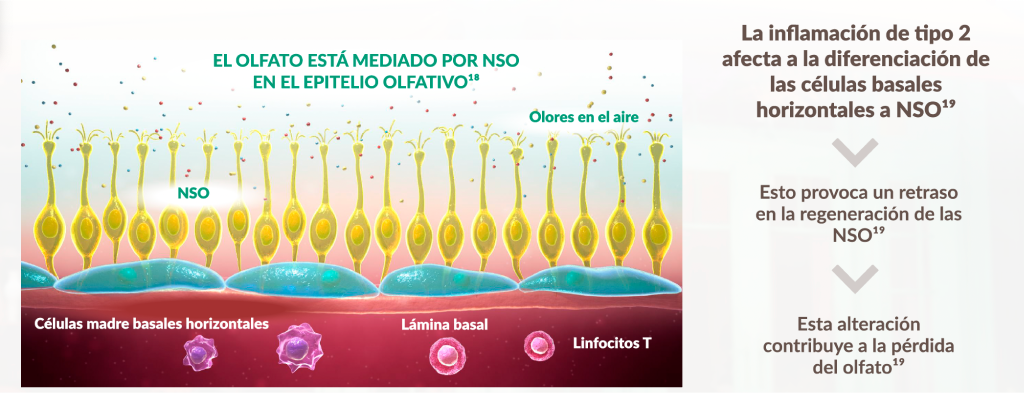
Figura de Yan X, et al. 202015 Chen M, et al. 201916 y Rouyar A, et al. 201917

INHIBIR LOS FACTORES QUE CAUSAN LA INFLAMACIÓN TIPO 2 PUEDE CONTRIBUIR A MEJORAR EL SENTIDO DEL OLFATO.15-18
Mejora rápida de la congestión nasal en el día 2, sostenida durante 52 semanas
Dupixent mejoró la puntuación de congestión nasal (NC) en comparación con el placebo a partir del Día 2, con resultados significativos en la Semana 24 y mantenidos hasta la Semana 52 en pacientes que recibían INCS.¹,¹²,¹³
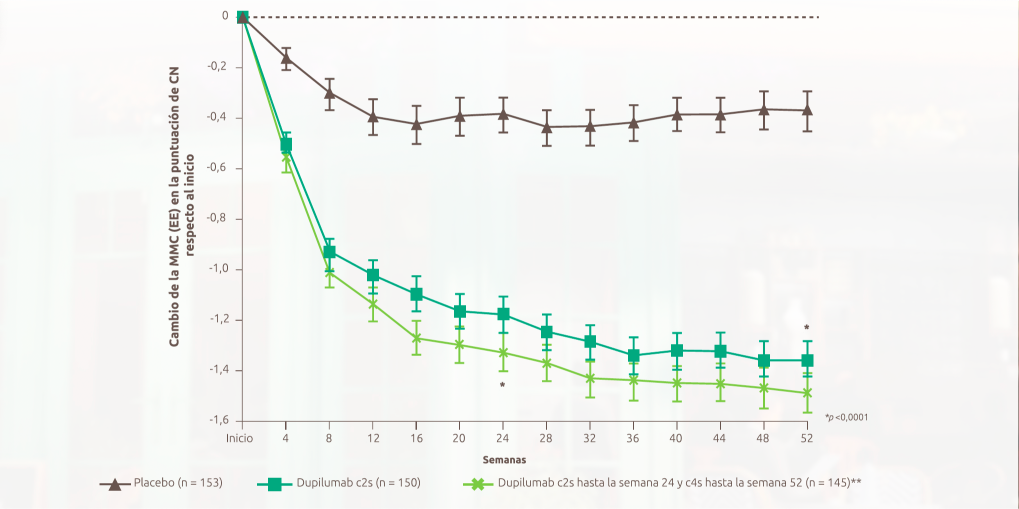
Figura de Bachert C, et al. 2019.13

>50% de mejoría en las semanas 24 y 52 con Dupixent® 300 mg c2s + INCS1,2
Mejoría de -1,35 en la semana 52 (en comparación con una puntuación inicial de 2,48 frente a mejoría de -0,37 con placebo en comparación con una puntuación inicial de 2,38) (diferencia de MMC: -0,98 [IC 95 %: -1,17, -0,79])1,2
La inflamación tipo 2 subyacente puede provocar congestión y reducir la calidad de vida5-9
La congestión nasal impulsa muchas cargas físicas, sociales y psicológicas relacionadas con la rinosinusitis crónica con pólipos nasales.19

Muchos pacientes reportaron frustración con el manejo de sus síntomas.19
-1.25 de mejora en la Semana 24 (punto final coprimario) desde una puntuación inicial de 2.46 con Dupixent 300 mg Q2W + INCS (n=295, brazos combinados de Dupixent) en comparación con -0.38 de mejora desde una puntuación inicial de 2.38 con placebo + INCS (n=153) (diferencia LSM: -0.87 [IC del 95%: -1.03, -0.71]).¹
Menor necesidad de cirugía para la mayoría de los pacientes
Dupixent redujo significativamente la necesidad de cirugía de los senos paranasales en comparación con el placebo durante 52 semanas en pacientes que recibían INCS.¹

83% de reducción en la necesidad de cirugía inicial o repetida de los senos paranasales.
La cirugía puede mantener a los pacientes en un ciclo de recurrencia
A pesar de tratar la obstrucción por pólipos, la cirugía no aborda la inflamación tipo 2 subyacente, que está asociada con la carga de la enfermedad de rinosinusitis crónica con pólipos nasales, incluyendo la formación de nuevos pólipos.20-22

Tabla construida a partir de las referencias 20-22.
Las guías de EPOS y EUFOREA consideran la reducción en la necesidad de cirugía como un criterio de respuesta biológica.²²
El único biológico que reporta una mejora >2 puntos en la puntuación NPS en ensayos fase 31,25,26
Dupixent redujo significativamente el tamaño de los pólipos nasales en comparación con el placebo, medido por la puntuación endoscópica bilateral NP tan pronto como en la Semana 4 y mantenido hasta la Semana 52.1,25,26
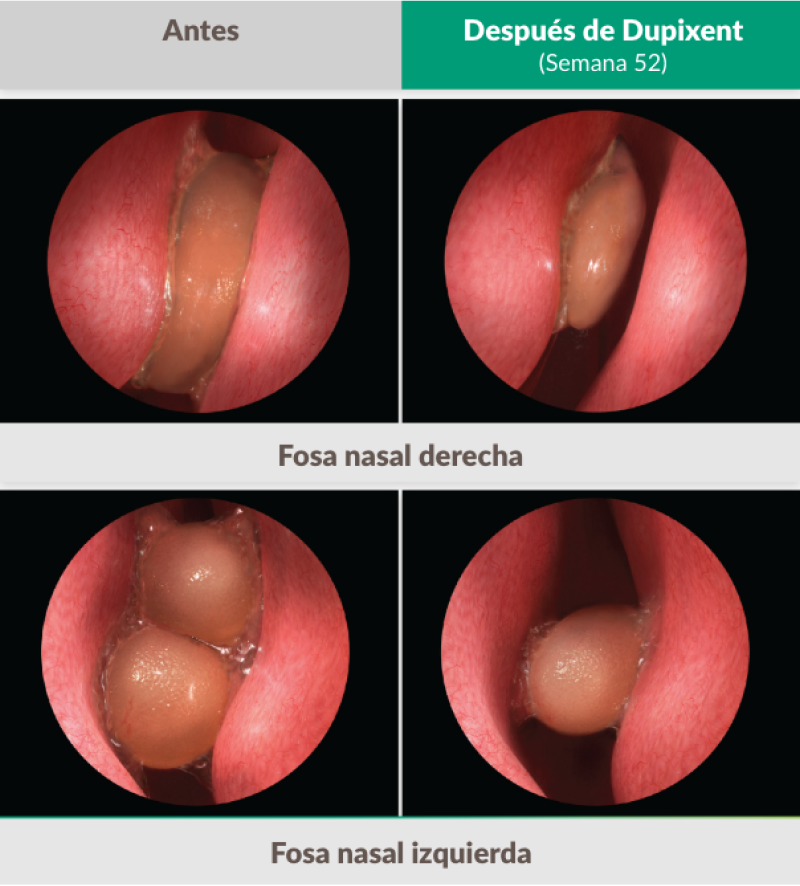
Las fotografías clínicas corresponden a pacientes reales tratados con Dupixent en el ensayo SINUS-52.
Los resultados individuales pueden variar.
Población analizada por ITT.

37% de mejora en la Semana 52
>1.71 de mejora en la Semana 24 (endpoint coprimario)
desde una puntuación inicial de 6.18 con Dupixent 300 mg Q2W + INCS (n=295, brazos combinados de Dupixent) en comparación con un empeoramiento de 0.10 desde una puntuación inicial de 5.96 con placebo + INCS (n=153) (Diferencia LSM: -1.80 [IC del 95%: -2.10, -1.51])
>2.24 de mejora desde una puntuación inicial de 6.07 (punto final secundario)
con Dupixent 300 mg Q2W + INCS (n=150) en comparación con un empeoramiento del 3% con placebo + INCS (n=153) (0.15 desde una puntuación inicial de 5.96) (Diferencia LSM: -2.40 [IC del 95%: -2.77, -2.02])
Los pólipos nasales son una manifestación de rinusitis crónica - la inflamación tipo 2 es una causa subyacente.11,27,28
La puntuación endoscópica bilateral NP puede ayudar a medir la formación y recurrencia de pólipos, los cuales son signos clave de inflamación tipo 2.11,27,28
Una mejora de >2 en la puntuación NP indica un alivio sustancial de la obstrucción.
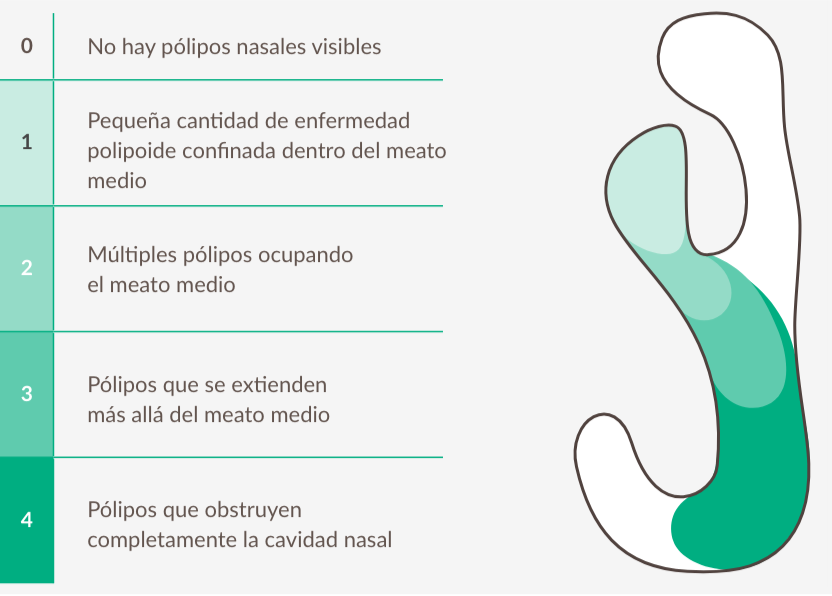
Figura de Ferguson BJ, et al. 2010.13
Actúa sobre la inflamación de tipo 2 para reducir el tamaño de los pólipos nasales y limitar su recurrencia.1,13
Puntuación bilateral de pólipos nasales (NP)
Los lectores ciegos centrales califican los pólipos en las fosas nasales izquierda y derecha, con un rango de 0 a 4, y asignan una puntuación basada en la suma de ambos lados. La puntuación máxima total es 8. Una puntuación más baja indica mejora (pólipos más pequeños).13
Dupixent actúa contra la inflamación tipo 2 para reducir la necesidad de esteroides sistémicos
Dupixent redujo significativamente la necesidad de esteroides sistémicos en comparación con el placebo durante 52 semanas en pacientes que recibían INCS.¹

74% de reducción en la necesidad de uso de corticosteroides sistémicos.
Dupixent reduce o elimina la carga de esteroides independientemente de la cirugía previa
Carga de SCS (corticosteroides sistémicos): EL USO ACUMULATIVO DE ESTEROIDES AGRAVA EL CICLO QUE ENFRENTAN LOS PACIENTES
El tratamiento con SCS afecta ampliamente la inflamación y, incluso su uso a corto plazo, conlleva el riesgo de efectos secundarios graves tanto a corto como a largo plazo.²²⁻²⁴
|
Limitaciones del uso de SCS22-24 |
|
El ICAR-RS no recomienda el uso de SCS para el tratamiento de rinosinusitis crónica con pólipos nasales más de una vez cada 2 años. |
|
Riesgos del uso de SCS |
|
Presión arterial alta |
|
Hiperglucemia |
|
Aumento de peso |
|
Osteoporosis |
|
Cataratas |
|
Glaucoma |
|
Trastornos del sueño |
Las guías de EPOS y EUFOREA consideran la reducción en la necesidad de cirugía como un criterio de respuesta biológica.²²
Actuación contra la inflamación tipo 2 subyacente para ver disminuciones sostenidas en la opacificación de los senos paranasales
Dupixent redujo significativamente la puntuación LMK-CT en comparación con el placebo en la Semana 24, con una mejora aún mayor observada en la Semana 52.¹
El único biológico que reporta resultados LMK-CT en la etiqueta aprobada.1,25,26
> 5.21 de mejora en la Semana 24 desde una puntuación inicial de 18.12 (endpoint secundario)
con Dupixent 300 mg Q2W + INCS (n=295, brazos combinados de Dupixent) en comparación con una mejora de 0.09 (desde una puntuación inicial de 17.65) con placebo + INCS (n=153) (Diferencia LSM: -5.13 [IC del 95%: -5.80, -4.46]).1,16,25
> 6.83 de mejora en la Semana 52 desde una puntuación inicial de 18.42 (endpoint secundario)
con Dupixent 300 mg Q2W + INCS (n=150) en comparación con un empeoramiento de 0.11 desde una puntuación inicial de 17.65 con placebo + INCS (n=153) (Diferencia LSM: -6.94 [IC del 95%: -7.87, -6.01]).1,16,25
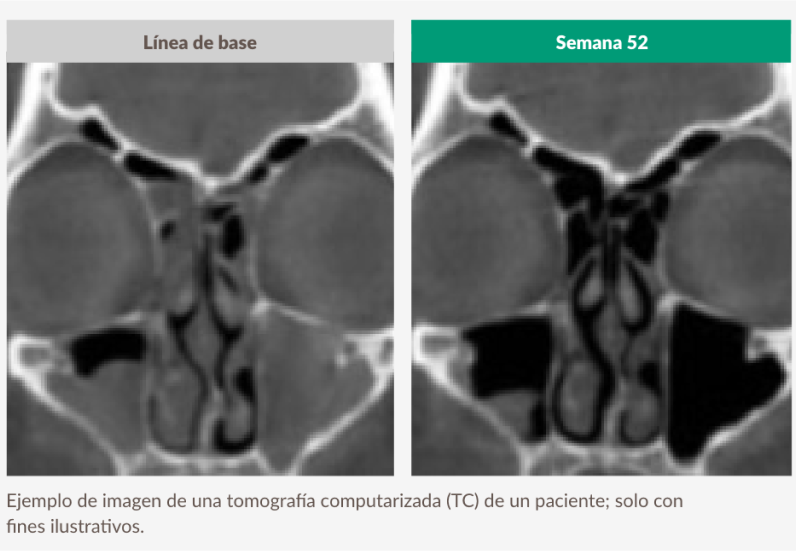
Puntuación de la tomografía computarizada Lund-Mackay (LMK-CT)
El lector evalúa una TC de cada seno y asigna una puntuación de 0 (normal) a 2 (opacificación completa). Para todos los sistemas sinusales (excepto el complejo osteomeatal), la puntuación total es la suma de los senos derechos e izquierdos con un máximo de 24. Una puntuación más baja indica menor opacificación.1,25,26
Dupixent se estudió en el programa de ensayos clínicos más grande para rinosinusitis crónica con pólipos nasales¹a
Se inscribieron pacientes independientemente de cirugías previas o uso de esteroides sistémicos.¹
|
|
SINUS-24 (N=276) 24 Semanas |
SINUS-52 (N=448) 52 Semanas |
|
Ensayo fase 3 aleatorizado |
Dupixent + INCS 300 mg Q2W por 24 semanas (n=143) |
Dupixent + INCS 300 mg Q2W por 52 semanas (n=150)b |
|
Población del estudio |
>Adultos (≥18 años) en tratamiento con INCS con rinosinusitis crónica con pólipos nasales a pesar de cirugía previa de los senos nasales o tratamiento previo con, o que fueron inelegibles para recibir, o intolerantes a, esteroides sistémicos en los últimos 2 añosd | |
~80% de los pacientes inscritos tenían un historial de otras enfermedades inflamatorias tipo 2.1,13
Demografía seleccionada en la línea de base para SINUS-24:13
Hombres: 57%; duración promedio de rinosinusitis crónica con pólipos nasales (DE): 11 (9) años; pacientes con >1 cirugía previa: 72%; pacientes con uso de esteroides sistémicos en los 2 años anteriores: 65%; puntuación endoscópica bilateral promedio de pólipos nasales (DE), rango 0-8: 5.8 (1.3); puntuación total promedio de la TC de senos paranasales LMK (DE), rango 0-24: 19.0 (4.4); puntuación promedio de UPSIT (DE), rango 0-40: 14.6 (8.5); puntuación promedio de pérdida de olfato (AM) (DE), rango 0-3: 2.7 (0.5); puntuación total promedio de SNOT-22 (DE), rango 0-110: 49.4 (20.2).
Demografía seleccionada en la línea de base para SINUS-52:13
Hombres: 62%; duración promedio de rinosinusitis crónica con pólipos nasales(DE): 11 (10) años; pacientes con >1 cirugía previa: 58%; pacientes con uso de esteroides sistémicos en los 2 años anteriores: 80%; puntuación endoscópica bilateral promedio de pólipos nasales (DE), rango 0-8: 6.1 (1.2); puntuación total promedio de la TC de senos paranasales LMK (DE), rango 0-24: 18.0 (3.8); puntuación promedio de UPSIT (DE), rango 0-40: 13.6 (8.0); puntuación promedio de pérdida de olfato (AM) (DE), rango 0-3: 2.8 (0.5); puntuación total promedio de SNOT-22 (DE), rango 0-110: 51.9 (20.9).
a Válido a partir de agosto de 2023.
b En SINUS-52, los datos desde la línea de base hasta la Semana 24 se agrupan en los brazos de tratamiento con Dupixent Q2W (n=295).
c La dosis recomendada de Dupixent para pacientes adultos con rinosinusitis crónica con pólipos nasales es de 300 mg administrados por vía subcutánea cada dos semanas.
d Todos los pacientes en los brazos de placebo y Dupixent recibían una terapia de fondo de INCS, es decir, aerosol nasal de furoato de mometasona.
Los pacientes recuperaron el olfato a partir del tercer día
Dupixent mejoró la pérdida de olfato (LoS) a partir del Día 3, con una proporción significativamente mayor de pacientes que recuperaron el sentido del olfato (puntuación UPSIT >18) en comparación con placebo en la Semana 24, y sostenido hasta la Semana 52 en pacientes que recibían INCS.1,12-14
Cambio en la puntuación UPSIT hasta la Semana 52 en SINUS-52 (endpoint secundario):

Figura de Bachert C, et al. 2019.13
**La dosis recomendada de dupilumab para pacientes adultos es una dosis inicial de 300 mg seguida de 300 mg c2s.1

2 DE CADA 3 PACIENTES PUDIERON VOLVER A OLER EN LA SEMANA 521,13,b
Mejoras significativas en la puntuación de UPSIT comparado con placebo en la semana 2
Mejoría de 9,53 en la puntuación de UPSIT, en la semana 52 con Dupixent ®14 frente a un empeoramiento de -0,77 con placebo (diferencia de MMC: -10,30 [IC 95 %: 8,50, 12,10])1
La pérdida del olfato es uno de los síntomas más importantes para los pacientes
Aproximadamente 9 de cada 10 pacientes con rinosinusitis crónica con pólipos nasales experimentan pérdida del olfato, lo cual está correlacionado con una mayor gravedad de la enfermedad y puede ser el primer signo en el ciclo de recurrencia de la enfermedad.15-18
Los pacientes recuperaron el olfato a partir del tercer día
Dupixent mejoró la pérdida de olfato (LoS) a partir del Día 3, con una proporción significativamente mayor de pacientes que recuperaron el sentido del olfato (puntuación UPSIT >18) en comparación con placebo en la Semana 24, y sostenido hasta la Semana 52 en pacientes que recibían INCS.1,12-14
La pérdida del olfato está fuertemente asociada con la inflamación tipo 211
La inflamación tipo 2 impacta la diferenciación de las células basales horizontales a las neuronas sensoriales olfativas (OSNs):

Figura de Yan X, et al. 202015 Chen M, et al. 201916 y Rouyar A, et al. 201917

INHIBIR LOS FACTORES QUE CAUSAN LA INFLAMACIÓN TIPO 2 PUEDE CONTRIBUIR A MEJORAR EL SENTIDO DEL OLFATO.15-18
Mejora rápida de la congestión nasal en el día 2, sostenida durante 52 semanas
Dupixent mejoró la puntuación de congestión nasal (NC) en comparación con el placebo a partir del Día 2, con resultados significativos en la Semana 24 y mantenidos hasta la Semana 52 en pacientes que recibían INCS.¹,¹²,¹³

Figura de Bachert C, et al. 2019.13

>50% de mejoría en las semanas 24 y 52 con Dupixent® 300 mg c2s + INCS1,2
Mejoría de -1,35 en la semana 52 (en comparación con una puntuación inicial de 2,48 frente a mejoría de -0,37 con placebo en comparación con una puntuación inicial de 2,38) (diferencia de MMC: -0,98 [IC 95 %: -1,17, -0,79])1,2
La inflamación tipo 2 subyacente puede provocar congestión y reducir la calidad de vida5-9
La congestión nasal impulsa muchas cargas físicas, sociales y psicológicas relacionadas con la rinosinusitis crónica con pólipos nasales.19

Muchos pacientes reportaron frustración con el manejo de sus síntomas.19
-1.25 de mejora en la Semana 24 (punto final coprimario) desde una puntuación inicial de 2.46 con Dupixent 300 mg Q2W + INCS (n=295, brazos combinados de Dupixent) en comparación con -0.38 de mejora desde una puntuación inicial de 2.38 con placebo + INCS (n=153) (diferencia LSM: -0.87 [IC del 95%: -1.03, -0.71]).¹
Menor necesidad de cirugía para la mayoría de los pacientes
Dupixent redujo significativamente la necesidad de cirugía de los senos paranasales en comparación con el placebo durante 52 semanas en pacientes que recibían INCS.¹

83% de reducción en la necesidad de cirugía inicial o repetida de los senos paranasales.
La cirugía puede mantener a los pacientes en un ciclo de recurrencia
A pesar de tratar la obstrucción por pólipos, la cirugía no aborda la inflamación tipo 2 subyacente, que está asociada con la carga de la enfermedad de rinosinusitis crónica con pólipos nasales, incluyendo la formación de nuevos pólipos.20-22

Tabla construida a partir de las referencias 20-22.
Las guías de EPOS y EUFOREA consideran la reducción en la necesidad de cirugía como un criterio de respuesta biológica.²²
El único biológico que reporta una mejora >2 puntos en la puntuación NPS en ensayos fase 31,25,26
Dupixent redujo significativamente el tamaño de los pólipos nasales en comparación con el placebo, medido por la puntuación endoscópica bilateral NP tan pronto como en la Semana 4 y mantenido hasta la Semana 52.1,25,26

Las fotografías clínicas corresponden a pacientes reales tratados con Dupixent en el ensayo SINUS-52.
Los resultados individuales pueden variar.
Población analizada por ITT.

37% de mejora en la Semana 52
>1.71 de mejora en la Semana 24 (endpoint coprimario)
desde una puntuación inicial de 6.18 con Dupixent 300 mg Q2W + INCS (n=295, brazos combinados de Dupixent) en comparación con un empeoramiento de 0.10 desde una puntuación inicial de 5.96 con placebo + INCS (n=153) (Diferencia LSM: -1.80 [IC del 95%: -2.10, -1.51])
>2.24 de mejora desde una puntuación inicial de 6.07 (punto final secundario)
con Dupixent 300 mg Q2W + INCS (n=150) en comparación con un empeoramiento del 3% con placebo + INCS (n=153) (0.15 desde una puntuación inicial de 5.96) (Diferencia LSM: -2.40 [IC del 95%: -2.77, -2.02])
Los pólipos nasales son una manifestación de rinusitis crónica - la inflamación tipo 2 es una causa subyacente.11,27,28
La puntuación endoscópica bilateral NP puede ayudar a medir la formación y recurrencia de pólipos, los cuales son signos clave de inflamación tipo 2.11,27,28
Una mejora de >2 en la puntuación NP indica un alivio sustancial de la obstrucción.

Figura de Ferguson BJ, et al. 2010.13
Actúa sobre la inflamación de tipo 2 para reducir el tamaño de los pólipos nasales y limitar su recurrencia.1,13
Puntuación bilateral de pólipos nasales (NP)
Los lectores ciegos centrales califican los pólipos en las fosas nasales izquierda y derecha, con un rango de 0 a 4, y asignan una puntuación basada en la suma de ambos lados. La puntuación máxima total es 8. Una puntuación más baja indica mejora (pólipos más pequeños).13
Dupixent actúa contra la inflamación tipo 2 para reducir la necesidad de esteroides sistémicos
Dupixent redujo significativamente la necesidad de esteroides sistémicos en comparación con el placebo durante 52 semanas en pacientes que recibían INCS.¹

74% de reducción en la necesidad de uso de corticosteroides sistémicos.
Dupixent reduce o elimina la carga de esteroides independientemente de la cirugía previa
Carga de SCS (corticosteroides sistémicos): EL USO ACUMULATIVO DE ESTEROIDES AGRAVA EL CICLO QUE ENFRENTAN LOS PACIENTES
El tratamiento con SCS afecta ampliamente la inflamación y, incluso su uso a corto plazo, conlleva el riesgo de efectos secundarios graves tanto a corto como a largo plazo.²²⁻²⁴
|
Limitaciones del uso de SCS22-24 |
|
El ICAR-RS no recomienda el uso de SCS para el tratamiento de rinosinusitis crónica con pólipos nasales más de una vez cada 2 años. |
|
Riesgos del uso de SCS |
|
Presión arterial alta |
|
Hiperglucemia |
|
Aumento de peso |
|
Osteoporosis |
|
Cataratas |
|
Glaucoma |
|
Trastornos del sueño |
Las guías de EPOS y EUFOREA consideran la reducción en la necesidad de cirugía como un criterio de respuesta biológica.²²
Actuación contra la inflamación tipo 2 subyacente para ver disminuciones sostenidas en la opacificación de los senos paranasales
Dupixent redujo significativamente la puntuación LMK-CT en comparación con el placebo en la Semana 24, con una mejora aún mayor observada en la Semana 52.¹

El único biológico que reporta resultados LMK-CT en la etiqueta aprobada.1,25,26
> 5.21 de mejora en la Semana 24 desde una puntuación inicial de 18.12 (endpoint secundario)
con Dupixent 300 mg Q2W + INCS (n=295, brazos combinados de Dupixent) en comparación con una mejora de 0.09 (desde una puntuación inicial de 17.65) con placebo + INCS (n=153) (Diferencia LSM: -5.13 [IC del 95%: -5.80, -4.46]).1,16,25
> 6.83 de mejora en la Semana 52 desde una puntuación inicial de 18.42 (endpoint secundario)
con Dupixent 300 mg Q2W + INCS (n=150) en comparación con un empeoramiento de 0.11 desde una puntuación inicial de 17.65 con placebo + INCS (n=153) (Diferencia LSM: -6.94 [IC del 95%: -7.87, -6.01]).1,16,25
Puntuación de la tomografía computarizada Lund-Mackay (LMK-CT)
El lector evalúa una TC de cada seno y asigna una puntuación de 0 (normal) a 2 (opacificación completa). Para todos los sistemas sinusales (excepto el complejo osteomeatal), la puntuación total es la suma de los senos derechos e izquierdos con un máximo de 24. Una puntuación más baja indica menor opacificación.1,25,26
Dupixent se estudió en el programa de ensayos clínicos más grande para rinosinusitis crónica con pólipos nasales¹a
Se inscribieron pacientes independientemente de cirugías previas o uso de esteroides sistémicos.¹
|
|
SINUS-24 (N=276) 24 Semanas |
SINUS-52 (N=448) 52 Semanas |
|
Ensayo fase 3 aleatorizado |
Dupixent + INCS 300 mg Q2W por 24 semanas (n=143) |
Dupixent + INCS 300 mg Q2W por 52 semanas (n=150)b |
|
Población del estudio |
>Adultos (≥18 años) en tratamiento con INCS con rinosinusitis crónica con pólipos nasales a pesar de cirugía previa de los senos nasales o tratamiento previo con, o que fueron inelegibles para recibir, o intolerantes a, esteroides sistémicos en los últimos 2 añosd | |
~80% de los pacientes inscritos tenían un historial de otras enfermedades inflamatorias tipo 2.1,13
Demografía seleccionada en la línea de base para SINUS-24:13
Hombres: 57%; duración promedio de rinosinusitis crónica con pólipos nasales (DE): 11 (9) años; pacientes con >1 cirugía previa: 72%; pacientes con uso de esteroides sistémicos en los 2 años anteriores: 65%; puntuación endoscópica bilateral promedio de pólipos nasales (DE), rango 0-8: 5.8 (1.3); puntuación total promedio de la TC de senos paranasales LMK (DE), rango 0-24: 19.0 (4.4); puntuación promedio de UPSIT (DE), rango 0-40: 14.6 (8.5); puntuación promedio de pérdida de olfato (AM) (DE), rango 0-3: 2.7 (0.5); puntuación total promedio de SNOT-22 (DE), rango 0-110: 49.4 (20.2).
Demografía seleccionada en la línea de base para SINUS-52:13
Hombres: 62%; duración promedio de rinosinusitis crónica con pólipos nasales(DE): 11 (10) años; pacientes con >1 cirugía previa: 58%; pacientes con uso de esteroides sistémicos en los 2 años anteriores: 80%; puntuación endoscópica bilateral promedio de pólipos nasales (DE), rango 0-8: 6.1 (1.2); puntuación total promedio de la TC de senos paranasales LMK (DE), rango 0-24: 18.0 (3.8); puntuación promedio de UPSIT (DE), rango 0-40: 13.6 (8.0); puntuación promedio de pérdida de olfato (AM) (DE), rango 0-3: 2.8 (0.5); puntuación total promedio de SNOT-22 (DE), rango 0-110: 51.9 (20.9).
a Válido a partir de agosto de 2023.
b En SINUS-52, los datos desde la línea de base hasta la Semana 24 se agrupan en los brazos de tratamiento con Dupixent Q2W (n=295).
c La dosis recomendada de Dupixent para pacientes adultos con rinosinusitis crónica con pólipos nasales es de 300 mg administrados por vía subcutánea cada dos semanas.
d Todos los pacientes en los brazos de placebo y Dupixent recibían una terapia de fondo de INCS, es decir, aerosol nasal de furoato de mometasona.
Mejoras en la calidad de vida
Los pacientes reportaron una mejora en los síntomas y en la calidad de vida relacionada con la salud
Dupixent disminuyó significativamente la puntuación SNOT-22 en comparación con el placebo tan pronto como en la Semana 4, con mejoras sostenidas hasta las Semanas 24 y 52.¹,¹³
Cambio en la puntuación de SNOT-22 hasta la semana 52 en SINUS-52 (variable secundaria)13
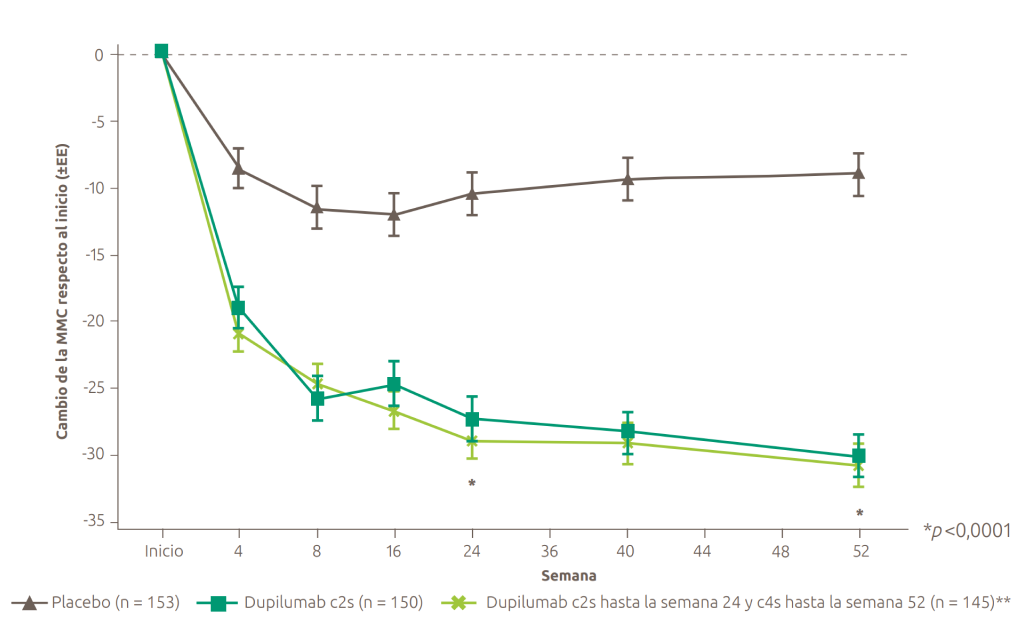
**La dosis recomendada de dupilumab para pacientes adultos es una dosis inicial de 300 mg seguida de 300 mg c2s.1

-29,84 puntos de mejoría en la semana 52 con Dupixent® 300 mg c2s + INCS1,13
El cuestionario SNOT-22 es una evaluación realizada por el paciente que incluye 22 síntomas y consecuencias de la rinosinusitis crónica con pólipos nasales, entre ellos:1,13
- Obstrucción nasal
- Secreción nasal
- Sensación de presión o dolor en el oído
- Estornudos
- Tos
- Pérdida del olfato/sabor
- Dificultad para conciliar el sueño
- Despertares nocturnos
- Fatiga
- Reducción de la productividad y concentración
- Frustración, inquietud e irritabilidad
- Tristeza y vergüenza
c2s: cada 2 semanas; c4s: cada 4 semanas; EE: error estándar; IC: intervalo de confianza; MMC: media de mínimos cuadrados; RSCcPN: rinosinusitis crónica con poliposis nasal; SNOT-22: Cuestionario de Resultados de la Rinosinusitis de 22 preguntas Los pacientes evalúan 22 síntomas y consecuencias de la rinosinusitis crónica con pólipos nasales. La puntuación máxima es de 110. La diferencia clínicamente importante significativa es 8.9. Una puntuación más baja indica una mejor calidad de vida relacionada con la salud.
En pacientes que tienen rinosinusitis crónica con pólipos nasales y asma coexistente,
dupixent mejoró la respiración y la calidad de vida
Dupixent mejoró significativamente la función pulmonar y el control del asma (ACQ-6) al mismo tiempo que mejoraba los resultados en rinosinusitis crónica con pólipos nasales.¹³
Mejoría rápida del FEV1 y mantenida hasta casi 2 años en pacientes con RSCcPN33
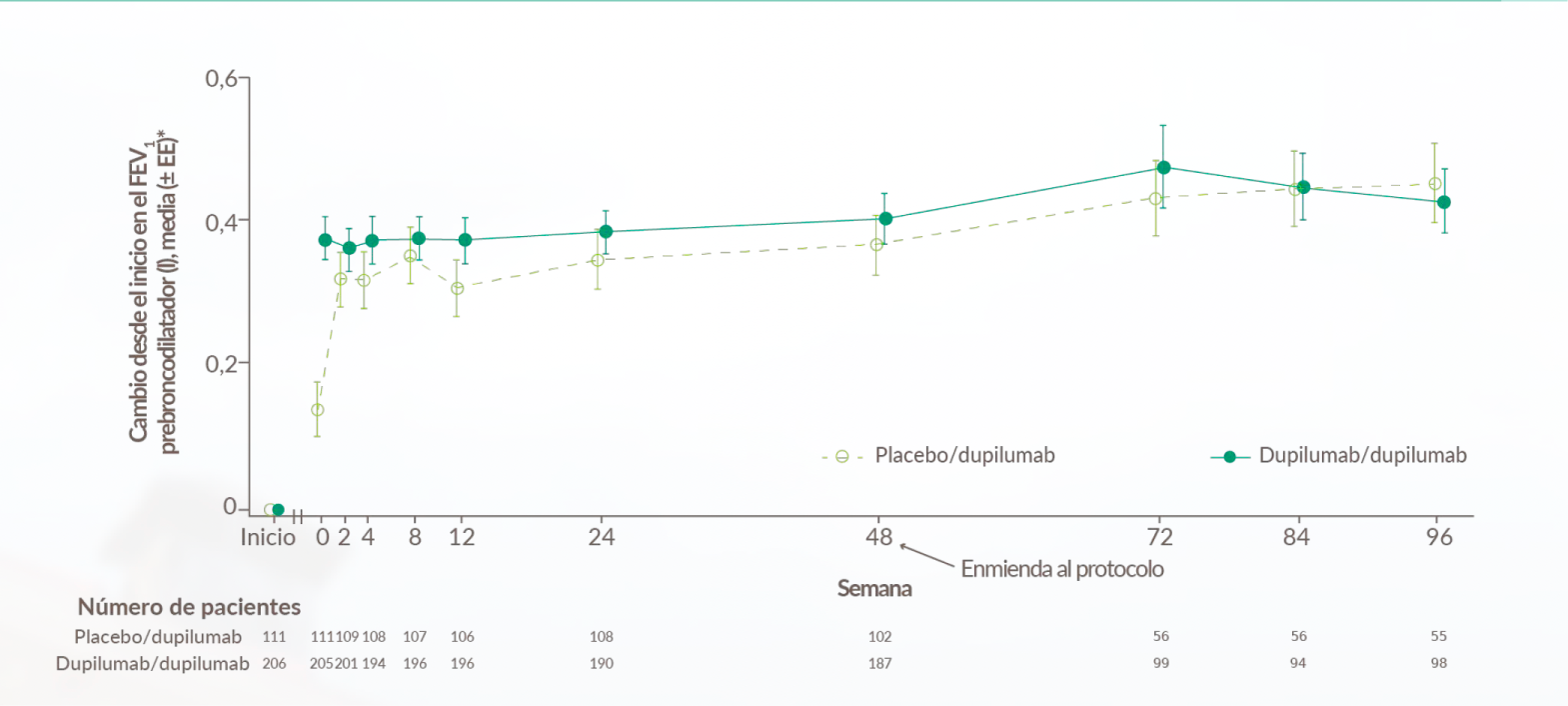
Figura de Berger P, et al, 2023.33
*Pacientes del estudio QUEST con RSCcPN que se inscribieron en el estudio TRAVERSE.

Hasta 450 ml de mejoría en el FEV1 prebroncodilatador a las 96 semanas33

Hasta un 73% de los pacientes libres de exacerbaciones graves durante casi 2 años33
FEV1 Pre-broncodilatador33
>170 mL de mejora en la Semana 24 desde el valor inicial en FEV1 pre-broncodilatador con Dupixent 300 mg Q2W + INCS (n=176, brazos combinados de Dupixent) en comparación con un empeoramiento de -50 mL con placebo (Diferencia LSM vs placebo: 210 mL [IC del 95%: 110, 320 mL]).
ACQ-633
> -0.78 de mejora en la Semana 24 desde una puntuación inicial de 1.55 en ACQ-6 con Dupixent 300 mg Q2W + INCS (n=176, brazos combinados de Dupixent) en comparación con un empeoramiento de 0.08 desde una puntuación inicial de 1.63 con placebo (Diferencia LSM: -0.87 [IC del 95%: -1.07, -0.66])
ACQ-6, Cuestionario de Control del Asma, versión de 6 ítems; EE: error estándar; FEV1, Volumen Espiratorio Forzado en 1 segundo; IC: intervalo de confianza; INCS: corticosteroides intranasales; MMC: media de mínimos cuadrados.
Medida reportada por el paciente sobre el control del asma (5 preguntas sobre los síntomas y 1 pregunta sobre el uso de medicación de alivio). La puntuación máxima es 6. La diferencia clínicamente importante significativa es 0.5. Una puntuación más baja indica mejor control del asma.
Los pacientes reportaron una mejora en los síntomas y en la calidad de vida relacionada con la salud
Dupixent disminuyó significativamente la puntuación SNOT-22 en comparación con el placebo tan pronto como en la Semana 4, con mejoras sostenidas hasta las Semanas 24 y 52.¹,¹³
Cambio en la puntuación de SNOT-22 hasta la semana 52 en SINUS-52 (variable secundaria)13

**La dosis recomendada de dupilumab para pacientes adultos es una dosis inicial de 300 mg seguida de 300 mg c2s.1

-29,84 puntos de mejoría en la semana 52 con Dupixent® 300 mg c2s + INCS1,13
El cuestionario SNOT-22 es una evaluación realizada por el paciente que incluye 22 síntomas y consecuencias de la rinosinusitis crónica con pólipos nasales, entre ellos:1,13
- Obstrucción nasal
- Secreción nasal
- Sensación de presión o dolor en el oído
- Estornudos
- Tos
- Pérdida del olfato/sabor
- Dificultad para conciliar el sueño
- Despertares nocturnos
- Fatiga
- Reducción de la productividad y concentración
- Frustración, inquietud e irritabilidad
- Tristeza y vergüenza
c2s: cada 2 semanas; c4s: cada 4 semanas; EE: error estándar; IC: intervalo de confianza; MMC: media de mínimos cuadrados; RSCcPN: rinosinusitis crónica con poliposis nasal; SNOT-22: Cuestionario de Resultados de la Rinosinusitis de 22 preguntas Los pacientes evalúan 22 síntomas y consecuencias de la rinosinusitis crónica con pólipos nasales. La puntuación máxima es de 110. La diferencia clínicamente importante significativa es 8.9. Una puntuación más baja indica una mejor calidad de vida relacionada con la salud.
En pacientes que tienen rinosinusitis crónica con pólipos nasales y asma coexistente,
dupixent mejoró la respiración y la calidad de vida
Dupixent mejoró significativamente la función pulmonar y el control del asma (ACQ-6) al mismo tiempo que mejoraba los resultados en rinosinusitis crónica con pólipos nasales.¹³
Mejoría rápida del FEV1 y mantenida hasta casi 2 años en pacientes con RSCcPN33

Figura de Berger P, et al, 2023.33
*Pacientes del estudio QUEST con RSCcPN que se inscribieron en el estudio TRAVERSE.

Hasta 450 ml de mejoría en el FEV1 prebroncodilatador a las 96 semanas33

Hasta un 73% de los pacientes libres de exacerbaciones graves durante casi 2 años33
FEV1 Pre-broncodilatador33
>170 mL de mejora en la Semana 24 desde el valor inicial en FEV1 pre-broncodilatador con Dupixent 300 mg Q2W + INCS (n=176, brazos combinados de Dupixent) en comparación con un empeoramiento de -50 mL con placebo (Diferencia LSM vs placebo: 210 mL [IC del 95%: 110, 320 mL]).
ACQ-633
> -0.78 de mejora en la Semana 24 desde una puntuación inicial de 1.55 en ACQ-6 con Dupixent 300 mg Q2W + INCS (n=176, brazos combinados de Dupixent) en comparación con un empeoramiento de 0.08 desde una puntuación inicial de 1.63 con placebo (Diferencia LSM: -0.87 [IC del 95%: -1.07, -0.66])
ACQ-6, Cuestionario de Control del Asma, versión de 6 ítems; EE: error estándar; FEV1, Volumen Espiratorio Forzado en 1 segundo; IC: intervalo de confianza; INCS: corticosteroides intranasales; MMC: media de mínimos cuadrados.
Medida reportada por el paciente sobre el control del asma (5 preguntas sobre los síntomas y 1 pregunta sobre el uso de medicación de alivio). La puntuación máxima es 6. La diferencia clínicamente importante significativa es 0.5. Una puntuación más baja indica mejor control del asma.
Perfiles de Pacientes
Identifica la inflamación tipo 2 en pacientes afectados por los síntomas de rinosinusitis crónica con pólipos nasales22,31
Busca signos de inflamación tipo 2 y un aumento en la gravedad de la enfermedad para interrumpir el ciclo con una terapia biológica.2,9,30

LUCÍA, 38 años
No ha tenido cirugías
---------------------
Lucía también padece condiciones inflamatorias tipo 2 coexistentes.

ANA, 47 años
Recurrencia 6 meses después de la cirugía sinusal
------------------
La anosmia de Ana fue su primer síntoma en recurrir después de la cirugía.

Alex, 42 años
Recurrencia 6 meses después de la cirugía sinusal
------------------
Los síntomas de Alex regresaron 2 meses después de su tratamiento con esteroides.

LUCÍA, 38 años
No ha tenido cirugías
---------------------
Lucía también padece condiciones inflamatorias tipo 2 coexistentes.

ANA, 47 años
Recurrencia 6 meses después de la cirugía sinusal
------------------
La anosmia de Ana fue su primer síntoma en recurrir después de la cirugía.

Alex, 42 años
Recurrencia 6 meses después de la cirugía sinusal
------------------
Los síntomas de Alex regresaron 2 meses después de su tratamiento con esteroides.
Perfiles de pacientes establecidos a partir de las referencias 22 y 31.
Los signos de inflamación tipo 2 incluyen:3,5
- Condiciones inflamatorias tipo 2 coexistentes, como:
- EREA (Enfermedad Respiratoria Exacerbada por Aspirina)
- Rinitis alérgica
- Asma
- Hipersensibilidad a los AINE (Anti-Inflamatorios No Esteroideos)
- Deterioro del sentido del olfato
- Recurrencia de pólipos o síntomas
Los perfiles de los pacientes son representativos y no corresponden a pacientes reales tratados con Dupixent.
El perfil de seguridad establecido se mantuvo consistente hasta la semana 52
Dupixent es un anticuerpo monoclonal humano con un perfil de seguridad comparable al placebo.1,a
|
Clasificación por Órganos y Sistemas de MedDRA |
Frecuencia |
Reacción Adversa |
|
Infecciones e infestaciones |
Frecuentes |
Conjuntivitis* |
|
Trastornos de la sangre y del sistema linfático |
Frecuentes |
Eosinofilia |
|
Trastornos del sistema inmunológico |
Poco frecuentes |
Angioedema# |
|
Trastornos oculares |
Frecuentes |
Conjuntivitis alérgica* |
|
Trastornos de la piel y del tejido subcutáneo |
Poco frecuentes |
Erupción facial# |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Frecuentes |
Artralgia# |
|
Trastornos generales y alteraciones en el lugar de administración |
Frecuentes |
Reacciones en el lugar de la inyección (incluye eritema, edema, prurito, dolor, hinchazón y hematomas) |
* los trastornos oculares y el herpes oral se produjeron predominantemente en los estudios de dermatitis atópica.
† las frecuencias para prurito ocular, blefaritis y ojo seco fueron frecuentes y la queratitis ulcerosa fue poco frecuente en los estudios de dermatitis atópica.
# a partir de informes de poscomercialización.
En la población de seguridad, la proporción de pacientes que interrumpieron el tratamiento debido a eventos adversos fue:1
- 2.0% en el grupo de Dupixent
- 4.6% en el grupo de placebo
Dupixent® no es un inmunosupresor
a Dupixent fue estudiado en 12 ensayos controlados aleatorizados, incluyendo pacientes con dermatitis atópica, asma y CRSwNP. Los estudios pivotales controlados incluyeron a 4,206 pacientes que recibieron dupilumab y 2,326 pacientes que recibieron placebo durante el período controlado.
b Común (≥1/100 a <1/10); poco común (≥1/1,000 a <1/100); raro (≥1/10,000 a <1/1,000).
c Datos reportados después de la comercialización.
d Las frecuencias de prurito ocular, blefaritis y ojo seco fueron comunes, y la queratitis ulcerativa fue poco común en los estudios de dermatitis atópica.
Dupixent ofrece la opción de administración en casa o en el consultorio
Dosis recomendada para pacientes con CRS no controlada con pólipos nasales¹:
Mayores de 18 años
300 mgᵃ
Cada dos semanas
No requiere dosis de carga
Jeringa precargada
> Inyección subcutánea
> Protector de aguja
> Agarre ergonómico para mayor comodidad
> Retroalimentación visual
> Portátil

Pluma precargada
> Autoinyector
> Aguja oculta
> Función de control de seguridad en 2 pasos
> Retroalimentación visual y auditiva
> Portátil
Si el profesional sanitario lo considera oportuno, el paciente se puede autoinyectar Dupixent® o bien se lo puede administrar el cuidador. Se debe asegurar que los pacientes y/o cuidadores reciben la formación adecuada sobre la preparación y administración de Dupixent® antes de su uso de acuerdo con las instrucciones de uso en el prospecto.1
ᵃ Solución de 300 mg/2 mL.
Contenido mínimo de Dupixent®
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
-
Dupixent 300 mg solución inyectable en jeringa precargada – 2 jeringas precargadas de 2 ml con protector de aguja (CN 718735.6).
-
Dupixent 300 mg solución inyectable en pluma precargada – 2 plumas precargadas de 2 ml (CN 758028.7).
-
Dupixent 200 mg solución inyectable en jeringa precargada – 2 jeringas precargadas de 1,14 ml (CN 727309.7).
-
Dupixent 200 mg solución inyectable en pluma precargada – 2 plumas precargadas de 1,14 ml (CN 758027.0).
PVP notificado: 1.267,45 €, PVP IVA notificado: 1.318,15 €.
Medicamento sujeto a prescripción médica. Diagnóstico hospitalario. Financiado por SNS. Dispensación hospitalaria sin cupón precinto.
CONSULTE LA FICHA TÉCNICA COMPLETA ANTES DE PRESCRIBIR ESTE MEDICAMENTO.
Ver ficha técnica DUPIXENT® 200 mg solución inyectable en jeringa precargada
Ver ficha técnica DUPIXENT® 200 mg solución inyectable en pluma precargada
Ver ficha técnica DUPIXENT® 300 mg solución inyectable en jeringa precargada
Ver ficha técnica DUPIXENT® 300 mg solución inyectable en pluma precargada
Dupixent está financiado en España de acuerdo con los criterios establecidos por el SNS.
1. NOMBRE DEL MEDICAMENTO
Dupixent 300 mg solución inyectable en jeringa precargada
Dupixent 300 mg solución inyectable en pluma precargada
Dupixent 200 mg solución inyectable en jeringa precargada
Dupixent 200 mg solución inyectable en pluma precargada
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Dupilumab 300 mg solución inyectable en jeringa precargada
Cada jeringa precargada de un solo uso contiene 300 mg de dupilumab en 2 ml de solución (150 mg/ml).
Dupilumab 300 mg solución inyectable en pluma precargada
Cada pluma precargada de un solo uso contiene 300 mg de dupilumab en 2 ml de solución (150 mg/ml).
Dupilumab 200 mg solución inyectable en jeringa precargada
Cada jeringa precargada de un solo uso contiene 200 mg de dupilumab en 1,14 ml de solución (175 mg/ml).
Dupilumab 200 mg solución inyectable en pluma precargada
Cada pluma precargada de un solo uso contiene 200 mg de dupilumab en 1,14 ml de solución (175 mg/ml).
Dupilumab es un anticuerpo monoclonal completamente humano producido por tecnología de ADN recombinante en las células de Ovario de Hámster Chino (OHC).
Para consultar la lista completa de excipientes, ver sección Lista de excipientes.
3. FORMA FARMACÉUTICA
Solución inyectable (inyectable).
Solución estéril transparente a ligeramente opalescente, de incolora a amarillo pálido, sin partículas visibles, con un pH de aproximadamente 5,9.


Abreviaturas
AERD, Enfermedad Respiratoria Exacerbada por Aspirina; AINE, Anti-Inflamatorios No Esteroideos.; AM, mañana; Anosmia, puntuación UPSIT ≤18; CRSwNP, rinosinusitis crónica con pólipos nasales; DE, desviación estándar; EPOS, Documento de Posición Europeo sobre Rinosinusitis y Pólipos Nasales 2020; EUFOREA, Foro Europeo para la Investigación y Educación en Alergias y Enfermedades de las Vías Respiratorias; HRQoL, calidad de vida relacionada con la salud; ICAR-RS, Consenso Internacional sobre Alergia y Rinología: Rinosinusitis; INCS, corticosteroides intranasales; ITT, intención de tratar; LoS, puntuación de pérdida del olfato, es una evaluación de la gravedad diaria de los síntomas por parte del paciente;
NC, congestión/obstrucción nasal; NPS: Nasal Polyp Score o PPN: Puntuación Pólipos Nasales; MedDRA, Diccionario Médico para Actividades Regulatorias; LSM, media cuadrática mínima; Q2W, cada 2 semanas; Q4W, una vez cada 4 semanas; SCS, corticosteroides sistémicos; UPSIT, Test de Identificación de Olfato de la Universidad de Pensilvania.
Referencias
- CIMA - Centro de información online de medicamentos de la AEMPS, Dupixent? (dupilumab). Ficha técnica [en línea] [consulta: agosto 2024]. Disponible en: Disponible en: https: //cima.aemps.es/cima/pdfs/es/ft/1171229006/FT_1171229006.pdf
- Gandhi NA, Bennet BL, Graham NMH, Pirozzi G, Stahl N, Yancopoulos GD. Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov. 2016;15(1):35-50. doi:10.1038/nrd4624
- Schleimer RP. Immunopathogenesis of chronic rhinosinusitis and nasal polyposis. Annu Rev Pathol. 2017;12:331-357. doi:10.1146/annurev-pathol-052016-100401
- Stevens WW, Peters AT, Tan BK, et al. Associations between inflammatory endotypes and clinical presentations in chronic rhinosinusitis. J Allergy Clin Immunol Pract. 2019;7(8):2812-2820.e3. doi:10.1016/j.jaip.2019.05.009
- Maspero J, Adir Y, Al-Ahmad M, et al. Type 2 inflammation in asthma and other airway diseases. ERJ Open Res. 2022;8(3):00576-2021. doi:10.1183/23120541.00576-2021
- Dietz de Loos DA, Hopkins C, Fokkens WJ. Symptoms in chronic rhinosinusitis with and without nasal polyps. Laryngoscope. 2013;123(1):57-63. doi:10.1002/lary.23671
- Tsunemi Y, Nakayama T, Kashiwagi T, Akutsu M, Saito S, Haruna S. Long-term efficacy of dupilumab for eosinophilic chronic rhinosinusitis. Am J Rhinol Allergy. 2024;38(1):14-22. doi:10.1177/19458924231204128
- Han JK, Bosso JV, Cho SH, et al. Multidisciplinary consensus on a stepwise treatment algorithm for management of chronic rhinosinusitis with nasal polyps. Int Forum Allergy Rhinol. 2021;11(10):1407-1416. doi:10.1002/alr.22851
- De Corso E, Baroni S, Settimi S, et al. Sinonasal biomarkers defining type 2-high and type 2-low inflammation in chronic rhinosinusitis with nasal polyps. J Pers Med. 2022;12(8):1251. doi:10.3390/jpm12081251
- Amirapu S, Biswas K, Radcliff FJ, Wagner Mackenzie B, Ball S, Douglas RG. Sinonasal tissue remodelling during chronic rhinosinusitis. Int J Otolaryngol. 2021;2021:7428955. doi:10.1155/2021/7428955
- Ferguson BJ, Rizk H, Ramakrishnan J, Pant H. Categorization of nasal polyps. In: Önerci TM, Ferguson BJ, eds. Nasal Polyposis. Springer-Verlag; 2010:103-110.
- Hellings PW, Peters AT, Chaker AM, et al. Rapid and sustained effects of dupilumab in severe chronic rhinosinusitis with nasal polyps. Int Forum Allergy Rhinol. 2022;12(7):958-962. doi:10.1002/alr.22944
- Bachert C, Han JK, Desrosiers M, et al. Efficacy and safety of dupilumab in patients with severe chronic rhinosinusitis with nasal polyps (LIBERTY NP SINUS-24 and LIBERTY NP SINUS-52): results from two multicentre, randomised, double-blind, placebo-controlled, parallel-group phase 3 trials. Lancet. 2019;394(10209):1638-1650. doi:10.1016/S0140-6736(19)31881-1
- Canonica GW, Bourdin A, Peters AT, et al. Dupilumab demonstrates rapid onset of response across three type 2 inflammatory diseases. J Allergy Clin Immunol Pract. 2022;10(6):1515-1526. doi:10.1016/j.jaip.2022.02.026
- Yan X, Whitcroft LK, Hummel T. Olfaction: sensitive indicator of inflammatory burden in chronic rhinosinusitis. Laryngoscope Investig Otolaryngol. 2020;5(6):992-1002. doi:10.1002/lio2.485
- Chen M, Reed RR, Lane AP. Chronic inflammation directs an olfactory stem cell functional switch from neuroregeneration to immune defense. Cell Stem Cell. 2019;25(4):501-513.e5. doi:10.1016/j.stem.2019.08.011
- Rouyar A, Classe M, Gorski R, et al. Type 2/Th2-driven inflammation impairs olfactory sensory neurogenesis in mouse chronic rhinosinusitis model. Allergy. 2019;74(3):549-559. doi:10.1111/all.13559
- Mullol J, Mariño-Sánchez F, Valls M, Alobid I, Marin C. The sense of smell in chronic rhinosinusitis. J Allergy Clin Immunol. 2020;145(3):773-776. doi:10.1016/j.jaci.2020.01.024
- Bachert C, Bahattacharyya N, Desrosiers M, Khan AH. Burden of disease in chronic rhinosinusitis with nasal polyps. J Asthma Allergy. 2021;14:127-134. doi:10.2147/JAA.S290424
- DeConde AS, Mace JC, Levy JM, Rudmik L, Alt JA, Smith TL. Prevalence of polyp recurrence after endoscopic sinus surgery for chronic rhinosinusitis with nasal polyposis. Laryngoscope. 2017;127(3):550-555. doi:10.1002/lary.26391
- De Corso E, Settimi S, Montuori C, et al. How to manage recurrences after surgery in CRSwNP patients in the biologic era: a narrative review. Acta Otorhinolaryngol Ital. 2023;43(2)(suppl 1) doi:10.14639/0392-100X-suppl.1-43-2023-01
- Fokkens WJ, Viskens AS, Backer V, et al. EPOS/EUFOREA update on indication and evaluation of biologics in chronic rhinosinusitis with nasal polyps 2023. Rhinology. 2023;61(3):194-202. doi:10.4193/Rhin22.489
- Orlandi RR, Kingdom TT, Hwang PH, et al. International Consensus Statement on Allergy and Rhinology: Rhinosinusitis. Int Forum Allergy Rhinol. 2016;6(suppl 1) doi:10.1002/alr.21695
- Hox V, Lourijsen E, Jordens A, et al. Benefits and harm of systemic steroids for short- and long-term use in rhinitis and rhinosinusitis: an EAACI position paper. Clin Transl Allergy. 2020;10:1. doi:10.1186/s13601-019-0303-6
- Ficha técnica de XOLAIR®
- Ficha técnica de NUCALA®
- Han JK, Bachert C, Lee SE, et al. Estimating clinically meaningful change of efficacy outcomes in inadequately controlled chronic rhinosinusitis with nasal polyposis. Laryngoscope. 2022;132(2):265-271. doi:10.1002/lary.29888
- Gelardi M, Bocciolini C, Notargiacomo M, et al. Chronic rhinosinusitis with nasal polyps: how to identify eligible patients for biologics in clinical practice. Acta Otorhinolaryngol Ital. 2022;42(1):75-81. doi:10.14639/0392-100X-N1699
- Asiri M, Alokby G. Validation and cross-cultural adaptation of the Sinonasal Outcome Test (SNOT)-22 for the Arabian patient population. Cureus. 2019;11(4) doi:10.7759/cureus.4447
- Mullol J, Bachert C, Amin N, et al. Olfactory outcomes with dupilumab in chronic rhinosinusitis with nasal polyps. J Allergy Clin Immunol Pract. 2022:1086-1095.e5. doi:10.1016/j.jaip.2021.09.037
- Bachert C, Han JK, Wagenmann M, et al. EUFOREA expert board meeting on uncontrolled severe chronic rhinosinusitis with nasal polyps (CRSwNP) and biologics: definitions and management. J Allergy Clin Immunol. 2021;147(1):29-36.
- Fujieda S, Matsune S, Takeno S, et al. Dupilumab efficacy in chronic rhinosinusitis with nasal polyps from SINUS-52 is unaffected by eosinophilic status. Allergy. 2022;77(1):186-196.
- Berger P, Menzies-Gow A, Peters AT, et al. Long-term efficacy of dupilumab in asthma with or without chronic rhinosinusitis and nasal polyps. Ann Allergy Asthma Immunol. 2023;130(2):215-224.
MAT-ES-2403132 - V1 Enero 2025