
Acerca de Xenpozyme®
Xenpozyme® está indicado como terapia enzimática de sustitución para el tratamiento de las manifestaciones no relacionadas con el sistema nervioso central (SNC) del déficit de esfingomielinasa ácida (Acid Sphingomyelinase Deficiency, ASMD) en pacientes pediátricos y adultos con tipo A/B o tipo B.1
El ASMD es una enfermedad progresiva con graves manifestaciones multisistémicas a largo plazo.4
El ASMD se asocia a síntomas multisistémicos que pueden afectar a diferentes órganos4
Púlmones >80% de los pacientes con ASMD
Bazo >90% de los pacientes con ASMD
Hígado >70% de los pacientes con ASMD
Sangre (trombocitopenia) >50% de los pacientes con ASMD
Los pacientes pediátricos con ASMD suelen padecer un retraso de crecimiento con un peso y una estatura por debajo de la media
Otros síntomas incluyen síntomas neurológicos*, cardíacos y óseos
Púlmones >80% de los pacientes con ASMD
Bazo >90% de los pacientes con ASMD
Hígado >70% de los pacientes con ASMD
Sangre (trombocitopenia) >50% de los pacientes con ASMD
Los pacientes pediátricos con ASMD suelen padecer un retraso de crecimiento con un peso y una estatura por debajo de la media
Otros síntomas incluyen síntomas neurológicos*, cardíacos y óseos
*XENPOZYME® no está indicado para tratar los síntomas neurológicos, al no tener el potencial de atravesar la barrera hematoencefálica.1
Características de Xenpozyme®
El primer y único tratamiento con la posibilidad de ayudar a transformar la vida de los pacientes con ASMD tipo A/B o tipo B.1-3,5

Una terapia enzimática de sustitución que aborda la causa subyacente del ASMD y ayuda a revertir la evolución de la enfermedad.1

Mejoras alcanzadas en los criterios de valoración clínicos1 tanto en pacientes adultos como en pacientes pediátricos.

Perfusión intravenosa de 3,0mg/kg cada 2 semanas* con un escalado de dosis inicial y requisitos de supervisión.1

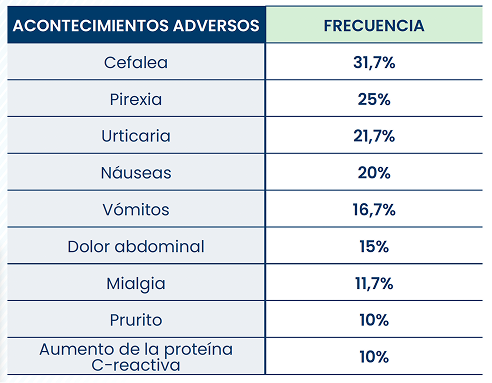
En general, es bien tolerado tanto en pacientes pediátricos como adultos siempre que se cumpla la pauta de administración. En los ensayos clínicos, los acontecimientos adversos más frecuentes† fueron cefalea, pirexia, urticaria, náuseas, vómitos, dolor abdominal, mialgia, prurito y aumento de la proteína C-reactiva.1
*3,0 mg/kg es la dosis objetivo de mantenimiento recomendada, que se puede alcanzar siguiendo la PAUTA DE ESCALADO DE DOSIS1
† Se produjeron en ≥10% de los pacientes tratados con Xenpozyme®1
Mecanismo de acción en ASMD
Xenpozyme® ayuda a transformar el manejo de la enfermedad al abordar la causa subyacente del ASMD1,5
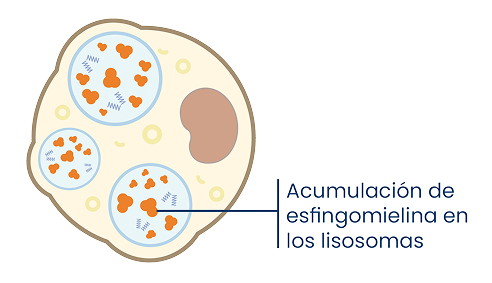
Célula con enzima ASM insuficiente:
- Los pacientes con ASMD carecen de una versión de la enzima ASM que funcione correctamente, lo que se traduce en la acumulación de esfingomielina.1
- En los pacientes con ASMD, la acumulación progresiva de esfingomielina en el sistema celular se manifiesta como una enfermedad multisistémica que puede dañar órganos como el bazo, el hígado, el corazón, los pulmones y/o el sistema hematológico.1,6
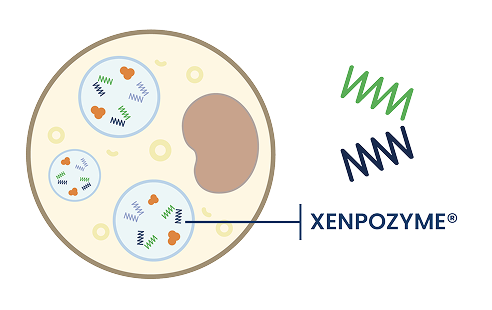
Xenpozyme® es una ASM humana recombinante que reduce la acumulación de esfingomielina en los órganos de los pacientes con ASMD1:
- Xenpozyme® actúa igual que lo haría la enzima ASM natural. Como tratamiento de sustitución, Xenpozyme® reduce la acumulación de esfingomielina en los órganos y trata los signos y síntomas del ASMD.1

Xenpozyme® ayuda a reducir la acumulación de esfingomielina:
- Xenpozyme® metaboliza la esfingomielina para eliminarla de los órganos y ayuda a revertir las manifestaciones clínicas multisistémicas del ASMD.1,35
- La metabolización rápida de la esfingomielina acumulada que lleva a cabo Xenpozyme® genera productos de degradación proinflamatorios, lo que puede producir reacciones asociadas a la perfusión y/o elevaciones transitorias de las enzimas hepáticas. Una pauta posológica de escalado de dosis puede minimizar la mayoría de estos acontecimientos adversos.1
Eficacia para pacientes con ASMD
El primer y único tratamiento con la posibilidad de ayudar a transformar la vida de los pacientes con ASMD tipo A/B o tipo B.1
Seguridad
Por lo general, Xenpozyme® es bien tolerado, siempre que se sigan estrictamente las instrucciones de escalado de dosis y de mantenimiento1,5
Acontecimientos adversos que se produjeron en ≥10% (al menos 2) de los pacientes tratados con Xenpozyme® en un análisis agrupado de estudios clínicos.1*
Se notificaron acontecimientos adversos graves en:
-
1 paciente adulto (2,5%): extrasístoles con antecedentes de miocardiopatía
-
1 paciente pediátrico (5%): reacción anafiláctica
-
1 paciente pediátrico (5%): urticaria
-
1 paciente pediátrico (5%): erupción
-
1 paciente pediátrico (5%): hipersensibilidad
-
1 paciente pediátrico (5%): aumento del nivel de alt
* El análisis de seguridad agrupado de 4 estudios clínicos (un estudio de tolerabilidad en pacientes adultos, ASCEND, ASCEND-Peds y un estudio de extensión en pacientes adultos y pediátricos) incluyó un total de 60 pacientes (40 pacientes adultos y 20 pediátricos) tratados con Xenpozyme® en dosis de hasta 3 mg/kg cada 2 semanas.
No se recomienda utilizar Xenpozyme® durante el embarazo ni en mujeres en edad fértil que no estén utilizando métodos anticonceptivos eficaces, a menos que los beneficios potenciales para la madre superen los riesgos potenciales, incluidos los del feto. Los estudios realizados en animales muestran toxicidad para la reproducción.
Los datos en animales no sugieren efectos perjudiciales directos ni indirectos en términos de fertilidad.
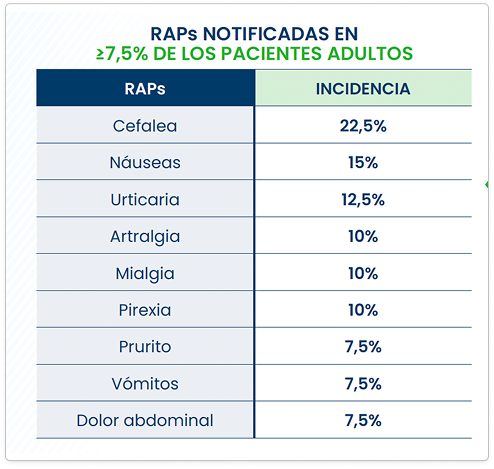
RAPs Notificadas en >7,5% de los pacientes adultos
- Se notificaron RAPs en el 55% de los pacientes adultos.
- Se produjeron RAPs relacionadas con la hipersensibilidad, incluida la anafilaxia, en el 26,7% de todos los pacientes de los ensayos clínicos. Los síntomas de RAPs relacionadas con hipersensibilidad notificados con mayor frecuencia fueron urticaria (20%), prurito (6,7%), eritema (6,7%) y erupción (5%).
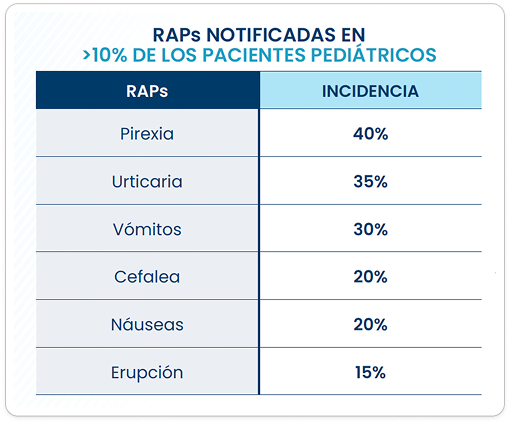
RAPs notificadas en el ›10% de los pacientes pediátricos
- Se notificaron RAPs en el 65% de los pacientes pediátricos.
- Se produjeron RAPs relacionadas con la hipersensibilidad, incluida la anafilaxia, en el 26,7% de todos los pacientes de los ensayos clínicos. Los síntomas de RAPs relacionadas con hipersensibilidad notificados con mayor frecuencia fueron urticaria (20%), prurito (6,7%), eritema (6,7%) y erupción (5%).

RAPs Notificadas en >7,5% de los pacientes adultos
- Se notificaron RAPs en el 55% de los pacientes adultos.
- Se produjeron RAPs relacionadas con la hipersensibilidad, incluida la anafilaxia, en el 26,7% de todos los pacientes de los ensayos clínicos. Los síntomas de RAPs relacionadas con hipersensibilidad notificados con mayor frecuencia fueron urticaria (20%), prurito (6,7%), eritema (6,7%) y erupción (5%).

RAPs notificadas en el ›10% de los pacientes pediátricos
- Se notificaron RAPs en el 65% de los pacientes pediátricos.
- Se produjeron RAPs relacionadas con la hipersensibilidad, incluida la anafilaxia, en el 26,7% de todos los pacientes de los ensayos clínicos. Los síntomas de RAPs relacionadas con hipersensibilidad notificados con mayor frecuencia fueron urticaria (20%), prurito (6,7%), eritema (6,7%) y erupción (5%).
DOSIS Y ADMINISTRACIÓN
Guía para la administración y preparación de Xenpozyme®
Accede a un PDF detallado que aborda aspectos esenciales de la administración de Xenpozyme®: desde el escalado de dosis y pautas posológicas, hasta el cálculo preciso de la perfusión y el manejo de dosis omitidas. Incluye información clave sobre pruebas de transaminasas, suministros y la fase de mantenimiento.
Descárgalo y consulta esta guía completa para garantizar un tratamiento eficaz y seguro.

Contenido mínimo de Xenpozyme®

PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
Xenpozyme 4 mg polvo para concentrado para solución para perfusión – 1 vial (CN 762543.8): PVP notificado: 3.430,91 €, PVP IVA notificado: 3.568,15 €. Medicamento sujeto a prescripción médica. Financiado por el SNS. Uso hospitalario.
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
Xenpozyme 20 mg polvo para concentrado para solución para perfusión – 1 vial (CN 758015.7): PVP notificado: 3.430,91 €, PVP IVA notificado: 3.568,15 €. Medicamento sujeto a prescripción médica. Financiado por el SNS. Uso hospitalario.
|
▼«Este medicamento está sujeto a seguimiento adicional, es prioritaria la notificación de sospechas de reacciones adversas asociadas a este medicamento.» |
1. Nombre del medicamento
Xenpozyme 4 mg polvo para concentrado para solución para perfusión
Xenpozyme 20 mg polvo para concentrado para solución para perfusión
2. Composición cualitativa y cuantitativa
Xenpozyme 4 mg polvo para concentrado para solución para perfusión
Cada vial contiene 4 mg de olipudasa alfa*.
Excipiente(s) con efecto conocido
Cada vial contiene 0,60 mg de sodio.
Xenpozyme 20 mg polvo para concentrado para solución para perfusión
Cada vial contiene 20 mg de olipudasa alfa*.
Excipiente(s) con efecto conocido
Cada vial contiene 3,02 mg de sodio.
Después de la reconstitución, cada vial contiene 4 mg de olipudasa alfa por ml. Cada vial se debe diluir aún más antes de su uso (ver sección Precauciones especiales de eliminación y otras manipulaciones).
*Olipudasa alfa es una esfingomielinasa ácida humana recombinante y se produce en una línea celular de ovario de hámster chino (Chinese Hamster Ovary, CHO) mediante tecnología de ADN recombinante.
Para consultar la lista completa de excipientes, ver sección Lista de excipientes.
3. Forma farmacéutica
Polvo para concentrado para solución para perfusión (polvo para concentrado).
Polvo liofilizado de color blanco a blanquecino.
Notas
ASMD = déficit de esfingomielinasa ácida (Acid Sphingomyelinase Deficiency), SNC = sistema nervioso central.
Referencias
- Ficha técnica Xenpozyme®. Disponible en: Pag web CIMA. Referencia a FT de CIMA: CIMA - Centro de información online de medicamentos de la AEMPS [en línea]. 2017, Agencia Española de Medicamentos y Productos Sanitarios. [Consulta: Febrero 2025]. Disponible en: https://cima.aemps.es/cima/publico/detalle.html?nregistro=1221659001 para Xenpozyme 20 mg, y https://cima.aemps.es/cima/publico/detalle.html?nregistro=1221659005 para Xenpozyme 4 mg.
- First therapy to treat two types of Niemann-Pick disease, a rare genetic metabolic disorder [en línea]. 1995-2023, European Medicine Agency (EMA). News, 20 mayo 2022. [último acceso: 30 abr. 2024]. Disponible en: https://www.ema.europa.eu/en/news/first-therapy-treat-two-types-niemann-pick-disease-rare-genetic-metabolic-disorder
- Agencia Española de Medicamentos y Productos Sanitarios. Centro de Información online de Medicamentos de la AEMPS – CIMA [en línea]. [último acceso: 30 abr. 2024]. Disponible en: https://cima.aemps.es/cima/publico/home.html
- McGovern MM, et al. Orphanet J Rare Dis. 2017;12(1):41.
- Wasserstein M, et al. Genet Med. 2022;24(7):1425-1436.
- Wasserstein M, et al. Mol Genet Metab. 2019;126(2):98-105.
- Diaz GA, et al. Genet Med. 2021;23(8):1543-1550
MAT-ES-2403626 V1 Abril 2025