- Artículo
- Fuente: Campus Sanofi
- 21 jul 2025
ASCEND: Estudio de ▼Xenpozyme® en pacientes adultos
ASCEND fue un estudio pivotal aleatorizado y controlado, de 52 semanas de duración, para evaluar la eficacia y seguridad.1
36 pacientes adultos de ASMD tipo A/B o tipo B
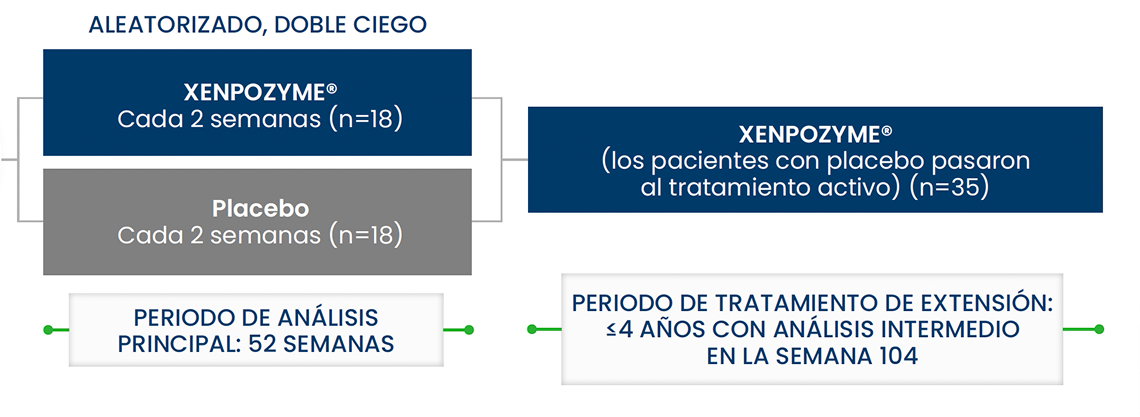
Criterios de valoración a las 52 semanas

Nota: En el momento inicial, se observaron manifestaciones neurológicas en 9 de los 36 pacientes adultos, compatibles con un diagnóstico clínico de ASMD tipo A/B. Los 27 pacientes restantes tenían un diagnóstico clínico compatible con ASMD tipo B.1
Con Xenpozyme® se consiguió una reversión rápida* y sostenida de las principales manifestaciones del ASMD en pacientes adultos1,2
Eficacia en pacientes adultos durante todo el estudio
Xenpozyme® mejoró significativamente la función pulmonar y ayudo a prevenir la posterior progresión de la enfermedad1,2
Diferencia significativa en la DLCO .
A las 52 semanas frente a placebo (P=0, 0004)1,3 *
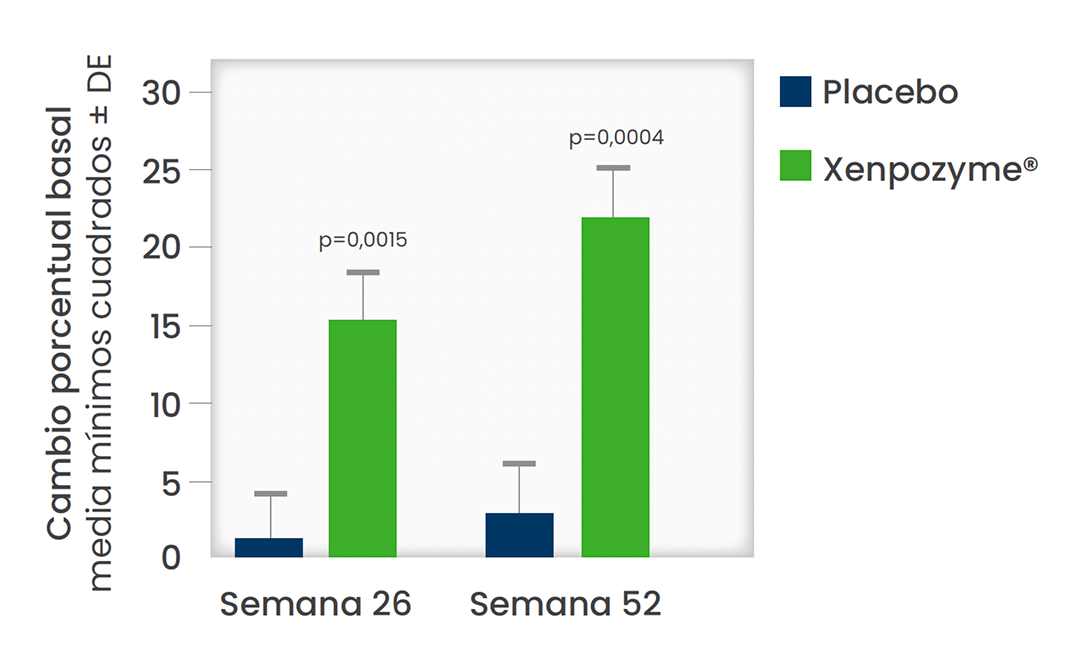
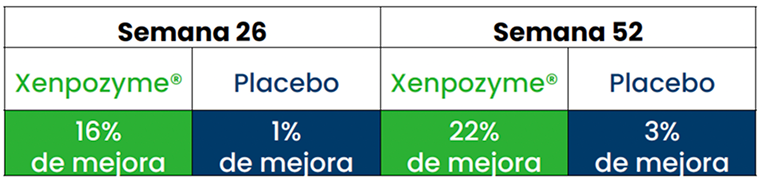
En la población general la DLco es un factor predictivo de morbilidad en pacientes con alteración de la función pulmonar.4
*Los datos presentados son medias MC. Las barras verticales representan la IC del 95% para las medias MC.1,3
La mejora en la función pulmonar se mantuvo.1,3,5,6
Mejora de la DLco durante 104 semanas respecto al inicio1,3,5,6*
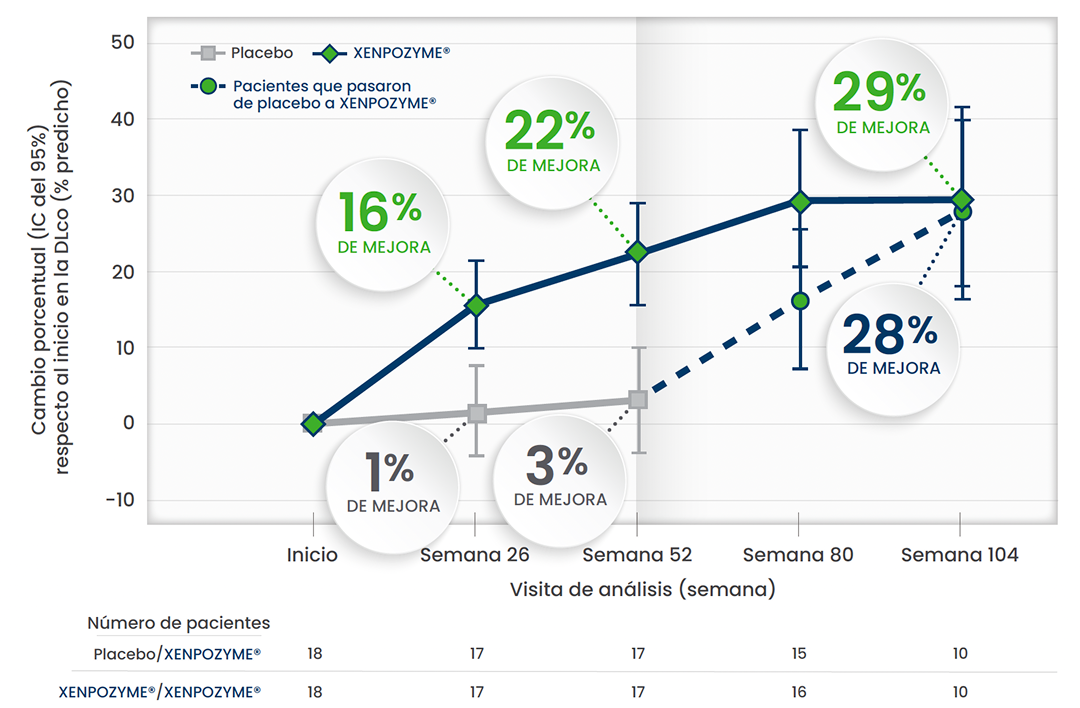
Esta gráfica ha sido creada a partir del texto de las publicaciones. Todos los pacientes pertenecen al estudio ASCEND
En otro estudio de extensión de diseño abierto,† se observó una MEJORA DEL 55% en la DLco al cabo de 6,5 años (n=5)1
* A partir de la semana 52, todos los pacientes recibieron XENPOZYME®. Las barras verticales representan los IC del 95% para las MMC.1
† Cinco pacientes de ASMD adultos que participaron en un estudio de diseño abierto de dosis incremental continuaron el tratamiento en un estudio de extensión de diseño abierto y recibieron XENPOZYME® durante al menos >7 años. Durante el transcurso del estudio, se observaron mejoras sostenidas en el % predicho de DLco, los volúmenes del bazo y el hígado y el recuento de plaquetas, respecto al inicio, en pacientes adultos.1
Xenpozyme® redujó significativamente el volumen del bazo y ayudó a prevenir la posterior progresión de la enfermedad.1,2
Diferencia significativa en el volumen del bazo a las 52 semanas frente a placebo (P < 0,0001)1,3*
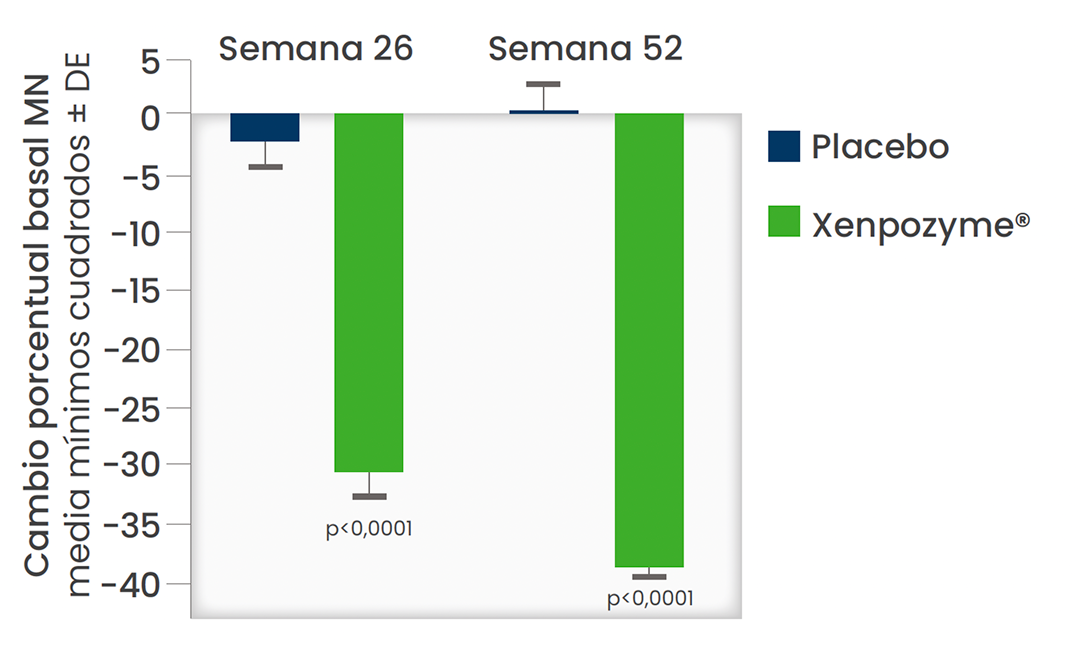
*Los datos presentados son medias MC. Las barras verticales representan la IC del 95% para las medias MC.1,3
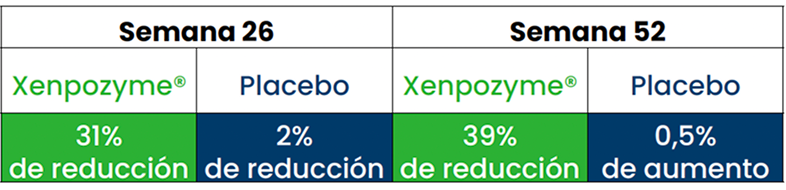
La reducciones en el volumen del bazo se mantuvieron.1,3,5,6
Reducción del volumen del bazo durante 104 semanas respecto al inicio1,3,5,6*
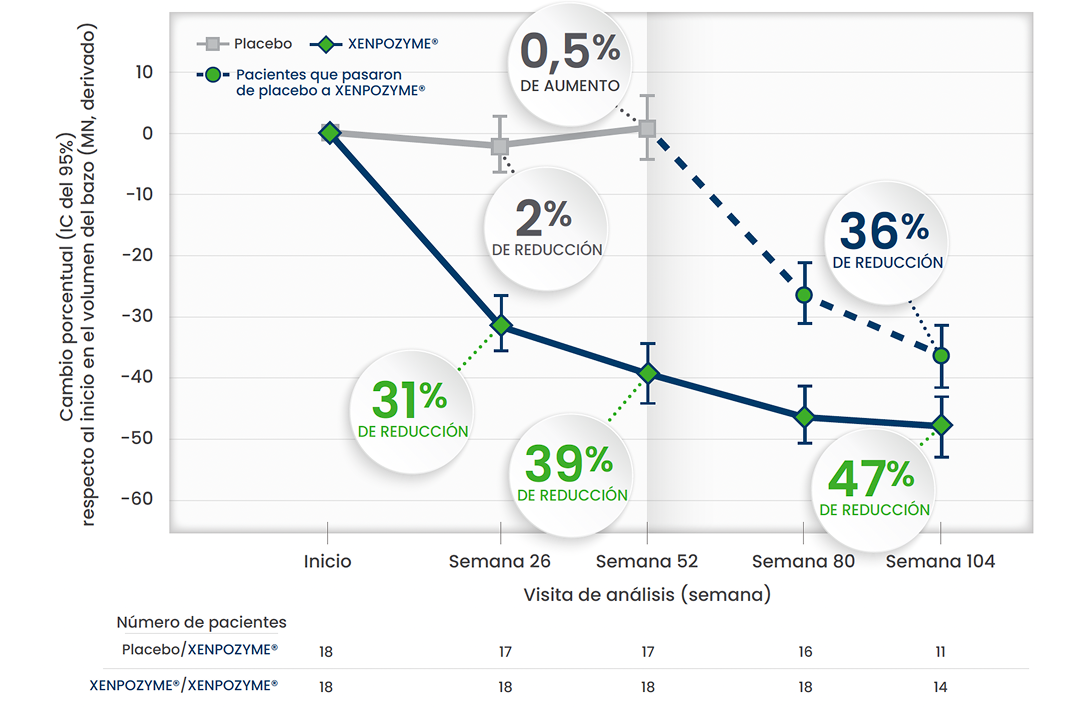
Esta gráfica ha sido creada a partir del texto de las publicaciones. Todos los pacientes pertenecen al estudio ASCEND
En otro estudio de extensión de diseño abierto,† se observó una REDUCCIÓN DEL 60% del volumen del bazo al cabo de 6,5 años (n=5)1
* A partir de la semana 52, todos los pacientes recibieron XENPOZYME®. Las barras verticales representan los IC del 95% para las MMC.1
† Cinco pacientes de ASMD adultos que participaron en un estudio de diseño abierto de dosis incremental continuaron el tratamiento en un estudio de extensión de diseño abierto y recibieron XENPOZYME® durante al menos >7 años. Durante el transcurso del estudio, se observaron mejoras sostenidas en el % predicho de DLco, los volúmenes del bazo y el hígado y el recuento de plaquetas, respecto al inicio, en pacientes adultos.1
Xenpozyme® redujó rápidamente el volumen del hígado y mejoró los marcadores de daño hepático.1,2
Reducción significativa del volumen del hígado a las 52 semanas frente a placebo (p<0.0001)1,3,6#
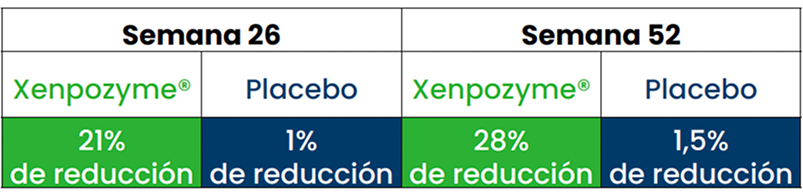
En comparación con el inicio, tras 52 semanas de tratamiento con XENPOZYME®1†:
- Diminución de ALT media del 45,9%
- Diminución de AST media de 40,2%
* Se observó una mejora significativa en el cambio porcentual medio del porcentaje predicho de DLco, volumen del bazo, volumen del hígado y recuento de plaquetas en la semana 26 de tratamiento, que fue la primera evaluación del criterio de valoración posterior a la primera dosis.1
# Los datos presentados son medias LS. Las barras verticales representan el SE para las medias LS.1,3,6
† En algunos pacientes tratados con XENPOZYME® durante la fase de escalado de dosis en los estudios clínicos, se produjeron elevaciones transitorias de las transaminasas (ALT o AST) al cabo de 24 a 48 horas tras la perfusión. Por lo general, estas elevaciones volvieron a los niveles de transaminasas previos a la perfusión antes de la siguiente perfusión programada.1
La reducciones del volumen del hígado se mantuvieron.1,3,5,6
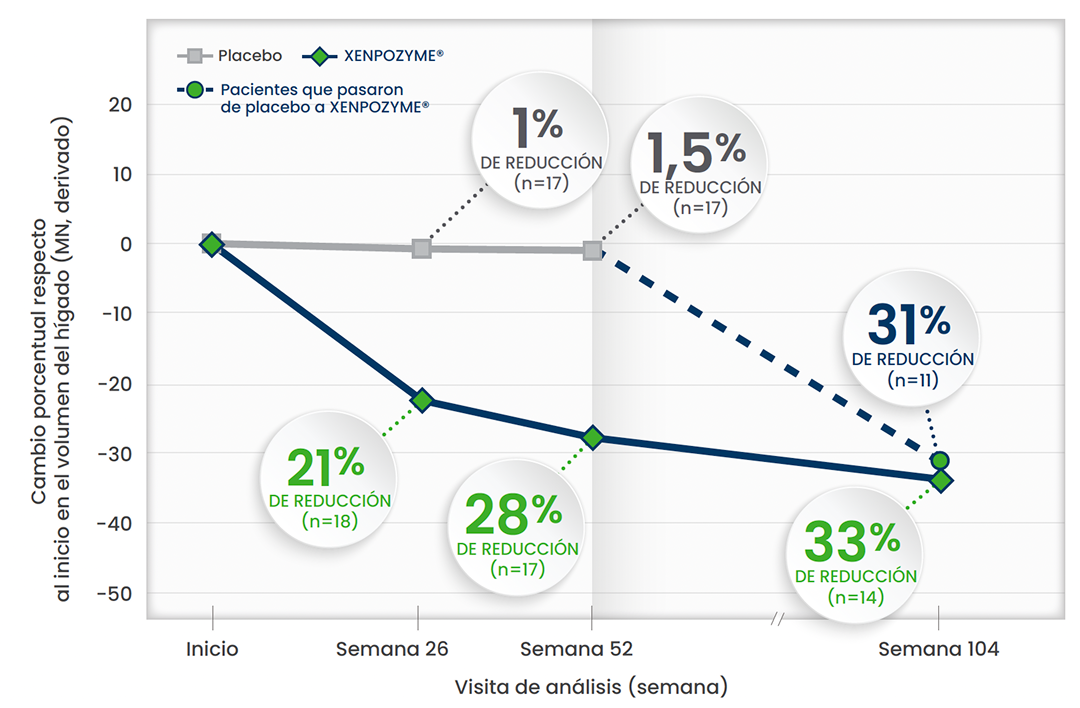
Esta gráfica ha sido creada a partir del texto de las publicaciones. Todos los pacientes pertenecen al estudio ASCEND
En otro estudio de extensión de diseño abierto,† se observó una REDUCCIÓN DEL 44% del volumen del hígado al cabo de 6,5 años (n=5)1
* A partir de la semana 52, todos los pacientes recibieron XENPOZYME®1
† Cinco pacientes de ASMD adultos que participaron en un estudio de diseño abierto de dosis incremental continuaron el tratamiento en un estudio de extensión de diseño abierto y recibieron XENPOZYME® durante al menos >7 años. Durante el transcurso del estudio, se observaron mejoras sostenidas en el % predicho de DLco, los volúmenes del bazo y el hígado y el recuento de plaquetas, respecto al inicio, en pacientes adultos.1
Xenpozyme® aumentó el recuento de plaquetas1
Aumento del recuento de plaquetas. Durante 52 semanas respecto al placebo(p=0,02) 1,3,6*
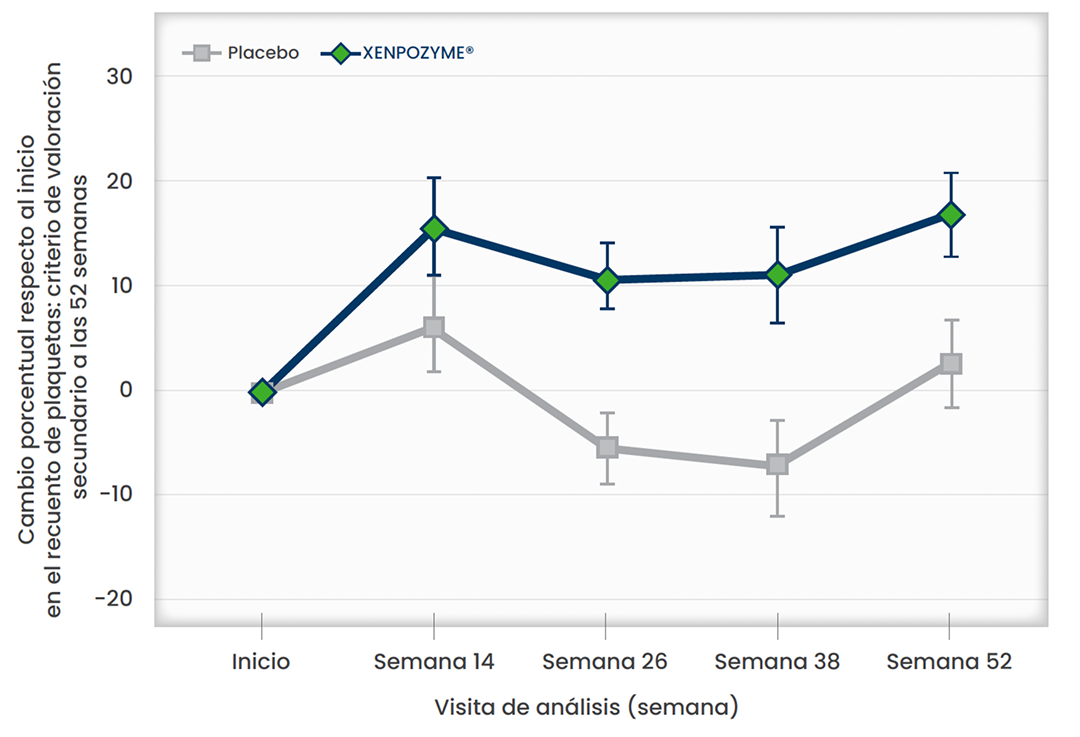
*Los datos presentados son medias MC. Las barras verticales representan el SE para las medias MC.1,3,6
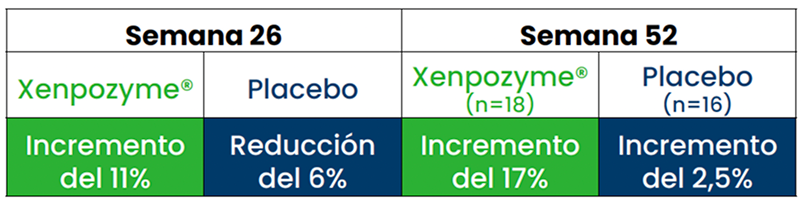
Aumento sostenido del recuento de plaquetas
Aumento del recuento de plaquetas durante 104 semanas respecto al inicio 1,3,6*
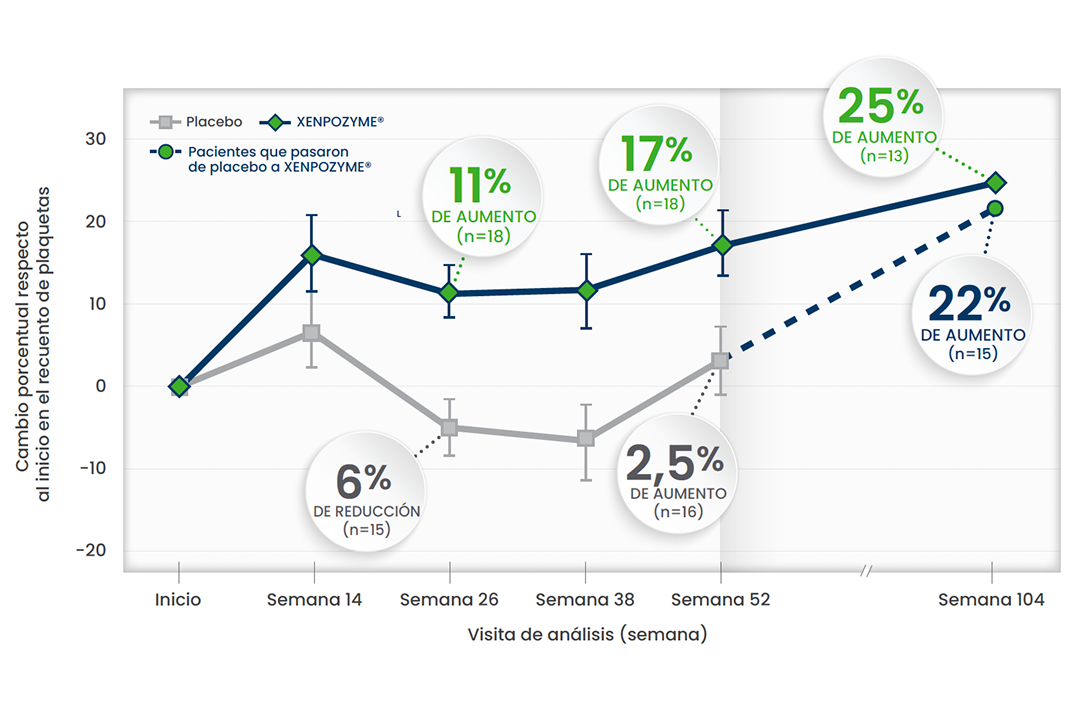
Esta gráfica ha sido creada a partir del texto de las publicaciones. Todos los pacientes pertenecen al estudio ASCEND
En otro estudio de extensión de diseño abierto,† se observó un AUMENTO DEL 39% del recuento de plaquetas al cabo de 6,5 años (n=5)1
* A partir de la semana 52, todos los pacientes recibieron XENPOZYME®.1
† Cinco pacientes de ASMD adultos que participaron en un estudio de diseño abierto de dosis incremental continuaron el tratamiento en un estudio de extensión de diseño abierto y recibieron XENPOZYME® durante al menos >7 años. Durante el transcurso del estudio, se observaron mejoras sostenidas en el % predicho de DLco, los volúmenes del bazo y el hígado y el recuento de plaquetas, respecto al inicio, en pacientes adultos.1
Xenpozyme® mejoró los parámetros lipídicos en comparación con el placebo6
Xenpozyme® mejoró significativamente la función pulmonar y ayudo a prevenir la posterior progresión de la enfermedad1,2
Diferencia significativa en la DLCO .
A las 52 semanas frente a placebo (P=0, 0004)1,3 *


En la población general la DLco es un factor predictivo de morbilidad en pacientes con alteración de la función pulmonar.4
*Los datos presentados son medias MC. Las barras verticales representan la IC del 95% para las medias MC.1,3
La mejora en la función pulmonar se mantuvo.1,3,5,6
Mejora de la DLco durante 104 semanas respecto al inicio1,3,5,6*

Esta gráfica ha sido creada a partir del texto de las publicaciones. Todos los pacientes pertenecen al estudio ASCEND
En otro estudio de extensión de diseño abierto,† se observó una MEJORA DEL 55% en la DLco al cabo de 6,5 años (n=5)1
* A partir de la semana 52, todos los pacientes recibieron XENPOZYME®. Las barras verticales representan los IC del 95% para las MMC.1
† Cinco pacientes de ASMD adultos que participaron en un estudio de diseño abierto de dosis incremental continuaron el tratamiento en un estudio de extensión de diseño abierto y recibieron XENPOZYME® durante al menos >7 años. Durante el transcurso del estudio, se observaron mejoras sostenidas en el % predicho de DLco, los volúmenes del bazo y el hígado y el recuento de plaquetas, respecto al inicio, en pacientes adultos.1
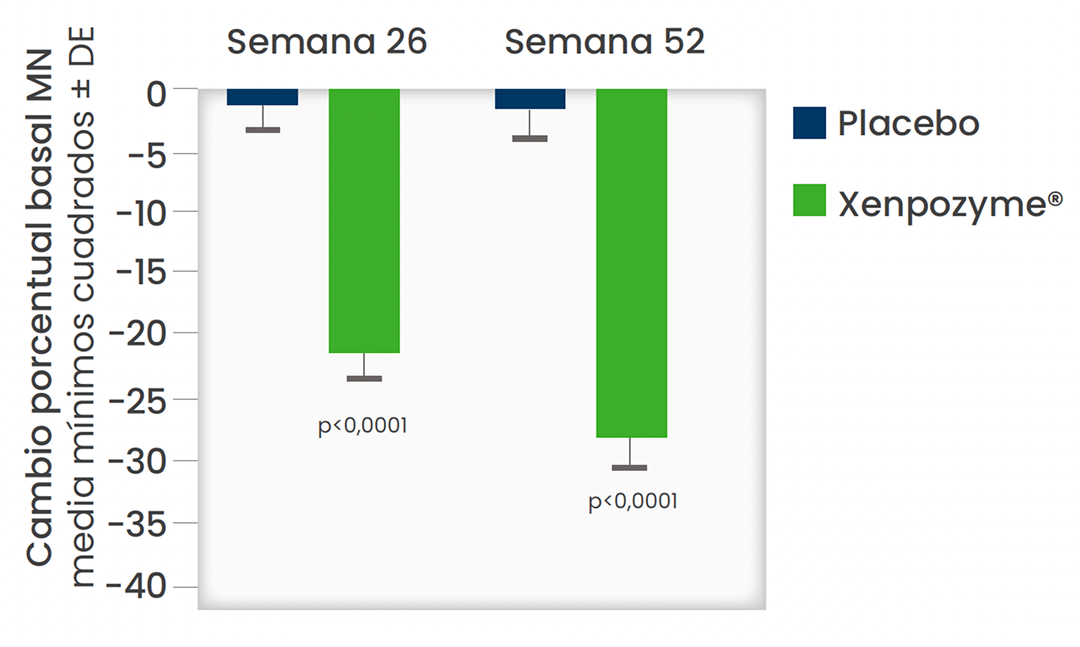
Xenpozyme® redujó significativamente el volumen del bazo y ayudó a prevenir la posterior progresión de la enfermedad.1,2
Diferencia significativa en el volumen del bazo a las 52 semanas frente a placebo (P < 0,0001)1,3*


*Los datos presentados son medias MC. Las barras verticales representan la IC del 95% para las medias MC.1,3
La reducciones en el volumen del bazo se mantuvieron.1,3,5,6
Reducción del volumen del bazo durante 104 semanas respecto al inicio1,3,5,6*

Esta gráfica ha sido creada a partir del texto de las publicaciones. Todos los pacientes pertenecen al estudio ASCEND
En otro estudio de extensión de diseño abierto,† se observó una REDUCCIÓN DEL 60% del volumen del bazo al cabo de 6,5 años (n=5)1
* A partir de la semana 52, todos los pacientes recibieron XENPOZYME®. Las barras verticales representan los IC del 95% para las MMC.1
† Cinco pacientes de ASMD adultos que participaron en un estudio de diseño abierto de dosis incremental continuaron el tratamiento en un estudio de extensión de diseño abierto y recibieron XENPOZYME® durante al menos >7 años. Durante el transcurso del estudio, se observaron mejoras sostenidas en el % predicho de DLco, los volúmenes del bazo y el hígado y el recuento de plaquetas, respecto al inicio, en pacientes adultos.1
Xenpozyme® redujó rápidamente el volumen del hígado y mejoró los marcadores de daño hepático.1,2
Reducción significativa del volumen del hígado a las 52 semanas frente a placebo (p<0.0001)1,3,6#


En comparación con el inicio, tras 52 semanas de tratamiento con XENPOZYME®1†:
- Diminución de ALT media del 45,9%
- Diminución de AST media de 40,2%
* Se observó una mejora significativa en el cambio porcentual medio del porcentaje predicho de DLco, volumen del bazo, volumen del hígado y recuento de plaquetas en la semana 26 de tratamiento, que fue la primera evaluación del criterio de valoración posterior a la primera dosis.1
# Los datos presentados son medias LS. Las barras verticales representan el SE para las medias LS.1,3,6
† En algunos pacientes tratados con XENPOZYME® durante la fase de escalado de dosis en los estudios clínicos, se produjeron elevaciones transitorias de las transaminasas (ALT o AST) al cabo de 24 a 48 horas tras la perfusión. Por lo general, estas elevaciones volvieron a los niveles de transaminasas previos a la perfusión antes de la siguiente perfusión programada.1
La reducciones del volumen del hígado se mantuvieron.1,3,5,6

Esta gráfica ha sido creada a partir del texto de las publicaciones. Todos los pacientes pertenecen al estudio ASCEND
En otro estudio de extensión de diseño abierto,† se observó una REDUCCIÓN DEL 44% del volumen del hígado al cabo de 6,5 años (n=5)1
* A partir de la semana 52, todos los pacientes recibieron XENPOZYME®1
† Cinco pacientes de ASMD adultos que participaron en un estudio de diseño abierto de dosis incremental continuaron el tratamiento en un estudio de extensión de diseño abierto y recibieron XENPOZYME® durante al menos >7 años. Durante el transcurso del estudio, se observaron mejoras sostenidas en el % predicho de DLco, los volúmenes del bazo y el hígado y el recuento de plaquetas, respecto al inicio, en pacientes adultos.1
Xenpozyme® aumentó el recuento de plaquetas1
Aumento del recuento de plaquetas. Durante 52 semanas respecto al placebo(p=0,02) 1,3,6*


*Los datos presentados son medias MC. Las barras verticales representan el SE para las medias MC.1,3,6
Aumento sostenido del recuento de plaquetas
Aumento del recuento de plaquetas durante 104 semanas respecto al inicio 1,3,6*

Esta gráfica ha sido creada a partir del texto de las publicaciones. Todos los pacientes pertenecen al estudio ASCEND
En otro estudio de extensión de diseño abierto,† se observó un AUMENTO DEL 39% del recuento de plaquetas al cabo de 6,5 años (n=5)1
* A partir de la semana 52, todos los pacientes recibieron XENPOZYME®.1
† Cinco pacientes de ASMD adultos que participaron en un estudio de diseño abierto de dosis incremental continuaron el tratamiento en un estudio de extensión de diseño abierto y recibieron XENPOZYME® durante al menos >7 años. Durante el transcurso del estudio, se observaron mejoras sostenidas en el % predicho de DLco, los volúmenes del bazo y el hígado y el recuento de plaquetas, respecto al inicio, en pacientes adultos.1
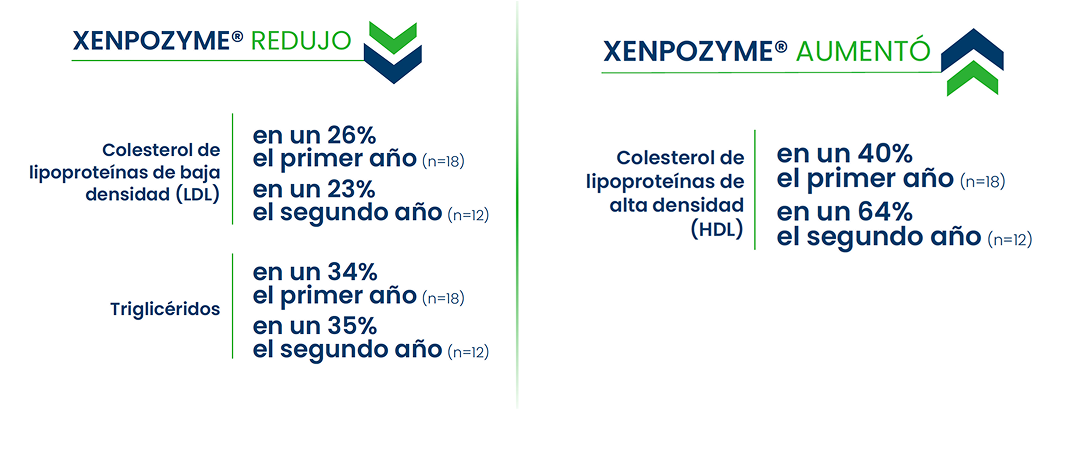
Xenpozyme® mejoró los parámetros lipídicos en comparación con el placebo6


Contenido mínimo de Xenpozyme®
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
Xenpozyme 4 mg polvo para concentrado para solución para perfusión – 1 vial (CN 762543.8): PVP notificado: 3.430,91 €, PVP IVA notificado: 3.568,15 €. Medicamento sujeto a prescripción médica. Financiado por el SNS. Uso hospitalario.
Ver ficha técnica de Xenpozyme 4 mg.
Xenpozyme 20 mg polvo para concentrado para solución para perfusión – 1 vial (CN 758015.7): PVP notificado: 3.430,91 €, PVP IVA notificado: 3.568,15 €. Medicamento sujeto a prescripción médica. Financiado por el SNS. Uso hospitalario.
Ver ficha técnica de Xenpozyme 20 mg
▼ «Este medicamento está sujeto a seguimiento adicional, es prioritaria la notificación de sospechas de reacciones adversas asociadas a este medicamento.»
Referencias
ALT = alanina aminotransferasa; ASMD = déficit de esfingomielinasa ácida (Acid Sphingomyelinase Deficiency); AST = aspartato aminotransferasa; DLco = difusión pulmonar de monóxido de carbono (diffusion capacity of the lungs for carbon monoxide); DE = desviación estándar; IC = intervalo de confianza; MN= múltiplos de lo normal.
- Ficha técnica Xenpozyme®. Consultado en julio 2025. Disponible en: https://cima.aemps.es/cima/dochtml/ft/1221659001/FT_1221659001.html#4.1
- McGovern MM,et al. Orphanet J Rare Dis. 2021;16(1):212.
- Wasserstein M, et al. Genet Med. 2022;24(7):1425-1436.
- McGovern MM, et al. Orphanet J Rare Dis. 2017;12(1):41.
- WassersteinMP, et al. Mol Genet Metab. 2021;135(2):S126-S127.
- Wasserstein MP, et al. Póster presentado en 18º simposio anual WORLD; Febrero 9, 2022; San Diego, CA.
MAT-ES 2502047 V2 julio 2025