- Artículo
- Fuente: Campus Sanofi
- 10 oct 2023
Fase II B: Estudio de ▼Beyfortus® en lactantes prematuros
En lactantes prematuros 29-35 semanas, Beyfortus® redujo el riesgo de ITRI por VRS atendida médicamente (AM), incluidas las hospitalizaciones, en un 70,1%1,2
Diseño del estudio
Ensayo multicéntrico de fase IIb aleatorizado, doble ciego y controlado con placebo. La población del estudio incluyó a 1.453 lactantes muy y moderadamente prematuros (EG ≥29 a <35 semanas) que iniciaban su primera temporada. Los lactantes fueron aleatorizados 2:1 para recibir una dosis intramuscular única fija de 50 mg de Beyfortus® (n=969) o placebo (n=484).1,2
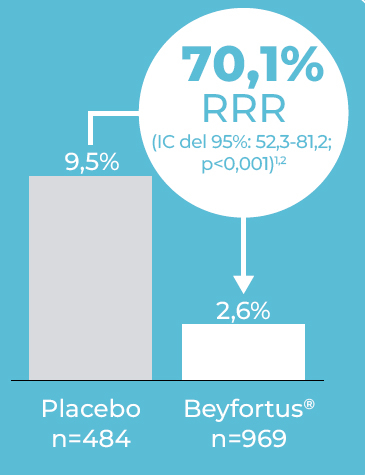
Criterio principal de valoración
Incidencia de ITRI por VRS AM (en hospital o ambulatorios) hasta 150 días después de la administración.1,2
Extraído de Griffin MP et al. 2020.
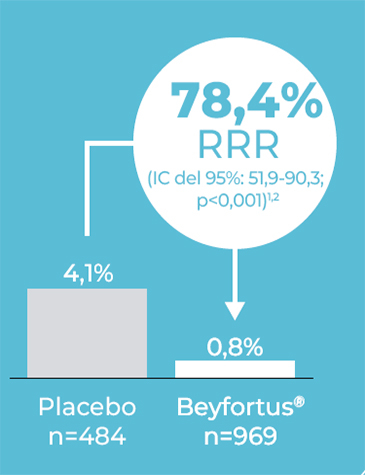
Criterio de valoración secundario
Incidencia de hospitalización por ITRI por VRS hasta150 días después de la inyección.1,2
Extraído de Griffin MP et al. 2020.
En un análisis post-hoc de 860 lactantes con peso <5 kg y que recibieron una dosis de 50 mg consistente con la dosis recomendada en función del peso en la ficha técnica,*,** Beyfortus® (n=570) mostró:3,4 86,2% RRR de ITRI por VRS AM hasta el día 150 vs. placebo (n=290) (IC del 95%: 68,0-94,0).3,4 La incidencia fue del 1% con Beyfortus® vs. 9% con placebo.3,4
Los tipos y frecuencias de las reacciones adversas fueron similares en los grupos de Beyfortus® y placebo.2
De acuerdo con la ficha técnica, la reacción adversa mas frecuente fue la erupción (0,7 %) que se produjo en los 14 días posteriores a la dosis. La mayoria de los casos fueron de intensidad leve a moderada. Ademas, se notificaron pirexia y reacciones en el lugar de la inyeccion en una tasa de 0,5 % y 0,3 % dentro de los 7 días posteriores a la dosis, respectivamente.1
Evidencia Clínica de Beyfortus® (Nirsevimab)
Consulta los estudios que apoyan los datos de eficacia Beyfortus® (Nirsevimab)
Contenido mínimo de Beyfortus®
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y PRESENTACIÓN
BEYFORTUS® 50 mg SOLUCIÓN INYECTABLE EN JERINGA PRECARGADA, 1 jeringa precargada (CN: 762403) y BEYFORTUS® 100 mg SOLUCIÓN INYECTABLE EN JERINGA PRECARGADA, 1 jeringa precargada (CN: 762405) PVP notificado: 812,67 € PVP IVA notificado: 845,18 €. Financiada por el SNS. Con receta.
Ficha Técnica Beyfortus® 50mg Ficha Técnica Beyfortus® 100 mg
▼ «Este medicamento está sujeto a seguimiento adicional, es prioritaria la notificación de sospechas de reacciones adversas asociadas a este medicamento.»
* En la ficha técnica de la UE, la dosis recomendada es una dosis única de 50 mg administrada por vía intramuscular para lactantes con un peso corporal <5 kg y una dosis única de 100 mg administrada por vía intramuscular para lactantes con un peso corporal >5 kg.1
**El análisis post-hoc incluyó solo a lactantes del estudio fase IIb que pesaban <5 kg en el momento de la administración y recibieron 50 mg de Beyfortus® (n=570) o placebo (n=290).3,4
IC, intervalo de confianza; EG, edad gestacional; ITRI, infección del tracto respiratorio inferior AM, médicamente atendido; RRR, reducción del riesgo relativo; VRS, Virus Respiratorio Sincitial.
Referencias
- Ficha técnica Beyfortus®. https://cima.aemps.es/cima/dochtml/ft/1221689004/FT_1221689004.html Acceso Noviembre 2023
- Griffin MP et al. N Engl J Med 2020; 383(5): 415–425
- Beyfortus®. European Public Assessment Report. 2022. https://www.ema.europa.eu/en/documents/assessment-report/beyfortus-epar-public-assessment-report_en.pdf. Último acceso: abril de 2023.
- Simoes EAF et al. Lancet Child Adolesc Health 2023. https://www.thelancet.com/journals/lanchi/article/PIIS2352-4642(22)00321-2/abstract [Epub ahead of print]
- Muller WJ. et N Engl Med. 2023 Apr 20;388(16):1533-1534
MAT-ES-2400637 V1 Febrero 2024