- Artículo
- Fuente: Campus Sanofi
- 10 abr 2024
Caso Clínico: Sevelámero y modulación de la inflamación en hemodiálisis, espectro y mecanismos

Se trata de un paciente varón de 68 años de edad con antecedentes de diabetes mellitus, con retinopatía y neuropatía diabética, hipertensión arterial, hiperuricemia, dislipemia y enfermedad renal crónica (ERC), presumiblemente secundaria a enfermedad renal diabética. Refería desde hacía años un cuadro de molestias abdominales inespecíficas, sensación ocasional de hinchazón abdominal y alteraciones en el hábito deposicional, alternando episodios de diarreas con estreñimiento, con estudios digestivos normales, que había sido catalogado como síndrome de intestino irritable. Se inicia el tratamiento renal sustitutivo mediante hemodiálisis en 2020 a través de una fístula arteriovenosa nativa. Recibía tratamiento con losartán, amlodipina, atorvastatina y acetato cálcico.
En la analítica realizada dos meses después del inicio de la hemodiálisis, presentaba: hemoglobina: 11,1 g/dL; hematocrito 33,4%; ferritina: 611 µ/L; índice de saturación de la transferrina: 29%; albúmina: 3,1 g/L; calcio: 9,8 mg/dL; fósforo: 6,1 mg/dL; hormona paratiroidea intacta: 462 pg/mL; y proteína C-reactiva (PCR): 10,3 mg/L.
El Kt/V era de 1,48. Destacaba la hiperfostatemia y las elevadas concentraciones de PCR, siendo especialmente llamativa esta última. El paciente no era portador de catéter venoso central ni presentaba ningún episodio intercurrente que justificase el incremento de PCR. Se decidió profundizar en el perfil inflamatorio solicitando niveles séricos de citocinas inflamatorias, endotoxinas y CD14 soluble (Tabla 1). Desde el punto de vista terapéutico, se suspendió el acetato cálcico y se inició carbonato de sevelámero, con una dosis inicial de 2,4 g/día y titulación hasta llegar a 2,4 g tres veces al día a las tres semanas.
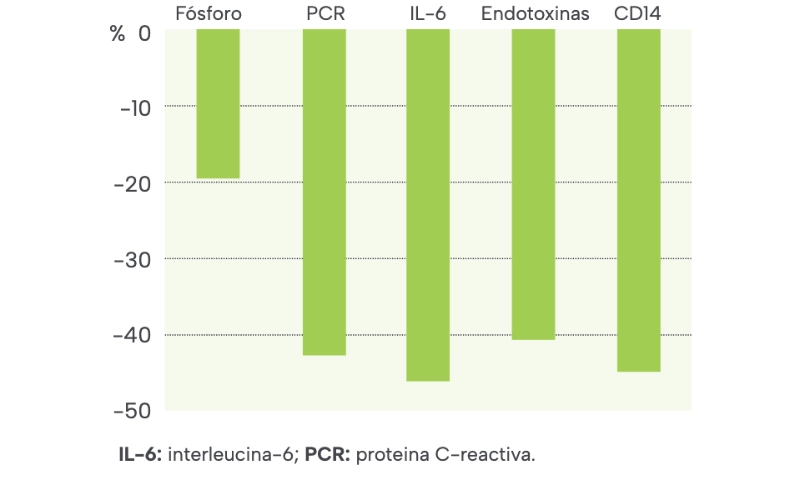
Tras un mes de tratamiento, las concentraciones de fósforo sérico habían descendido a 5,4 mg/dL. Después de tres meses de iniciar la terapia con sevelámero, la concentración de fósforo sérico era de 4,9 mg/dL, y los estudios analíticos complementarios demostraron una reducción en las concentraciones de los parámetros inflamatorios, así como los niveles séricos de endotoxinas y CD14 (Tabla 1 y Figura 1).
Tabla 1. Evolución de parámetros de metabolismo mineral y perfil inflamatorio tras el tratamiento con carbonato de sevelámero
|
Basal |
3 meses |
Cambio | |
|
Calcio (mg/dL) |
9,8 |
9,5 |
-0,3 |
|
Fósforo (mg/dL) |
6,1 |
4,9 |
-1,2 |
|
Producto CaxP (mg2/dL2) |
59,7 |
46,5 |
-13,2 |
|
PTH intacta (pg/mL) |
462 |
388 |
-74 |
|
Proteína C-reactiva (mg/L) |
10,3 |
5.9 |
-4,4 |
|
Interleucina-6 (pg/mL) |
9.1 |
4.9 |
-4,2 |
|
Endotoxinas (UE/mL) |
0,59 |
0,35 |
-0,24 |
|
CD14 soluble (µg/mL) |
4,9 |
2,7 |
-2,2 |
Figura 1. Cambio porcentual en los niveles de parámetros séricos después de tres meses de tratamiento con sevelámero.
Discusión
Las alteraciones del metabolismo mineral, con especial protagonismo para la hiperfosfatemia, y la inflamación son hechos característicos y prácticamente consustanciales a la ERC. Entre el 30 y el 50% de estos pacientes presentan marcadores indicativos de la presencia de un estado inflamatorio activo, con una frecuencia aún más elevada en los estadios más avanzados de la enfermedad1,2. Las causas de este proceso inflamatorio son numerosas, y entre ellas, se encuentran: la disbiosis intestinal, la generación de endotoxinas y las alteraciones de la permeabilidad de la pared del tracto digestivo3.
Importantemente, las elevadas concentraciones de fósforo sérico en los pacientes con ERC se asocian de forma directa y significativa con mayores niveles de parámetros inflamatorios (PCR e interleucina-6), siendo la hiperfosfatemia un factor de riesgo independiente para la presencia de un estado inflamatorio en estos pacientes4. El caso clínico que se presenta es un ejemplo de lo comentado: un paciente con ERC en estadio 5D, con un estado inflamatorio evidente (PCR: 10,3 mg/L), sin foco inflamatorio aparente, pero con niveles elevados de endotoxinas y CD14 soluble.
Es conocido que la exposición a productos bacterianos solubles, tales como fragmentos de lipopolisacáridos (endotoxinas), es una fuente importante de inflamación5, y que en pacientes en diálisis, los niveles plasmáticos de endotoxinas están elevados, correlacionándose con marcadores de inflamación y aterosclerosis6. En el torrente circulatorio, las endotoxinas son transferidas a moléculas de CD14, que actúan como un receptor de reconocimiento con un papel crítico en la señalización de la respuesta inflamatoria7.
En este contexto, es de gran interés el efecto de la administración de sevelámero. En nuestro paciente, tras el inicio del tratamiento, no solo se evidencia una clara reducción de la concentración sérica de fósforo, sino también un descenso de los niveles de parámetros inflamatorios y de endotoxinas y CD14. Estas acciones del sevelámero, más allá de su papel como captor de fósforo, dan consistencia a los efectos pleiotrópicos reportados para esta molécula8, que no son observados con los captores de fósforo de base cálcica9.
Autor

Dr. Juan F. Navarro González
Unidad de Investigación y Servicio de Nefrología. Hospital Universitario Nuestra Señora de Candelaria. Santa Cruz de Tenerife
Contenido mínimo de Renvela®
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
Renvela 800 mg comprimidos recubiertos con película.
P.V.P.: 140,11 €. P.V.P. (IVA): 145,71 €. CN 663699. Financiado por el Sistema Nacional de
Salud. Medicamento sujeto a prescripción médica. Aportación reducida.
Renvela 0,8 g polvo para suspensión oral.
P.V.P.: 70,70 €. P.V.P. (IVA): 73,53 €. Consulte la ficha técnica completa antes de prescribir este medicamento. Financiado por el Sistema Nacional de Salud. Medicamento sujeto a prescripción médica. Aportación reducida.
Renvela 2,4 g polvo para suspensión oral.
P.V.P.: 187,21 €. P.V.P. (IVA): 194,70 €. CN 663700. Financiado por el Sistema Nacional de Salud. Medicamento sujeto a prescripción médica. Aportación reducida.

Referencias
- Stenvinkel P, Alvestrand A. Inflammation in end-stage renal disease: Sources, consequences, and therapy. Semin Dial. 2002;15(5):329-37.
- Oberg BP, McMenamin E, Lucas FL, McMonagle E, Morrow J, Ikizler TA, et al. Increased prevalence of oxidant stress and inflammation in patients with moderate to severe chronic kidney disease. Kidney Int. 2004;65(3):1009-16.
- Ebert T, Pawelzik SC, Witasp A, Arefin S, Hobson S, Kublickiene K, et al. Inflammation and premature ageing in chronic kidney disease. Toxins. 2020;12(4):227.
- Navarro-González JF, Mora-Fernández C, Muros M, Herrera H, García J. Mineral metabolism and inflammation in chronic kidney disease patients: a cross-sectional study. Clin J Am Soc Nephrol. 2009;4(10):1646-54.
- Sundaram S, Barrett TW, Meyer KB, Perella C, Neto MC, King AJ, et al. Transmembrane passage of cytokine-inducing bacterial products across new and reprocessed polysulfone dialyzers. J Am Soc Nephrol. 1996;7(10):2183-91.
- Hauser AB, Stingher AEM, Gonçalves SM, Bucharles S, Pecoits-Filho R. A gut feeling on endotoxemia: Causes and consequences in chronic kidney disease. Nephrol Clin Pract. 2010;118(2):c165-72.
- Pugin J, Heumann ID, Tomasz A, Kravchenko VV, Akamatsu Y, Nishijima M, et al. CD14 is a pattern recognition receptor. Immunity. 1994;1(6):509-16.
- Nikolov IJ, Joki M, Maizel J, Lacour B, Drueke T, Massy ZA. Pleiotropic effects of the non-calcium phosphate binder sevelamer. Kidney Int Suppl. 2006;70(105):S16-23.
- Navarro-González JF, Mora-Fernández C, Muros de Fuentes M, Donate-Correa J, Cazaña-Pérez V, García-Pérez J. Effect of Phosphate Binders on Serum Inflammatory Profile, Soluble CD14, and Endotoxin Levels in Hemodialysis Patients. Clin J Am Soc Nephrol. 2011;6(9):2272-9.
MAT-ES-2301867-V.1-Octubre 2023