- Artículo
- Fuente: Campus Sanofi
- 17 ene 2024
Caso clínico: Control de la hormona paratiroidea, no te olvides del fósforo
Introducción
Se trata de una mujer de 52 años con antecedentes de hipertensión arterial, enolismo crónico en abstinencia durante seis meses, hepatopatía crónica de origen enólico sin descompensaciones hidrópicas e infección previa por virus de la hepatitis C.

Formato PDF, 4 páginas
La paciente estaba diagnosticada de enfermedad renal crónica (ERC) de origen no filiado, presumiblemente nefroangioesclerosis (no biopsiada por negativa de la paciente) y creatinina basal de 3 mg/dL (filtrado glomerular estimado [FGe] de 26 mL/min/1,72 m3CKD-EPI).
Ingresa procedente de urgencias por empeoramiento del estado general, disnea de mínimos esfuerzos (clase funcional de la New York Heart Association [NYHA] III/IV), astenia, adinamia y náuseas en el contexto de reagudización de su ERC con creatinina de hasta 10 mg/dL y oligoanuria. La analítica al ingreso se puede ver en la Tabla 1. Los niveles de albúmina eran de 3,2 g/dL. Destacaba una hipoalbuminemia y había sospecha de malnutrición en la escala de desnutrición-inflamación (MIS, Malnutrition Inflammation Score).
Su tratamiento habitual incluía omeprazol, furosemida, espironolactona, enalapril e hidroferol cada 15 días. Durante el ingreso, dado el empeoramiento del FGe y la clínica urémica, se decide el inicio de terapia renal sustitutiva mediante hemodiálisis. Los anticuerpos citoplasmáticos antineutrófilos, los anticuerpos antinucleares, las crioglobulinas y el complemento sérico, fueron normales. La serología viral fue negativa para hepatitis C.
Tratamiento
La paciente fue valorada por la unidad de nutrición, quien ajustó la dieta, incrementando el aporte de proteínas. El tiempo de diálisis se fue aumentando de forma incremental, manteniendo una adecuada diuresis residual. Nutrición recomendó una dieta con aporte de proteínas de origen vegetal y animal con restricción de fósforo inorgánico.
Adicionalmente, se instauró un tratamiento con captores del fósforo sin contenido cálcico (carbonato de sevelámero) en las principales comidas, lo que permitió reducir la carga de calcio asociada a captores con contenido cálcico. Se mantuvo estable la suplementación de vitamina D.
Evolución
En el momento del ingreso, se detectó un incremento notable de los niveles de fósforo y de hormona paratiroidea (PTH) de 4,1 a 6,6 mg/dL y de 198 a 632 pg/dL respectivamente (Tabla 1).
Una vez iniciadas las recomendaciones dietéticas e instaurado el tratamiento con carbonato de sevelámero, se observó una reducción progresiva en los niveles de fosfato sérico y una normalización de la albúmina sérica (Figura 1). Concomitantemente, las cifras de PTH se situaron en el rango recomendado por las guías clínicas actuales1. La paciente mejoró su estado general progresivamente.
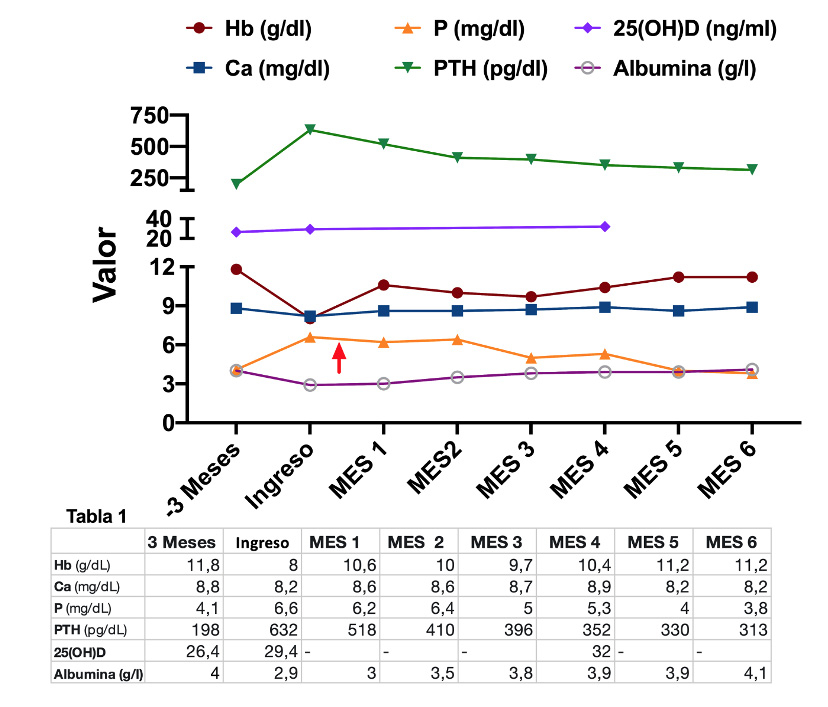
Figura 1. Evolución analítica de la paciente. La flecha roja representa el momento en el que se introdujo el carbonato de sevelámero (2.400 mg en comida y cena)*.
Dicusión
La hiperfostatemia es una de las principales causas del desarrollo de un hiperparatiroidismo secundario. Se estima que hasta el 50% de los sujetos con ERC terminal presentan hiperfosfatemia durante su seguimiento2.
El hiperparatiroidismo secundario es una respuesta fisiológica al déficit de calcio, pero también al incremento del fosfato sérico y al déficit de vitamina D3,4. Estudios en animales demostraron que la restricción de fósforo en la dieta no solo reducía la producción de PTH por parte de la paratiroides, sino que también era capaz de corregir parcialmente el hiperparatiroidismo secundario de forma independiente a la homeostasis del calcio y de la vitamina D5,6.
Estudios in vivo e in vitro han demostrado que la célula paratiroidea responde a los cambios en los niveles de fosfato a nivel de secreción, nivel génico y de proliferación celular3.
De hecho, estudios en animales sometidos a dietas bajas en calcio y fosfato y, por tanto, niveles bajos de calcio y fosfato en suero, demostraron que el déficit de vitamina D no se acompañó de incremento en los niveles de PTH, sino, por el contrario, de un descenso de hasta el 70% en los niveles de esta hormona6, lo que señala directamente al fósforo como modulador de la secreción de PTH de forma independiente a los niveles de vitamina D y calcio. Estos resultados han sido refrendados por estudios clínicos que han mostrado que la restricción de fosfato se asoció a una reducción en los niveles de PTH7.
Además, recientemente se ha descrito cómo el fosfato es capaz de unirse al receptor sensor de calcio paratiroideo estimulando la liberación de paratohormona8, al tiempo que puede atenuar el efecto de los calcimiméticos9.
No se puede olvidar que, en el contexto de hiperparatiroidismo secundario severo, el alto recambio óseo favorece la liberación de fosfato desde el hueso, de tal forma que parte del fosfato circulante proviene del hueso y no de la dieta. La reducción de los niveles de PTH, y, por tanto, del recambio óseo, favorecerá también la reducción de la fosfatemia por la reducción de su liberación desde el hueso.
Nuestra paciente muestra un hiperparatiroidismo secundario severo que parece haber empeorado en el contexto de la agudización de su ERC. La hiperfosfatemia requiere una aproximación multifactorial, incluyendo ajustes en la dieta, la técnica de diálisis y el uso de captores de fosfato. El uso de captores sin contenido cálcico reduce el riesgo de progresión de calcificaciones arteriales. Dado que el incremento de la paratohormona se asoció a la hiperfosfatemia, se decidió intensificar el tratamiento de los niveles elevados de fósforo sérico, con lo que se consiguió una reducción en los niveles de paratohormona hasta los rangos recomendados por las guías actuales de práctica clínica1.
Este caso refuerza la hipótesis de que se debe iniciar precozmente el tratamiento de la hiperfosfatemia, si es factible con un captor no cálcico, en el momento de enfrentarnos a un incremento en los niveles circulantes de PTH en pacientes con ERC avanzada.
Autores

Dr. Alejandro Martín Malo
Unidad de Gestión Clínica (UGC) de Nefrología. Hospital Universitario Reina Sofía. Córdoba Instituto Maimónides de Investigación Biomédica de Córdoba (IMIBIC). Hospital Universitario Reina Sofía. Universidad de Córdoba.
Redes Temáticas de Investigación Cooperativa en Salud (RETICS), Red Renal (Instituto de Salud Carlos III). Madrid.

Dr. Cristian Rodelo-Haad
Unidad de Gestión Clínica (UGC) de Nefrología. Hospital Universitario Reina Sofía. Córdoba Instituto Maimónides de Investigación Biomédica de Córdoba (IMIBIC). Hospital Universitario Reina Sofía. Universidad de Córdoba.
Redes Temáticas de Investigación Cooperativa en Salud (RETICS), Red Renal (Instituto de Salud Carlos III). Madrid.
*Datos obtenidos de evolutivo del paciente. Autoría del primer firmante.
25(OH)D: 25-hidroxivitamina D; Ca: calcio; Hb: hemoglobina; P: fósforo; PTH: hormona paratiroidea.
Contenido mínimo de Renvela®
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
Renvela 800 mg comprimidos recubiertos con película.
P.V.P.: 140,11 €. P.V.P. (IVA): 145,71 €. CN 663699. Financiado por el Sistema Nacional de
Salud. Medicamento sujeto a prescripción médica. Aportación reducida.
Renvela 0,8 g polvo para suspensión oral.
P.V.P.: 70,70 €. P.V.P. (IVA): 73,53 €. Consulte la ficha técnica completa antes de prescribir este medicamento. Financiado por el Sistema Nacional de Salud. Medicamento sujeto a prescripción médica. Aportación reducida.
Renvela 2,4 g polvo para suspensión oral.
P.V.P.: 187,21 €. P.V.P. (IVA): 194,70 €. CN 663700. Financiado por el Sistema Nacional de Salud. Medicamento sujeto a prescripción médica. Aportación reducida.

Referencias
- Torregrosa JV, Bover J, Cannata Andia J, Lorenzo V, De Francisco AL, Martinez I, et al. Spanish Society of Nephrology recommendations for controlling mineral and bone disorder in chronic kidney disease patients (S.E.N.-M.B.D.). Nefrología. 2011;31 Supl 1:3-32.
- Isakova T, Wahl P, Vargas GS, Gutiérrez OM, Scialla J, Xie H, et al. Fibroblast growth factor 23 is elevated before parathyroid hormone and phosphate in chronic kidney disease. Kidney Int. 2011;79(12):1370-8.
- Almaden Y, Canalejo A, Hernández A, Ballesteros E, García-Navarro S, Torres A, et al. Direct effect of phosphorus on PTH secretion from whole rat parathyroid glands in vitro. J Bone Miner Res. 1996;11(7):970-6.
- Almaden Y, Felsenfeld AJ, Rodríguez M, Cañadillas S, Luque F, Bas A, et al. Proliferation in hyperplastic human and normal rat parathyroid glands: role of phosphate, calcitriol, and gender. Kidney Int. 2003;64(6):2311-7.
- Slatopolsky E, Finch J, Denda M, Ritter C, Zhong M, Dusso A, et al. Phosphorus restriction prevents parathyroid gland growth. High phosphorus directly stimulates PTH secretion in vitro. J Clin Invest. 1996;97(11):2534-40.
- Lopez-Hilker S, Dusso AS, Rapp NS, Martin KJ, Slatopolsky E. Phosphorus restriction reverses hyperparathyroidism in uremia independent of changes in calcium and calcitriol. Am J Physiol. 1990;259(3 Pt 2):F432-7.
- Combe C, Aparicio M. Phosphorus and protein restriction and parathyroid function in chronic renal failure. Kidney Int. 1994;46(5):1381-6.
- Centeno PP, Herberger A, Mun HC, Tu C, Nemeth EF, Chang W, et al. Phosphate acts directly on the calcium-sensing receptor to stimulate parathyroid hormone secretion. Nat Commun. 2019;10(1):4693.
- Goodman WG, Ward DT, Martin KJ, Drayer D, Moore C, Xu J, et al. Activation of the Calcium Receptor by Calcimimetic Agents Is Preserved Despite Modest Attenuating Effects of Hyperphosphatemia. J Am Soc Nephrol. 2022;33(1):201-12.
MAT-ES-2301864-V.1-Enero 2024