- Artículo
- Fuente: Campus Sanofi
- 17 dic 2025
Estudio SAPHYR: Kevzara®, primer y único tratamiento aprobado para la PMR¹⁻²
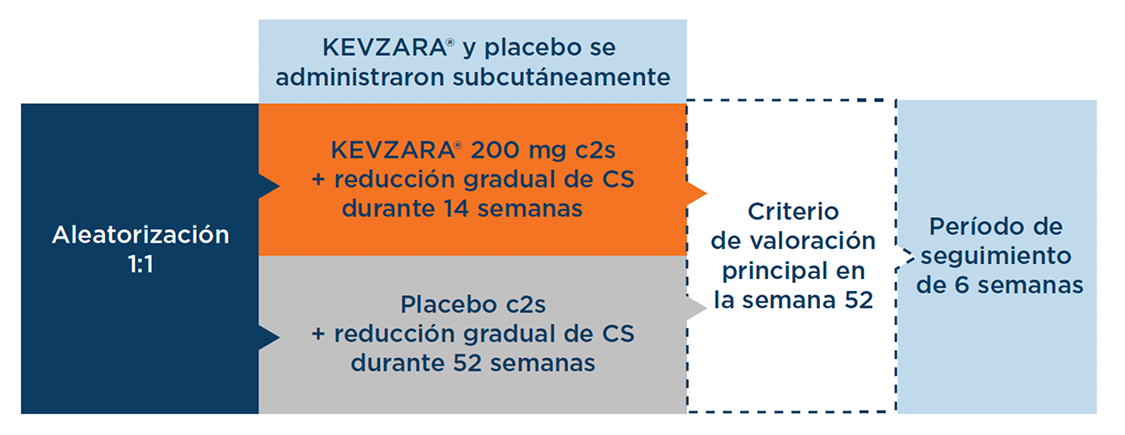
SAPHYR: ensayo clínico multicéntrico, con doble ciego y controlado con placebo, de 52 semanas de duración1,3
En el ensayo de fase III, se aleatorizaron 118 pacientes con PMR* a recibir KEVZARA® 200 mg cada 2 semanas con una pauta de reducción gradual de CS predefinida de 14 semanas (N = 60) o placebo cada 2 semanas con una pauta de reducción gradual de los CS predefinida de 52 semanas (N = 58).1,3,†
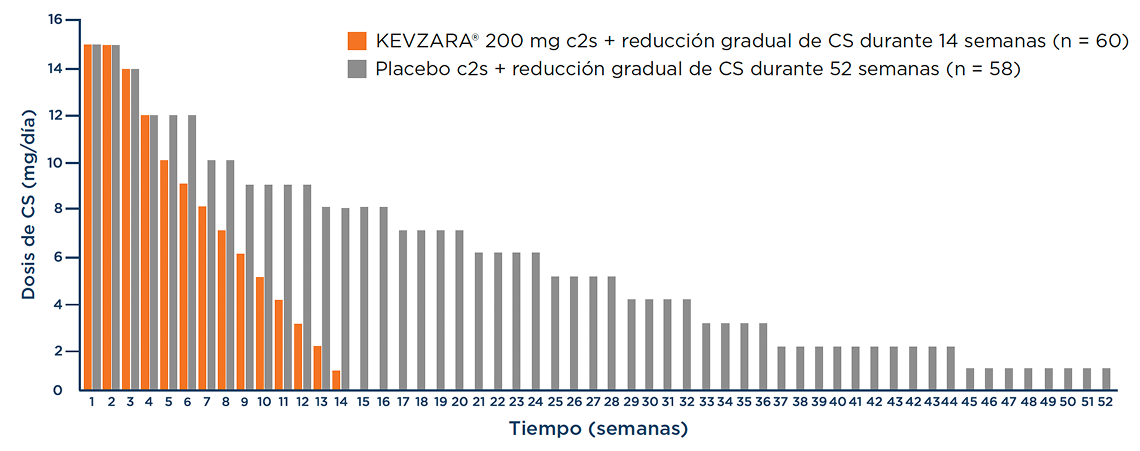
Pauta de reducción gradual de CS predefinida1,3
*La polimialgia reumática (PMR) se diagnosticó basándose en los criterios ACR/EULAR.1
†Un paciente se aleatorizó a KEVZARA® + reducción gradual de CS durante 14 semanas, aunque no recibió tratamiento.1
El criterio de valoración principal fue un criterio de valoración compuesto de 4 parámetros1,3
Criterio de valoración principal1,3
Proporción de pacientes con remisión sostenida en la semana 52. La remisión sostenida se definió como el cumplimiento de los 4 parámetros establecidos:
- Ausencia de signos, y síntomas y PCR <10 mg/l (remisión de la enfermedad*) no más tarde de la semana 12
- Ausencia de exacerbación de la enfermedad† entre la semana 12 y la semana 52
- Reducción sostenida de la PCR (<10 mg/l) entre la semana 12 y la semana 52
- Cumplimiento satisfactorio de la reducción gradual de prednisona entre la semana 12 y la semana 52
Criterios de valoración secundarios1,3
- Parámetros del criterio de valoración compuesto de remisión sostenida en la semana 52
- Dosis total acumulada de CS durante las 52 semanas
- Tiempo hasta la primera exacerbación de la enfermedad tras remisión clínica
- Puntuación compuesta del Índice de Toxicidad de los Glucocorticoides
- Criterios de valoración de seguridad
Características demográficas y basales de los pacientes3
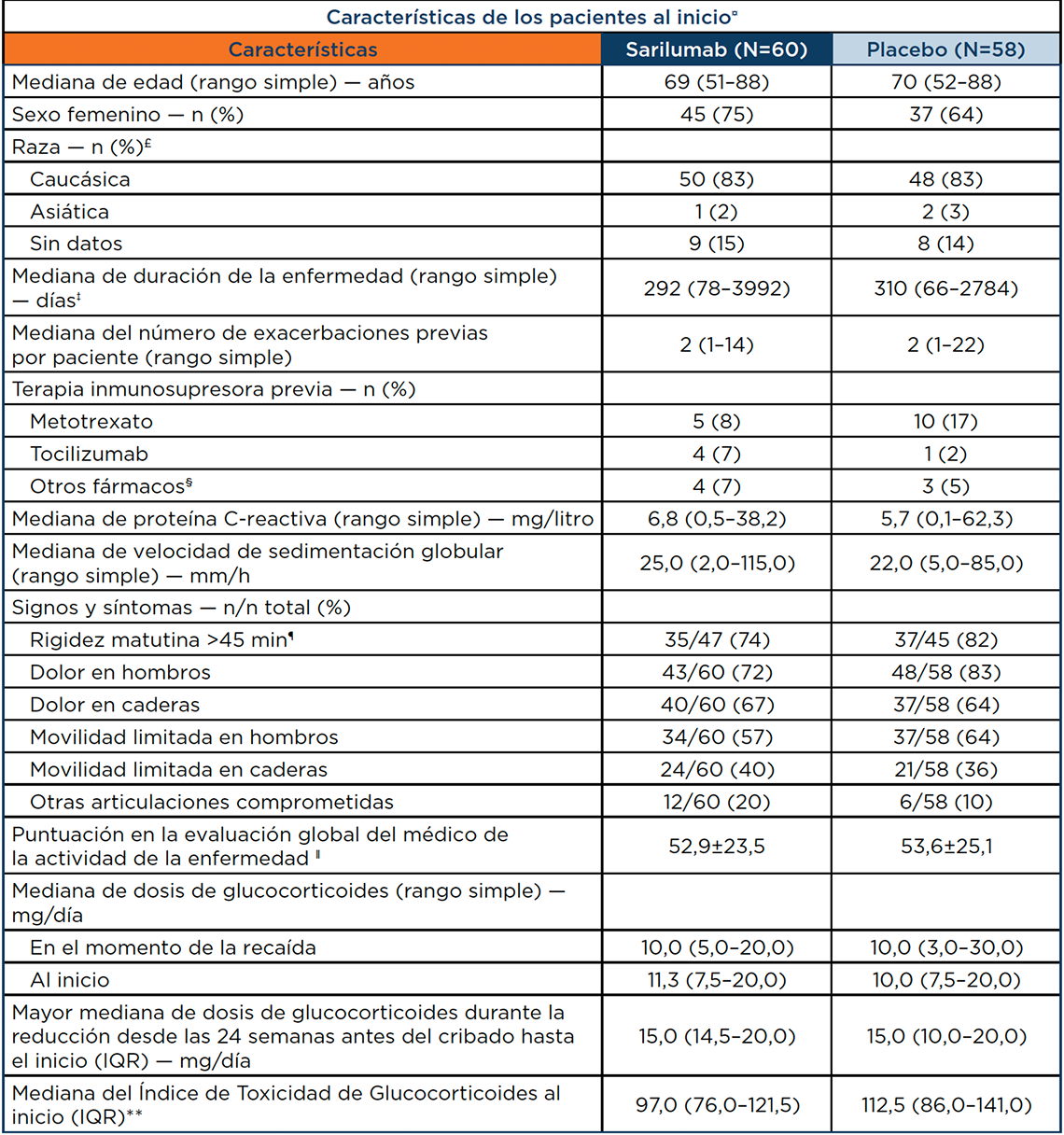
Tabla extraída de Spiera R, et al. N Engl J Med. 2023.
* La remisión de la enfermedad se define como la resolución de los signos y síntomas de PMR y la normalización de los valores de PCR (<10 mg/l).3
† La exacerbación se define como la recurrencia de los signos y síntomas atribuible a la PMR activa que precisa un aumento de la dosis de corticoides o el aumento de la VSG atribuible a la PMR activa más un aumento de la dosis de corticoides.1,3
¤ Los valores con signo ± son medias ±DE. Los valores de la mediana se presentan con un rango simple o un rango intercuartílico (IQR), según se indica.
£ La raza fue reportada por los pacientes. La recopilación de datos sobre raza o antecedentes étnicos no estaba permitida en Francia. Ningún paciente se identificó como negro o afroamericano, nativo de Hawái u otra isla del Pacífico, o nativo americano o nativo de Alaska.
‡ La duración de la enfermedad se midió desde la fecha del diagnóstico hasta el inicio del ensayo. Los datos sobre la duración de la enfermedad estuvieron disponibles para 54 pacientes en el grupo de sarilumab y para 50 en el grupo placebo. La mediana global de la duración de la enfermedad en los dos grupos combinados fue de 300 días (rango simple, 66 a 3992).
§ Otros fármacos inmunosupresores fueron leflunomida (en 2 pacientes del grupo de sarilumab y 1 del grupo placebo), hidroxicloroquina (en 1 paciente de cada grupo), azatioprina (en 1 paciente del grupo placebo) y adalimumab (en 1 paciente del grupo de sarilumab).
¶ Incluidos en esta categoría están los pacientes que informaron tener rigidez matutina.
‖ En la evaluación global del médico de la actividad de la enfermedad sobre la base de una escala analógica visual, las puntuaciones oscilan entre 0 y 100, siendo las puntuaciones más altas indicativas de una mayor actividad de la enfermedad.
** Las puntuaciones en el Índice de Toxicidad de Glucocorticoides varían de 0 a 538, siendo las puntuaciones más altas indicativas de mayores efectos tóxicos.
KEVZARA® demostró una remisión sostenida estadísticamente significativa en la semana 521,3
Criterio de valoración principal: proporción de pacientes que lograron una remisión sostenida en la semana 521,3
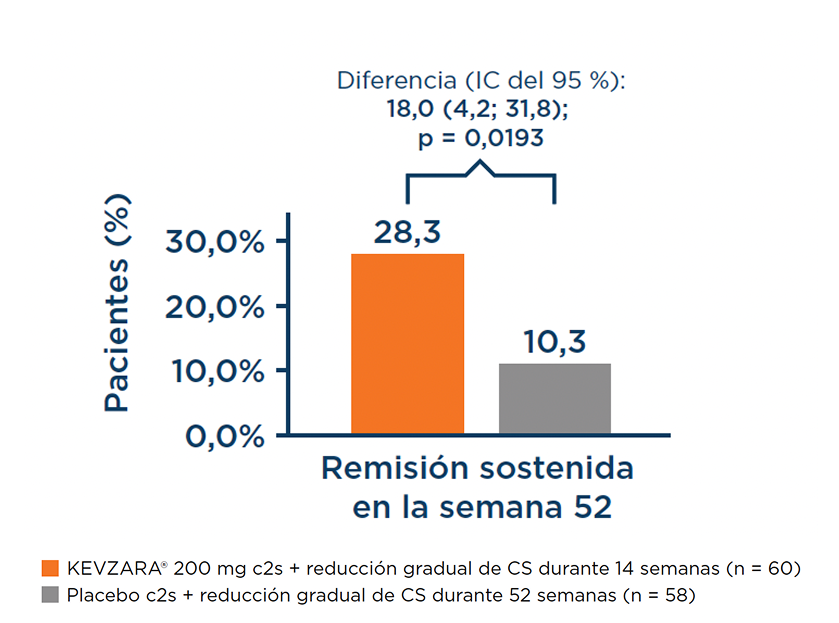
Gráfica extraida del estudio SAPHYR.3
Con la remisión sostenida, los pacientes alcanzaron la remisión de la enfermedad como máximo en la semana 12 y la mantuvieron hasta la semana 52.
KEVZARA® mostró una mejoría en todos los componentes de la remisión sostenida1,3*
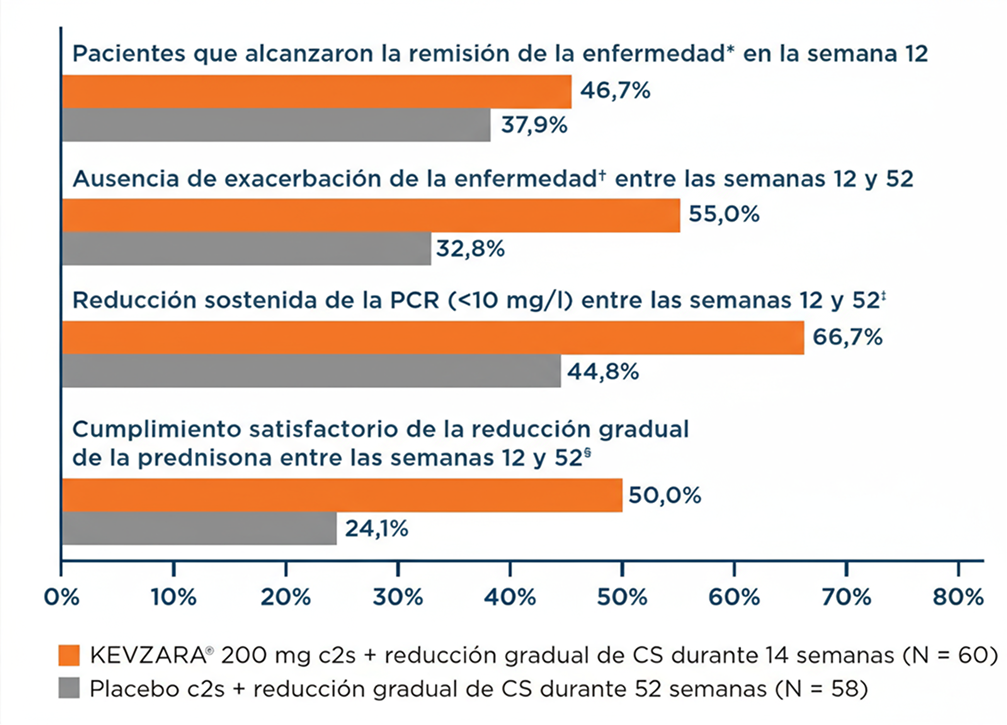
Gráfica extraida del estudio SAPHYR.3
Al llegar a la semana 12, los pacientes del grupo de KEVZARA® recibían 3 mg diarios de CS, mientras que los pacientes del grupo controlado con placebo recibían 9 mg diarios de CS (excluyendo los CS de rescate, según el protocolo del estudio).4
* La remisión de la enfermedad se define como la resolución de los signos y síntomas de PMR y la normalización de los valores de PCR (<10 mg/l).2
† La exacerbación se define como la recurrencia de los signos y síntomas atribuible a una PMR activa que precisa un aumento de la dosis de corticoides o el aumento de la VSG atribuible a una PMR activa más un aumento de la dosis de corticoides.2
‡ El estado de normalización de la PCR entre la semana 12 y la semana 52 se determinó sobre la base de los valores de PCR medidos en las semanas 16, 20, 32, 40 y 52. En caso de haber 2 o más visitas consecutivas con valores de PCR ≥10 mg/l, no se consideró como normalización de la PCR.5
§ El cumplimiento satisfactorio de la reducción gradual de la prednisona desde la semana 12 hasta la semana 52 se define como los pacientes que no recibieron tratamiento de rescate entre las semanas 12 y 52, y puede incluir cualquier uso en exceso de prednisona (superior a la pauta de reducción gradual de CS por protocolo) con una dosis acumulada de ≤100 mg (o equivalente), como la empleada para el tratamiento de los AA no relacionados con la PMR. La dosis acumulada del exceso de prednisona se contó desde la situación basal hasta la semana 52.5
Efecto ahorrador de corticoides
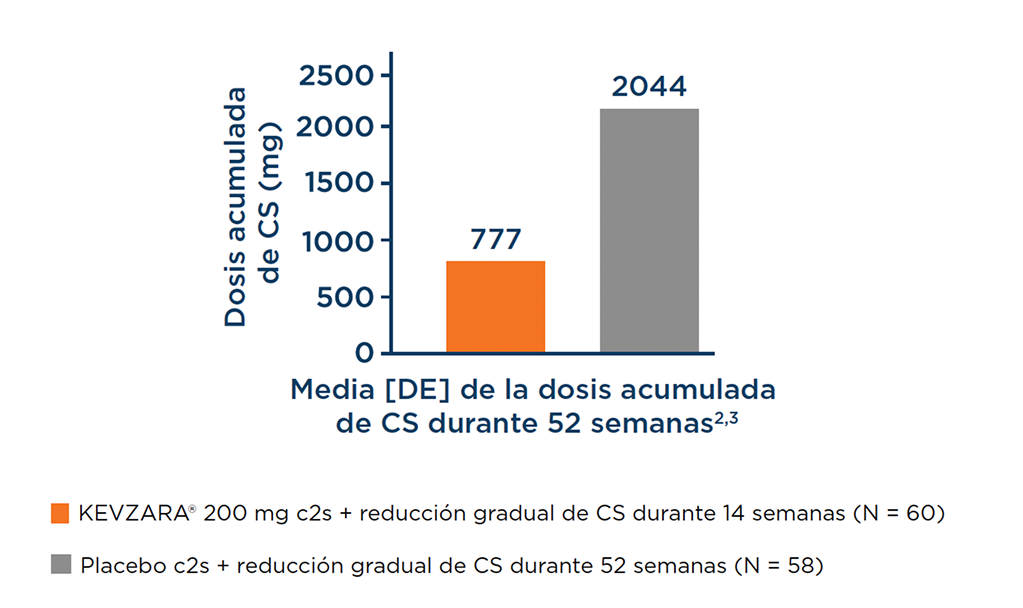
Los pacientes recibieron una dosis acumulada más baja de CS durante el periodo de tratamiento de 52 semanas en el grupo de KEVZARA® en comparación con el grupo controlado con placebo1,3
La mediana de la diferencia entre la dosis de CS acumulada real y la esperada de acuerdo con la reducción gradual de prednisona asignada fue de 0 mg en el grupo de KEVZARA® frente a 199 mg en el grupo de comparación (>50 % de los pacientes del grupo de KEVZARA® tenían la misma dosis acumulada real y esperada de CS).3
Otros análisis: Datos de resolución de los signos y síntomas de PMR sin uso de CS3,4
Análisis de la población ITT3,4
En la semana 52, 27/60 (45 %) pacientes del grupo de KEVZARA® presentaban una resolución de los signos y síntomas de PMR sin uso de CS frente a 8/58 (14 %) pacientes del grupo de comparación.
Análisis de casos observados3,4*
De los pacientes evaluables en la semana 52 que completaron el tratamiento, 27/42 (64 %) del grupo de KEVZARA® frente a 8/36 (22 %) del grupo de comparación presentaban una resolución de los signos y síntomas de PMR sin uso de CS.
A la semana 52, el 64% de los pacientes evaluables alcanzó la resolución sin CS, frente al 22% del grupo de comparación
Pese a la reducción gradual más rápida de la prednisona en el grupo de sarilumab (14 frente a 52 semanas).
Los resultados son descriptivos. No se pueden extraer conclusiones definitivas, ya que los datos no se controlaron respecto a las comparaciones múltiples.
PROs a la semana 526
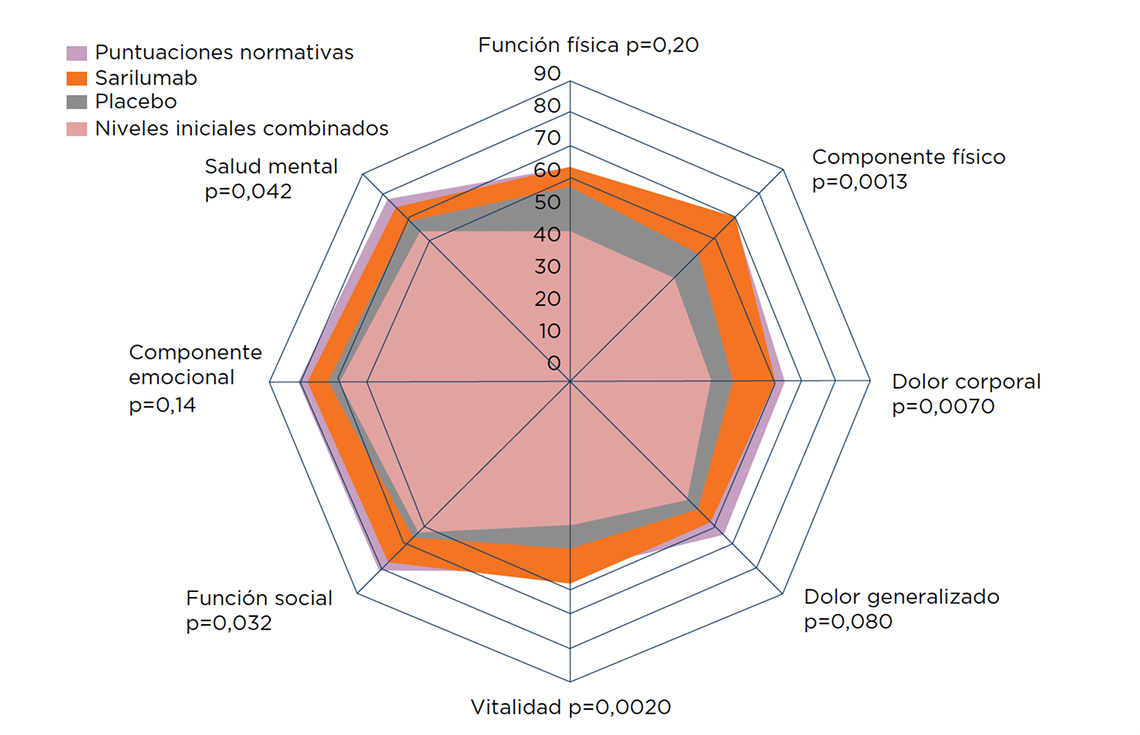
Figura: puntuaciones medias de los dominios del SF-36 al inicio y a la semana 52 en la población por intención de tratar
* Los casos observados se basan en pacientes con evaluaciones de PMR en cada visita (no se incluyeron las evaluaciones de PMR tras la suspensión del tratamiento); la primera evaluación planificada se realizó una vez completada la reducción gradual predefinida de los CS en la semana 16 en el grupo de KEVZARA® y en la semana 52 en el grupo de comparación.4
** Número de pacientes incluidos en el modelo de análisis de medidas repetidas de efectos mixtos, que incluye a los pacientes con un valor basal y al menos un valor posterior al inicio en la semana 12, 24 o 52.
† Los valores de p son nominales.
Seguridad de KEVZARA®
Por lo general, los datos de seguridad estuvieron en consonancia con el perfil de seguridad conocido de KEVZARA®1,3,7
En el ensayo SAPHYR en pacientes con PMR, la incidencia de infecciones fue más baja en el grupo de KEVZARA (37,3 %) que en el grupo controlado con placebo (50,0 %).1
- La incidencia de infecciones graves fue similar en el grupo de KEVZARA® (5,1 %) y el grupo controlado con placebo (5,2 %).1
Acontecimientos adversos más frecuentes (≥ 10%) en los pacientes del estudio SAPHYR3
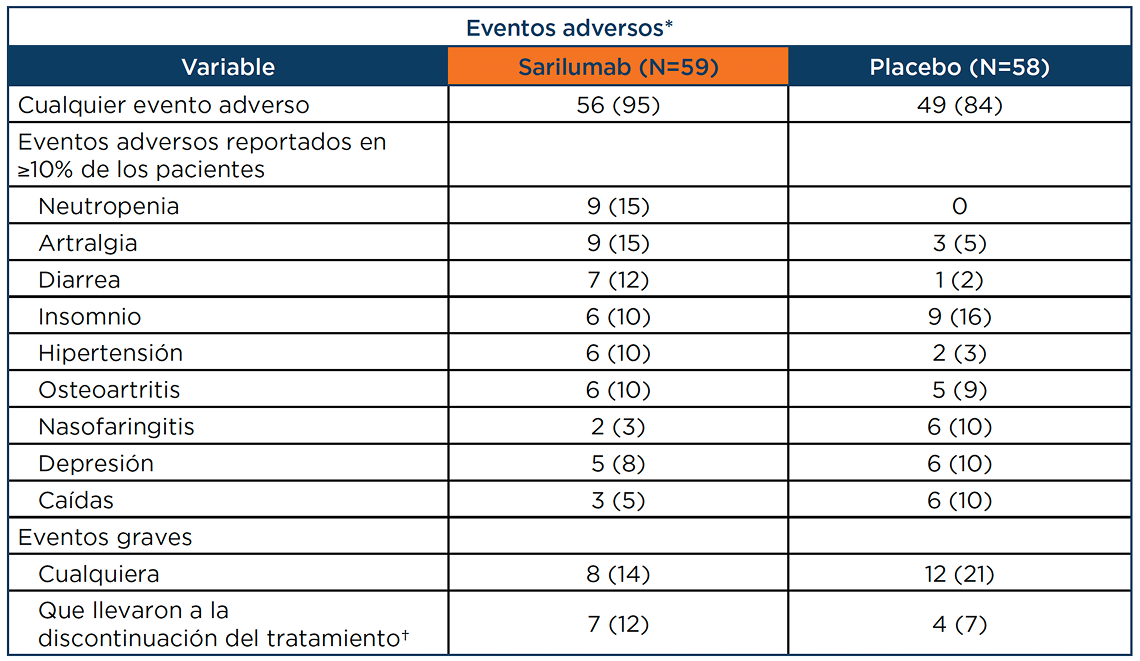
Acontecimientos adversos graves
Se produjeron acontecimientos adversos graves de neutropenia en 2 pacientes (3,4 %) del grupo de KEVZARA®, en comparación con ninguno en el grupo de placebo. En ambos casos de neutropenia, los participantes tenían un recuento de neutrófilos de menos de 500 por mm3, sin infecciones; la neutropenia se resolvió tras la suspensión definitiva del fármaco en estudio.3,4
Acontecimientos adversos posteriores al tratamiento
Se notificaron AA posteriores al tratamiento en 4/59 (7 %) pacientes del grupo de KEVZARA® y 7/58 (12 %) pacientes del grupo placebo.3
Se notificaron AA graves posteriores al tratamiento en 2/59 (3 %) pacientes del grupo de KEVZARA® y 1/58 (2 %) pacientes del grupo placebo.3
*Los términos para los eventos adversos provienen del Diccionario Médico para Actividades Regulatorias (MedDRA), versión 24.0. Los eventos adversos fueron identificados por los investigadores y supervisados por el equipo del patrocinador. Si un evento adverso no parecía cumplir los criterios de evento adverso de especial interés o de evento adverso grave, el equipo del patrocinador consultaba al investigador para garantizar la adherencia al protocolo. Un proceso de consulta similar se siguió para los eventos adversos de especial interés o eventos adversos graves que claramente cumplían los criterios según el protocolo pero que no habían sido identificados como tales por el investigador.
† En el grupo de sarilumab, los eventos adversos que llevaron a la discontinuación del tratamiento se reportaron en 1 paciente cada uno con enfermedad por coronavirus 2019 (Covid-19), discitis intervertebral, neumonía y nefrolitiasis, y en 3 pacientes con neutropenia. En el grupo placebo, estos eventos se reportaron en 1 paciente cada uno con Covid-19, arteritis de células gigantes, embolia pulmonar y elevación de alanina aminotransferasa. No se produjeron muertes en ninguno de los grupos del ensayo.
KEVZARA® primer y único tratamiento aprobado para el tratamiento de la PMR1,2
KEVZARA® demostró una remisión sostenida estadísticamente significativa en la semana 521,3
Los pacientes tratados con KEVZARA® utilizaron menos corticoides en el ensayo SAPHYR3
- Mientras que en el grupo de comparación se siguió una pauta de reducción gradual de los CS durante 52 semanas conforme a las directrices ACR/EULAR, en el grupo de KEVZARA® se siguió una pauta de reducción gradual de los CS de 14 semanas3,8
Se observó un menor número de pacientes tratados con KEVZARA® con exacerbaciones tras la remisión clínica entre las semanas 12 y 521,3
En la PMR, el perfil de seguridad global observado en el grupo de tratamiento con KEVZARA® 200 mg c2s + reducción gradual de CS durante 14 semanas estuvo, en términos generales, en consonancia con el perfil de seguridad conocido de KEVZARA1,3,7
*La dosis total acumulada real de corticoides equivalente a prednisona fue inferior en el grupo de KEVZARA® (KEVZARA® 200 mg c2s + reducción gradual de CS durante 14 semanas), con una media [DE] de 1039,5 [612,2] mg y una mediana de la dosis de 777 mg respecto al grupo de placebo (placebo c2s + reducción gradual de CS durante 52 semanas), con una media [DE] de 2235,8 [839,4] mg y una mediana de la dosis de 2.044 mg.2

Contenido mínimo de Kevzara®
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
KEVZARA® 200 mg solución inyectable en jeringa precargada, envase de 2 jeringas precargadas (CN 716173).
KEVZARA® 200 mg solución inyectable en pluma precargada, envase de 2 plumas precargadas (CN 716176).
PVP notificado: 1.033,06 € PVP IVA notificado: 1.074,38 €
Medicamento sujeto a prescripción médica. Diagnóstico hospitalario. Dispensación hospitalaria sin cupón precinto.
CONSULTE LA FICHA TÉCNICA COMPLETA ANTES DE PRESCRIBIR ESTE MEDICAMENTO.
Kevzara 200mg Jeringa
Kevzara 200mg Pluma
Kevzara está financiado en España de acuerdo con los criterios establecidos por el SNS.
Notas
AA: acontecimientos adversos; ACR: Colegio Estadounidense de Reumatología (American College of Rheumatology); c2s: cada 2 semanas; CS: corticoesteroides; DE: desviación estándar; EULAR: Alianza Europea de Asociaciones de Reumatología (European Alliance of Associations for Rheumatology); FACIT: Functional Assessment of Chronic Illness Therapy; HAQ-DI: Health Assessment Questionnaire-Disability Index; IC: intervalo de confianza; ITT: por intención de tratar; MC: mínimos cuadrados; MD-VAS: evaluación global de la actividad de la enfermedad por parte del médico - escala analógica visual; PCR: proteína C-reactiva; PMR: polimialgia reumática; PMR-AS: puntuación de la actividad de la polimialgia reumática; RPP: resultados percibidos por los pacientes; SAPHYR: Sarilumab in Patients witH polYmialgia Rheumatica; SF-36; cuestionario breve de 36 ítems; VSG: velocidad de sedimentación globular.
Referencias
- Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica de Kevzara; [consultado 12 nov 2025]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/1171196003/FT_1171196003.html.
- Agencia Española de Medicamentos y Productos Sanitarios. Boletín del Comité de Medicamentos de Uso Humano. Noviembre de 2025 [Internet]. Madrid: AEMPS; 2024 [consultado 12 nov 2025]. Disponible en: https:// www.aemps.gob.es/in forma/boletin-del-comite-demedicamentos-de-usohumano-octubre-de-2024/
- Spiera RF, Unizony S, Warrington KJ, et al. Sarilumab for relapse of polymyalgia rheumatica during glucocorticoid taper. N Engl J Med. 2023;389(14):1263-1272.
- Spiera RF, Unizony S, Warrington KJ, et al. Sarilumab for relapse of polymyalgia rheumatica during glucocorticoid taper. N Engl J Med. 2023;389(14):1263-1272. Supplementary appendix disponible en: https://www.nejm.org/doi/suppl/10.1056/NEJMoa2303452/suppl_file/nejmoa2303452_appendix.pdf. Último acceso: nov 2025
- Spiera RF, Unizony S, Warrington KJ, et al. Sarilumab for relapse of polymyalgia rheumatica during glucocorticoid taper. N Engl J Med. 2023;389(14):1263-1272. Protocol. Disponible en: https://www.nejm.org/doi/suppl/10.1056/NEJMoa2303452/suppl_file/ nejmoa2303452_protocol.pdf. Ültimo acceso: nov 2025.
- Strand V, Msihid J, Sloane J, et al. Sarilumab in relapsing polymyalgia rheumatica: patientreported outcomes from a phase 3, double-blind, randomised controlled trial. Lancet Rheumatol. 2025 Aug;7(8):e544-e553.
- Fleischmann R, Genovese MC, Lin Y, et al. Long-term safety of sarilumab in rheumatoid arthritis: an integratedanalysis with up to 7 years’ follow-up. Rheumatology. 2020;59(2):292-302.
- Dejaco C, Singh YP, Perel P, et al. 2015 recommendations for the management of polymyalgia rheumatica: a European League Against Rheumatism/American College of Rheumatology collaborative initiative. Ann Rheum Dis. 2015;74(10):1799-1807.
MAT-ES-2503751 - V1 Diciembre 2025