
Puntos Clave:
- Desde enero del 2022 en España2 existe una opción terapéutica para los niños con DA grave a partir de 6 años, Dupilumab.3-7
- Más de 500.000 pacientes* están siendo tratados con DUPIXENT® en las diferentes indicaciones en todo el mundo.8
- DUPIXENT® proporciona un alivio rápido y mantenido en el prurito y en la gravedad y extensión de las lesiones en niños (6-11 años) y adolescentes (12-17 años).3-7,9,10
- DUPIXENT® proporciona mejoras rápidas y sostenidas en la calidad de vida tanto en niños como en adolescentes.3,5,11
- DUPIXENT® ha demostrado resultados de eficacia y seguridad a largo plazo.1
DUPIXENT® es un tratamiento sistémico de primera línea para pacientes con dermatitis atópica a partir de los 6 años, mal controlados con tratamientos tópicos.1** Administrado por vía subcutánea, DUPIXENT® ofrece la opción de elegir entre jeringa precargada (disponible en pacientes ≥6 años), o pluma precargada (disponible para pacientes ≥12 años) para la administración hospitalaria o en el domicilio del paciente.1
Con Dupixent® un cambio duradero es posible1,3-7,12-14
DUPIXENT®, con un perfil de seguridad y tolerabilidad demostrado en pacientes desde los 6 años de edad, proporciona resultados consistentes en los signos y síntomas de la DA en adultos, adolescentes y niños a partir de 6 años.1,3-7,12-14 Al mejorar las lesiones de la piel, el prurito y las alteraciones en el sueño, DUPIXENT® también ha logrado mejorar la calidad de vida de esta población pediátrica.14 Con DUPIXENT® + corticoides tópicos (TCS) se han observado mejoras en la calidad de vida en niños con DA (6-11 años) relacionada con:11
DUPIXENT® + TCS mejora la calidad de vida de los familiares y cuidadores de niños (6-11 años) con DA mejorando, entre otros aspectos, el sueño, las actividades de ocio en familia, las actividades diarias, el estrés emocional y el cansancio y la relación con el resto de los niños de la familia.13
Dupixent® ha demostrado una mejora en los signos y síntomas de la dermatitis atópica en los estudios a 16 y 52 semanas en niños y adolescentes3,5,6,7
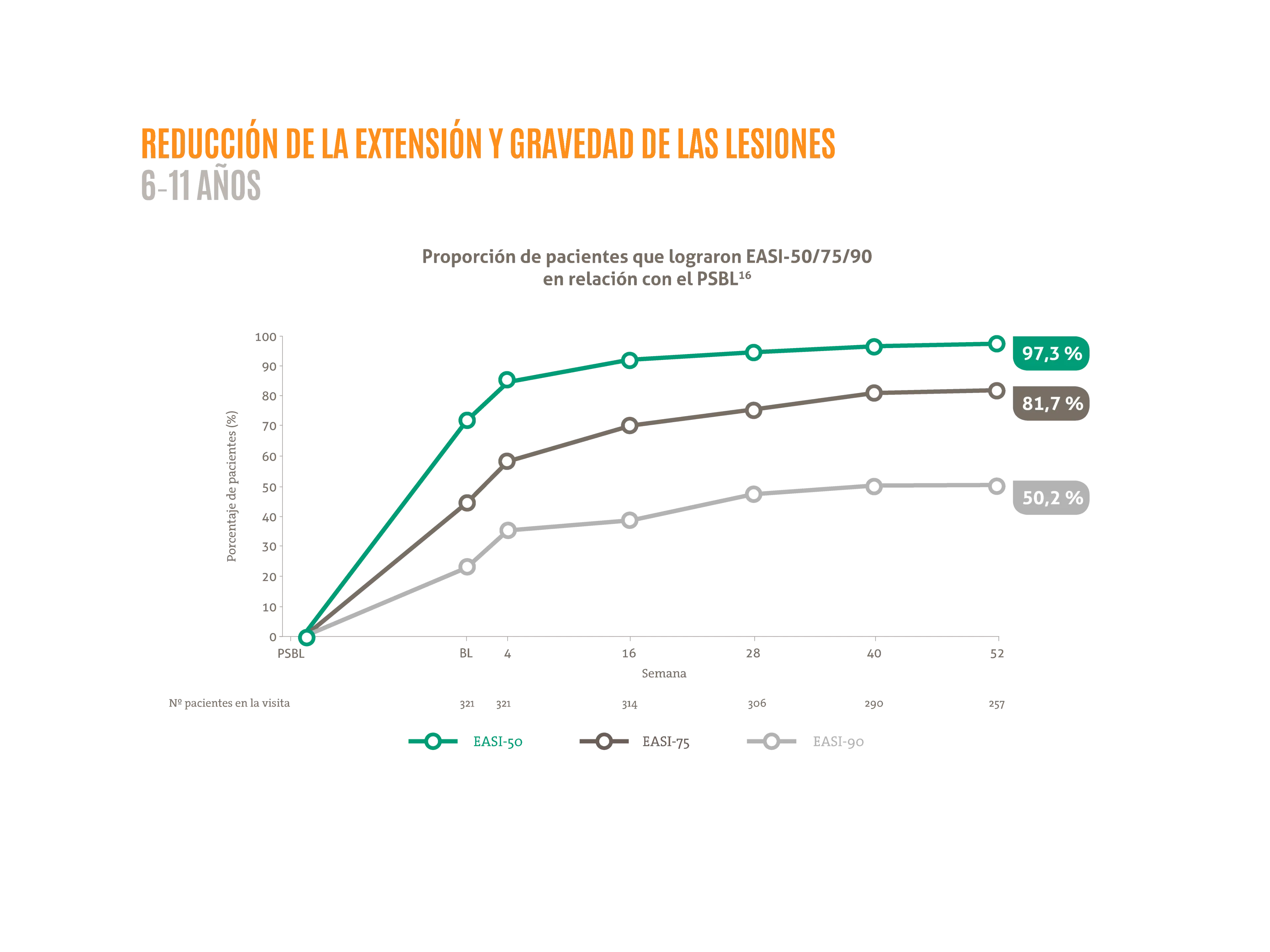
DUPIXENT® mejora de forma sostenida los signos y síntomas de la DA en niños de 6 a 11 años hasta 52 semanas15,16
- ≈ 90 % de mejora porcentual media de la puntuación EASI desde basal hasta la semana 52.16*
La posología aprobada para niños (6-11 años entre 15 y 60 kg) es una inducción de 300 mg seguida por otra inyección de 300 mg a los 14 días y posteriormente una dosis de 300 mg cada 4 semanas. DUPIXENT® 200 mg cada 2 semanas también está disponible para niños de 6-11 años con un peso entre 15 y 60 kg según la evaluación del médico.
BL: estado basal; EASI-50/75/90: 50 %/75 %/90 % porcentaje de mejora en EASI desde el estado basal; EASI: área del eccema e índice de gravedad; PSBL: estado basal del estudio inicial.
*Subanálsis del estudio AD-1434 (LIBERTY AD PED-OLE) que tiene como objetivo evaluar la eficacia y seguridad a largo plazo de dupilumab en pacientes pediátricos de 6-11 años con DA grave.16 LIBERTY AD PED-OLE es un estudio de fase III de OLE a largo plazo en curso que incluye pacientes pediátricos que participaron en ensayos anteriores de dupilumab en DA.16 El objetivo del OLE es evaluar la seguridad y eficacia a largo plazo de dupilumab.16 Se permitieron TCS y TCI de potencia baja o media o ambas a discreción del investigador; se prohibió el uso de tratamientos sistémicos para la DA.18
DUPIXENT® mejora de forma mantenida la calidad de vida en niños y adolescentes hasta las 52 semanas15,17-19.
Seguridad y tolerabilidad consistente con Dupixent®1,3,5
El perfil de seguridad de DUPIXENT® ha sido demostrado en más de 10.000 pacientes de ensayos clínicos que abarcan múltiples grupos de edad en distintas indicaciones como dermatitis atópica y asma.1 Se trata de un fármaco que no requiere monitorización y para el que no existen indicios de aumento de riesgo de trombosis, infecciones graves o malignidad.1 Además, la respuesta inmunitaria frente a vacunas muertas/inactivadas fue similar entre los grupos de DUPIXENT® y placebo.1 Su perfil de seguridad y tolerabilidad en niños y adolescentes con DA, ha demostrado:20
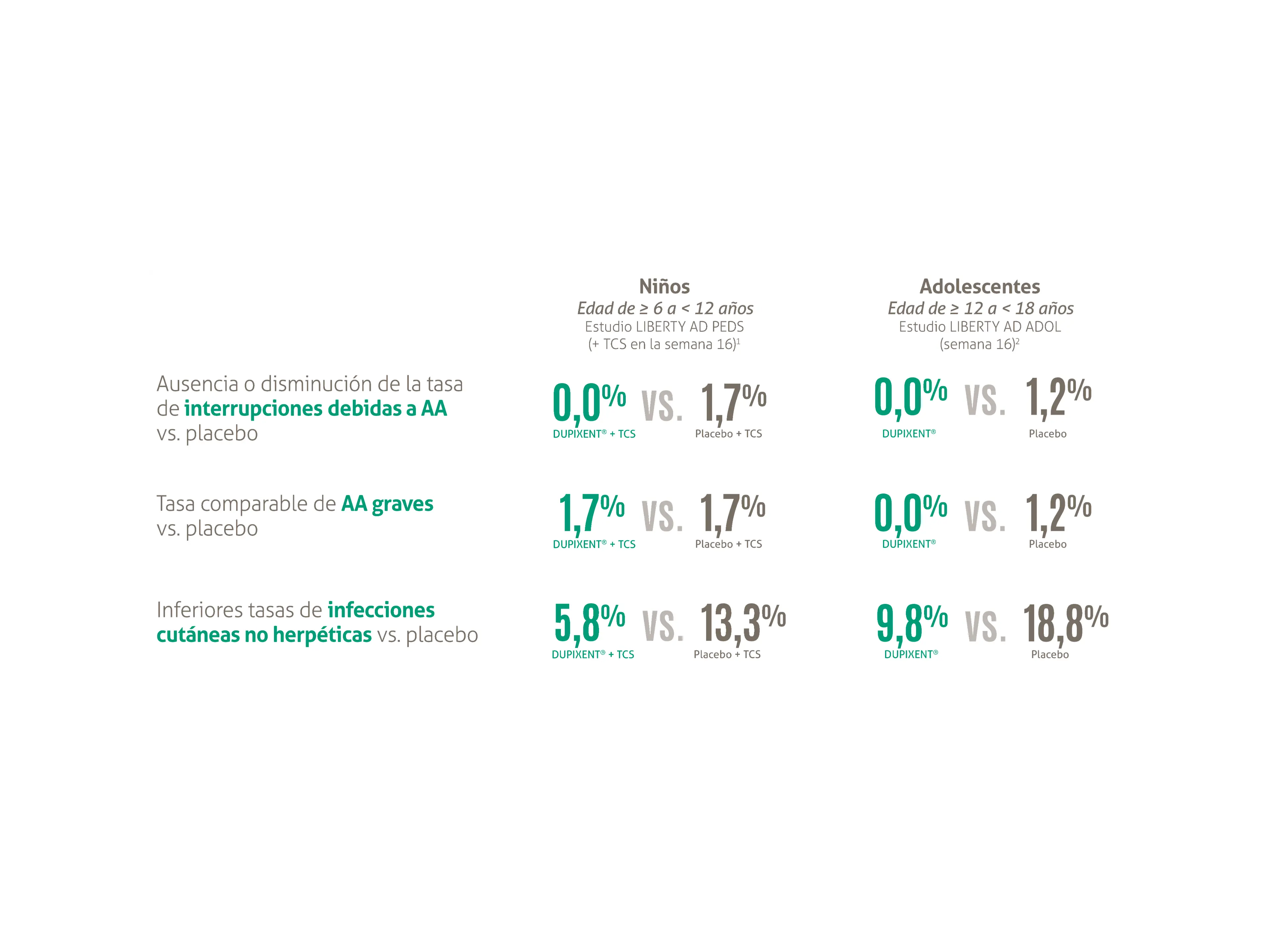
AA: acontecimientos adversos; TCS: corticoides tópicos.
Figura elaborada a partir de datos de Paller, et al. 2020.5 y Simpson EL, et al. 2020.3
En los ensayos clínicos, se observaron acontecimientos adversos (AA) en ≤ 5,5% de los pacientes pediátricos durante las 16 semanas de tratamiento.1,3,5

- Si ocurre una reacción de hipersensibilidad sistémica (inmediata o tardía), DUPIXENT® debe suspenderse inmediatamente e iniciarse la terapia adecuada.1
- Los pacientes que desarrollan conjuntivitis que no se resuelve después del tratamiento estándar deben someterse a un examen oftalmológico. 1
- Los pacientes dermatitis atópica moderada-grave y asma comórbida no deben ajustar o suspender sus tratamientos para el asma sin consultar a sus médicos. Monitorice cuidadosamente a los pacientes con asma comórbida después de la interrupción de DUPIXENT®.1
- En la mayoría de los casos, en aquellos pacientes que presentaron conjuntivitis, remitieron durante el tratamiento.1
- Trate cualquier infección por helmintos preexistente antes de iniciar el tratamiento con DUPIXENT®. Si los pacientes se infectan mientras reciben tratamiento y no responden al tratamiento antihelmíntico, suspenda el tratamiento hasta que se resuelva la infección.1
*Incluye queratoconjuntivitis atópica, conjuntivitis alérgica, conjuntivitis bacteriana y conjuntivitis vírica. **Las infecciones cutáneas fueron adjudicadas caso por caso e incluyeron infecciones bacterianas, víricas y fúngicas.
†Acontecimiento adverso notificado como término de alto nivel de la jerarquía del MedDRA.
Dupixent®: en un vistazo
Con un perfil de seguridad demostrado en pacientes ≥6 años, desde enero 20222 está disponible DUPIXENT® para tratar la DA grave en niños (6-11 años) y adolescentes (12-17 años), mejorando de forma rápida y mantenida los signos y síntomas de esta enfermedad y la calidad de vida de los pacientes pediátricos.1,3-7,9,11-19
*511.047 pacientes tratados en todas las indicaciones en todo el mundo.8
** Indicación de DUPIXENT® en dermatitis atópica para adultos y adolescentes: DUPIXENT® está indicado para el tratamiento de la dermatitis atópica de moderada a grave en pacientes adultos y adolescentes a partir de 12 años que son candidatos a tratamiento sistémico. Indicación de DUPIXENT® en dermatitis atópica para niños: DUPIXENT® está indicado para el tratamiento de la dermatitis atópica grave en niños de 6 a 11 años que son candidatos a tratamiento sistémico.
Referencias
- Ficha técnica de DUPIXENT®.
- Ministerio de Sanidad. Nomenclátor de Facturación de septiembre 2022. Disponible en: https://www.sanidad.gob.es/profesionales/nomenclator.do. Último acceso: septiembre 2022.
- Simpson EL, Paller AS, Siegfried EC, et al. Efficacy and safety of dupilumab in adolescents with uncontrolled moderate to severe atopic dermatitis: a phase 3 randomized clinical trial. JAMA Dermatol. 2020;156(1):44-56.
- Paller AS, Bansal A, Simpson EL, et al. Clinically meaningful responses to dupilumab in adolescents with uncontrolled moderate-to-severe atopic dermatitis: post-hoc analyses from a randomized clinical trial. Am J Clin Dermatol. 2020;21(1):119-131.
- Paller AS, Siegfried EC, Thaçi D, et al. Efficacy and safety of dupilumab with concomitant topical corticosteroids in children 6 to 11 years old with severe atopic dermatitis: A randomized, double-blinded, placebo-controlled phase 3 trial. J Am Acad Dermatol. 2020;83(5):1282-1293.
- Cork MJ, Thaçi D, Eichenfield L, et al. Long-term efficacy and safety data of dupilumab in a phase 3, open-label extension trial (LIBERTY AD PED-OLE) in patients aged ≥ 6 to < 12 years with uncontrolled, moderate-to-severe atopic dermatitis. Poster presentado en the RAD Conference, 2021.
- Blauvent A, Guttman-Yassky E, Paller AS, et al. Long-Term Efficacy and Safety of Dupilumab in Adolescents with Moderate-to-Severe Atopic Dermatitis: Results Through Week 52 from a Phase III Open-Label Extension Trial (LIBERTY AD PED-OLE). Am J Clin Dermatol. 2022;23(3):365-83.
- IQVIA Sanofi Integrated DUPIXENT® Platform, data through August 2022.
- Gandhi NA, Bennett BL, Graham NM, et al. Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov. 2016;15(1):35-50.
- Wollenberg A, Christen‐Zäch S, Taieb A, et al. ETFAD/EADV Eczema task force 2020 positions paper on diagnosis and treatment of atopic dermatitis in adults and children. JEADV. 2020;34:2717-2744.
- Irvine A, Deleuran M, Praestgaard A, et al. Dupilumab Treatment Improves Health-Related Quality of Life in Children Aged ≥ 6 to < 12 Years With Severe Atopic Dermatitis. Presentado en: The 2021 Annual Meeting of the American Academy of Dermatology (AAD 2021),2022.
- Blauvelt A, de Bruin-Weller M, Gooderham M, et al. Long-term management of moderate-to-severe atopic dermatitis with dupilumab and concomitant topical corticosteroids (LIBERTY AD CHRONOS): a 1-year, randomised, double-blinded, placebo-controlled, phase 3 trial. Lancet. 2017;389(10086):2287-2303.
- Silverberg JI, Simpson EL, Boguniewicz M, et al. Dupilumab Provides Rapid and Sustained Clinically Meaningful Responses in Adults with Moderate-to-severe Atopic Dermatitis. Acta Derm Venereol. 2021;101(11):adv00585.
- Eichenfield LF, Simpson EL, Lynde CW, et al. Dupilumab improves family quality of life in children (6–11 years) with severe atopic dermatitis: Phase 3 LIBERTY AD PEDS. Presentado en: 21st ESPD Annual Meeting, 2022.
- Cork MJ, Thaçi D, Eichenfield LF, et al. Dupilumab provides favourable long‐term safety and efficacy in children aged ≥ 6 to < 12 years with uncontrolled severe atopic dermatitis: results from an open‐label phase IIa study and subsequent phase III open‐label extension study. Br J Dermatol 2021; 184(5); 857-870.
- Paller AS, Cork MJ, Siegfried EC, et al. Efficacy and safety of dupilumab in children aged 6–11 years with inadequately controlled severe atopic dermatitis: results from an open-label extension trial up to 1 year. Presentado en 3rd Annual RAD Conference, 2021.
- Cork MJ, Thaçi D, Eichenfield LF, et al. Dupilumab in adolescents with uncontrolled moderate-to-severe atopic dermatitis: results from a phase IIa open-label trial and subsequent phase III open-label extension*. Br J Dermatol 2020; 182(1); 85-96
- Cork MJ, Thaçi D, Eichenfield LF, et al. Dupilumab in adolescents with uncontrolled moderate-to-severe atopic dermatitis: results from a phase IIa open-label trial and subsequent phase III open-label extension*. Br J Dermatol 2020; 182(1); 85-96. [suppl].
- Napolitano M, Fabbrocini G, Neri I, et al. Dupilumab Treatment in Children Aged 6-11 Years With Atopic Dermatitis: A Multicentre, Real-Life Study. Paediatr Drugs. 10.1007/s40272-022-00531-0.
- ClinicalTrials.gov (NCT03912259, NCT03387852, NCT03345914, NCT03054428, NCT02912468, NCT02898454, NCT02755649, NCT02573233, NCT02528214, NCT02414854, NCT02407756, NCT02277769, NCT02277743, NCT02260986, NCT02210780, NCT02134028, NCT01979016, NCT01859988, NCT01854047, NCT01639040, NCT01548404, NCT01312961). Acceso: septiembre 2022.
- Thyssen JP, Vestergaard C, Barbarot S, et al. European Task Force on Atopic Dermatitis: position on vaccination of adult patients with atopic dermatitis against COVID-19 (SARS-CoV-2) being treated with systemic medication and biologics. J Eur Acad Dermatol Venereol. 2021;35(5):e308-e311.
Eficacia de Dupixent® en detalle: reducción rápida y sostenida de signos y síntomas:
Dupixent® ha demostrado resultados en los estudios a 16 y 52 semanas
Semana 16: resultados de reducción de síntomas y signos
DUPIXENT® + TCS proporciona mejoras rápidas en los signos y síntomas de la DA en niños de 6 a 11 años:1,2
- La diferencia con respecto a placebo es significativa desde la semana 2.1
- Resultados visibles en la semana 16.2
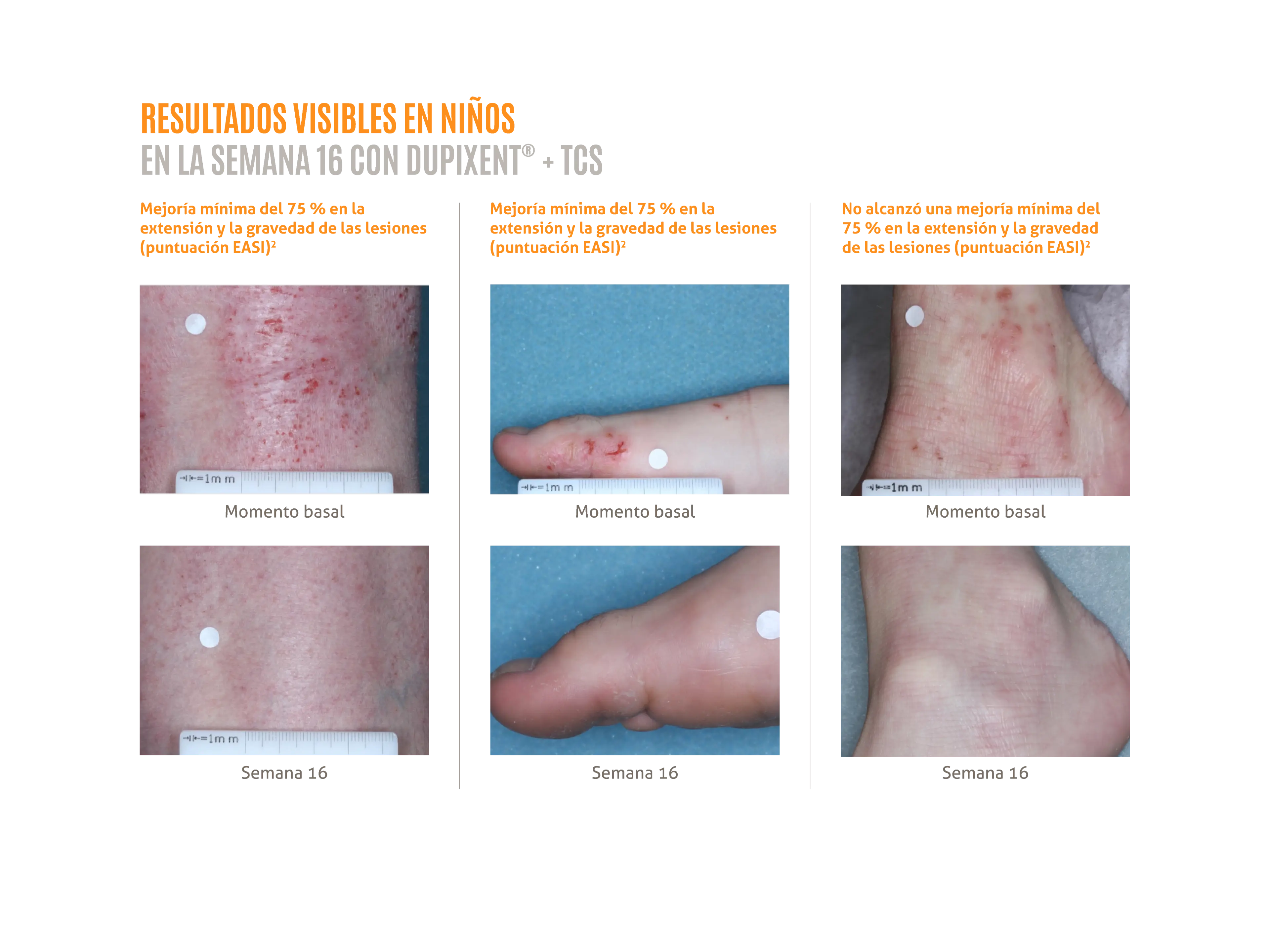
Las fotografías clínicas son pacientes reales tratados con DUPIXENT® en el ensayo LIBERTY AD PEDS y se utilizan con el consentimiento del paciente. Los resultados individuales pueden variar.
EASI: área del eccema e índice de gravedad.
Las fotografías clínicas se muestran en Shumel B, et al. 2020.2
- ≈ 80 % de mejora porcentual media de la puntuación EASI desde basal hasta la semana 16.1*
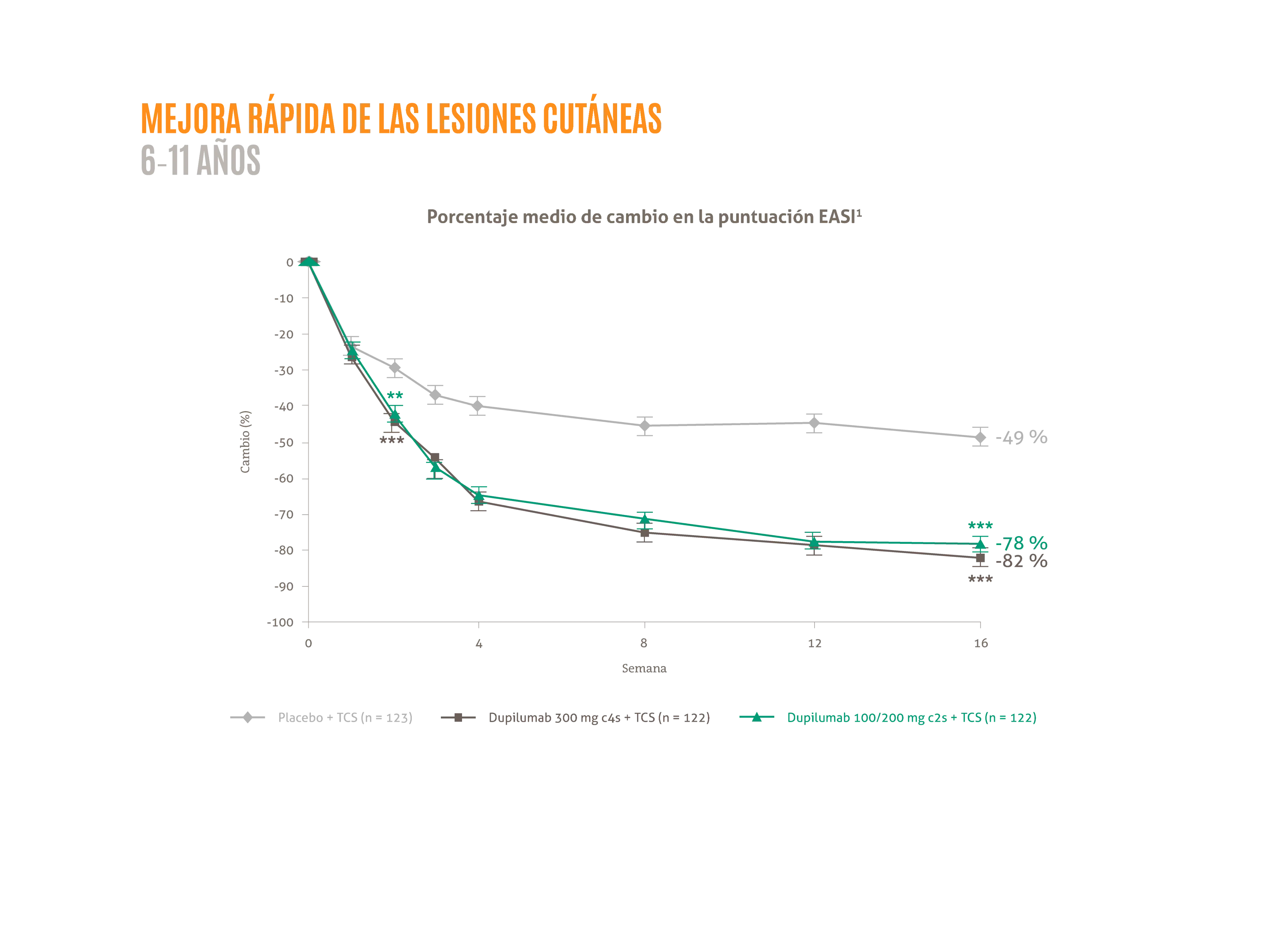
**p <0,001; ***p <0,0001.
Figura adaptada de Paller AS, et al. 2020.1
La posología aprobada para niños (6-11 años entre 15 y 60 kg) es una inducción de 300 mg seguida por otra inyección de 300 mg a los 14 días y posteriormente una dosis de 300 mg C4S. DUPIXENT® 200 mg C2S también está disponible para niños de 6-11 años con un peso entre 15 y 60 kg según la evaluación del médico.
C2S: cada dos semanas; C4S: cada cuatro semanas; EASI: Área del eccema e índice de gravedad3; TCS: corticoides tópicos.3
- Mejora media de la NRS de prurito del ≈ 55 % desde el valor basal hasta la semana 16.1*
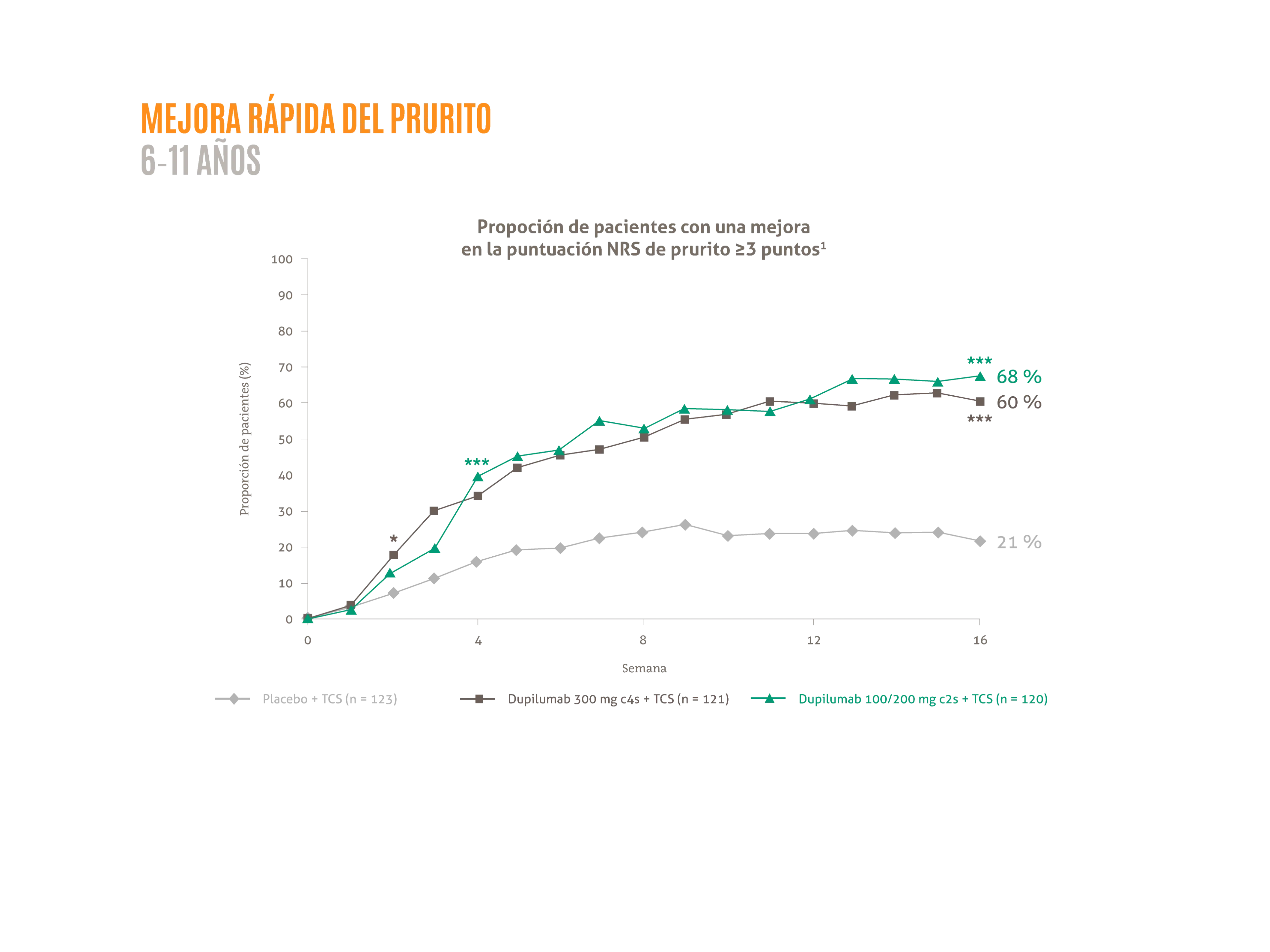
*p <0,05; ***p <0,0001 vs. placebo + TCS.
Figura adaptada de Paller AS, et al. 2020.1
La posología aprobada para niños (6-11 años entre 15 y 60 kg) es una inducción de 300 mg seguida por otra inyección de 300 mg a los 14 días y posteriormente una dosis de 300 mg C4S. DUPIXENT® 200 mg C2S también está disponible para niños de 6-11 años con un peso entre 15 y 60 kg según la evaluación del médico.
*LIBERTY AD PEDS fue un ensayo aleatorizado, doble ciego, controlado con placebo3, en niños de 6 a 11 años de edad con dermatitis atópica grave (N = 367) con un control insuficiente de la enfermedad con tratamiento tópico3, aleatorizado a DUPIXENT® 300 mg C4S + TCS, 100/200 mg C2S + TCS o placebo + TCS durante 16 semanas. 1 Las variables co-principales fueron la proporción de pacientes que alcanzaron EASI-75 (70 % de los pacientes tratados con DUPIXENT® + TCS versus 27 % con placebo + TCS), y una puntuación de IGA de 0 o 1 con una reducción desde el inicio de ≥2 puntos en la semana 16 (33 % de los pacientes tratados con DUPIXENT® + TCS vs 11 % con placebo + TCS). 1
Referencias
- Paller AS, Siegfried EC, Thaçi D, et al. Efficacy and safety of dupilumab with concomitant topical corticosteroids in children 6 to 11 years old with severe atopic dermatitis: A randomized, double-blinded, placebo-controlled phase 3 trial. J Am Acad Dermatol. 2020;83(5):1282-1293.
- Shumel B, Rossi AB. Dupilumab treatment provides multidimensional improvement of signs, symptoms, and quality of life in children with severe atopic dermatitis: a pictorial guide. Dermatologist. 2020;28:42-46.
DUPIXENT® en monoterapia proporciona mejoras rápidas y sostenidas en los signos y síntomas de la DA en adolescentes:1
- Reducción rápida del prurito desde el día 5.2
- Resultados visibles en la semana 16.3
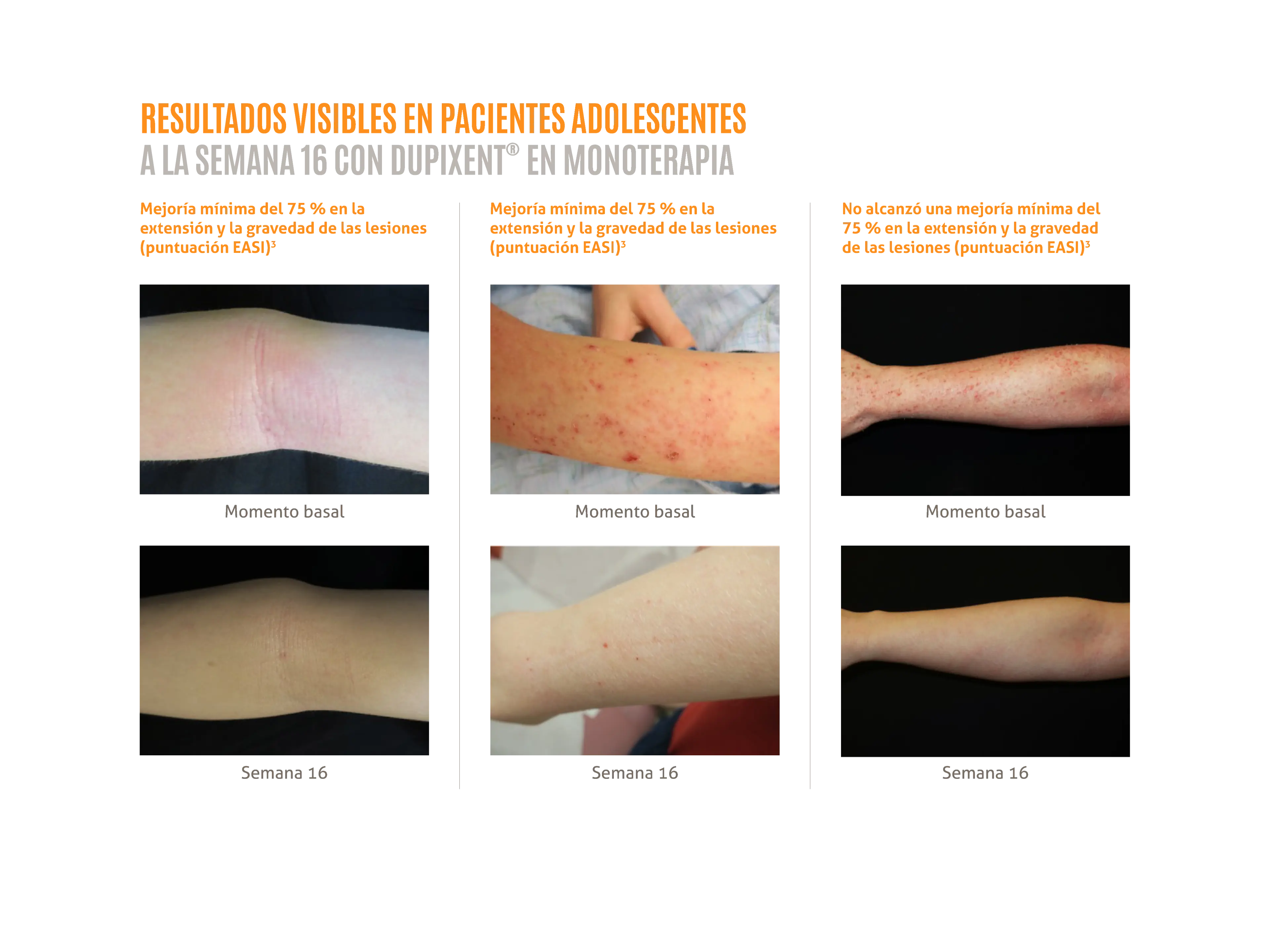
Las fotografías clínicas son pacientes reales tratados con DUPIXENT® en el ensayo LIBERTY AD ADOL y se utilizan con el consentimiento del paciente. Los resultados individuales pueden variar.
EASI: área del eccema e índice de gravedad.
Las fotografías clínicas se muestran en Shumel B, et al. 2020.2
- ≈ 66 % de mejora porcentual media de la puntuación EASI desde basal hasta la semana 16.1*
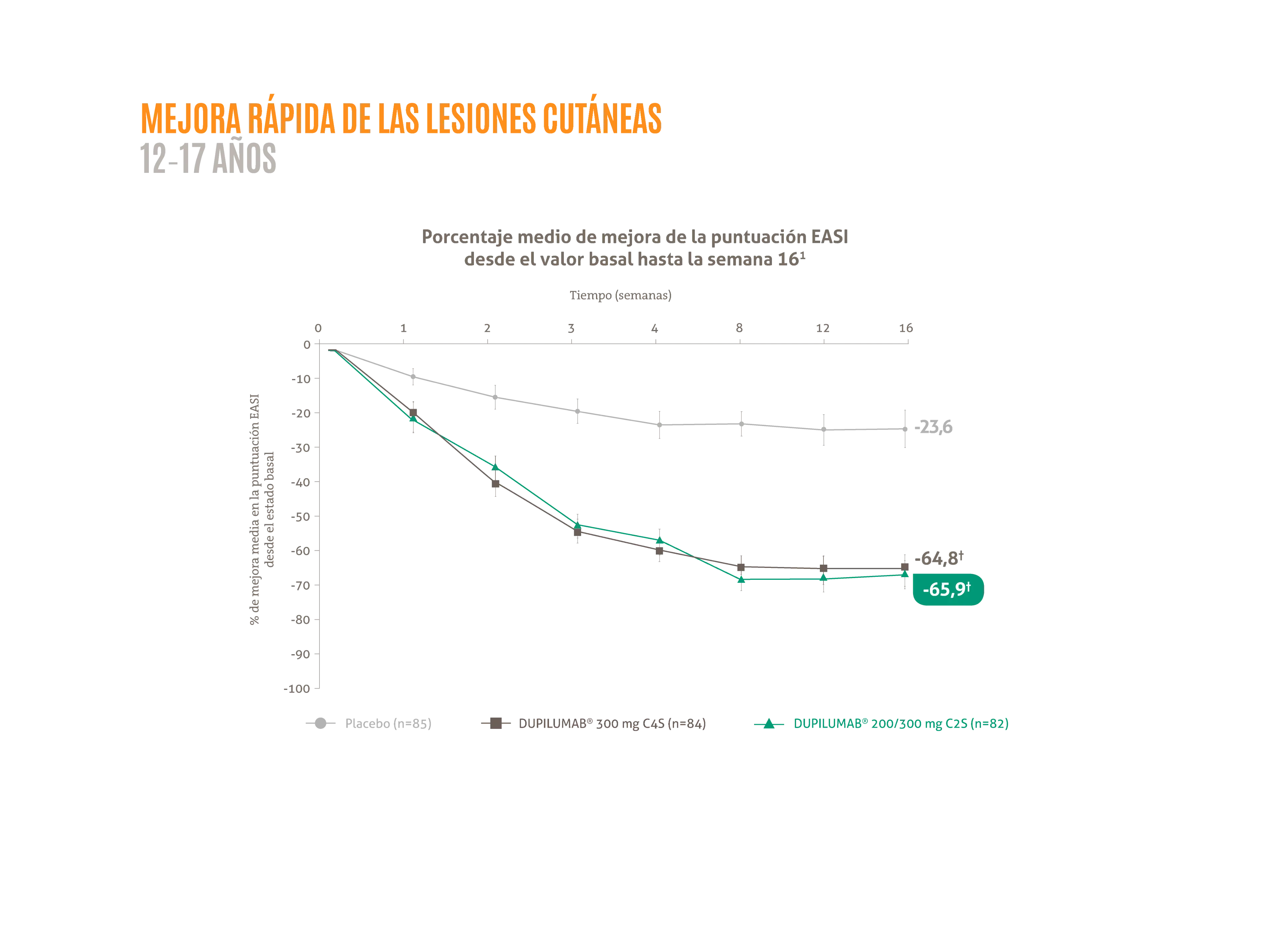
†p <0,001 vs. placebo.
Figura adaptada de Simpson EL, et al. 2020.1
La posología aprobada en España para adolescentes con DA es: para los adolescentes con un peso <60 kg una dosis inicial de 400 mg seguido por una inyección de 200 mg cada 14 días. Para los adolescentes con un peso >60 kg una dosis de inducción de 600 mg seguido por una inyección de 300 mg cada 14 días.
C2S: cada dos semanas; C4S: cada cuatro semanas; EASI: área del eccema e índice de gravedad.4
- Mejora media de la NRS de prurito del ≈ 50 % desde el valor basal hasta la semana 16. 1*
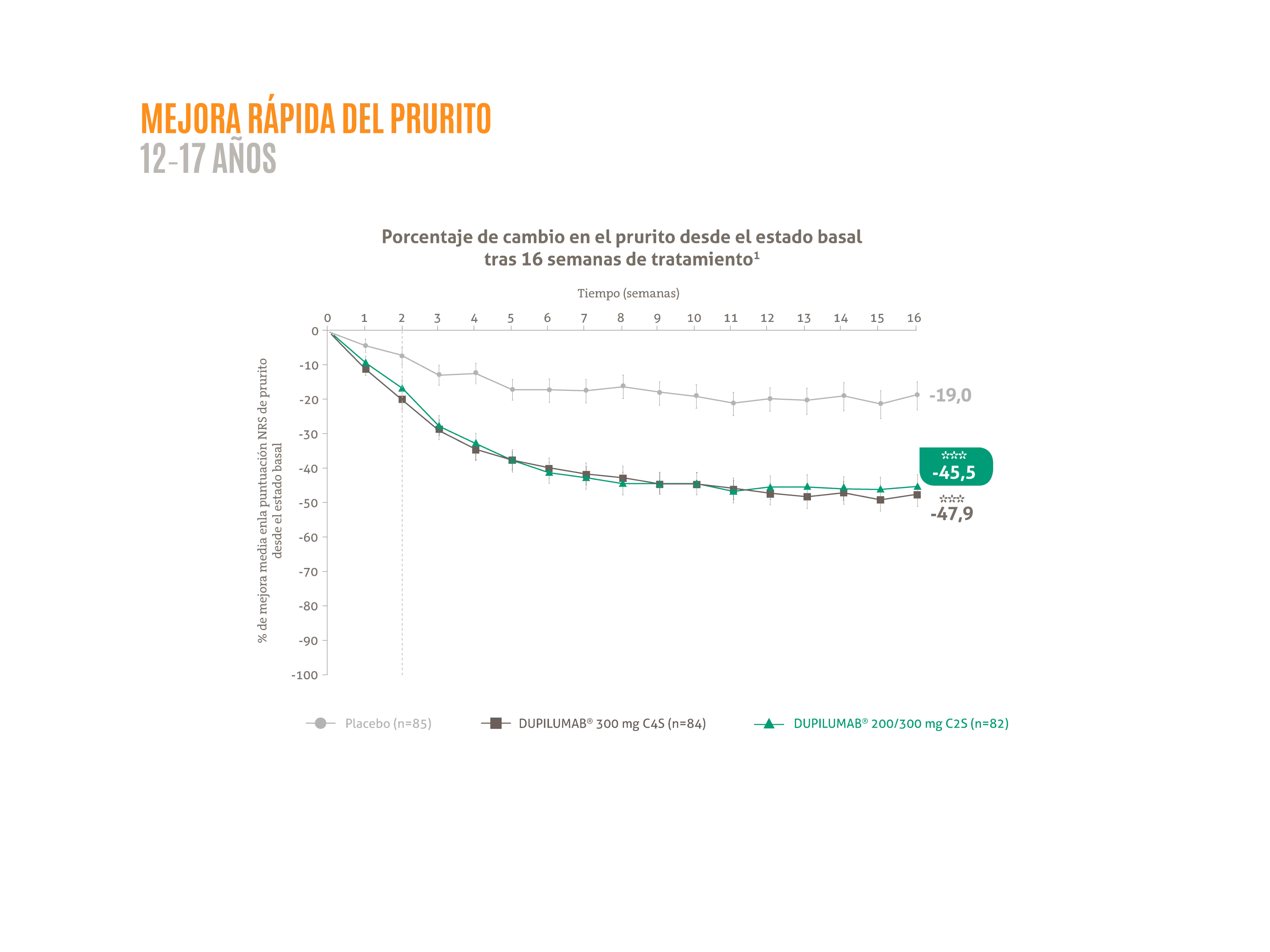
***p <0,001 vs. placebo.
Figura adaptada de Simpson EL, et al. 2020.1
La posología aprobada en España para adolescentes con DA es: para los adolescentes con un peso <60 kg una dosis inicial de 400 mg seguido por una inyección de 200 mg cada 14 días. Para los adolescentes con un peso >60 kg una dosis de inducción de 600 mg seguido por una inyección de 300 mg cada 14 días.
C2S: cada dos semanas; C4S: cada cuatro semanas; NRS: escala de calificación numérica.
*LIBERTY AD ADOL fue un estudio aleatorizado, doble ciego, controlado con placebo4, de grupos paralelos4 en adolescentes con dermatitis atópica moderada-grave (N = 251) con un control insuficiente de la enfermedad con el tratamiento tópico, aleatorizado a DUPIXENT® 200/300 mg C2S o placebo durante 16 semanas.1 Las variables co-principales fueron la proporción de pacientes que alcanzaron EASI-75 (42 % de los pacientes tratados con DUPIXENT® versus 8% con placebo), y una puntuación de IGA de 0 o 1 con una reducción desde el inicio de ≥2 puntos en la semana 16 (24 % de los pacientes tratados con DUPIXENT® vs 2 % con placebo).1
Referencias
- Simpson EL, Paller AS, Siegfried EC, et al. Efficacy and Safety of Dupilumab in adolescents with uncontrolled moderate to severe atopic dermatitis: a phase 3 randomized clinical trial. JAMA Dermatol. 2020;156(1):44-56.
- Silverberg JI, Yosipovitch G, Simpson EL, et al. Dupilumab treatment results in early and sustained improvements in itch in adolescents and adults with moderate to severe atopic dermatitis: Analysis of the randomized phase 3 studies SOLO 1 and SOLO 2, AD ADOL, and CHRONOS. J Am Acad Dermatol. 2020;82(6):1328-1336.
- Shumel B, Rossi AB. Dupilumab treatment provides multidimensional improvement of signs, symptoms, and quality of life in children with severe atopic dermatitis: a pictorial guide. Dermatologist. 2020;28: 42-46.
Semana 52: resultados de reducción de síntomas y signos
La DA es una enfermedad inflamatoria de la piel que cursa con prurito y que afecta a niños, adolescentes y adultos.1 Dada la naturaleza crónica de sus brotes, la calidad de vida de los pacientes y sus cuidadores se ve significativamente perjudicada por esta enfermedad.1
DUPIXENT® proporciona un control de la enfermedad a largo plazo en adolescentes y niños (a partir de 6 años).2-5
DUPIXENT® mejora de forma sostenida los signos y síntomas de la DA en niños de 6 a 11 años hasta 52 semanas2,3
- ≈ 90 % de mejora porcentual media de la puntuación EASI desde basal hasta la semana 52.3*

Figura adaptada de Paller AS, et al. 2021.3
La posología aprobada para niños (6-11 años entre 15 y 60 kg) es una inducción de 300 mg seguida por otra inyección de 300 mg a los 14 días y posteriormente una dosis de 300 mg cada 4 semanas. DUPIXENT® 200 mg cada 2 semanas también está disponible para niños de 6-11 años con un peso entre 15 y 60 kg según la evaluación del médico.
BL: estado basal; EASI-50/75/90: 50 %/75 %/90 % porcentaje de mejora en EASI desde el estado basal4; EASI: área del eccema e índice de gravedad4; PSBL: estado basal del estudio inicial.
- ≈ 40,5 % de los pacientes alcanzaron un IGA 0/1 a la semana 52 de tratamiento.3*
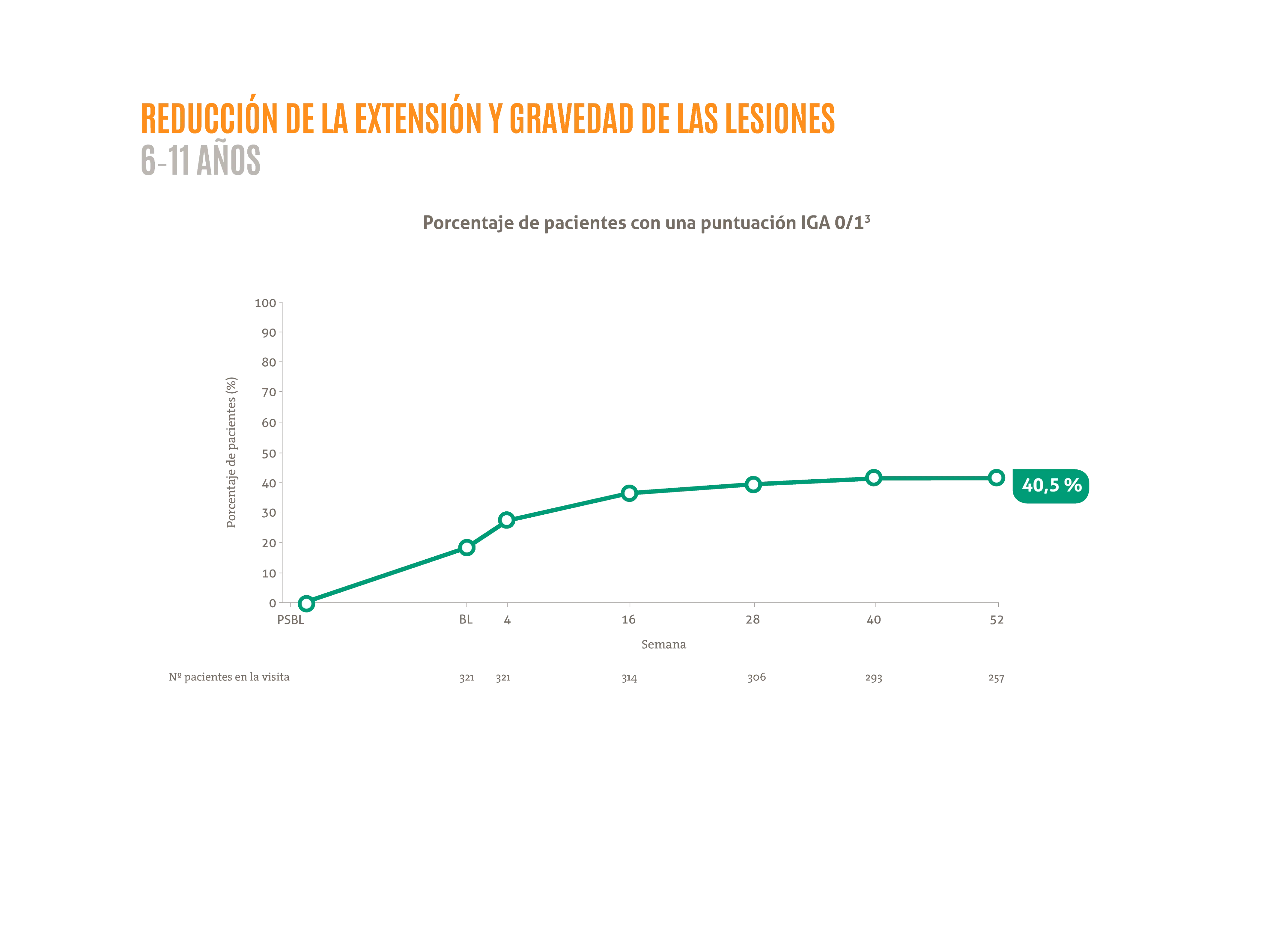
Figura adaptada de Paller AS, et al. 2021.3
La posología aprobada para niños (6-11 años entre 15 y 60 kg) es una inducción de 300 mg seguida por otra inyección de 300 mg a los 14 días y posteriormente una dosis de 300 mg cada 4 semanas. DUPIXENT® 200 mg cada 2 semanas también está disponible para niños de 6-11 años con un peso entre 15 y 60 kg según la evaluación del médico.
BL: estado basal; IGA: escala de evaluación global del investigador; PSBL: estado basal del estudio inicial.
*Subanálsis del estudio AD-1434 (LIBERTY AD PED-OLE) que tiene como objetivo evaluar la eficacia y seguridad a largo plazo de dupilumab en pacientes pediátricos de 6-11 años con DA grave.3 LIBERTY AD PED-OLE es un estudio de fase III de OLE a largo plazo en curso que incluye pacientes pediátricos que participaron en ensayos anteriores de dupilumab en DA.3 El objetivo del OLE es evaluar la seguridad y eficacia a largo plazo de dupilumab.3 Se permitieron TCS y TCI de potencia baja o media o ambas a discreción del investigador; se prohibió el uso de tratamientos sistémicos para la DA.3
Referencias
- Lee JH, Kim JE, Park GH, Bae JM, Byun JY, Shin MK, et al. Consensus Update for Systemic Treatment of Atopic Dermatitis. Ann Dermatol. 2021;33(6):497-514.
- Cork MJ, Thaçi D, Eichenfield LF, et al. Dupilumab provides favourable long‐term safety and efficacy in children aged ≥ 6 to < 12 years with uncontrolled severe atopic dermatitis: results from an open‐label phase IIa study and subsequent phase III open‐label extension study. Br J Dermatol 2021; 184(5); 857-870.
- Paller AS, Cork MJ, Siegfried EC, et al. Efficacy and safety of dupilumab in children aged 6–11 years with inadequately controlled severe atopic dermatitis: results from an open-label extension trial up to 1 year. Presentado en 3rd Annual RAD Conference, 2021.
DUPIXENT® muestra una eficacia rápida1 y sostenida con mejoras en los signos y síntomas hasta la semana 52 en adolescentes2,3
- Disminución de la extensión y gravedad de las lesiones hasta la semana 524*
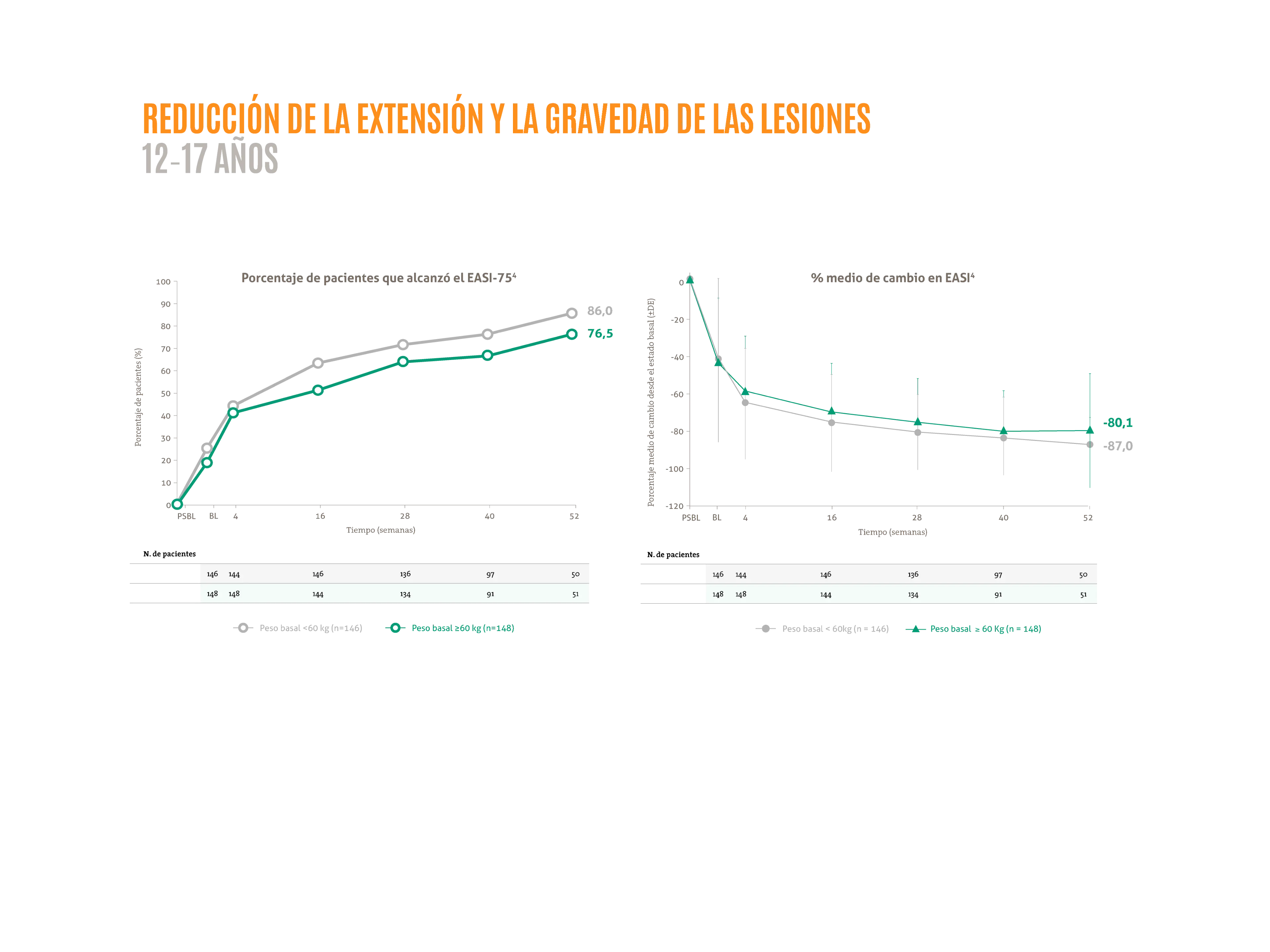
Figuras adaptadas de Blauvent A, et al. 2022.4
En este estudio OLE fase 3, en marcha, los pacientes recibían 300 mg C4S pudiendo ser incrementada la dosis en función del peso a 200 mg C2S si el peso <60 kg o 300 mg C2S si el peso >60 kg en caso de respuesta inadecuada.
La posología aprobada en España para adolescentes con DA es: para los adolescentes con un peso >60 kg una dosis de inducción de 600 mg seguido por una inyección de 300 mg cada 14 días. Para los adolescentes con un peso <60 kg una dosis inicial de 400 mg seguido por una inyección de 200 mg cada 14 días.
BL: estado basal; EASI: área del eccema e índice de gravedad; PSBL: estado basal del estudio inicial.5
*LIBERTY AD PED-OLE que tiene como objetivo evaluar la eficacia y seguridad a largo plazo de dupilumab en adolescentes de 12-17 años con DA moderada a grave.4 El estudio LIBERTY AD PED-OLE es un estudio de fase III de OLE a largo plazo en curso que incluye pacientes pediátricos que participaron en ensayos anteriores de dupilumab en DA.4 El objetivo del OLE es evaluar la seguridad y eficacia a largo plazo de dupilumab en la población pediátrica.4 Se permitieron TCS y TCI de potencia baja o media o ambas a discreción del investigador; se prohibió el uso de tratamientos sistémicos para la DA.4
Referencias
- Simpson EL, Paller AS, Siegfried EC, et al. Efficacy and safety of dupilumab in adolescents with uncontrolled moderate to severe atopic dermatitis: a phase 3 randomized clinical trial. JAMA Dermatol. 2020;156(1):44-56.
- Cork MJ, Thaçi D, Eichenfield LF, et al. Dupilumab in adolescents with uncontrolled moderate-to-severe atopic dermatitis: results from a phase IIa open-label trial and subsequent phase III open-label extension*. Br J Dermatol 2020; 182(1); 85-96
- Cork MJ, Thaçi D, Eichenfield LF, et al. Dupilumab in adolescents with uncontrolled moderate-to-severe atopic dermatitis: results from a phase IIa open-label trial and subsequent phase III open-label extension*. Br J Dermatol 2020; 182(1); 85-96. [suppl].
- Blauvent A, Guttman-Yassky E, Paller AS, et al. Long-Term Efficacy and Safety of Dupilumab in Adolescents with Moderate-to-Severe Atopic Dermatitis: Results Through Week 52 from a Phase III Open-Label Extension Trial (LIBERTY AD PED-OLE). Am J Clin Dermatol. 2022;23(3):365-83.
Calidad de vida en detalle: Mejoras rápidas y sostenidas en la calidad de vida:
Dupixent® ha demostrado resultados en los estudios a 16 y 52 semanas
Semana 16: resultados de mejora de calidad de vida
DUPIXENT® + TCS proporciona mejoras de las medidas de calidad de vida de niños de 6-11 años en la semana 16.1
- Mejora rápida de la calidad de vida en niños 6-11 años1*
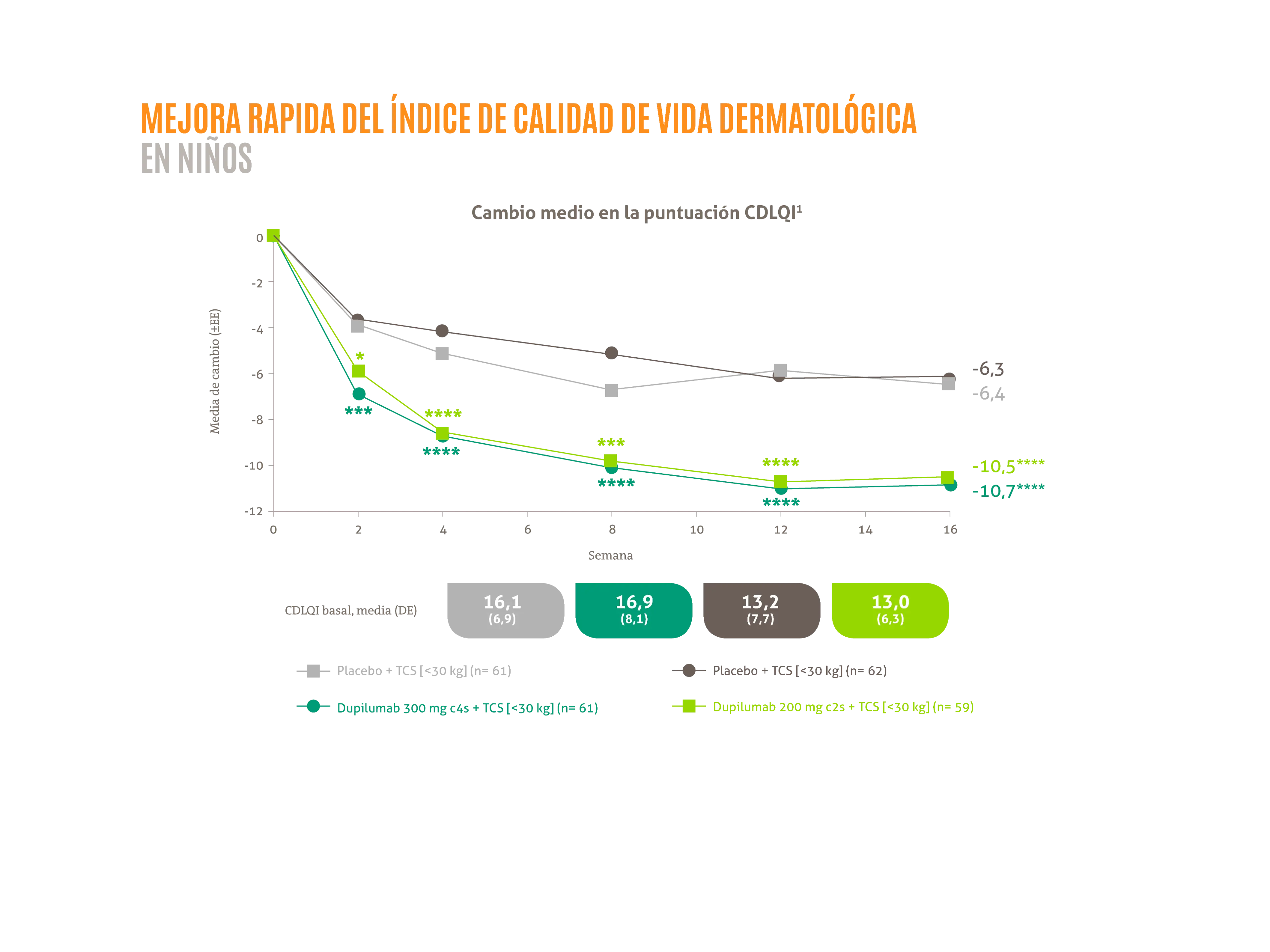
*p <0,05; ***p <0,001; ****p <0,0001 vs. placebo correspondiente.
Figura adaptada de Irvine A, et al. 2021.1
La posología aprobada para niños (6-11 años entre 15 y 60 kg) es una inducción de 300 mg seguida por otra inyección de 300 mg a los 14 días y posteriormente una dosis de 300 mg C4S. DUPIXENT® 200 mg C2S también está disponible para niños de 6-11 años con un peso entre 15 y 60 kg según la evaluación del médico.
C2S: cada dos semanas; C4S: cada cuatro semanas; CDLQI: índice de calidad de vida dermatológica en niños3; DE: desviación estándar3; EE: error estándar; TCS: corticoides tópicos.
- Reducción de la falta de sueño en niños 6-11 años 2**
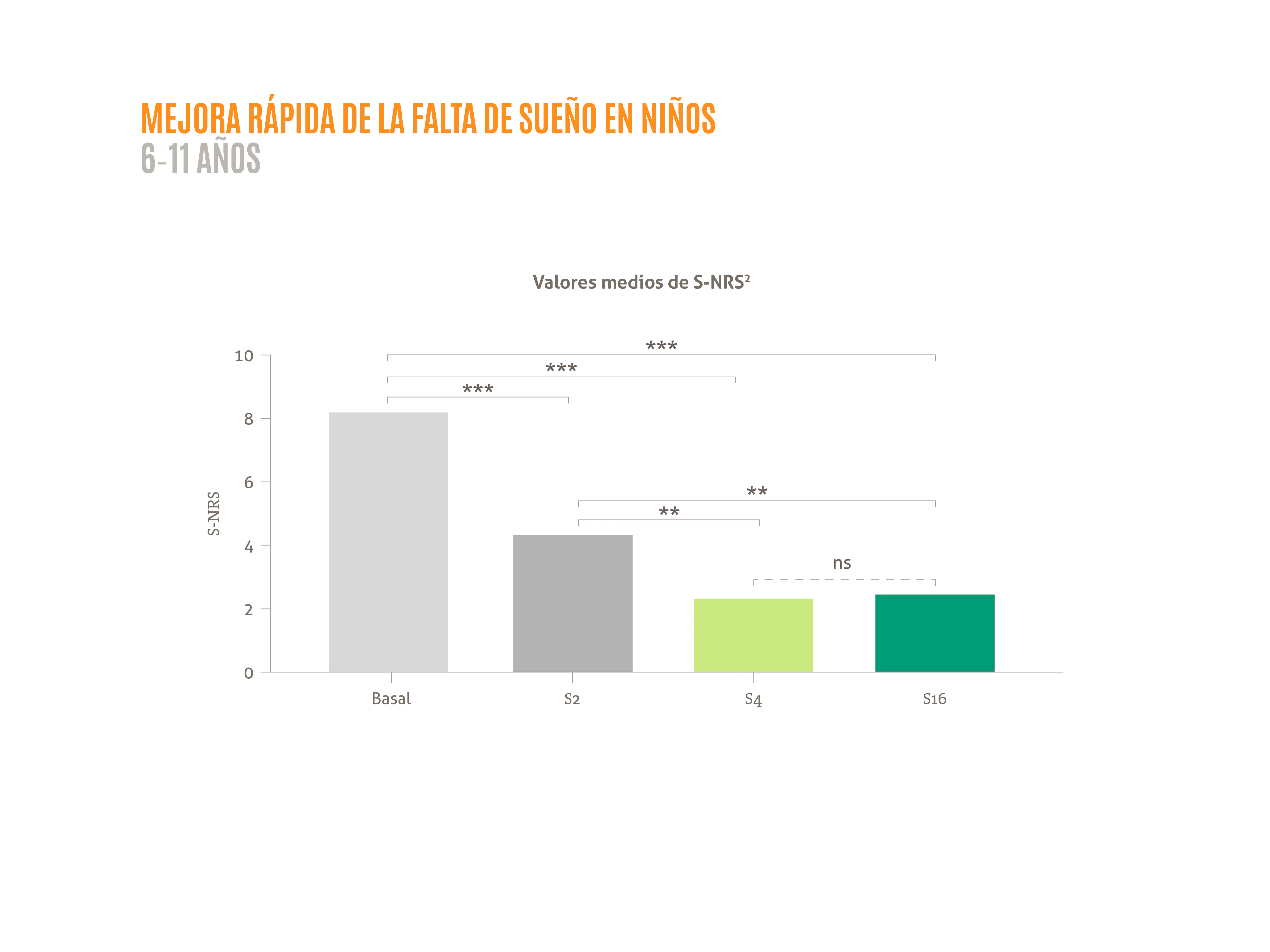
***p <0,0001; **p <0,001; *p <0,005; ns: no significativo.
Figura adaptada de Napolitano M, et al. 2022.2
La posología aprobada para niños (6-11 años entre 15 y 60 kg) es una inducción de 300 mg seguida por otra inyección de 300 mg a los 14 días y posteriormente una dosis de 300 mg cada 4 semanas. DUPIXENT® 200mg cada 2 semanas también está disponible para niños de 6-11 años con un peso entre 15 y 60 kg según la evaluación del médico.
S-NRS: Escala de calificación numérica del sueño; S: semana.3
*Subanálsis del estudio AD-14343 (LIBERTY AD PED-OLE) que evalua los cambios en la calidad de vida de niños 6-11 años tratados con Dupilumab.1 El estudio LIBERTY AD PED-OLE es un estudio de fase III de OLE a largo plazo en curso que incluye pacientes pediátricos que participaron en ensayos anteriores de dupilumab en DA.1 El objetivo del OLE es evaluar la seguridad y eficacia a largo plazo de dupilumab en la población pediátrica.1 Se permitieron TCS y TCI de potencia baja o media o ambas a discreción del investigador; se prohibió el uso de tratamientos sistémicos para la DA.1
**Estudio de vida real en el que se recogen, de manera retrospectiva, datos clínicos y demográficos de niños de 6-11 años con DA moderada a grave tratados con dupilumab(n=55).2 Los pacientes recibieron una dosis inicial de 300mg en el día 1 seguidos por 300 mg en el día 15 y después, 300 mg cada 4 semanas.2 La gravedad de la enfermedad fue evaluada en el estado basal y después a la semana 2, 4 y 16 mediante EASI, NRS (para evaluar el prurito [P-NRS] y también el sueño [S-NRS]) y CDLQI.2 Además de la eficacia también se evaluó el perfil de seguridad durante las 16 semanas del tratamiento con dupilumab.2
Referencias
- Irvine A, Deleuran M, Praestgaard A, et al. Dupilumab treatment improves health-related quality of life in children aged ≥ 6 to < 12 years with severe atopic dermatitis. Presentado en: The 2021 Annual Meeting of the American Academy of Dermatology, 2021.
- Napolitano M, Fabbrocini G, Neri I, et al. Dupilumab Treatment in Children Aged 6-11 Years With Atopic Dermatitis: A Multicentre, Real-Life Study. Paediatr Drugs. 10.1007/s40272-022-00531-0.
En pacientes adolescentes, DUPIXENT® en monoterapia proporcionó una mejora rápida y sostenida en la calidad de vida en la semana 16.1
- ≈ 60 % de los pacientes lograron una mejora clínicamente significativa del CDLQI2*
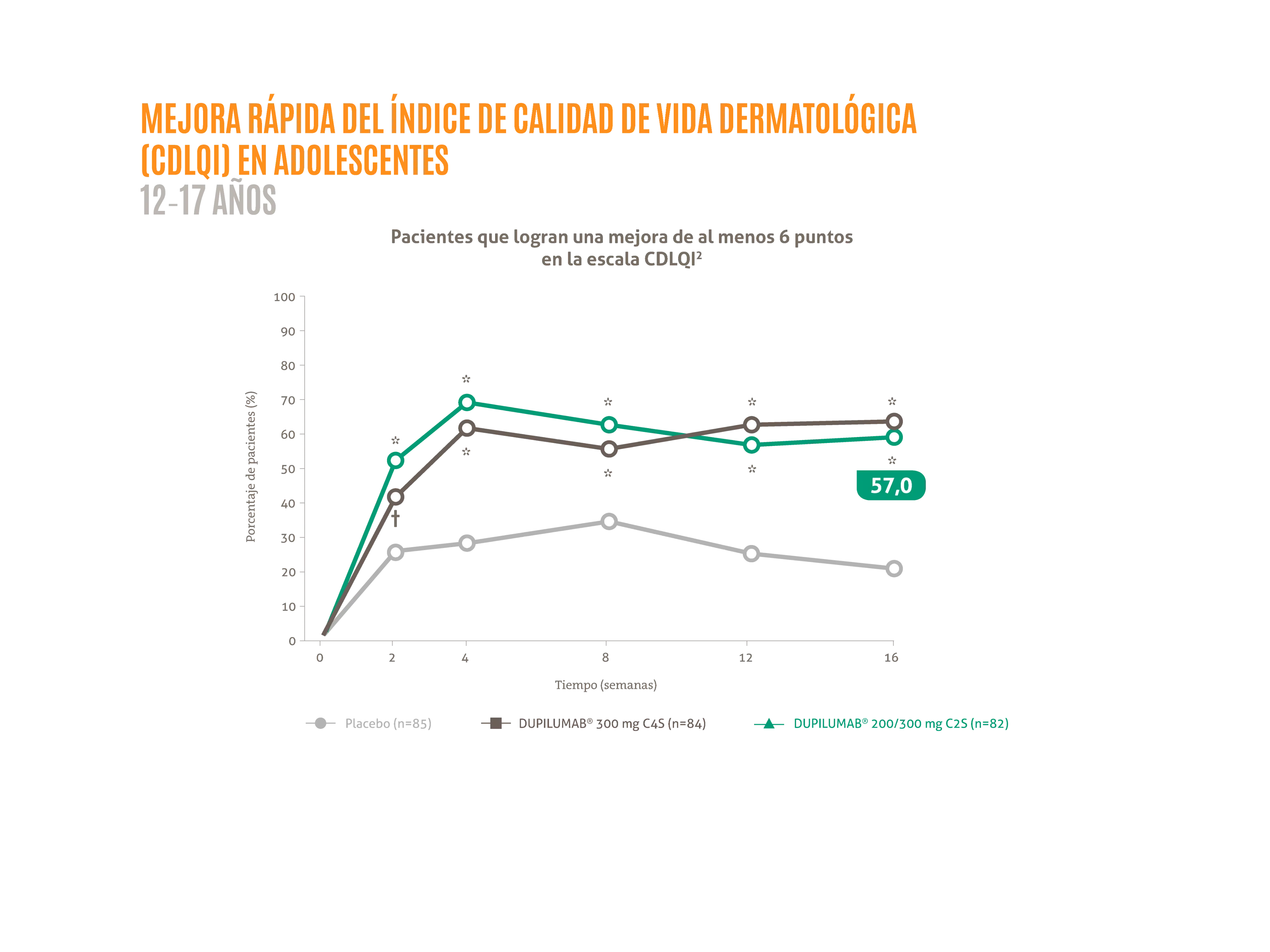
*Nominal p <0,01 vs. placebo. †Nominal p <0,05 vs. placebo.
Figura adaptada de Paller AS, et al. 2020.2
La posología aprobada en España para adolescentes con DA es: para los adolescentes con un peso <60 kg una dosis inicial de 400 mg seguido por una inyección de 200 mg cada 14 días y para los adolescentes con un peso >60 kg una dosis de inducción de 600 mg seguido por una inyección de 300 mg cada 14 días.
C2S: cada dos semanas; C4S: cada cuatro semanas; CDLQI: índice de calidad de vida dermatológica en niños.3
- Reducción de la falta de sueño en adolescentes 12-17 años2*
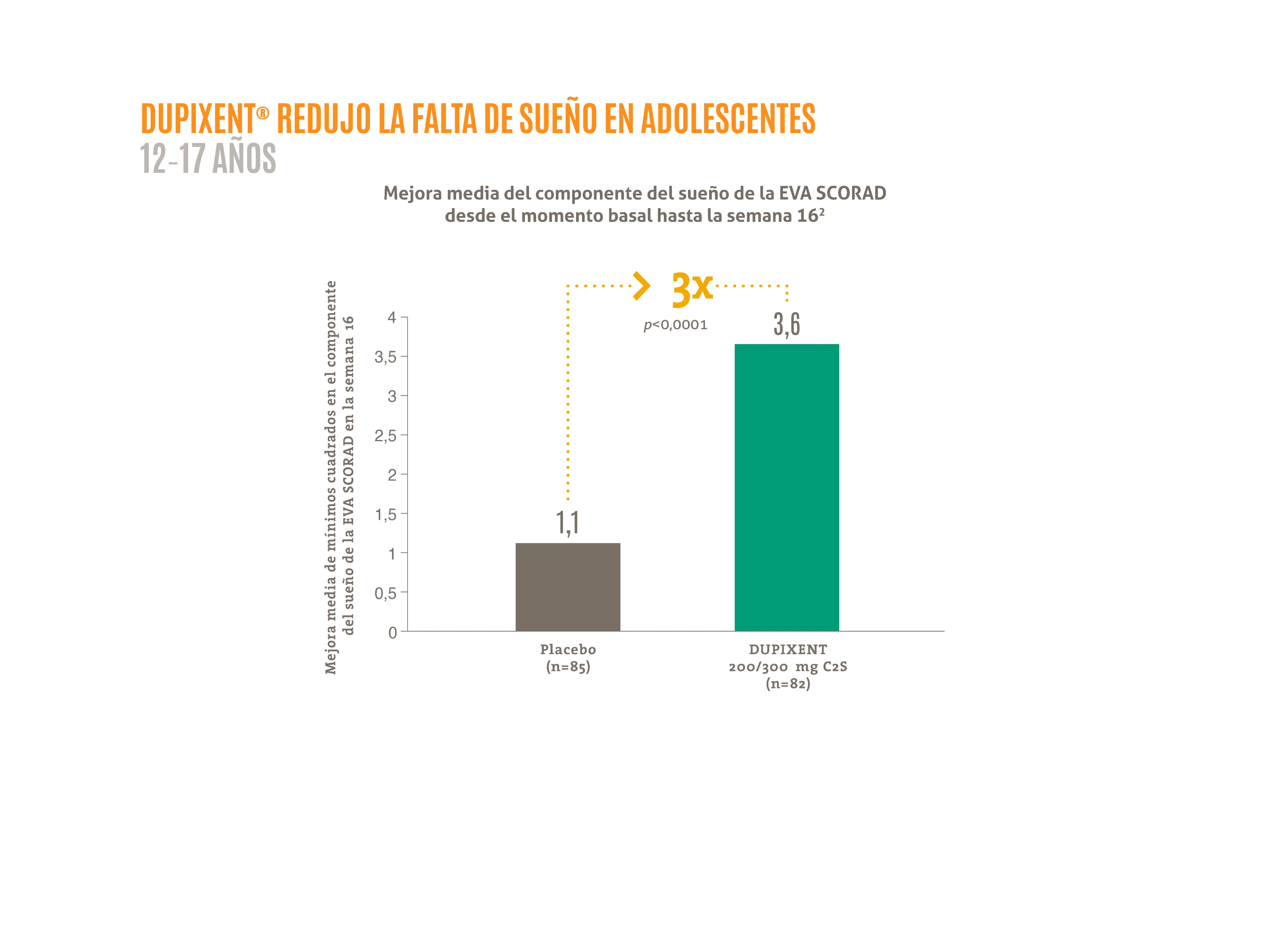
Figura elaborada a partir de los datos que aparecen en Paller AS, et al. 2020.2
– El componente del sueño de la EVA SCORAD es una escala que va desde 0 («ausencia de insomnio») hasta 10 («peor insomnio imaginable»).
En el momento basal del estudio LIBERTY AD ADOL, la puntuación media del componente del sueño de la EVA SCORAD fue de 5,6 y 5,4 en los grupos de placebo y de DUPIXENT® 200/300 mg C2S, respectivamente.
La posología aprobada en España para adolescentes con DA es: para los adolescentes con un peso <60 kg, una dosis inicial de 400 mg seguido por una inyección de 200 mg cada 14 días, y para los adolescentes con un peso >60 kg una dosis2 de inducción de 600 mg seguido por una inyección de 300 mg cada 14 días.
C2S: cada 2 semanas; C4S: cada 4 semanas; EVA: escala visual análoga; SCORAD: puntuación de gravedad de la dermatitis atópica.
*Análisis post-hoc del estudio LIBERTY AD ADOL sobre un subgrupo de 214 pacientes con un IGA >13 en la semana 16.2 El objetivo de este estudio fue la evaluación del impacto de dupilumab vs. placebo en conseguir una mejora clínicamente significativa de los signos, síntomas y calidad de vida de la dermatitis atópica.2 La significación clínica en uno o más de los tres dominios de signos, síntomas y calidad de vida se definió como: mejora ≥50 % de la puntuación EASI, ≥3 puntos en la escala de prurito NRS, o ≥6 puntos en la puntuación de CDLQI desde el estado basal.2
Referencias
- Simpson EL, Paller AS, Siegfried EC, et al. Efficacy and safety of dupilumab in adolescents with uncontrolled moderate to severe atopic dermatitis: a phase 3 randomized clinical trial. JAMA Dermatol. 2020;156(1):44-56.
- Paller AS, Bansal A, Simpson EL, et al. Clinically meaningful responses to dupilumab in adolescents with uncontrolled moderate-to-severe atopic dermatitis: post-hoc analyses from a randomized clinical trial. Am J Clin Dermatol. 2020;21(1):119-131.
Semana 52: resultados de mejora de calidad de vida
DUPIXENT® mejora de forma mantenida la calidad de vida en niños de 6-11 años hasta 52 semanas.1,2
- ≈87,5% de los pacientes mejoran ≥6 puntos en CDLQI a la semana 52.3*
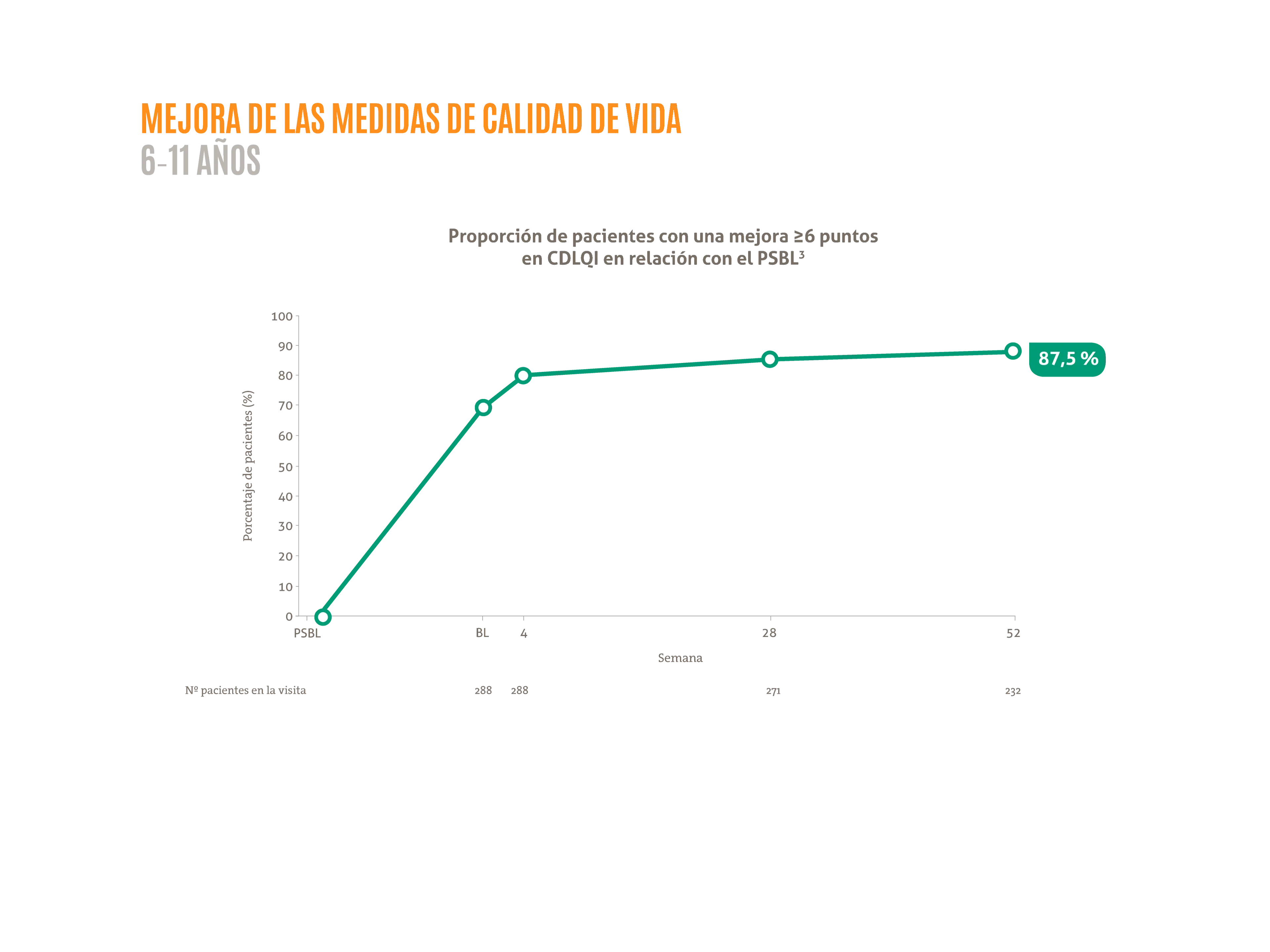
Figura adaptada de Paller AS, et al. 2021.3
La posología aprobada para niños (6-11 años entre 15 y 60 kg) es una inducción de 300 mg seguida por otra inyección de 300 mg a los 14 días y posteriormente una dosis de 300 mg cada 4 semanas. DUPIXENT® 200 mg cada 2 semanas también está disponible para niños de 6-11 años con un peso entre 15 y 60 kg según la evaluación del médico.
Los pacientes recibieron una dosis de 300 mg pudiendo ser incrementada la dosis en función del peso4 a 200 mg C2S si el peso <60 kg o 300 mg C4S si el peso >60 kg en caso de respuesta inadecuada.
BL: estado basal; CDLQI: índice de calidad de vida dermatológica en niños4; PSBL: estado basal del estudio inicial.
*Subanálsis del estudio AD-1434 (LIBERTY AD PED-OLE) que tiene como objetivo evaluar la eficacia y seguridad a largo plazo de dupilumab en pacientes pediátricos de 6-11 años con DA grave. El estudio LIBERTY AD PED-OLE es un estudio de fase III de OLE a largo plazo en curso que incluye pacientes pediátricos que participaron en ensayos anteriores de dupilumab en DA.3 El objetivo del OLE es evaluar la seguridad y eficacia a largo plazo de dupilumab en la población pediátrica .3 Se permitieron TCS y TCI de potencia baja o media o ambas a discreción del investigador; se prohibió el uso de tratamientos sistémicos para la DA.3
Referencias
- Cork MJ, Thaçi D, Eichenfield LF, et al. Dupilumab provides favorable long‐term safety and efficacy in children aged ≥ 6 to < 12 years with uncontrolled severe atopic dermatitis: results from an open‐label phase IIa study and subsequent phase III open‐label extension study. Br J Dermatol 2021; 184(5); 857-870.
- Cork MJ, Thaçi D, Eichenfield LF, et al. Dupilumab provides favorable long‐term safety and efficacy in children aged ≥ 6 to < 12 years with uncontrolled severe atopic dermatitis: results from an open‐label phase IIa study and subsequent phase III open‐label extension study. Br J Dermatol 2021; 184(5); 857-870. [suppl]
- Paller AS, Cork MJ, Siegfried EC, et al. Efficacy and safety of dupilumab in children aged 6–11 years with inadequately controlled severe atopic dermatitis: results from an open-label extension trial up to 1 year. Presentado en 3rd Annual RAD Conference, 2021.
DUPIXENT® mejora de forma mantenida la calidad de vida en adolescentes hasta 52 semanas.1
- 86,4 % de los pacientes mejoran ≥6 puntos en CDLQI a la semana 521
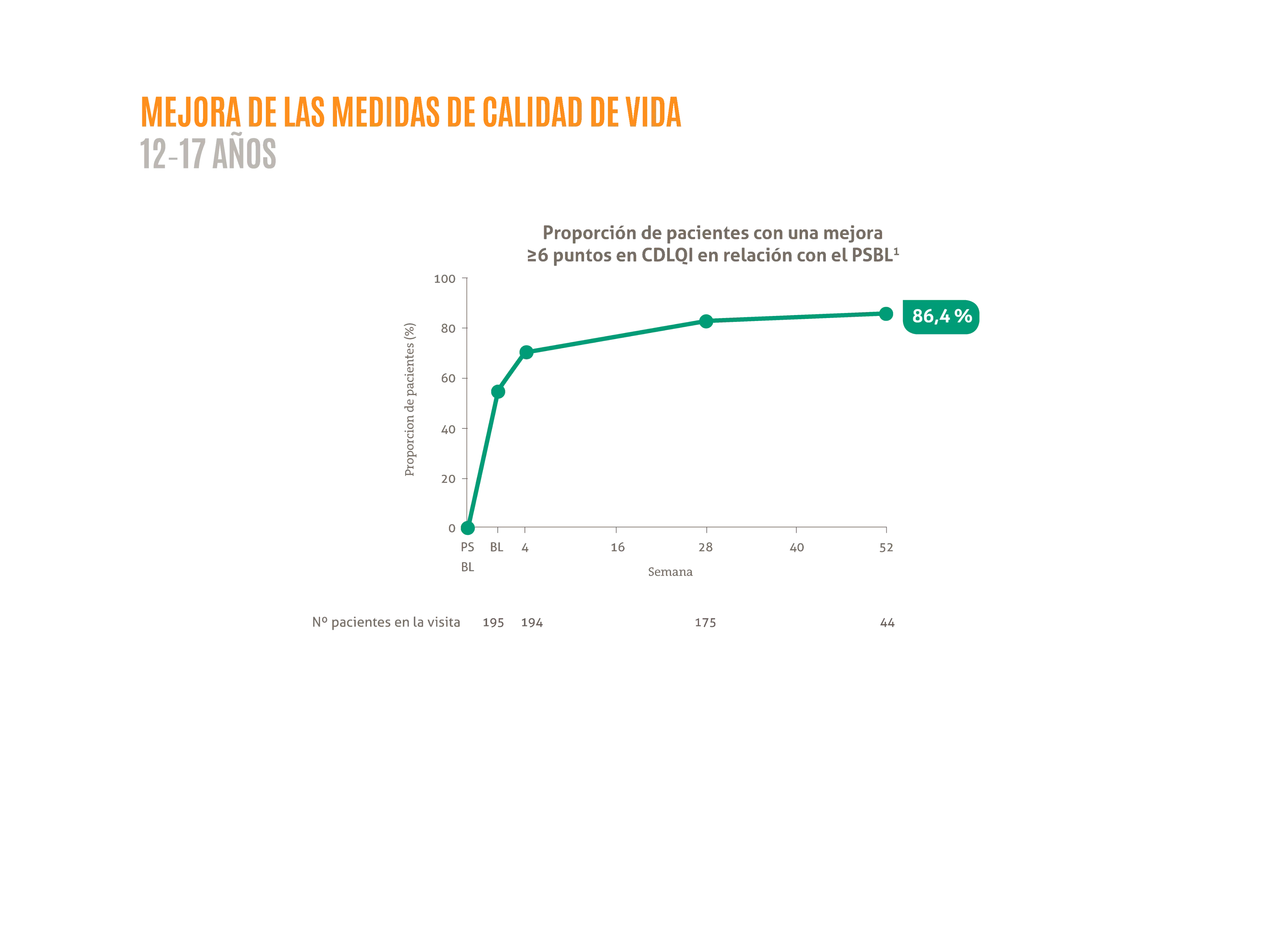
Figura adaptada de Blauvent A, et al. 2022.1
La posología aprobada en España para adolescentes con DA es: Para los adolescentes con un peso <60 kg una dosis inicial de 400 mg seguido por una inyección de 200 mg cada 14 días. Para los adolescentes con un peso >60 kg una dosis de inducción de 600 mg seguido por una inyección de 300 mg cada 14 días.
BL: estado basal; CDLQI: índice de calidad de vida dermatológica en niños; PSBL: estado basal del estudio inicial.
*LIBERTY AD PED-OLE que tiene como objetivo evaluar la eficacia y seguridad a largo plazo de dupilumab en adolescentes de 12-17 años con DA moderada a grave.1 El estudio LIBERTY AD PED-OLE es un estudio de fase III de OLE a largo plazo en curso que incluye pacientes pediátricos que participaron en ensayos anteriores de dupilumab en DA.1 El objetivo del OLE es evaluar la seguridad y eficacia a largo plazo de dupilumab en la población pediátrica.1 Se permitieron TCS y TCI de potencia baja o media o ambas a discreción del investigador; se prohibió el uso de tratamientos sistémicos para la DA.1
Contenido mínimo de Dupixent®
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
-
Dupixent 300 mg solución inyectable en jeringa precargada – 2 jeringas precargadas de 2 ml con protector de aguja (CN 718735.6).
-
Dupixent 300 mg solución inyectable en pluma precargada – 2 plumas precargadas de 2 ml (CN 758028.7).
-
Dupixent 200 mg solución inyectable en jeringa precargada – 2 jeringas precargadas de 1,14 ml (CN 727309.7).
-
Dupixent 200 mg solución inyectable en pluma precargada – 2 plumas precargadas de 1,14 ml (CN 758027.0).
PVP notificado: 1.267,45 €, PVP IVA notificado: 1.318,15 €.
Medicamento sujeto a prescripción médica. Diagnóstico hospitalario. Financiado por SNS. Dispensación hospitalaria sin cupón precinto.
CONSULTE LA FICHA TÉCNICA COMPLETA ANTES DE PRESCRIBIR ESTE MEDICAMENTO.
Ver ficha técnica DUPIXENT® 200 mg solución inyectable en jeringa precargada
Ver ficha técnica DUPIXENT® 200 mg solución inyectable en pluma precargada
Ver ficha técnica DUPIXENT® 300 mg solución inyectable en jeringa precargada
Ver ficha técnica DUPIXENT® 300 mg solución inyectable en pluma precargada
Dupixent está financiado en España de acuerdo con los criterios establecidos por el SNS.
1. NOMBRE DEL MEDICAMENTO
Dupixent 300 mg solución inyectable en jeringa precargada
Dupixent 300 mg solución inyectable en pluma precargada
Dupixent 200 mg solución inyectable en jeringa precargada
Dupixent 200 mg solución inyectable en pluma precargada
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Dupilumab 300 mg solución inyectable en jeringa precargada
Cada jeringa precargada de un solo uso contiene 300 mg de dupilumab en 2 ml de solución (150 mg/ml).
Dupilumab 300 mg solución inyectable en pluma precargada
Cada pluma precargada de un solo uso contiene 300 mg de dupilumab en 2 ml de solución (150 mg/ml).
Dupilumab 200 mg solución inyectable en jeringa precargada
Cada jeringa precargada de un solo uso contiene 200 mg de dupilumab en 1,14 ml de solución (175 mg/ml).
Dupilumab 200 mg solución inyectable en pluma precargada
Cada pluma precargada de un solo uso contiene 200 mg de dupilumab en 1,14 ml de solución (175 mg/ml).
Dupilumab es un anticuerpo monoclonal completamente humano producido por tecnología de ADN recombinante en las células de Ovario de Hámster Chino (OHC).
Para consultar la lista completa de excipientes, ver sección Lista de excipientes.
3. FORMA FARMACÉUTICA
Solución inyectable (inyectable).
Solución estéril transparente a ligeramente opalescente, de incolora a amarillo pálido, sin partículas visibles, con un pH de aproximadamente 5,9.
Referencias
- Blauvent A, Guttman-Yassky E, Paller AS, et al. Long-Term Efficacy and Safety of Dupilumab in Adolescents with Moderate-to-Severe Atopic Dermatitis: Results Through Week 52 from a Phase III Open-Label Extension Trial (LIBERTY AD PED-OLE). Am J Clin Dermatol. 2022;23(3):365-83.
- Ficha técnica de DUPIXENT®.