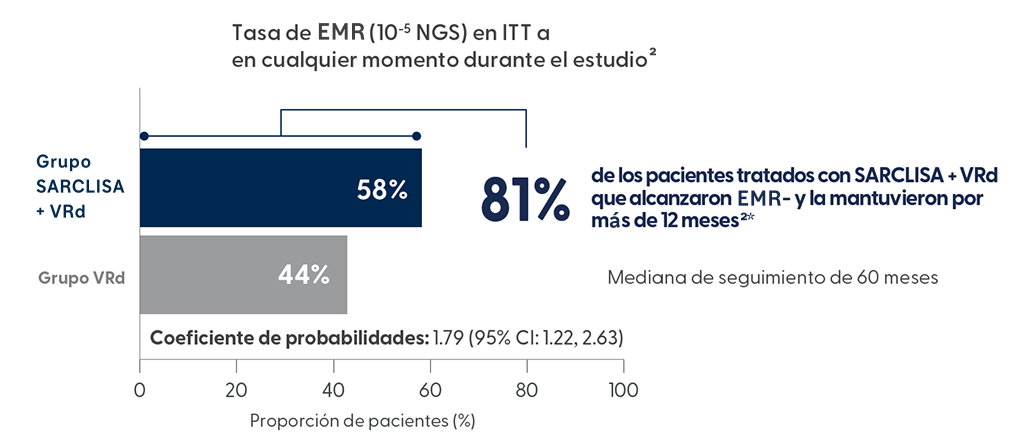
Extraído de N Engl J Med. 2024 Oct 31;391(17):1597-1609
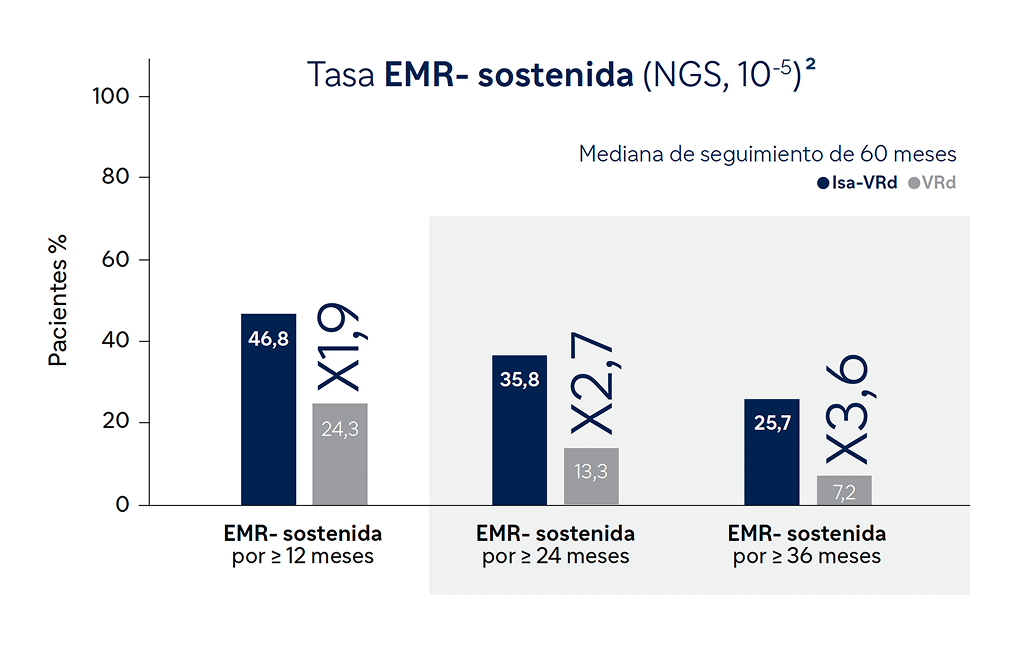
Extraído de Orlowski RZ, et al. ASH 2024; Abstract 770

El 58% de los pacientes alcanzaron la EMR- con SARCLISA + VRd1
En el seguimiento medio de 60 meses
Con SARCLISA+VRd la mediana de EMR- se alcanzó en la mitad de tiempo que con VRd (14,7 vs 32,8 meses) y la proporción de pacientes que mantuvieron tasas de negatividad sostenida durante ≥36 meses fue hasta 3,6 veces superior (25,7% Isa-VRd vs 7,2% VRd)4

Contenido mínimo de Sarclisa®
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
|
MEDICAMENTO |
INDICACIONES |
¿FINANCIADO POR SNS? |
PRECIO / REGIMEN DE PRESCRIPCIÓN Y DISPENSACIÓN / CONDICIONES DE FINANCIACIÓN |
|---|---|---|---|
|
SARCLISA 20 mg/ml concentrado para solución para perfusión – 1 vial de 5 ml (CN: 728802.2) |
1. En combinación con pomalidomida y dexametasona, para el tratamiento de pacientes adultos con mieloma múltiple resistente al tratamiento o recidivante que han recibido al menos dos tratamientos previos, incluyendo lenalidomida y un inhibidor del proteosoma y han demostrado progresión de la enfermedad en el último tratamiento. |
SÍ |
(CN: 728802.2): PVP notificado: 894,02€. PVP IVA notificado: 929,78€. |
|
2. En combinación con carfilzomib y dexametasona, para el tratamiento de pacientes adultos con mieloma múltiple que han recibido al menos un tratamiento previo. | |||
|
3. En combinación con bortezomib, lenalidomida y dexametasona, para el tratamiento de pacientes adultos con mieloma múltiple de nuevo diagnóstico que no son elegibles para trasplante autólogo de células madre. | |||
|
4. En combinación con bortezomib, lenalidomida y dexametasona, para el tratamiento de inducción de pacientes adultos con mieloma múltiple de nuevo diagnóstico que son elegibles para trasplante autólogo de células madre. |
NO |
(CN: 728802.2): PVP notificado: 894,02€. PVP IVA notificado: 929,78€. |
CONSULTE LA FICHA TÉCNICA COMPLETA ANTES DE PRESCRIBIR ESTE MEDICAMENTO.
Abreviaturas
1L = primera línea; EMR = enfermedad mínima residual; EMR- = enfermedad mínima residual negativa; ITT = intención de tratar; MMND = mieloma múltiple nuevo diagnóstico; NGS = secuenciación de nueva generación; VRd = bortezomib, lenalidomida y dexametasona.
Referencias
- Ficha técnica de SARCLISA, https://cima.aemps.es/cima/publico/detalle.html?nregistro=1201435001
- Ficha técnica DARZALEX, https://cima.aemps.es/cima/publico/detalle.html?nregistro=1161101001
- Facon T, et al. N Engl J Med. 2024;391:1597–1609.
- Orlowski RZ, et al. ASH 2024; Abstract 770.


