- Recurso
- Fuente: Campus Sanofi
- 30 abr 2024
Monografía: Eficacia de leflunomida

Formato PDF, 20 páginas
Introducción
La leflunomida es un agente antirreumático modificador de la enfermedad, con propiedades antiproliferativas, indicado para el tratamiento de pacientes adultos con artritis reumatoide (AR) activa como un fármaco antirreumático modificador de la enfermedad (FAME), y también indicado para el tratamiento de la artritis psoriásica (AP) activa1. Administrado por vía oral, se absorbe rápidamente desde el tracto gastrointestinal y ejerce una acción inmunomoduladora e inmunosupresora a través de la inhibición de la síntesis de pirimidinas2,3.
Efectivamente, una vez absorbida, la LEF se transforma en su forma activa, una malononitrilamida conocida como teriflunomida4 (Figura 1). El efecto más importante de esta sustancia a las dosis utilizadas en la AR y la AP es la inhibición de la dihidro-orotato deshidrogenasa (DHODH), enzima mitocondrial que regula la producción de la ribonucleótido uridina monofosfato (rUMP) pirimidina. La inhibición de la DHODH impide que las células activadas pasen de la fase G1 a la fase S a través de la vía apoptótica p52. La enzima es esencial para la proliferación de los linfocitos T. Se piensa que la inhibición de la síntesis de rUMP es el mecanismo fundamental de la acción antiinflamatoria e inmunomoduladora de la LEF a las dosis empleadas habitualmente en el tratamiento de las artropatías inflamatorias crónicas5,6.
Figura 1. Leflunomida.
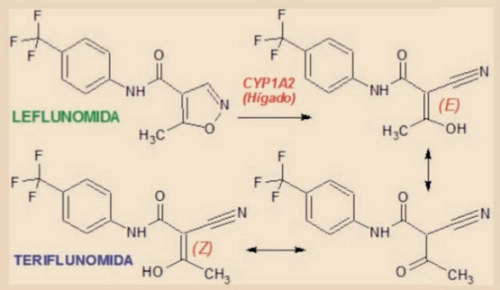
La estructura de la enzima DHODH ha sido determinada por análisis cristalográfico de rayos X. La DHODH humana tiene dos dominios: un dominio alfa helicoidal que forma el canal de apertura que conduce al lugar activo y un dominio alfa-beta en tonel que contiene el locus activo. La teriflunomida se une al canal de entrada y ejerce el efecto inhibitorio sobre la enzima.
Farmacodinamia
La LEF ejerce importantes acciones in vitro sobre células inmunoinflamatorias (Tabla 1). Entre ellas, se incluyen algunas que resultan relevantes conocer para comprender su mecanismo de acción en la terapia de la AR y la AP2,3,6-12:
- Inhibición de la adhesión leucocitaria a las células del endotelio vascular.
- Efecto inhibitorio preferencial sobre las células B autorreactivas de memoria.
- Interferencia con la función de las células dendríticas alterando la presentación antigénica.
- Bloqueo de dos pasos esenciales para la activación del factor nuclear (NF)-kappa B, incluyendo la degradación del inhibidor del kappa B alfa y la subsiguiente translocación de la subunidad p65 al núcleo, impidiendo las consecuencias proinflamatorias de la activación del NF-kappa B.
- Inhibición de la diferenciación osteoclástica mediada por el receptor activador de ligando de factor nuclear kappa B.
- Inhibición de las tirosinas cinasas Jano 1 (JAK1) y JAK3 y de MAP3K2, alterando la señalización intracelular de los receptores de citocinas.
- Disminución de la respuesta de células B a interleucina-4 (IL-4).
- Disminución de la secreción de IL-1 e IL-11, con reducción de la síntesis de IL-2.
- Aumento de la síntesis de factor de crecimiento transformante beta.
- Alteración del metabolismo de pirimidinas, originando un cambio de respuesta Th1 a Th2.
Tabla 1. Mecanismos de acción de la leflunomida: efectos subsiguientes a la administración del fármaco6-12.
|
Inhibición de la síntesis de pirimidinas. |
|
Inhibición de la síntesis de dUMP. |
|
Inhibición de la proliferación de células T. |
|
Inhibición de la diapédesis y de la quimiotaxis. |
|
Inhibición del contacto intercelular. |
|
Inhibición de la señalización intracelular. |
|
Inhibición de la adhesión leucocitaria. |
|
Inhibición de las tirosinas cinasas. |
|
Inhibición de la expresión génica del NF-kappa B. |
|
Inhibición de la expresión de la IL-1β. |
|
Inhibición de la producción de metaloproteinasas. |
dUMP: monofosfato de desoxiuridina; IL: interleucina; NF: factor nuclear.
Después de la administración de LEF, se han observado importantes cambios en los marcadores in vivo de respuesta inflamatoria y daño articular. Un ensayo clínico aleatorizado13, que incluyó 39 pacientes con AR activa tratados con LEF o metotrexato (MTX), analizó biopsias sinoviales de estos sujetos basalmente, y a los cuatro meses de tratamiento, detectó similares cambios antiinflamatorios en ambos grupos, consistentes en:
- Reducción en el número de macrófagos y de células T.
- Disminución de la infiltración sinovial por linfocitos y por sinoviocitos tipo I con reducción de la inflamación vascular, incluyendo la expresión de molécula de adhesión intercelular-1 (ICAM- 1, intercellular adhesion molecule-1) y molécula de adhesión de células vasculares-1 (VCAM-1, vascular cell adhesion molecule-1), con reducción de la producción de metaloproteasas, lo cual podría disminuir la progresión del daño radiológico articular14.
- En el grupo de pacientes que cumplieron criterios de respuesta en la escala del American College of Rheumatology (ACR) de 20 (ACR-20), se detectó una mayor reducción de la expresión de ICAM-1, VCAM-1, IL-1-β, de metaloproteasas 1 (MMP-1) y de colagenasa, comparativamente con los que no alcanzaron este porcentaje de repuesta clínica.
La LEF reduce los niveles séricos de interferón gamma sin afectar a los de IL-6; sin embargo, el MTX disminuye ambas citocinas séricas15. Los pacientes con AR tratados con LEF muestran disminuciones de los niveles de MMP-1, de la actividad de MMP-9 (y de su marcador de degradación de la proteína oligométrica de la matriz del cartílago)16.
La LEF también disminuye los niveles séricos del reactante de fase aguda amiloide A sérico. La LEF directamente o a través de su metabolito activo A771726 inhibe la acumulación de prostaglandina E2 hasta unos niveles que resultan menores de los necesarios para alterar la activación de la ciclooxigenasa 217. Sin embargo, no parece que la LEF tenga propiedades antiinflamatorias in vivo a través de mecanismos que incluyan la inhibición de la ciclooxigenasa 2 o de la sintetasa inducible del óxido nítrico.
Farmacocinética
Tras su administración por vía oral, la LEF es metabolizada para dar lugar a un metabolito activo (A771726, antes llamado M1), que es el responsable de casi toda la actividad in vivo (Figura 1)18. Las concentraciones plasmáticas de LEF observadas de manera ocasional son muy bajas. Los estudios farmacocinéticos de la LEF han examinado fundamentalmente las concentraciones plasmáticas de este metabolito activo.
Tras la administración por vía oral, se alcanzaron unas concentraciones máximas del metabolito activo, entre 6 y 12 horas después de la toma, ya que la vida media de este es muy prolongada (dos semanas aproximadamente), en los estudios clínicos iniciales, se utilizó una dosis de ataque de 100 mg durante tres días para facilitar la rápida obtención de las concentraciones de equilibrio estable.
Sin esta dosis de ataque, se calcula que la obtención de las concentraciones plasmáticas de equilibrio estable requeriría casi de dos meses de tratamiento. Las concentraciones plasmáticas obtenidas tanto al utilizar las dosis de ataque como con la administración clínica continuada indican que los valores plasmáticos del metabolito son proporcionales a la dosis. La biodisponibilidad de LEF es del 80%. Las concentraciones plasmáticas del metabolito M1 no experimentan cambios significativos con la ingesta de comidas grasas.
El metabolito M1 tiene un volumen de distribución bajo, y su unión a la albúmina es alta (99,3%). La fijación a las proteínas es lineal a concentraciones terapéuticas. La fracción libre de metabolito es ligeramente superior en los pacientes con AR, y se duplica en los pacientes con insuficiencia renal crónica.
La LEF es metabolizada para originar el metabolito principal nombrado anteriormente y múltiples metabolitos menores. El compuesto original rara vez es identificable en el plasma. Se desconoce el lugar específico en el que se produce el metabolismo de la LEF. Diversos estudios sugieren que el metabolismo del fármaco puede producirse tanto en la pared gastrointestinal como en el hígado. No se ha identificado ninguna enzima específica como vía principal del metabolismo de la LEF, pero sí se han identificado las fracciones celulares citosólica y microsómica hepáticas como localizaciones de este metabolismo.
El metabolito activo M1 es eliminado mediante un ulterior metabolismo y posterior excreción renal, así como mediante excreción biliar directa. En un estudio de 28 días de duración realizado sobre la excreción del fármaco (n = 3), en el que se utilizó una dosis única del compuesto marcado radiactivamente, aproximadamente un 43% de la radiactividad total fue eliminada por vía urinaria y un 48% se eliminó por las heces. El posterior análisis de las muestras reveló que los metabolitos urinarios principales eran glucurónidos de LEF y un derivado del ácido oxanílico del metabolito M1. El metabolito fecal principal es el M1. De las dos vías de eliminación, la renal es la más importante a lo largo de las 96 primeras horas, tras lo cual empieza a predominar la eliminación fecal. El aclaramiento del metabolito M1 tras la administración venosa es de 31 mL/hora.
Debido a que el metabolito activo de la LEF experimenta una marcada circulación enterohepática y una recirculación, se pueden detectar niveles plasmáticos del mismo hasta dos años después.
El metabolismo del fármaco se ve influido por la actividad de CP2C19, una enzima hepática que metaboliza el 10% de los fármacos usados habitualmente, incluyendo el omeprazol, el clopidogrel y el diacepam19-21. En adultos, no se han encontrado diferencias en la farmacocinética de la LEF según la edad, el sexo o la raza. Sin embargo, el aclaramiento de la LEF aumenta un 38% en los fumadores. Algunos estudios han sugerido que un polimorfismo en el alelo del receptor estrogénico 1 puede ser el responsable de diferencias en la eficacia entre mujeres tratadas con LEF22. También se ha relacionado un polimorfismo genético en el CYP1A2 con el mayor riesgo de toxicidad23.
Las principales interacciones medicamentosas de la LEF se producen con:
- Warfarina24,25: la LEF puede potenciar la acción de la warfarina por una inhibición competitiva sobre el metabolismo del citocromo.
- Colestiramina: se une a las sales biliares e impide que lo haga la LEF, con lo cual anula su circulación enterohepática y facilita su eliminación.
Precisamente esta última interacción se puede utilizar para acelerar la eliminación del fármaco (por ejemplo, para prevenir el riesgo fetal durante el embarazo en caso de exposición accidental a la LEF). La administración oral de 8 g de colesteramina cada 8 horas durante 11 días reduce la persistencia de la LEF en sangre, ya que la misma depende de la circulación enterohepática del metabolito activo. Para demostrar el lavado completo, se debe comprobar que la concentración sérica es menor de 0,02 mg/L en dos muestras separadas por al menos 14 días. Si una vez realizada esta determinación el nivel sigue siendo elevado, se puede repetir el lavado con colestiramina.
En los ensayos clínicos iniciales con LEF se usó una dosis de carga consistente en administrar 100 mg diarios los tres primeros días de terapia. La finalidad de esta estrategia era acelerar en el tiempo la consecución de la eficacia terapéutica. Sin embargo, esta dosis de carga aumenta el riesgo de efectos adversos, especialmente diarrea y malestar abdominal, por lo que hoy día ha caído en desuso y se suele comenzar con dosis de 20 mg diarios26. Un ensayo clínico aleatorizado que incluyó 120 pacientes no encontró ventajas para usar la dosis de carga (100 mg diarios los tres primeros días) cuando se comparaba con el inicio de terapia a una dosis fija de 20 mg diarios desde el principio del tratamiento27.
La dosis de 10 mg se puede utilizar en pacientes con intolerancia gastrointestinal o si se combina la LEF con MTX. La información disponible sobre la dosificación de la LEF en casos de insuficiencia renal o hepática es limitada. Estudios de una única dosis en pacientes con enfermedad renal crónica indican que la LEF no se elimina por la diálisis peritoneal continua o por la hemodiálisis, debido a su alto grado de unión a proteínas28.
Eficacia de la leflunomida en las artritis reumatoide
Monoterapia
La LEF fue aprobada en 1998 para el tratamiento de los adultos con AR, tras la realización de ensayos clínicos que evaluaron su eficacia comparativamente con placebo, MTX, sulfasalacina (SSZ) e incluso ciclosporina A (CsA) (Tabla 2)5,29-33. LEF fue similar a MTX en la mayoría de las variables clínicas analizadas y superior a SSZ a los 24 meses de seguimiento. El efecto de la LEF sobre la progresión del daño estructural radiológico es mayor que el placebo y similar al ejercido por MTX y SSZ en pacientes con AR34.
De gran interés resultan los datos a los cinco años de un estudio abierto, extensión de dos de los estudios fase III35. Los datos de este estudio demuestran cómo la eficacia de la LEF se mantiene a lo largo de los años, con porcentajes de respuesta ACR-20, ACR-50 y ACR-70 a los cinco años del 69, el 43 y el 19%, respectivamente, calculados sobre los 214 pacientes que entraron en el estudio de extensión.
Tabla 2. Eficacia de la monoterapia con leflunomida en la artritis reumatoide
|
Estudio |
Nº de pacientes |
Diseño |
Dosificación |
Comparadores |
Respuestas ACR- 20, 50, 70 (%) |
Seguimiento |
|
Strand et al., 19995 |
482 |
Doble ciego, aleatorizado, controlado con placebo |
– LEF 100 mg 3 días y luego 20 mg/día – MTX 7,5-15 mg/sem – Placebo |
LEF MTX Placebo |
52, 34, 20 46, 23, 9 26, 8, 4 |
12 |
|
Cohen et al., 200130 |
199 |
Doble ciego aleatorizado |
– LEF 10-20 mg/día – MTX 15-20 mg/sem |
LEF MTX |
79, 56, 26 67, 43, 20 |
12 |
|
Smolen et al., 199931 |
358 |
Doble ciego, aleatorizado, controlado con placebo |
– LEF 100 mg 3 días y luego 20 mg/día – SSZ 2 g/día – Placebo |
LEF SSZ Placebo |
55, 33, NR 56, 30, NR 29, 14, NR |
6 |
|
Scott et al., 200132 |
168 |
Doble ciego aleatorizado |
– LEF 20 mg diarios – SSZ 2 g/día |
LEF SSZ Placebo/SSZ |
82, 52, 25 60, 25, 17 NR, NR, NR |
24 |
|
Emery et al., 200033 |
999 |
Doble ciego aleatorizado |
– LEF 100 mg 3 días y luego 20 mg/día – MTX 7,5-15 mg/sem |
LEF MTX |
50, NR, NR 65, NR, NR |
24 |
ACR: American College of Rheumatology; LEF: leflunomida; MTX: metotrexato; NR: no descrito; PL: placebo; sem: semana; SSZ: sulfasalacina.
Leflunomida frente a metotrexato
Un ensayo clínico de fase III, de 52 semanas de duración, comparó, en pacientes con AR, la LEF con MTX y placebo30. La LEF se inició con una dosis de carga de 100 mg diarios durante tres días, seguida de 20 mg diarios por vía oral. El MTX se inició en una dosis de 7,5 mg semanales, que se podían incrementar hasta 15 mg en la novena semana. Se incluyeron 482 sujetos. Un análisis por intención de tratar obtuvo respuestas ACR-20 del 52% en el grupo LEF frente al 46% en MTX y 26% en el placebo (p <0,001 para los grupos de LEF y MTX frente a placebo). Las respuestas ACR-50 a las 52 semanas fueron del 52, el 23 y el 8% para los grupos LEF, MTX y placebo, respectivamente (p <0,001 para los grupos de LEF y MTX frente a placebo). La mejoría del índice de discapacidad funcional del cuestionario de evaluación de la salud (HAQ, Health Assessment Questionnaire) fue de –0,60 para los pacientes tratados con LEF. La progresión del daño estructural medida por el índice de Sharp total fue menor en el grupo de LEF frente a placebo (p <0,001)14.
Alfaro-Lara et al.36 han realizado recientemente una revisión sistemática y metaanálisis para analizar la utilidad de la LEF frente a MTX como primer FAME clásico sintético (FAMEcs) en la AR. Incluyeron en este análisis 1.984 pacientes procedentes de seis ensayos clínicos; 986 pacientes recibieron LEF 20 mg diarios después de tres días iniciales de dosis de carga de 100 mg diarios y 998 tomaron MTX (entre 7,5 y 20 mg semanales). No se detectaron diferencias en la probabilidad de alcanzar respuestas ACR-20 a las 52 semanas entre lo sujetos que recibieron LEF y MTX (OP = 0,88; intervalo de confianza [IC] del 95%, 0,74-1,06; p = nivel de significación).
La diferencia media en la reducción del número de articulaciones inflamadas al final del estudio fue mayor para MTX; la diferencia en el número de articulaciones dolorosas no fue estadísticamente significativa. Tampoco se encontraron diferencias estadísticamente significativas entre LEF y MTX en la reducción de los niveles de PCR sérica o en la evaluación por el médico de la situación de la enfermedad.
Desde el punto de la seguridad, la elevación de los niveles séricos de enzimas hepáticas fue más frecuente en el grupo LEF, odds ratio (OR) o razón de probabilidades: 0,38 (IC del 95%, 0,27-0,53; p <0,001); la incidencia de molestias gastrointestinales fue mayor en el grupo que tomó MTX, OR: 1,44, (IC del 95%, 1,17-1,79; p <0,001). La frecuencia de infecciones no graves fue similar en ambos grupos, OR: 0,87 (IC del 95%: 0,64-1,18; p = nivel de significación). El número de interrupciones del tratamiento fue similar entre ambos grupos de tratamiento.
Una revisión sistemática (RS) de la Fundación Cochrane29 ha comparado también la eficacia de la monoterapia con LEF frente a la de MTX en pacientes con AR. Incluyeron 11 ensayos clínicos con duración entre tres meses y dos años de terapia. No detectaron diferencias entre LEF y MTX en respuestas ACR-20 a los 3, 4, 6, 12 y 24 meses. Tampoco observaron diferencias en respuestas ACR-50 a los 12 y 24 meses. Un número significativamente mayor de pacientes tratados con LEF obtuvo respuestas ACR-70 a los 12 meses (riesgo relativo [RR]: 0,44; IC del 95%, 0,26-077) pero no a los dos años (RR: 0,72; IC del 95%, 0,44-1,18).
Durante el seguimiento cronológico de los pacientes, los efectos de la LEF no fueron significativamente diferentes a los de MTX en la reducción del número de articulaciones inflamadas, de la velocidad de sedimentación globular o de la intensidad del dolor. La mejoría de la capacidad funcional fue similar en ambos grupos. Los cambios en la progresión del daño articular radiológico medido por el índice de Sharp total no fueron significativamente diferentes cuando se comparó la LEF con MTX a los 12 y 24 meses de tratamiento.
Leflunomida frente a sulfasalacina
La RS anterior29 ha comparado LEF y SSZ en la AR con datos obtenidos de tres estudios32,37,38. No encontraron diferencias en las tasas de respuesta ACR-20, ACR-50 y ACR-70 a los 6 y a los 12 meses. Solo a los 24 meses la respuesta ACR-20 fue significativamente mejor en el grupo LEF frente a SSZ (RR: 0,73; IC del 95%, 0,57-0,93). De la misma forma, la tasa de respuesta ACR-50 fue mejor en el grupo LEF a los 24 meses (RR: 0,48; IC del 95%, 0,28-0,80). No se observaron diferencias en la respuesta ACR-70 entre LEF y SSZ en ningún momento del seguimiento cronológico.
A los seis y dos meses, la reducción del número de articulaciones dolorosas o inflamadas fue similar; a los 24 meses, el grupo LEF mostraba mejor comportamiento en la reducción del número de articulaciones dolorosas (diferencia de medias ponderada [WMD, weighted mean difference]: −3,33 articulaciones; IC del 95%, de −5,83 a −0,83) y de inflamadas (WMD: -2,62; IC del 95%, de −4,67 a −0,57).
A los 6 y 12 meses, no se observaron diferencias estadísticamente significativas entre LEF y SSZ en la evaluación del estado de la enfermedad por el paciente y el médico ni en la progresión del daño estructural medido por el índice de Sharp. La intensidad del dolor articular medida por escalas analógicas visuales (EAV) disminuyó de forma significativa (comparada con la SSZ) en el grupo que tomó LEF a los 6, 12 y 24 meses. También el índice de discapacidad HAQ mejoró más con LEF a los 6 y 24 meses, pero no a los 12 meses.
En el estudio Rheumatoid arthritis Evaluation of Leflunomide further insights into its efficacy (RELIEF)39, los individuos recibieron inicialmente LEF durante seis meses. Aquellos que presentaron una respuesta inadecuada de acuerdo con el índice de actividad de la enfermedad con recuento de 28 articulaciones (DAS28, disease activity score 28) fueron aleatorizados para recibir LEF y SSZ o para cambiar desde LEF a SSZ + placebo. Se incluyeron 56 y 50 pacientes, respectivamente, en cada rama de tratamiento. La combinación de LEF y SSZ producía, de una forma significativa, más porcentaje de pacientes con respuesta ACR-50 que la rama de SSZ + placebo. Esto podría significar que, en individuos con AR y respuesta inadecuada a la LEF, es mejor añadir SSZ que cambiar a SSZ. Las interrupciones por toxicidad fueron más frecuentes en el grupo que recibió la combinación. No se detectaron acontecimientos adversos nuevos o inesperados.
Terapia combinada
Terapia combinada de leflunomida con metotrexato
Los FAMEcs constituyen la base del manejo terapéutico de los pacientes con AR. La EULAR recomienda, en pacientes con intolerancia o contraindicación para el uso de MTX, iniciar el tratamiento con LEF o SSZ. En el caso de la LEF, la EULAR recomienda una dosificación de 20 mg/día sin dosis de carga. En esta situación, además, la EULAR habla de estrategia terapéutica, lo cual significa que la LEF puede usarse tanto en monoterapia como en terapia combinada con MTX. Además, la combinación se puede establecer de una forma escalonada en el tiempo, según los requerimientos del paciente41.
Eficacia de leflunomida + metotrexato, comparada con metotrexato
La RS anteriormente citada ha analizado también la eficacia de la terapia combinada LEF + MTX frente a MTX en monoterapia en pacientes con AR (Tabla 3)29,42,43.
Un número significativamente mayor de pacientes con AR alcanzan respuestas ACR-20, ACR-50 y ACR-70 a las 24 semanas con la combinación de MTX + LEF, comparados con la monoterapia con MTX. El RR para conseguir una respuesta ACR-20 fue de 0,42 (IC del 95%, 0,20-0,63), el de una respuesta ACR-50 fue de 0,23 (IC del 95%, 0,11-0,48), y el de una respuesta ACR-70 fue del 0,23 (IC del 95%, 0,07-0,77). A las 48 semanas, el estudio de extensión confirmó que las respuestas ACR-20, ACR-50 y ACR-70 se obtenían en igual cuantía independientemente de que el paciente tomara la combinación desde el principio o la iniciara por cambio desde la monoterapia con MTX.
El número de articulaciones dolorosas y el de articulaciones inflamadas se redujo en mayor cuantía, de forma estadísticamente significativa, en los sujetos que recibían la combinación LEF + MTX a las 24 semanas: la WMD fue de –7,6 articulaciones dolorosas (IC del 95 %, de –10,59 a –4,61) y la de articulaciones inflamadas fue de –3,6 articulaciones (IC del 95 %, de –5,47 a –1,73). A las 48 semanas, los pacientes que recibían MTX + placebo fueron trasvasados a LEF + MTX; los cambios en los recuentos articulares no fueron diferentes de los que recibieron LEF + MTX desde el comienzo del estudio.
Tabla 3. Leflunomida + metotrexato frente a monoterapia con metotrexato en la artritis reumatoide. Resultados a seis meses. Revisión sistemática29.
| Variable | Riesgo comparativo ilustrativo IC del 95% |
Efecto relativo IC del 95% |
Nº de Nº de estudios | Calidad de la evidencia Grado |
Diferencias (IC del 95%) | |
|
Riesgo |
Riesgo LEF +/- FAMEcs | |||||
|
Respuesta ACR-50 |
60 por 1.000 |
261 por 1.000 125-542 |
RR: 4,35 2,09- 9,03 |
263 (1 estudio) |
++++ Alta |
Diferencia absoluta de riesgos: 20% (7 a 48%) NNT: 5 (4 a 9) |
|
Cambio HAQ desde basal |
−0,1 unidades |
−0,3 unidades −0,42 a −0,18 |
263 (1 estudio) |
++++ Alta | ||
|
Cambios en la intensidad del dolor (EAV 0-100 mm) |
−8,3 mm |
−16,9 mm −10,0 a −23,7 mm |
263 (1 estudio) |
++++ Alta | ||
|
Interrupciones por acontecimientos adversos |
68 por 100 |
124 por 1.000 56 a 270 |
1,82 0,83- 3,57 |
263 (1 estudio) |
+++ Moderada |
Diferencia absoluta de riesgos: 5% (1 a 20%) NNH: 17 (sin significado estadístico) |
ACR: American College of Rheumatology; EAV: escala analógica visual; FAMEcs: fármacos modificadores de enfermedad clásicos sintéticos; HAQ: cuestionario de evaluación de la salud (Health Assessment Questionnaire); IC: intervalo de confianza; LEF: leflunomida; NNH: número de pacientes que hay que tratar para desencadenar un efecto secundario (number needed to harm); NNT: número de pacientes necesario para tratar; RR: riesgo relativo.
La intensidad del dolor se redujo significativamente en el grupo LEF + MTX frente al de MTX en la semana 24: la diferencia ponderada de las medias en la gravedad del dolor medida por la EAV fue de –16,9 mm (IC del 95 %, de –23,7 a –10,1). La combinación de LEF y MTX redujo los niveles séricos de proteína C-reactiva (PCR) a las 24 semanas significativamente con respecto al grupo que solo recibía MTX. La diferencia ponderada de las medias en el cambio de la PCR fue de –12,1 mg/L (IC del 95 %, de –19,84 a –4,36). A las 48 semanas no hubo diferencias.
Desde el punto de vista de la valoración de la capacidad funcional, a las 24 semanas de tratamiento, LEF + MTX mejoraron la puntuación del índice de discapacidad HAQ de forma significativa con respecto a la monoterapia con MTX (diferencia ponderada de medias: –0,3 puntos; IC del 95%, de –0,42 a –0,18). A las 48 semanas, cuando los dos grupos de pacientes estaban tratados con la terapia combinada LEF + MTX, estas diferencias desaparecieron.
La evidencia obtenida de esta comparación29 fue de categoría oro, lo cual supone que procede de uno o más ensayos clínicos con los siguientes criterios para la variable principal de valoración:
- Tamaño muestral mayor o igual de 50 individuos por grupo.
- Adecuado diseño del ciego para pacientes y evaluadores.
- Tratamiento adecuado de las pérdidas e interrupciones de los estudios (imputaciones adecuadas en más del 80% de las pérdidas de seguimiento).
- Ocultación adecuada de las asignaciones de tratamiento.
Eficacia de leflunomida + metotrexato, comparada con leflunomida29,44-48
Las respuestas de la EULAR buena, moderada y sin respuesta y las tasas de remisión de la EULAR a los tres meses fueron similares entre los pacientes con AR que tomaban LEF + MTX y los que recibieron LEF en monoterapia. La calidad de esta evidencia fue de categoría plata. Esto significa que está obtenida de una revisión sistemática o un ensayo clínico que no cumple los criterios de calidad oro o superior. Se incluye también la evidencia procedente de uno o más estudios no aleatorizados de cohortes o de uno o más estudios de casos y controles (Tabla 4).
Tabla 4. Eficacia de la terapia combinada leflunomida + metotrexato en la artritis reumatoide.
|
Estudio |
Diseño/duración/calidad |
Intervenciones (n) |
Eficacia: respuestas ACR-20, 50, 70 (%) |
|
Fleischmann et al., 201446 |
Datos agregados APPEAL + Latin RA, 16 semanas Jadad 4 |
– ETN + MTX (n = 478) – HCQ + MTX (n = 81) – SSZ + MTX (n = 95) – LEF + MTX (n = 69) |
82, 56, 24 59, 31,12 54, 20, 6 62, 38, 7 |
|
Kremer et al., 200244 |
Doble ciego Controlado 24 semanas Jadad 5 |
– MTX (15-20 mg/sem) + placebo (n = 130) – MTX + LEF 100 mg/día, 2 días → LEF 10 mg/día (si actividad, ↑ dosis a 20 mg/día) (n = 133) |
19, 6, 2 46, 26, 10 |
|
Wijesinghe et al., 201747 |
Doble ciego, Controlado 24 semanas Jadad 5 |
– RTX + MTX: RTX 500 mg i.v. días 0 y 14 + MTX (n = 20) – LEF + MTX: LEF 10 mg/día (hasta 20 mg/día) + MTX (n = 19) |
85, 60, 35 84, 64, 32 |
ACR: American College of Rheumatology; ETN: etanercept; HCQ: hidroxicloroquina; LEF: leflunomida; MTX: metotrexato; RTX: rituximab; sem: semana; SSZ: sulfasalacina.
Seguridad de la terapia combinada de leflunomida + metotrexato42,43
El número total y el porcentaje de interrupciones del tratamiento debidas a acontecimientos adversos relacionados en el fármaco fueron similares entre los sujetos que recibieron LEF + MTX y los tratados con MTX al cabo de 24 semanas de terapia. Se observaron resultados similares al terminar la extensión de 48 semanas del estudio. Después de que los pacientes que inicialmente recibían monoterapia con MTX fueron transferidos a la combinación MTX + LEF (sin dosis de carga de LEF), entre la semana 24 y la 48, hubo determinados acontecimientos adversos que aparecieron con mayor frecuencia en el grupo que realizó la transferencia que en el que tomó la terapia combinada desde el principio.
Estos efectos secundarios incluyeron diarrea (RR: 5,33; IC del 95%, 1,61-17,71) y alopecia (RR; 8,0; IC del 95%, 1,02-62,74). No hubo diferencias estadísticamente significativas en el riesgo de náusea, erupción cutánea, infección o elevación de las enzimas hepáticas entre estos dos grupos de tratamiento. Tampoco se observaron diferencias en la frecuencia de aparición de efectos adversos graves entre ambos grupos y después de 48 semanas de terapia.
No obstante, un estudio realizado en población china detectó un mayor riesgo de acontecimientos adversos en los pacientes que recibían la terapia combinada a las 24 semanas de tratamiento (RR: 3,5; IC del 95%, 1,29-9,49). En la población india, no se confirmaron estos hallazgos: el número total y la frecuencia de interrupciones del tratamiento en los sujetos tratados con terapia LEF + MTX no fueron significativamente más altos que en los que recibieron la monoterapia con MTX después de 24 y 36 meses de tratamiento.
Terapia combinada con sulfasalacina
Un estudio realizado en 200549 comparó LEF + SSZ con SSZ en pacientes con AR que no habían respondido a LEF en un estudio abierto previo. Las respuestas ACR-20 y ACR-50 fueron similares a las 24 semanas (no se obtuvo respuesta ACR-70 en ningún grupo). Lo mismo sucedió con la reducción de los recuentos de articulaciones dolorosas e inflamadas a los seis meses y con la disminución de la intensidad del dolor. A las 24 semanas no se observaron tampoco diferencias estadísticamente significativas en la disminución de los valores séricos de PCR, en la reducción de la puntuación del índice DAS28, en los cambios de puntuación del HAQ ni en el porcentaje de pacientes que alcanzaban respuestas de la EULAR buena o moderada.
Terapia combinada con ciclosporina A
Una rama del estudio de Karanikolas40 realizado en 2006 examinó este aspecto. Las tasas de respuesta ACR-20 y ACR-50 fueron similares entre los sujetos con AR que recibieron la LEF, la terapia combinada LEF + CsA a los 12 meses de tratamiento.
Por otro lado, el porcentaje de sujetos que consiguieron respuesta ACR-70 fue significativamente superior en los individuos que recibieron LEF + CsA que en aquellos que recibieron LEF sola (RR: 1,96; IC del 95%, 1,12-3,44). A los 12 meses, la reducción media desde la situación basal de la puntuación del índice DAS28 fue significativamente mayor en los sujetos que tomaron LEF + CsA que en los que solo tomaron LEF; WMD: 0,46 puntos; IC del 95%, 0,35-0,57. Sin embargo, el número de pacientes que consiguieron una respuesta de la EULAR de baja actividad de la enfermedad (DAS28 menor de 3,2) no fue significativamente diferente entre los dos grupos de terapia.
Eficacia de leflunomida en la artritis psoriásica
El estudio TOPAS50 es un ensayo clínico internacional, aleatorizado y controlado con placebo en el que se ha estudiado la eficacia del uso de LEF en pacientes con AP. Se incluyeron un total de 186 pacientes, aleatorizados para recibir placebo o una dosis de carga de 100 mg de LEF durante tres días, seguidos de una dosis diaria de 20 mg de LEF al día durante 24 semanas.
La variable principal de eficacia fue la tasa de respuesta según los criterios de respuesta a la AP, y la secundaria, la respuesta ACR-20. Los resultados indican que el tratamiento con LEF fue significativamente superior al placebo tanto en el criterio primario de eficacia como en el secundario (58,9% de los pacientes del grupo de LEF fueron considerados respondedores, frente al 29,7% en el grupo placebo, p <0,0001). Un análisis de los pacientes basado en el índice de la severidad del área de psoriasis (PASI, Psoriasis Area and Severity Index) (50, 75 y 90) reflejó los mismos resultados, con diferencias estadísticamente significativas a favor del grupo tratado con LEF respecto a placebo (30,4; 17,4 y 9,8% frente al 18,9; 7,8 y 2,2%, respectivamente).
El índice de calidad de vida en dermatología (DLQI, Dermatology Life Quality Index) mejoró significativamente en los tratados frente a los del grupo placebo (puntuaciones correspondientes a síntomas o sensaciones, p = 0,0092; actividad diaria, p = 0,013, y relación personal, p = 0,030, en comparación con el grupo placebo). La mejoría de los síntomas cutáneos se observó a partir de la cuarta semana de tratamiento en el grupo de LEF y fue aumentando a lo largo de las 24 semanas que duró la investigación.
El estudio observacional OSPAL51 estudió la eficacia de la LEF en 330 pacientes con AP. Los pacientes recibieron una dosis de carga de 100 mg de LEF durante tres días, seguidos de una dosis diaria de 20 mg de LEF al día durante 24 semanas. Se compararon con 77 pacientes en tratamiento con MTX, que no habían respondido al tratamiento y a los que se añadió LEF, a dosis de 20 mg al día durante 24 semanas. La tasa general de respuesta en el estudio OSPAL (78,1%) fue claramente superior a la observada en el estudio TOPAS (60%), lo que tiene gran relevancia, considerando que los estudios observacionales reflejan la situación clínica diaria de manera más realista que los estudios aleatorizados y controlados.
Las principales diferencias entre el examen pretratamiento y postratamiento con LEF se observaron en la mejoría del dolor (84,2%), dactilitis (49,7%), fatiga (64,7%) y enfermedad cutánea (muy bien, 57,7%) (p <0,001 para todas). Al final del tratamiento, el 75% de los pacientes valoraron su situación cutánea como buena o muy buena y el 80% refirieron ausencia de fatiga o fatiga leve.
Finalmente, el análisis de seguridad y de tolerancia no reveló efectos adversos inesperados. Como conclusión de los estudios clínicos TOPAS y OSPAL, se puede establecer que la LEF constituye una opción terapéutica eficaz y de primera línea en el tratamiento de la AP, y proporciona beneficios terapéuticos para los síntomas de dolor y efectos positivos sobre la dactilitis y los síntomas cutáneos.
Dosificación de la leflunomida
La dosificación de LEF se ha estudiado en tres ensayos clínicos52-54. Se han comparado 10 y 20 mg diarios, 20 mg diarios con 100 mg semanales y 100 y 200 mg semanales. Los datos publicados no muestran diferencias notables en variables de eficacia y seguridad entre estos estudios. Se ha sugerido, por ello, que la administración de LEF puede ser diaria (tanto la dosis plena como la mitad de la dosis) o en una toma semanal, de acuerdo con la situación de cada paciente
Conclusiones
- La LEF mejora la situación clínica de los pacientes con AR y retrasa la progresión del daño Su eficacia y su perfil de seguridad son comparables con los del MTX, después de un seguimiento de más de dos años de terapia. La combinación de LEF y MTX es más eficaz que la monoterapia con MTX en estudios que abarcan hasta tres años de seguimiento. Los efectos secundarios no se incrementan al combinar ambos fármacos29.
- Por lo tanto, la adición de LEF es mejor que MTX en monoterapia para mejorar la actividad, la función y la calidad de vida a corto-medio plazo, sin diferencias significativas entre ambas opciones de tratamiento en lo que respecta a los acontecimientos adversos (número y aparición de efectos secundarios graves). No se ha podido demostrar la superioridad de MTX + LEF frente a MTX + hidroxicloroquina o MTX + SSZ en pacientes con AR establecida refractaria a MTX, a corto plazo48.
- En pacientes con AR establecida refractaria a tratamiento de primera línea con FAMEcs, se debería tener en cuenta, aunque algunas guías de actuación no lo especifiquen claramente, la opción de administrar conjuntamente MTX y LEF, dependiendo del contexto clínico y el criterio médico41.
- La LEF constituye una opción terapéutica eficaz y de primera línea en el tratamiento de la AP; proporciona beneficios terapéuticos para los síntomas de dolor y efectos positivos sobre la dactilitis y los síntomas cutáneos50,51.
Autor

Dr. Jesús Tornero
Servicio de Reumatología. Hospital General Universitario de Guadalajara Departamento de Medicina y Especialidades Médicas. Universidad de Alcalá. Madrid
Contenido mínimo de AravaTM
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
Arava 10 mg comprimidos recubiertos con película. Envase de 30 comprimidos (CN: 848093.7); P.V.P: 25,92€. P.V.P IVA: 26,96€. Medicamento sujeto a prescripción médica. Diagnóstico hospitalario. Financiado por el SNS. Aportación reducida. Con visado de inspección.
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
Arava 20 mg comprimidos recubiertos con película. Envase de 30 comprimidos (CN: 8481354); P.V.P:
51,85€. P.V.P IVA: 53,92€. Envase de 100 comprimidos (CN: 7274797); P.V.P: 161,04€. P.V.P IVA: 167,48€. Medicamento sujeto a prescripción médica. Diagnóstico hospitalario. Financiado por el SNS. Aportación reducida. Con visado de inspección.

Referencias
- Agencia Europea de Medicamentos. Ficha técnica o resumen de las características del producto: Arava 10 mg comprimidos recubiertos con película. [Internet]. EMA. Disponible en: https://www.ema.europa.eu/es/documents/product-information/arava-epar-product-information_es.pdf
- Breedveld FC, Dayer JM. Leflunomide: mode of action in the treatment of rheumatoid arthritis. Ann Rheum Dis. 2000;59(11):841-9.
- Fox RI, Herrmann ML, Frangou CG, Wahl GM, Morris RE, Strand V, et al. Mechanism of action for leflunomide in rheumatoid Clin Immunol. 1999;93(3):198-208.
- Panek JJ, Jezierska A, Mierzwicki K, Latajka Z, Kohl A. Molecular modeling study of leflunomide and its active metabolite J Chem Inf Model. 2005;45(1):39-48.
- Strand V, Cohen S, Schiff M, Weaver A, Fleichsman R, Cannon G, Fox R, et al. Treatment of active rheumatoid arthritis with leflunomide compared with placebo and methotrexate. Leflunomide Rheumatoid Arthritis Investigators Arch Intern Med. 1999;159(21):2542-50.
- Fox Mechanism of action of leflunomide in rheumatoid arthritis. J Rheumatol Suppl. 1998;53:20-6.
- Liu S, Neidhardt EA, Grossman TH, Ocain T, Clardy Structures of human dihydroorotate dehydrogenase in complex with antiproliferative agents. Structure. 2000;8(1):25-33.
- Xu X, Blinder L, Shen J, Gong H, Finnegan A, Williams JW, et In vivo mechanism by which leflunomide controls lymphoproliferative and autoimmune disease in MRL/MpJ-lpr/lpr mice. J Immunol. 1997; 159(1):167-74.
- Dimitrijevic M, Bartlett RR. Leflunomide, a novel immunomodulating drug, inhibits homotypic adhesion of mononuclear cells in rheumatoid Transplant Proc. 1996;28(6):3086-7.
- Grisar J, Aringer M, Köller MD, Stummvoll G, Eselbock D, Zwolfer B, et al. Leflunomide inhibits transendothelial migration of peripheral blood mononuclear Ann Rheum Dis. 2004;63(12):1632-7.
- Salmi M, Rajala P, Jalkanen S. Homing of mucosal leukocytes to joints. Distinct endothelial ligands in synovium mediate leukocyte-subtype specific J Clin Invest. 1997;99(9):2165-72.
- Kraan MC, De Koster BM, Elferink JG, Post WJ, Bredveld FC, Tak TT. Inhibition of neutrophil migration soon after initiation of treatment with leflunomide or methotrexate in patients with rheumatoid arthritis: findings in a prospective, randomized, double-blind clinical trial in fifteen Arthritis Rheum. 2000;43(7):1488-95.
- Kraan MC, Reece RJ, Barg EC, Smeets TJ, Farnell J, Rosenburg R, et al. Modulation of inflammation and metalloproteinase expression in synovial tissue by leflunomide and methotrexate in patients with active rheumatoid arthritis. Findings in a prospective, randomized, double-blind, parallel-design clinical trial in thirty-nine patients at two Arthritis Rheum. 2000;43(8):1820-30.
- Sharp JT, Strand V, Leung H, Hurley F, Loew-Friedrichet I. Treatment with leflunomide slows radiographic progression of rheumatoid arthritis: results from three randomized controlled trials of leflunomide in patients with active rheumatoid Leflunomide Rheumatoid Arthritis Investigators Group. Arthritis Rheum. 2000;43(3):495-505.
- Kraan MC, Smeets TJ, Van Loon MJ, Breedveld F, Dijkmans B, Tak PP. Differential effects of leflunomide and methotrexate on cytokine production in rheumatoid Ann Rheum Dis. 2004;63(9):1056-61.
- Kullich WC, Mur E, Aglas F, Niksic F, Czerwenka C. Inhibitory effects of leflunomide therapy on the activity of matrix metalloproteinase-9 and the release of cartilage oligomeric matrix protein in patients with rheumatoid Clin Exp Rheumatol. 2006;24(2):155-60.
- Hamilton LC, Vojnovic I, Warner TD. A771726, the active metabolite of leflunomide, directly inhibits the activity of cyclo-oxygenase-2 in vitro and in vivo in a substrate-sensitive Br J Pharmacol. 1999; 127(7):1589-96.
- Rozman Clinical pharmacokinetics of leflunomide. Clin Pharmacokinet. 2002;41(6):421-30.
- Wiese MD, Schnabl M, O’Doherty C, Spargo LD, Sorich MJ, Clelandet LG, et al. Polymorphisms in cytochrome P450 2C19 enzyme and cessation of leflunomide in patients with rheumatoid arthritis. Arthritis Res 2012;14(4):R163.
- Prakash A, Jarvis Leflunomide: a review of its use in active rheumatoid arthritis. Drugs. 1999;58(6):1137-64.
- Kirchheiner J, Brockmöller J. Clinical consequences of cytochrome P450 2C9 polymorphisms. Clin Pharmacol 2005;77(1):1-16.
- Dziedziejko V, Kurzawski M, Safranow K, Chlubek D, Pawlik A. The effect of ESR1 and ESR2 gene polymorphisms on the outcome of rheumatoid arthritis treatment with leflunomide. Pharmacogenomics. 2011;12(1):41-7.
- Hopkins AM, Wiese MD, Proudman SM, O’Doherty CE, Upton RN, Foster Genetic polymorphism of CYP1A2 but not total or free teriflunomide concentrations is associated with leflunomide cessation in rheumatoid arthritis. Br J Clin Pharmacol. 2016;81(1):113-23.
- Chonlahan J, Halloran MA, Hammonds A. Leflunomide and warfarin interaction: case report and review of the Pharmacotherapy. 2006;26:868-71.
- Lim V, Pande Leflunomidecanpotentiatetheanticoagulanteffectofwarfarin. BMJ. 2002;325(7376):1333.
- Cohen SB, Iqbal Leflunomide. Int J Clin Pract. 2003;57(2):115-20.
- Cutolo M, Bolosiu H, Perdriset G; LEADER Study Group. Efficacy and safety of leflunomida in DMARD- naive patients with early rheumatoid arthritis: comparison of a loading and a fixed-dose regimen. Rheumatology. 2013;52(6):1132-40.
- Bergner R, Peters L, Schmitt V, Löffler C. Leflunomide in dialysis patients with rheumatoid arthritis: a pharmacokinetic Clin Rheumatol. 2013;32(2):267-70.
- Osiri M, Shea B, Welch V, Suárez-Almazor ME, Strand V, Tugwell P, et al. Leflunomide for the treatment of rheumatoid Cochrane Database Syst Rev. 2002;2002(1):CD002047.
- Cohen S, Cannon GW, Schiff M, Weaver A, Fox R, Olsen N, et al. Two-year, blinded, randomized, controlled trial of treatment of active rheumatoid arthritis with leflunomide compared with Utilization of Leflunomide in the Treatment of Rheumatoid Arthritis Trial Investigator Group. Arthritis Rheum. 2001;44(9):1984-92.
- Smolen JS, Kalden JR, Scott DL, Rozman B, Kvien TK, Larsen A, et al. Efficacy and safety of leflunomide compared with placebo and sulophasalazine in active rheumatoid arthritis: a double-blind, randomized, multicenter European Leflunomide Study Group. Lancet. 1999;353(9149):259-66.
- Scott DL, Smolen JS, Kalden JR, Van de Putte LB, Larsen A, Kvien TK, et al. Treatment of active rheumatoid arthritis with leflunomide: two year follow up of a double blind, placebo controlled trial versus Ann Rheum Dis. 2001;60(10):913-23.
- Emery P, Breedveld FC, Lemmel EM, Kaltwasser JP, Dawes PT, Gömör B, et al. A comparison of the efficacy and safety of leflunomide and methotrexate for the treatment of rheumatoid arthritis. Rheumatology. 2000;39(6):655-65.
- Álvaro-Gracia Álvaro JM. Leflunomida: actualización sobre su eficacia y seguridad en la artritis Rev Esp Reumatol. 2002;1;36-43.
- Kalden J, Schattenkirchner M, Sorensen H, Emery P, Deighton C, Rozman B, et al. Five-year follow-up efficacy and safety of leflunomide in patients with active rheumatoid arthritis. Arthritis Rheum. 2001;44:S173.
- Alfaro-Lara R, Espinosa-Ortega HF, Arce-Salinas CA; PRECIS study group, all physicians belong to Division of Internal Medicine. Systematic review and meta-analysis of the efficacy and safety of leflunomide and methotrexate in the treatment of rheumatoid Reumatol Clin. 2019;15(3):133-9.
- Kalden JR, Scott DL, Smolen JS, Schattenkirchner M, Rozman B, Williams BD, et al. Improved functional ability in patients with rheumatoid arthritis - long term treatment with leflunomide versus sulfasalazine. European Leflunomide Study J Rheumatol. 2001;28(9):1983-91.
- Larsen A, Kvien T, Schattenkirchner M, Rau R, Scott DL, Smolen JS, et al. European Leflunomide Study Slowing of disease progression in rheumatoid arthritis patients during long-term treatment with leflunomide or sulfasalazine. Scand J Rheumatol. 2001;30(3):135-42.
- Dougados M, Emery P, Lemmel EM, De la Serna R, Zerbini CA, Brin S, et al. Efficacy and safety of leflunomide and predisposing factors for treatment response in patients with active rheumatoid arthritis: RELIEF 6-month J Rheumatol. 2003;30(12):2572-9.
- Karanikolas G, Charalambopoulos D, Andrianakos A, Antoniades C, Katsilambros Combination of cyclosporine and leflunomide versus single therapy in severe rheumatoid arthritis. J Rheumatol. 2006;33(3):486-9.
- Smolen JS, Landewé RBM, Bergstra SA, Kerschbaume A, Sepriano A, Aletaha D, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease- modifying antirheumatic drugs: 2022 Ann Rheum Dis. 2023;82(1):3-18.
- Amit M, Rakhee M. A comparative 3-year clinical study of combined leflunomide and methotrexate vs methotrexate alone as DMARD in rheumatoid J Rheumatol. 2006;9 Supl 1:A190.
- Antony T, Jose VM, Paul BJ, Thomas T. Efficacy and safety of leflunomide alone and in combination with methotrexate in the treatment of refractory rheumatoid Indian J Med Sci. 2006;60(8):318-26.
- Kremer M, Genovese MC, Cannon GW, Caldwell JR, Cush JJ, Furst DE, et al. Concomitant leflunomide therapy in patients with active rheumatoid arthritis despite stable doses of A randomized, double-blind, placebo-controlled trial. Ann Int Med. 2002;137(9):726-33.
- Kremer J, Genovese M, Cannon GW, Caldwell J, Cush J, Furst DE, et al. Combination leflunomide and methotrexate therapy for patients with active rheumatoid arthritis failing MTX monotherapy: open-label extension of a randomized, double-blind, placebo controlled J Rheumatol. 2004;31(8):1521-31.
- Fleischmann R, Koenig AS, Szumski A, Nab HW, Marshall L, Bananis Short-term efficacy of etanercept plus methotrexate vs. combinations of disease-modifying anti-rheumatic drugs with methotrexate in established rheumatoid arthritis. Rheumatology. 2014;53(11):1984-19.
- Wijesinghe H, Galappatthy P, De Silva R, Seneviratne SL, Saravanamuttu U, Udagama P, et al. Leflunomide is equally efficacious and safe compared to low doce rituximab in refractory rheumatoid arthritis given in combination with methotrexate: results from a randomized double blind controlled clinical BMC Musculoskelet Disord. 2017;18(1):310.
- Calvo Alén J, Pérez T, Romero Yuste S, Ferraz-Amarod I, Alegre Sancho JJ, Pinto Tasen JA, et Eficacia y seguridad de la terapia combinada con fármacos modificadores de la enfermedad sintéticos en la artritis reumatoide: revisión sistemática de la literatura. Reumatol Clin. 2020;16(5 Pt 1):324-32.
- Dougados M, Emery P, Lemmel EM, Zerbini CAF, Brin S, Van Riel P. When a DMARD fails, should patients switch to sulfasalazine or add sulfasalazine to continuing leflunomide? Ann Rheum Dis. 2005;64(1):44-51 .
- Kaltwasser JP, Nash P, Gladman D, Rosen CF, Behrens F, Jones P, et Efficacy and safety of leflunomide in the treatment of psoriatic arthritis and psoriasis: a multinational, double-blind, randomized, placebo- controlled clinical trial. Arthritis Rheum. 2004;50(6):1939-50.
- Behrens F, Finkenwirth C, Pavelka K, Štolfa J, Šipek-Dolnicar A, Thaçi D, et al. Leflunomide in psoriatic arthritis: results from a large European prospective observational Arthritis Care Res. 2013;65(3):464-70.
- Rozman B, Domijan Z, Popovic M, Mladenovic V, Mihajlovic D, Jajic I, et al. Weekly administration of leflunomide to patients with active rheumatoid Arthritis Rheum. 1994;37 Supl 9:339.
- Jakez-Ocampo J, Richaud-Patin Y, Simón A, Llorente L. Weekly dose of leflunomide for the treatment of refractory rheumatoid arthritis: an open pilot comparative Joint Bone Spine. 2002;69(3):307-11.
- Poór G, Strand V; Leflunomide Multinational Study Eficacy and safety of leflunomide 10 mg vs 20 mg once daily in patients with active rheumatoid arthritis: multinational double-blind, randomized trial. Rheumatology. 2004;43(6):744-9.
MAT-ES-2003538 v1.0 Abril 2021
