- Recurso
- Fuente: Campus Sanofi
- 30 abr 2024
Monografía: Seguridad de leflunomida
Introducción
La leflunomida (LEF) es un agente antirreumático modificador de la enfermedad, con propiedades antiproliferativas1, que tiene una estructura y un mecanismo de acción diferente del de otros fármacos antirreumáticos modificadores de enfermedad (FAME) clásicos (Figura 1). La LEF es un derivado isoxazólico cuyo metabolito activo (A771726, teriflunomida) actúa como un inhibidor de la síntesis de pirimidinas2,3.

Formato PDF, 17 páginas
Dado que las pirimidinas se requieren para la proliferación de linfocitos T activados autoinmunes, la reducción de su síntesis disminuye el número de estas células T y la respuesta autoinmune, con el beneficio consiguiente para los pacientes con artritis reumatoide (AR)4-6.
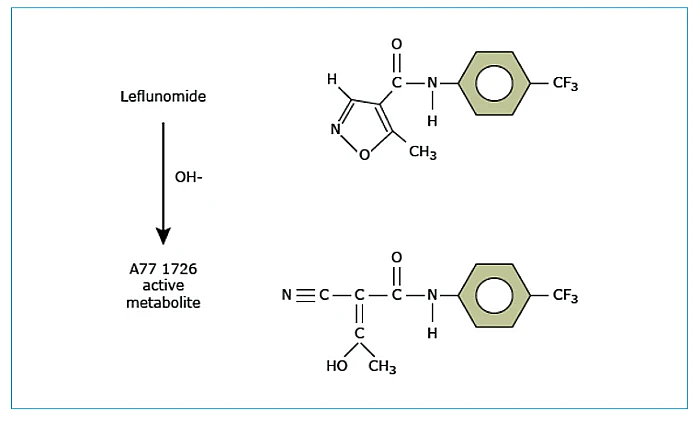.jpg)
La LEF puede producir una variedad de efectos secundarios que es preciso conocer para garantizar la seguridad del paciente. Esta toxicidad potencial incluye la hipertensión arterial (especialmente en pacientes que reciben simultáneamente fármacos antiinflamatorios no esteroideos [AINE]), la diarrea y la náusea, la hepatotoxicidad y sus efectos sobre la concepción, la gestación y la lactancia. Este riesgo de acontecimientos adversos puede estar condicionado por polimorfismos genéticos específicos7. Los estudios observacionales sugieren que polimorfismos del gen del citocromo P450 (CYP1A2)8,9y del de la dihidro-oroato deshidrogenasa (DHODH)10 pueden influir sobre la aparición de efectos secundarios. Sin embargo, el estudio sistemático de estos marcadores no está todavía incorporado a la práctica clínica rutinaria. Algunos efectos adversos pueden presentarse como consecuencia de interacciones medicamentosas.
Toxicidad de la Leflunomida
Vamos a repasar a continuación los principales problemas de seguridad que plantea la LEF.
Efectos gastrointestinales
La diarrea y la náusea pueden ocurrir en el 10-15% de los pacientes que toman LEF; rara vez son tan graves como para tener que suspender la medicación. La diarrea puede ser más intensa cuando se utiliza una dosis de carga inicial11.
Generalmente estos síntomas aparecen en el inicio de la terapia, pero a veces se pueden desencadenar tras su uso crónico. En raras ocasiones, puede producirse una pérdida de peso inexplicada12.
Toxicidad hepática
Una elevación de las transaminasas séricas igual o superior al triple del límite superior de su valor normal (LSN) puede observarse en hasta el 13% de los sujetos tratados con LEF. Un estudio de práctica real realizado en Australia13, en el que se incluyeron 2.975 pacientes, encontró que la incidencia global de afectación hepática fue similar entre los sujetos que recibían únicamente metotrexato (MTX) (12%) o LEF (16%) y los que tomaban la combinación de ambos fármacos (19%). Otros estudios, sin embargo, encuentran un riesgo mayor de hepatotoxicidad cuando se utiliza la combinación de MTX + LEF. El riesgo parece ser mayor en la artritis psoriásica y con las dosis altas de MTX14.
Por ello, cuando se instaura un tratamiento con LEF, se deben aplicar las mismas medidas de seguimiento y monitorización analítica que las que se usan con MTX15,16. Las alteraciones de la función hepática generalmente son reversibles con la reducción de la dosificación o la interrupción del fármaco. Es infrecuente, por lo tanto, la hepatotoxicidad grave.
Existen determinadas comorbilidades que pueden contribuir a la aparición de toxicidad hepática por LEF; entre estas, se incluyen el abuso de la ingesta de alcohol, el uso concomitante de fármacos AINE, la hepatitis viral17 o autoinmune y la esteatosis hepática no alcohólica.
Hipertensión arterial
Un pequeño porcentaje de pacientes con AR que reciben LEF desarrollan hipertensión arterial; esto es más frecuente si se combina LEF con un AINE18,19.
El mecanismo propuesto es el siguiente: la teriflunomida originaría un desplazamiento de la unión a albúmina del AINE, aumentando por ello la cantidad de fármaco libre y su actividad19. Se recomienda la monitorización de la presión arterial durante los primeros meses del tratamiento con LEF y siempre que se añada a la misma un AINE.
Toxicidad pulmonar
Se discute si el tratamiento con LEF se asocia o no a un incremento del riesgo de enfermedad pulmonar intersticial. Podría ser que los pacientes con AR y neumopatía intersticial preexistente fueran tratados preferiblemente con LEF frente a MTX20. Una revisión sistemática con metaanálisis realizada en 2016 no encontró un incremento de la toxicidad pulmonar inducida por el uso de LEF21. Sin embargo, hay autores que no indican LEF en pacientes con AR y neumopatía intersticial o historia previa de toxicidad pulmonar por MTX.
Toxicidad neurológica
Se han descrito casos de polineuropatía periférica en pacientes que recibían LEF, con mejoría parcial de la misma después de realizar un lavado de este fármaco con colestiramina22,23.
Una revisión de 80 casos informados a la Food and Drug Administration (FDA) estableció que los síntomas de la disfunción nerviosa (caracterizada por una polineuropatía axonal) comenzaron una media de seis meses después del inicio de la LEF24. Una interrupción temprana de la LEF (dentro de los 30 días siguientes al comienzo de los síntomas) se asociaba a un mejor desenlace que si se realizaba más tardíamente22.
Efectos secundarios dermatológicos
El 10-15% de los pacientes que ingieren LEF pueden presentar una erupción cutánea y alopecia, de carácter leve y que rara vez obliga a suspender la medicación. Se ha descrito la aparición del síndrome de Stevens-Johnson en un paciente con lupus eritematoso sistémico que recibió esta medicación25.
Toxicidad hematológica
La leucopenia es muy rara. La toxicidad hematológica de la LEF procede fundamentalmente de su interacción con otros fármacos; la LEF puede aumentar la toxicidad medular del MTX y originar pancitopenia, agranulocitosis o trombopenia.
La LEF puede potenciar el efecto anticoagulante de la warfarina, lo cual obliga a extremar la monitorización del cociente internacional normalizado (INR, international normalised ratio) en pacientes que toman ambos agentes terapéuticos, especialmente cuando se inicia la terapia combinada26.
Interacciones farmacológicas
Debido a sus vías de metabolismo y eliminación, la LEF puede interaccionar con otros fármacos:
Warfarina: LEF compite con warfarina y otras antivitaminas K por su unión a los citocromos y al metabolismo consiguiente26,27. Esta interacción puede originar tanto un incremento como una reducción del efecto farmacológico del anticoagulante oral. Se requiere por ello un estrecho control clínico y analítico del paciente en esta situación.
Colestiramina: aumenta rápidamente la eliminación de la LEF, ya que se une a las sales biliares y previene su recirculación enterohepática28.
Otros fármacos: teóricamente la administración de LEF a pacientes con polimorfismos de citocromo 2C9 podría alterar los niveles de tolbutamida, glipicida, celecoxib y fluvastatina8,29.
Monitorización de la terapia con Leflunomida
Durante el tratamiento con LEF, se debe vigilar la presión arterial y controlar periódicamente el hemograma, las transaminasas, la albúmina y la creatinina; esta vigilancia debe ser más intensa al principio del tratamiento o cuando se incrementa la dosis (por ejemplo, una vez al mes durante los 3-6 primeros meses y luego cada tres meses a medida que se vaya estabilizando la terapia)30. Se recomienda extremar el control cuando se utilice la terapia combinada LEF + MTX.
El American College of Rheumatology (ACR) no recomienda el uso de LEF en pacientes con enfermedad hepática previa significativa sugestiva de cirrosis (escala Child-Pugh A o superior), pero permite el uso de este agente terapéutico en sujetos con alteración de la analítica hepática previa, siempre y cuando se hubiera normalizado en el momento de iniciar la terapia con LEF31.
Los pacientes portadores de infección aguda o crónica por virus de la hepatitis B o C deben ser tratados de esta infección antes de iniciar la LEF. En cualquier caso, estos últimos individuos (especialmente los portadores previos de virus C) deben ser estrechamente vigilados durante todo el tratamiento con LEF.
La FDA estableció en 2010 varias advertencias después de revisar los casos de toxicidad hepática inducida por LEF32 (Tabla 1).
Monitorización de la terapia con Leflunomida
Tabla 1. Recomendaciones de la FDA para monitorizar la función hepática en pacientes tratados con leflunomida32.
|
– No se debe prescribir LEF a pacientes con enfermedad hepática preexistente. |
|
– Los pacientes con elevación de enzimas hepáticas (ALT superior a dos veces el LSN) no deben recibir LEF. |
|
– Se debe prestar especial atención a los individuos que ingieren simultáneamente con la LEF otros fármacos potencialmente tóxicos para el hígado. |
|
– Monitorizar periódicamente las enzimas hepáticas (mensualmente en los tres primeros meses y luego cada tres meses). |
|
– Si durante el tratamiento con LEF se incrementa ALT por encima de dos veces el LSN, se debe interrumpir la LEF y realizar un lavado con colestiramina; posteriormente se monitorizarán los niveles séricos de transaminasas hasta que ALT regrese a su rango normal. |
ALT: alanina-aminotransferasa; FDA: Food and Drug Administration; LEF: leflunomida; LSN: límite superior del valor normal.
En pacientes que toman antivitaminas K (warfarina y otros agentes), la estimación del INR se debe realizar con mayor asiduidad, ya que la combinación puede alterar el estado previo de anticoagulación del paciente y aumentar tanto el riesgo de hemorragia como el de falta de efecto anticoagulante.
Estrategia para incrementar la eliminación del fármaco
La eliminación de la LEF puede acelerarse en caso de toxicidad o para prevenir el riesgo fetal durante el embarazo tras una exposición al mismo. Esto se puede conseguir administrando colestiramina durante 11 días a una dosis de 8 g cada 8 horas por vía oral. Esta estrategia es efectiva, debido a que la persistencia del fármaco depende en gran medida de la circulación enterohepática de su metabolito activo.
El éxito de esta acción se demuestra por la consecución de niveles del metabolito activo de la LEF (A771726) inferiores a 0,02 mg/L en dos pruebas separadas por al menos 14 días. El lavado se puede repetir si no se consigue la suficiente reducción de los niveles séricos con el primer intento. Como alternativa a la colestiramina, se puede utilizar el carbón activado para acelerar la eliminación de la LEF.
Contraindicaciones
La LEF está contraindicada en mujeres gestantes y durante la lactancia, y en pacientes con enfermedad hepática preexistente. No se deben administrar vacunas con agentes vivos a pacientes que estén tratados con LEF.
Concepción, embarazo y lactancia
Estudios realizados en animales han demostrado un marcado efecto embriotóxico y teratogénico para la LEF. El uso de LEF está contraindicado durante el embarazo, y se debe extremar el cuidado y la indicación de medidas para evitar la concepción en mujeres que tomen este fármaco. El uso de LEF también está contraindicado durante la lactancia materna.
Aunque la vida media de la LEF es solo de 15 días, su metabolito mayor (teriflunomida) presenta una intensa recirculación enterohepática, y puede permanecer detectable en suero hasta dos años. Por lo tanto, la interrupción de la LEF inmediatamente antes de la concepción no es suficiente para su eliminación. Para conseguir acelerar la eliminación del fármaco y sus metabolitos, se puede administrar colestiramina (8 g por vía oral tres veces al día durante 11 días). El éxito de esta estrategia de lavado se debe confirmar demostrando que los niveles del fármaco tras el lavado son inferiores a 0,02 mg/L en dos muestras separadas por dos semanas. Si el primer lavado resulta infructuoso y no se consigue reducir los niveles por debajo del umbral descrito previamente, se puede repetir.
Por lo tanto y debido a la larga vida media de los metabolitos de la LEF, si se planifica un embarazo, se debe suspender la LEF 24 semanas antes y demostrar la existencia de niveles indetectables de metabolito de LEF en sangre antes de interrumpir la estrategia contraceptiva (<0,02 mg/L).
La mayor serie descrita de mujeres expuestas a la LEF durante la concepción y las primeras semanas del embarazo comparó 64 mujeres con AR que quedaron gestantes mientras tomaban LEF con 108 mujeres embarazadas con AR que no la tomaban y 78 sanas33.
La LEF fue interrumpida en todas las pacientes expuestas a la misma (con una media de 3,1 semanas de exposición, intervalo: 0-8,6 semanas). El 95% de las mujeres fueron tratadas con colestiramina, resultando en un nivel indetectable del fármaco en una media de 10,7 semanas tras la concepción. No se detectaron diferencias significativas en la aparición de defectos estructurales mayores en los sujetos expuestos comparativamente con los controles (5,4, 4,2 y 4,2, respectivamente). No aumentó la tasa de pérdidas fetales ni se asoció la exposición a LEF con una anomalía específica de mayor o menor gravedad34. Sin embargo, dado el pequeño tamaño de esta muestra, se debe ser extremadamente prudente y cauteloso35.
Seguridad comparada de la leflunomida
Monoterapia con leflunomida
Una revisión sistemática de la evidencia36,37 analizó la incidencia de acontecimientos adversos en ensayos clínicos aleatorizados y controlados publicados hasta 2008 en pacientes con AR que recibieron LEF en monoterapia o combinada con otros FAME; 33 estudios fueron adecuados para el análisis final (Tabla 2).
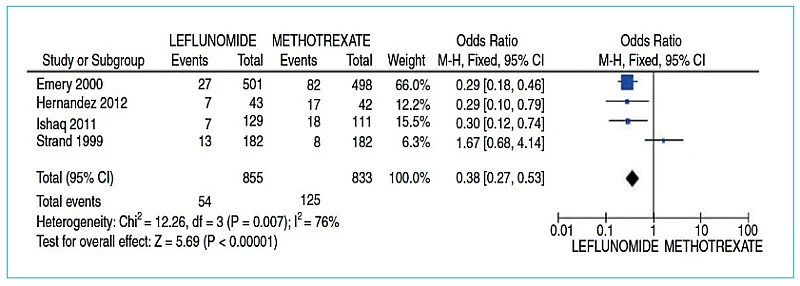
Cuando se compara la monoterapia con LEF frente a placebo, MTX, sulfasalacina (SSZ) o ciclosporina A (CsA), el riesgo de presentar elevación de las pruebas de función hepática es más alto para LEF comparado con placebo a los seis meses (riesgo relativo [RR]: 2,45; intervalo de confianza [IC] del 95%, 1,02 a 5,87), a los 12 meses (RR: 5,84; IC del 95%, 1,81-18,8) y a los dos años (RR: 3,23; IC del 95%, 1,27-8,25). Sin embargo, la probabilidad de esta reacción adversa no es diferente entre LEF y MTX o SSZ (Figura 2).
Tabla 2. Seguridad a seis meses de leflunomida según la estrategia de tratamiento y comparada con otros FAME36,37.
|
LEF frente a placebo |
LEF + MTX frente a MTX | |||
|
Control |
LEF |
LEF |
LEF + MTX | |
|
bandonos por AA |
58 por 103 |
158 por 103 (97-259) |
68 por 103 |
124 por 103 (56-270) |
|
Efecto relativo (IC del 95%) |
2,73 (1,67-4,47) |
1,82 (0,83-3,97) | ||
|
Número de pacientes (estudios) |
726 (3) |
263 (1) | ||
|
Calidad evidencia |
++++ Alta |
+++ Moderada | ||
|
Diferencias absolutas NNH (IC del 95%) |
Diferencia absoluta de riesgos: 10% (6-15%) NNH = 10 (7-17) |
Diferencia absoluta de riesgos: 5% (1-20%) NNH = 17 (no es significativo) | ||
AA: acontecimientos adversos; IC: intervalo de confianza; FAME: fármacos antirreumáticos modificadores de enfermedad; LEF: leflunomida; MTX: metotrexato; NNH: número de pacientes que hay que tratar para desencadenar un efecto secundario (number needed to harm).
Figura 2. Odds ratio de elevación de AST/ALT comparativamente entre leflunomida y metotrexato39-43.
.jpg)
ALT: alanina-aminotransferasa; AST: aspartato-aminotransferasa; odds ratio: razón de probabilidades. Fuente original: Alfaro-Lara R, Espinosa-Ortega HF, Arce-Salinas CA; PRECIS study group, all physicians belong to Division of Internal Medicine. Hospital Central Sur de Pemex. Systematic review and meta-analysis of the efficacy and safety of leflunomide and methotrexate in the treatment of rheumatoid arthritis. Reumatol Clin (Engl Ed). 2019 May-Jun;15(3):133-139. English, Spanish. doi: 10.1016/j.reuma.2017.07.020. Epub 2017 Sep 1. PMID: 28867467.
© 2017 Elsevier España, S.L.U. and Sociedad Española de Reumatología y Colegio Mexicano de Reumatología. All rights reserved.
El riesgo de que los pacientes con AR tratados con LEF suspendan el tratamiento es más bajo que con placebo (RR: 0,70; IC del 95%, 0,59-0,83), pero no resulta diferente si lo comparamos con SSZ (RR: 0,75; IC del 95%, 0,53-1,07). Por el contrario, los individuos que ingieren LEF suelen interrumpir más frecuentemente el tratamiento que los que toman MTX (RR: 1,26; IC del 95%, CI: 1,08-1,48) a los 12 meses, pero no a los dos años.
El número de interrupciones de terapia debidas a acontecimientos adversos relacionados con el fármaco en el grupo de LEF fue mayor que con placebo (RR: 2,73; IC del 95%, 1,67-4,47) y que con MTX a los 12 meses (RR: 1,43, IC del 95%, CI: 1,13-1,83), pero no fue mayor que con MTX a los dos años (RR: 1,15; IC del 95%, 0,83-1,61), o que con SSZ (RR: 0,77, IC del 95%, CI: 0,45-1,33), o que con CsA (RR: 8,76; IC del 95%, CI: 0,49-156,85). Los principales efectos adversos comunicados con la monoterapia con LEF fueron los síntomas gastrointestinales (diarrea, dispepsia, náuseas, vómitos, dolor abdominal o úlceras orales) (Figura 3), la elevación de las pruebas de función hepática, las reacciones alérgicas, las infecciones, la pérdida de peso y la hipertensión arterial38,39.
Figura 3. Odds ratio de aparición de nuevos síntomas gastrointestinales comparativamente entre leflunomida y metotrexato39-43.
.jpg)
Fuente original: Alfaro-Lara R, Espinosa-Ortega HF, Arce-Salinas CA; PRECIS study group, all physicians belong to Division of Internal Medicine. Hospital Central Sur de Pemex. Systematic review and meta-analysis of the efficacy and safety of leflunomide and methotrexate in the treatment of rheumatoid arthritis. Reumatol Clin (Engl Ed). 2019 May-Jun;15(3):133-139. English, Spanish. doi: 10.1016/j.reuma.2017.07.020. Epub 2017 Sep 1. PMID: 28867467.
© 2017 Elsevier España, S.L.U. and Sociedad Española de Reumatología y Colegio Mexicano de Reumatología. All rights reserved.
La elevación de las enzimas hepáticas tres veces mayor que el LSN fue más frecuente en el grupo que recibió LEF comparado con el que tomó placebo (RR: 3,74; IC del 95%, 1,86-7,54), pero no resultó distinta del riesgo con SSZ (RR: 0,60; IC del 95%, 0,15-2,46) o MTX (RR: 0,66; IC del 95%, 0,31-1,39).
La alopecia reversible ocurrió más frecuentemente en el grupo LEF que en el placebo (RR: 6,60; IC del 95%, 2,36-18,44) o MTX (RR: 1,72; IC del 95%, 1,32-2,24) pero no fue distinta del grupo SSZ (RR: 1,57; IC del 95%, CI: 0,63-3,93). la frecuencia de infecciones y la pérdida significativa de peso no fue diferente entre los grupos LEF, placebo, SSZ y MTX. La hipertensión arterial apareció en el grupo que tomó LEF con la misma probabilidad que en el placebo (RR: 3,36; IC del 95%, 0,58- 19,32) o SSZ (RR: 1,00; IC del 95%, 0,21-4,87), pero fue más frecuente que en el grupo que tomó MTX (RR: 2,29; IC del 95%, 1,42-3,69).
En resumen, los efectos adversos que se observan significativamente elevados en los pacientes tratados con LEF comparativamente con placebo incluyen la alopecia, los síntomas gastrointestinales y las enzimas hepáticas elevadas. Sin embargo, las infecciones, la hipertensión arterial y la pérdida de peso, no aparecen con una frecuencia diferente.
El perfil de seguridad de la monoterapia con LEF es similar a la de la SSZ. La alopecia, los síntomas gastrointestinales, las reacciones alérgicas y la hipertensión arterial son más frecuentes en los pacientes que tomaron LEF frente a los que ingirieron MTX; la elevación de las enzimas hepáticas fue más frecuente en el grupo de MTX.
Como era de esperar, el número de interrupciones debidas a acontecimientos adversos fue significativamente mayor en el grupo de LEF que en el placebo; sin embargo, la tasa total de suspensiones en el grupo LEF fue inferior, y ello se debe a que las interrupciones por falta de eficacia fueron superiores en el grupo placebo.
La tasa total de interrupciones en los grupos SSZ y MTX no fueron diferentes de las del grupo LEF. Después de dos años de seguimiento, los estudios comparativos de LEF con SSZ y MTX no detectaron diferencias en la aparición de efectos secundarios entre estos grupos.
Terapia combinada de leflunomida + FAME frente a monoterapia con cualquier FAME
La tasa total de interrupciones y la de suspensiones debidas a acontecimientos adversos relacionados con el tratamiento no fue, a las 24 semanas, significativamente diferente en los pacientes que recibieron LEF + MTX comparada con los que tomaron únicamente MTX36,37.
Se observó un resultado similar en los estudios de extensión a las 48 semanas. Después de que los pacientes con AR de los grupos placebo + MTX fueron transferidos (entre las semanas 24 y 48) a la combinación LEF + MTX (sin recibir dosis de carga de LEF al principio de esta transferencia), se observaron ciertos efectos adversos en este grupo frente a los sujetos que habían tomado la terapia combinada LEF + MTX desde el principio de los ensayos. Estos efectos secundarios incluyeron la diarrea (RR: 5,33; IC del 95%, 1,61-17,71) y la alopecia (RR: 8,0; IC; del 95%, 1,02-62,74). El riesgo de náusea, erupción cutánea, infección o elevación de enzimas hepáticas no fue significativamente diferente entre los dos grupos de tratamiento. Tampoco el riesgo de acontecimientos adversos graves fue distinto a las 48 semanas de terapia.
El estudio del grupo chino de LEF, no obstante, detectó a las 24 semanas un riesgo de acontecimientos adversos significativamente mayor en los pacientes que tomaron LEF + MTX frente a la monoterapia con MTX (RR: 3,5; IC del 95%, 1,29-9,49).
Los estudios indios de LEF no encontraron que la tasa total de interrupciones ni la de suspensiones por el tratamiento combinado de LEF + MTX fueran significativamente mayores que en el grupo de monoterapia con LEF a las 24 y 36 semanas.
En el ensayo que comparó LEF + SSZ con SSZ, no se detectaron a las 24 semanas diferencias significativas en los acontecimientos adversos comunicados, los acontecimientos adversos graves, el número total de interrupciones y las suspensiones debidas a los fármacos. Lo mismo sucedió cuando se comparó el perfil de seguridad de LEF + CsA con el de CsA a los 12 meses.
Cuando se compararon los acontecimientos adversos y las interrupciones debidas a la terapia en los pacientes que tomaban 10 y 20 mg diarios de LEF, no se encontraron diferencias significativas. Los pacientes que tomaron una dosis semanal de LEF mostraron un riesgo menor de efectos adversos y de interrupciones del tratamiento debidas al fármaco que los que tomaban la dosis diariamente, aunque esta diferencia no fue estadísticamente significativa (RR: 3,0; IC del 95%, 0,85-10,63; RR: 5,0; IC del 95%, 0,28-90,18, respectivamente). Tampoco un estudio que comparó dosis de 100 mg/ semana y 200 mg/semana de LEF mostró diferencias significativas en suspensiones por acontecimientos adversos a los seis meses de tratamiento.
Como conclusión de este epígrafe, podemos afirmar que los acontecimientos adversos descritos en los pacientes tratados con la terapia combinada de LEF y MTX son más frecuentes que en los pacientes que tomaron MTX solo; sin embargo, la tasa de efectos secundarios graves y el número de pacientes que tuvieron interrupciones de tratamiento relacionados con acontecimientos adversos relacionados con el tratamiento no fue significativamente diferente entre los dos grupos. En el mismo sentido, los acontecimientos adversos descritos, la tasa total de interrupciones y la tasa de suspensiones debidas a efectos secundarios relacionados con el tratamiento no fue significativamente mayor en el grupo que combinó LEF con cualquier otro FAME (MTX, SSZ o CsA) comparativamente con los que recibieron la monoterapia con FAME (LEF, SSZ o CsA). Estos hallazgos han permitido el uso de la combinación de FAME clásicos como alternativa más eficaz que la monoterapia con un aceptable perfil de su seguridad44,45.
Conclusiones
La LEF es un fármaco antirreumático modificador de la enfermedad clásico sintético indicado en el tratamiento de la artritis reumatoide y la artritis psoriásica. Suele ser bien tolerado y su principal toxicidad potencial incluye la intolerancia gastrointestinal, la hipertensión arterial, las alteraciones hepáticas y las hematológicas. No debe ser utilizado durante el embarazo ni la lactancia. Su toxicidad potencial aumenta cuando se combina con MTX, circunstancia en la cual se debe prestar especial atención al control del paciente.
Autor

Dr. Jesús Tornero
Servicio de Reumatología. Hospital General Universitario de Guadalajara Departamento de Medicina y Especialidades Médicas. Universidad de Alcalá. Madrid
Contenido mínimo de AravaTM
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
Arava 10 mg comprimidos recubiertos con película. Envase de 30 comprimidos (CN: 848093.7); P.V.P: 25,92€. P.V.P IVA: 26,96€. Medicamento sujeto a prescripción médica. Diagnóstico hospitalario. Financiado por el SNS. Aportación reducida. Con visado de inspección.
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
Arava 20 mg comprimidos recubiertos con película. Envase de 30 comprimidos (CN: 8481354); P.V.P:
51,85€. P.V.P IVA: 53,92€. Envase de 100 comprimidos (CN: 7274797); P.V.P: 161,04€. P.V.P IVA: 167,48€. Medicamento sujeto a prescripción médica. Diagnóstico hospitalario. Financiado por el SNS. Aportación reducida. Con visado de inspección.

Referencias
- Agencia Europea de Medicamentos. Ficha técnica o resumen de las características del producto: Arava 10 mg comprimidos recubiertos con película. [Internet]. EMA. Disponible en: https://www.ema.europa. eu/en/documents/product-information/arava-epar-product-information_es.pdf
- Breedveld FC, Dayer JM. Leflunomide: mode of action in the treatment of rheumatoid arthritis. Ann Rheum Dis. 2000;59(11):841-9.
- Fox RI, Herrmann ML, Frangou CG, Wahl GM, Morris RE, Strand V, et al. Mechanism of action for leflunomide in rheumatoid arthritis. Clin Immunol. 1999;93(3):198-208.
- Panek JJ, Jezierska A, Mierzwicki K, Latajkka Z, Koll A. Molecular modeling study of leflunomide and its active metabolite analogues. J Chem Inf Model. 2005;45(1):39-48.
- Fox RI. Mechanism of action of leflunomide in rheumatoid arthritis. J Rheumatol Suppl. 1998;53:20-6.
- Fragoso YD, Brooks JB. Leflunomide and teriflunomide: altering the metabolism of pyrimidines for the treatment of autoimmune diseases. Expert Rev Clin Pharmacol. 2015;8(3):315-20.
- Dziedziejko V, Kurzawski M, Safranow K, Chlubeck D, Pawlik A. The effect of ESR1 and ESR2 gene polymorphisms on the outcome of rheumatoid arthritis treatment with leflunomide. Pharmacogenomics. 2011;12(1):41-7.
- Hopkins AM, Wiese MD, Proudman SM, O’Doherty CE, Upton RN, Foster DJR. Genetic polymorphism of CYP1A2 but not total or free teriflunomide concentrations is associated with leflunomide cessation in rheumatoid arthritis. Br J Clin Pharmacol. 2016;81(1):113-23.
- Bohanec Grabar P, Rozman B, Tomsic M, Suput D, Logar D, Dolzan V. Genetic polymorphism of CYP1A2 and the toxicity of leflunomide treatment in rheumatoid arthritis patients. Eur J Clin Pharmacol. 2008;64(9):871-6. 1
- Grabar PB, Rozman B, Logar D, Praprotnick S, Dolzan V. Dihydroorotate dehydrogenase polymorphism influences the toxicity of leflunomide treatment in patients with rheumatoid arthritis. Ann Rheum Dis. 2009;68(8):1367-8.
- Cohen SB, Iqbal I. Leflunomide. Int J Clin Pract. 2003;57(2):115-20.
- Coblyn JS, Shadick N, Helfgott S. Leflunomide-associated weight loss in rheumatoid arthritis. Arthritis Rheum. 2001;44(5):1048-51.
- Bird P, Griffiths H, Tymms K, Nichols D, Roberts L, Arnold M, et al. The SMILE study -- safety of methotrexate in combination with leflunomide in rheumatoid arthritis. J Rheumatol. 2013;40(3):228-35.
- Curtis JR, Beukelman T, Onofrei A, Cassell S, Greenberg JD, Kavanaugh A, et al. Elevated liver enzyme tests among patients with rheumatoid arthritis or psoriatic arthritis treated with methotrexate and/or leflunomide. Ann Rheum Dis. 2010;69(1):43-7.
- Gupta R, Bhatia J, Gupta SK. Risk of hepatotoxicity with add-on leflunomide in rheumatoid arthritis patients. Arzneimittelforschung. 2011;61(5):312-6.
- Saag KG, Teng GG, Patkar NM, Anuntiyo J, Finney C, Curtis JR, et al. American College of Rheumatology 2008 recommendations for the use of nonbiologic and biologic disease-modifying antirheumatic drugs in rheumatoid arthritis. Arthritis Rheum. 2008;59(6):762-84.
- Sebastiani M, Milazzo L, Atzeni F, Vacchi C, Manfredi A, Quartuccio L, et al. Italian consensus recommendations for the management of hepatitis C infection in patients with rheumatoid arthritis. Mod Rheumatol. 2019;29(6):895-902.
- Nurmohamed MT, Van Halm VP, Dijkmans BA. Cardiovascular risk profile of antirheumatic agents in patients with osteoarthritis and rheumatoid arthritis. Drugs. 2002;62(11):1599-609.
- Rozman B, Praprotnik S, Logar D, Tomsic M, Hojnik M, Kos-Golja M, et al. Leflunomide and hypertension. Ann Rheum Dis. 2002;61(6):567-9.
- Suissa S, Hudson M, Ernst P. Leflunomide use and the risk of interstitial lung disease in rheumatoid arthritis. Arthritis Rheum. 2006;54(5):1435-9.
- Conway R, Low C, Coughlan RJ, O’Donnell MJ, Carey JJ. Leflunomide Use and Risk of Lung Disease in Rheumatoid Arthritis: A Systematic Literature Review and Metaanalysis of Randomized Controlled Trials. J Rheumatol. 2016;43(5):855-60.
- Bharadwaj A, Haroon N. Peripheral neuropathy in patients on leflunomide. Rheumatology. 2004;43(7):934.
- Kho LK, Kermode AG. Leflunomide-induced peripheral neuropathy. J Clin Neurosci. 2007;14(2):179-81.
- Bonnel RA, Graham DJ. Peripheral neuropathy in patients treated with leflunomide. Clin Pharmacol Ther. 2004;75(6):580-5.
- Rincón-Riaño DN, Fernández-Ávila DG, Gutiérrez JM. Leflunomide-induced Stevens Johnson syndrome in a patient with systemic lupus erythematosus. Rev Colomb Reumatol. 2017;24(4):242-6.
- Lim V, Pande I. Leflunomidecanpotentiatetheanticoagulanteffectofwarfarin. BMJ. 2002;325(7376):1333.
- Chonlahan J, Halloran MA, Hammonds A. Leflunomide and warfarin interaction: case report and review of the literature. Pharmacotherapy. 2006;26(6):868-71.
- Rozman B. Clinical pharmacokinetics of leflunomide. Clin Pharmacokinet. 2002;41(6):421-30.
- Kirchheiner J, Brockmöller J. Clinical consequences of cytochrome P450 2C9 polymorphisms. Clin Pharmacol Ther. 2005;77(1):1-16.
- Conley B, Bunzli S, Bullen J, O´Brien P, Persaud J, Gunatillake T, et al. What are the core recommendations for rheumatoid arthritis care? Systematic review of clinical practice guidelines. Clin Rheumatol. 2023;42(9):2267-78.
- Fraenkel L, Bathon JM, England BR, St. Clair EW, Arayssi T, Carandang K, et al. American College of Rheumatology guideline for the treatment of rheumatoid arthritis. Arthritis Rheumatol. 2021;73(7):1108-23.
- FDA Drug Safety Communication: New boxed warning for severe liver injury with arthritis drug Arava (leflunomida). [Internet]. En: FDA.gov. Food and Drug Administration (FDA). 13 Jul 2010. [Consultado 9 Ago 2023]. Disponible en: https://www.fda.gov/drugs/postmarket-drug-safety-information-patients-and-providers/ fda-drug-safety-communication-new-boxed-warning-severe-liver-injury-arthritis-drug-arava-leflunomide
- Bérard A, Zhao JP, Shui I, Colilla S. Leflunomide use during pregnancy and the risk of adverse pregnancy outcomes. Ann Rheum Dis. 2018;77(4):500-9.
- Chambers CD, Johnson DL, Robinson LK, Braddock SR, Xu R, López-Jiménez J, et al. Birth outcomes in women who have taken leflunomide during pregnancy. Arthritis Rheum. 2010;62(5):1494-503.
- Merino-Ibarra E, Delgado Beltrán C. Rheumatoid arthritis: how to use drugs during pregnancy and lactation? Reumatol Clin. 2011;7(4):262-6.
- Osiri M, Shea B, Robinson V, Suárez-Almazor M, Strand V, Tugwell P, et al. Leflunomide for treating rheumatoid arthritis. Cochrane Database Syst Rev. 2003;2002(1):CD002047.
- Osiri M, Shea B, Robinson V, Suárez-Almazor M, Strand V, Tugwell P, et al. Leflunomide for the treatment of rheumatoid arthritis: a systematic review and meta-analysis. J Rheumatol. 2003;30(6):1182-90.
- Cohen S, Cannon GW, SchiL M, Weaver A, Fox R, Olsen N, et al. Two year, blinded, randomized, controlled trial of treatment of active rheumatoid arthritis with leflunomide compared with methotrexate. Utilization of Leflunomide in the Treatment of Rheumatoid Arthritis Trial Investigator Group. Arthritis Rheum. 2001;44(9):1984-92.
- Alfaro-Lara R, Espinosa-Ortega HF, Arce-Salinas CA; PRECIS study group, all physicians belong to Division of Internal Medicine. Systematic review and meta-analysis of the efficacy and safety of leflunomide and methotrexate in the treatment of rheumatoid arthritis. Reumatol Clin. 2019;15(3):133-9.
- Emery P, Breedveld FC, Lemmel EM, Kaltwasser JP, Dawes PT, Gömör B, et al. A comparison of the efficacy and safety of leflunomide and methotrexate for the treatment of rheumatoid arthritis. Rheumatology. 2000;39(6):655-65.
- Jaimes-Hernández J, Meléndez-Mercado CI, Mendoza-Fuentes A, Aranda-Pereira P, Castañeda- Hernández G. Eficacia de leflunomida 100 mg semanales comparado con dosis bajas de metotrexate en pacientes con artritis reumatoide activa. Estudio clínico doble ciego aleatorizado. Reumatol Clin. 2012;8(5):243-9.
- Ishaq M, Muhammad JS, Hameed K, Mirza AI. Leflunomide or methotrexate? Comparison of clinical efficacy and safety in low socio-economic rheumatoid arthritis patients. Mod Rheumatol. 2011;21(4):375-80.
- Strand V, Cohen S, Schiff M, Weaver A, Fleischmann R, Cannon G, et al. Treatment of active rheumatoid arthritis with leflunomide compared with placebo and methotrexate. Arch Intern Med. 1999;159(21):2542-50.
- Grijalva C, Chung CP, Arbogast PG, Stein CM, Mitchel EF, Griffin MR. Assessment of adherence to and persistence on disease-modifying antirheumatic drugs (DMARDs) in patients with rheumatoid arthritis. Med Care. 2007;45(10 Supl 2):S66-76.
- Scott DL, Smolen JS, Kalden JR, Van den Putte LBA, Larsen A, Kvien TK, et al. Treatment of active rheumatoid arthritis with leflunomide: two year follow up of a double blind, placebo controlled trial versus sulfasalazine. Ann Rheum Dis. 2001;60(10):913-23
MAT-ES-2302975-V.1-Enero 2024
