- Artículo
- Fuente: Campus Sanofi
- 6 sept 2024
Inflamación y Enfermedad Renal Crónica: un círculo vicioso

Mucho hemos avanzado en el conocimiento acerca de las causas, manifestaciones y las consecuencias de la hiperfosfatemia en el paciente con afección renal. Gran cantidad de estudios avalan una estrategia dual en su manejo, la restricción en la ingesta y el uso de captores de fósforo y dentro de este segundo grupo la literatura se decanta por el uso de los quelantes no cálcicos y sobre todo del sevelamer, con el que se tiene una mayor experiencia y se ha asociado en algunos estudios y metaanálisis a la disminución de mortalidad de estos pacientes1, 2.
Dicha disminución en la mortalidad se debe a efectos de este fármaco a varios niveles, lo que hoy denominamos efectos pleiotrópicos (etimológicamente “que afecta a más de una característica”) y no solo a su efecto como quelante del fósforo.
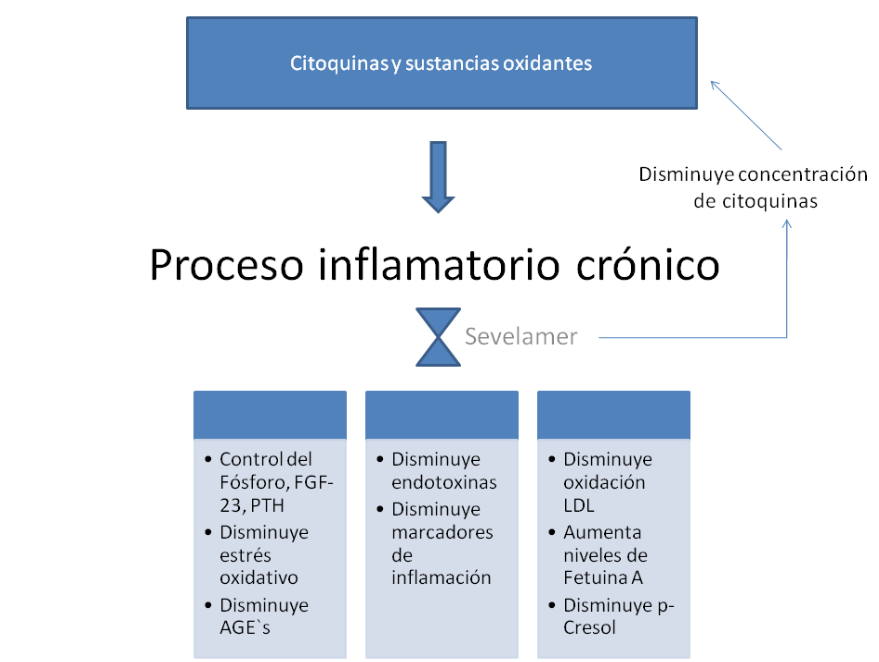
Si nos remitimos al origen molecular de las complejas vías de las manifestaciones sobre las que actúa el Sevelamer, vemos que muchas confluyen, en mayor o menor grado y de forma directa o indirecta en un estado inflamatorio crónico mediado por diversas sustancias (citoquinas) y éste es más notorio a medida que se avanza en los estadios de la enfermedad renal crónica (ERC) hasta llegar a la diálisis3, 4, 5. Cabe recordar que el fósforo per se, es una molécula altamente inflamatoria que ocasiona daños a nivel vascular6.
Sevelamer tiene efecto en este estado inflamatorio ya que se ha asociado a una disminución en la concentración de citoquinas proinflamatorias, los niveles de endotelina-1, el inhibidor del factor del plasminógeno y la PCR7 y en pacientes en diálisis también disminuye la concentración de CD-14 y los niveles de endotoxinas8, generadas por la traslocación bacteriana en el tracto gastrointestinal asociada a la ERC9,10. Esta flora intestinal anómala genera toxinas al metabolizar aminoácidos, entre ellos el p-Cresol que se asocia a progresión del daño renal y vascular11 al generar un aumento en la actividad inflamatoria celular y la oxidación12. Se extienden estos efectos a la influencia que tiene Sevelamer en el control de PTH y FGF -23, moléculas consideradas también pro-inflamatorias13.
Estudios sugieren que Sevelamer reduce los productos finales de la glicosilación avanzada (AGEs)14, moléculas aterogénicas, oxidantes y también con alta capacidad inflamatoria. Otro ejemplo es la relación con la fetuína A, glicoproteína disminuida en estados de inflamación sistémica15, e inhibida por las citoquinas proinflamatorias presentes en la ERC16, 17 y cuyos niveles aumentaron significativamente con el uso de Sevelamer18.
Cabe decir, que el proceso inflamatorio y el espectro de sus manifestaciones son eventos que se retroalimentan entre sí dando lugar a un círculo vicioso.
En la Figura 1 se puede ver un esquema que ilustra cómo el uso de Sevelamer tiene efectos positivos al contrarrestar los efectos del proceso de inflamación crónica presente en la ERC.
No parece entonces descabellado pensar en un tratamiento específico teniendo como base una terapia anticitoquinas. Se ha valorado en algunos estudios la farmacocinética y seguridad del Etanercept (anti-TNF) en pacientes en diálisis en el que no se reportaron efectos adversos a corto plazo19, 20. Hay un estudio con Anakinra (antagonista del receptor de la IL-1) en el que su uso evidenció una mejoría en los parámetros inflamatorios, niveles de pre-albúmina y estado nutricional y una disminución de PCR e IL-6 en pacientes en diálisis21. Sin embargo son necesarios más datos para valorar seguridad a largo plazo y la utilidad clínica de estos agentes.
Dado el sustrato inflamatorio de los procesos expuestos, algunos autores proponen la medición de la PCR de manera periódica en pacientes en diálisis como un marcador que podría ser un complemento en la evaluación de estos22, a falta de consenso y de una estandarización en los niveles y su significación clínica.
En todo caso a día de hoy contamos con una base sólida para afirmar que Sevelamer actúa de manera eficaz en varios niveles del proceso de inflamación que subyace en muchas de las manifestaciones de la ERC.
Autor
.jpg)
Dr. John Camacho Ruidíaz
Responsable Servicio de Nefrología y hemodiálisis de Policlínica Gipuzkoa
Contenido mínimo de Renvela®
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
Renvela 800 mg comprimidos recubiertos con película.
P.V.P.: 140,11 €. P.V.P. (IVA): 145,71 €. CN 663699. Financiado por el Sistema Nacional de
Salud. Medicamento sujeto a prescripción médica. Aportación reducida.
Renvela 0,8 g polvo para suspensión oral.
P.V.P.: 70,70 €. P.V.P. (IVA): 73,53 €. Consulte la ficha técnica completa antes de prescribir este medicamento. Financiado por el Sistema Nacional de Salud. Medicamento sujeto a prescripción médica. Aportación reducida.
Renvela 2,4 g polvo para suspensión oral.
P.V.P.: 187,21 €. P.V.P. (IVA): 194,70 €. CN 663700. Financiado por el Sistema Nacional de Salud. Medicamento sujeto a prescripción médica. Aportación reducida.

Referencias
- Jamal SA, Vandermeer B, Raggi P, Mendelssohn DC, Chatterley T, Dorgan M, Lok CE, Fitchett D, Tsuyuki RT. Effect of calcium-based versus non-calcium-based phosphate binders on mortality in patients with chronic kidney disease: an updated systematic review and meta-analysis. Lancet. 2013 Oct 12;382(9900):1268-77. doi: 10.1016/S0140-6736(13)60897-1. Epub 2013 Jul 19. PMID: 23870817.
- Di Iorio B, Molony D, Bell C, Cucciniello E, Bellizzi V, Russo D, Bellasi A; INDEPENDENT Study Investigators. Sevelamer versus calcium carbonate in incident hemodialysis patients: results of an open-label 24-month randomized clinical trial. Am J Kidney Dis. 2013 Oct;62(4):771-8. doi: 10.1053/j.ajkd.2013.03.023. Epub 2013 May 16. PMID: 23684755.
- U. Feroze, K. Kalantar-Zadeh, K.A. Sterling, M.Z. Molnar, N. Noori, D. Benner, et al. Examining associations of circulating endotoxin with nutritional status, inflammation, and mortality in hemodialysis patients.J Ren Nutr, 22 (2012), pp. 317-326. http://dx.doi.org/10.1053/j.jrn.2011.05.004
- A.B. Hauser, I.R. Azevedo, S. Gonçalves, A. Stinghen, C. Aita, R. Pecoits-Filho.Sevelamer carbonate reduces inflammation and endotoxemia in an animal model of uremia. Blood Purif, 30 (2010), pp. 153-158. http://dx.doi.org/10.1159/000319850
- N. Noori, C.P. Kovesdy, R. Dukkipati, U. Feroze, M.Z. Molnar, R. Bross, et al. Racial and ethnic differences in mortality of hemodialysis patients: role of dietary and nutritional status and inflammation.Am J Nephrol, 33 (2011), pp. 157-167. http://dx.doi.org/10.1159/000323972
- J.F. Navarro-González, C. Mora-Fernández, M. Muros, H. Herrera, J. García. Mineral metabolism and inflammation in chronic kidney disease patients. Clin J Am Soc Nephrol, 4 (2009), pp. 1646-1654
- S.P. Chennasamudram, T. Noor, T.L. Vasylyeva. Comparison of sevelamer and calcium carbonate on endothelial function and inflammation in patients on peritoneal dialysis. J Ren Care, 39 (2013), pp. 82-89
- J.F. Navarro-González, C. Mora-Fernández, M. Muros de Fuentes, J. Donate-Correa, V. Cazaña-Pérez, J. García-Pérez. Effect of phosphate binders on serum inflammatory profile, soluble CD14, and endotoxin levels in hemodialysis patients.Clin J Am Soc Nephrol, 6 (2011), pp. 2272-2279
- N. Kubotera, A.J. Prokopienko, A.O. Garba, A.B. Pai. Endotoxin binding by sevelamer: potential impact on nutritional status. Int J Nephrol, 2013 (2013), pp. 954956. http://dx.doi.org/10.1155/2013/954956
- Lau WL, Kalantar-Zadeh K, Vaziri ND. The Gut as a Source of Inflammation in Chronic Kidney Disease. Nephron. 2015; 130:92¿98. [PubMed: 25967288]
- Meijers BK, Evenepoel P. The gut-kidney axis: indoxyl sulfate, p-cresyl sulfate and CKD progression. Nephrol Dial Transplant. 2011 Mar;26(3):759-61. doi: 10.1093/ndt/gfq818. PMID: 21343587.
- Hauser, A. Stinghen, S. Goncalves, S. Bucharles, R. Pecoits-Filho. A gut feeling on endotoxemia: causes and consequences in chronic kidney disease. Nephron Clin Pract, 118 (2011), pp. 165-172
- Levin, C. Rigatto, B. Barrett, F. Madore, N. Muirhead, D. Holmes, et al. CanPREDDICT Investigators Biomarkers of inflammation, fibrosis, cardiac stretch and injury predict death but not renal replacement therapy at 1 year in a Canadian chronic kidney disease cohort Nephrol Dial Transplant, 29 (2014), pp. 1037-104
- H. Vlassara, J. Uribarri, W. Cai, S. Goodman, R. Pyzik, J. Post, et al. Effects of sevelamer on HbA1c, inflammation, and advanced glycation end products in diabetic kidney disease. Clin J Am Soc Nephrol, 7 (2012), pp. 934-942. http://dx.doi.org/10.2215/CJN.12891211
- J.P. Lebreton, F. Joisel, J.P. Raoult, B. Lannuzel, J.P. Rogez, G. Humbert. Serum concentration of human alpha 2 HS glycoprotein during the inflammatory process: Evidence that alpha 2 HS glycoprptein is a negative acute-phase reactant. J Clin Invest, 64 (1979), pp. 1118-1129. http://dx.doi.org/10.1172/JCI109551
- Gangneux C, Daveau M, Hiron M, et al. The inflammation-induced down-regulation of plasma Fetuin-A (alpha2HS-Glycoprotein) in liver results from the loss of interaction between long C/EBP isoforms at two neighbouring binding sites. Nucleic acids research 2003; 31: 5957-5970.
- Moe SM, Chen NX. Inflammation and vascular calcification. Blood Purif 2005; 23: 64-71.
- K. Caglar, M.I. Yilmaz, M. Saglam, E. Cakir, C. Acikel, T. Eyileten, et al. Short-term treatment with sevelamer increases serum fetuin-a concentration and improves endothelial dysfunction in chronic kidney disease stage 4 patients. Clin J Am Soc Nephrol, 3 (2008), pp. 61-68
- Don BR, Spin G, Nestorov I, et al. The pharmacokinetics of etanercept in patients with end-stage renal disease on haemodialysis. J Pharm Pharmacol 2005; 57: 1407-1413.
- Don BR, Kim K, Li J, et al. The effect of etanercept on suppression of the systemic inflammatory response in chronic hemodialysis patients. Clin Nephrol 2010; 73: 431-438
- Hung AM, Ellis CD, Shintani A, et al. IL-1beta receptor antagonist reduces inflammation in hemodialysis patients. J Am Soc Nephrol 2011; 22: 437-442.
- Carrero JJ, González García ME. Nefrología al día. Inflamación en Diálisis. Disponible en: https://www.nefrologiaaldia.org/299
MAT-ES-2402532-V.1-Septiembre 2024