- Artículo
- Fuente: Campus Sanofi
- 19 oct 2022
El papel actual del TPH en linfomas en la era de las terapias CAR-T

En la era actual, la terapia de células T con receptores quiméricos de antígenos (CAR-T) se ha posicionado como tratamiento de tercera línea en pacientes con linfoma B difuso de célula grande en recaída o refractario, y probablemente el trasplante alogénico se planteará tras la recaída de la terapia CAR-T. El futuro irá dirigido a la aplicación de dicha terapia en líneas más precoces.
El linfoma B difuso de célula grande (LBDCG) es el linfoma más frecuente. A pesar de que se considera una enfermedad curable, en torno a un 30-40% de los pacientes experimentará una recaída o será refractario (R/R) tras la primera línea de tratamiento. En este subgrupo de pacientes, por tanto, se plantea una quimioterapia de rescate y la posterior consolidación con trasplante autólogo de progenitores hematopoyéticos (auto-TPH)1.
El estudio retrospectivo SCHOLAR-1 ha definido una población especialmente refractaria que incluye pacientes que progresan o no responden a la primera línea al tratamiento de rescate, o aquellos que llegan al auto-TPH, pero recaen en menos de 12 meses (Figura 1)2. Estos pacientes presentan una tasa de respuestas completas menores a un 10% a la siguiente línea de tratamiento, con una mediana de supervivencia global de seis meses, aproximadamente.
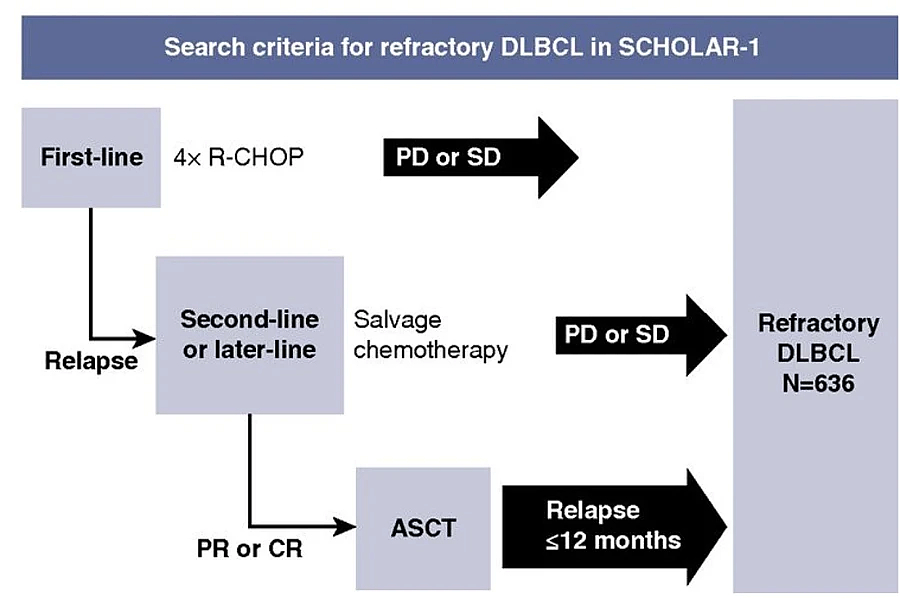
Figura 1. Criterios SCHOLAR-1.
DLBCL: Linfoma B difuso de célula grande; PD: Progresión; SD: Enfermedad estable; PR: Respuesta parcial; CR: Respuesta completa; ASCT: Trasplante autólogo de progenitores hematopoyéticos.
Por tanto, ante un pronóstico tan pobre, se requiere una mejor estrategia terapéutica para estos pacientes. El trasplante alogénico de progenitores hematopoyéticos (alo-TPH) se ha establecido como una opción curativa en este contexto3, pero su eficacia está limitada por la mortalidad relacionada con el procedimiento, debido al acondicionamiento, la enfermedad injerto contra receptor o las infecciones (Tabla 1). También hay que tener en cuenta que muchos de estos pacientes habrán recibido múltiples líneas de tratamiento previas, incluyendo el auto-TPH, que conllevarán una mayor toxicidad.
| N | MRT a 3 años | IA recaída a 3 años | SLP a 3 años | SG a 3 años | |
| Van Kampen et al. (2011)12 | 101 | 28% | 30% | 42% | 52% |
| Bacher et al. (2012)13 | 396 | -- | -- | 42% | 54% |
| Rigacci et al. (2012)14 | 165 | 28% | -- | 34% | 42% |
| Glass et al. (2014)15 | 84 | 35% | -- | 25% | 26% |
| Fenske et al. (2016)16 | 503 | 30% | 38% | 31% | 37% |
Tabla 1. Experiencia publicada de alo-TPH en LBDCG R/R
IA: incidencia acumulada; MRT: mortalidad relacionada con el trasplante; SG: supervivencia global; SLP: supervivencia libre de progresión.
En los últimos años, la aprobación de la terapia CAR-T para los pacientes con LBDCG en R/R, tras al menos dos líneas de tratamiento, se ha posicionado como una opción curativa, con una supervivencia global que está en torno a un 40% a los cuatro años, confirmando así unas respuestas duraderas en el tiempo.
Por otra parte, esta terapia presenta una menor toxicidad relacionada con el procedimiento, a diferencia del alo-TPH4,5. Otro aspecto beneficioso también es que se considera una estrategia factible y efectiva en pacientes con enfermedad activa, a diferencia del alo-TPH, que es una opción curativa únicamente en pacientes con respuesta tras un tratamiento de rescate. Asimismo, la terapia CAR-T se podría plantear en un subgrupo de pacientes que, de entrada, no sean candidatos a trasplante por edad.
El futuro de la terapia CAR-T irá dirigido a poderlo aplicar en líneas más precoces. De hecho, recientemente, en el Congreso Americano de Hematología (ASH) de 2021, se han publicado resultados de los distintos ensayos clínicos sobre el uso de la terapia CAR-T en segunda línea que podrían sustituir el papel del auto-TPH6-8. En breve, también saldrán nuevas indicaciones en otras histologías, como en el linfoma de células del manto o en el linfoma folicular, con resultados muy prometedores.
Por otra parte, hoy en día, se disponen de nuevas terapias diana, como anticuerpos biespecíficos9,10 o anticuerpos monoclonales conjugados11, que se han incorporado al algoritmo terapéutico de estos pacientes.
En conclusión, la terapia CAR-T se ha posicionado como tratamiento de tercera línea en pacientes con LBDCG R/R, y probablemente el alo-TPH se planteará en aquellos pacientes que sean candidatos por edad y quimiosensibilidad tras la recaída de la terapia CAR-T. |
Autora

Leyre Bento de Miguel, MD, PhD
Médico Adjunto de Hematología, Hospital Universitario Son Espases
Licenciada en Medicina por la Universidad de Navarra (2002-2008). Médico Interno Residente en Hematología y Hemoterapia en el Hospital General Universitario Gregorio Marañón (2009-2013). Facultativa Especialista de Área en Hematología y Hemoterapia en el Hospital Universitario Son Espases de Palma (desde 2013 hasta la actualidad). Tesis doctoral por la Universidad de las Islas Baleares en 2019.

Referencias
- Philip T, Guglielmi C, Hagenbeek A, Somers R, Van der Lelie H, Bron D, et al. Autologous bone marrow transplantation as compared with salvage chemotherapy in relapses of chemotherapy-sensitive non-Hodgkin’s lymphoma. N Engl J Med. 1995;333(23):1540-5.
- Crump M, Neelapu SS, Farooq U, Van Den Neste E, Kuruvilla J, Westin J, et al. Outcomes in refractory diffuse large B-cell lymphoma: results from the international SCHOLAR-1 study. Blood. 2017;130(16):1800-8.
- Bento L, Gutiérrez A, Novelli S, Montoro J, Piñana JL, López-Corral L, et al. Allogeneic stem cell transplantation as a curative option in relapse/refractory diffuse large B cell lymphoma: Spanish multicenter GETH/GELTAMO study. Bone Marrow Transplant. 2021;56(8):1919-28.
- Neelapu SS, Locke FL, Bartlett NL, Lekakis LJ, Miklos DB, Jacobson CA, et al. Axicabtagene Ciloleucel CAR T-Cell Therapy in Refractory Large B-Cell Lymphoma. N Engl J Med. 2017;377(26):2531-44.
- Schuster SJ, Bishop MR, Tam CS, Waller EK, Borchmann P, McGuirk JP, et al. Tisagenlecleucel in Adult Relapsed or Refractory Diffuse Large B-Cell Lymphoma. N Engl J Med. 2019;380(1):45-56.
- Locke FL, Miklos DB, Jacobson C, Perales M-A, Kersten MJ, Oluwole OO, et al. Primary Analysis of ZUMA-7: A Phase 3 Randomized Trial of Axicabtagene Ciloleucel (Axi-Cel) Versus Standard-of-Care Therapy in Patients with Relapsed/Refractory Large B-Cell Lymphoma. Blood. 2021;138(Supl 1):2.
- Bishop MR, Dickinson M, Purtill D, Barba P, Santoro A, Hamad N, et al. Tisagenlecleucel Vs Standard of Care As Second-Line Therapy of Primary Refractory or Relapsed Aggressive B-Cell Non-Hodgkin Lymphoma: Analysis of the Phase III Belinda Study. Blood. 2021;138(Supl 2):LBA-6.
- Kamdar M, Solomon SR, Arnason JE, Johnston PB, Glass B, Bachanova V, et al. Lisocabtagene Maraleucel (liso-cel), a CD19-Directed Chimeric Antigen Receptor (CAR) T Cell Therapy, Versus Standard of Care (SOC) with Salvage Chemotherapy (CT) Followed By Autologous Stem Cell Transplantation (ASCT) As Second-Line (2L) Treatment in Patients (Pts) with Relapsed or Refractory (R/R) Large B-Cell Lymphoma (LBCL): Results from the Randomized Phase 3 Transform Study. Blood. 2021;138(Supl 1):91.
- Budde LE, Assouline S, Sehn LH, Schuster SJ, Yoon S-S, Yoon DH, et al. Single-Agent Mosunetuzumab Shows Durable Complete Responses in Patients With Relapsed or Refractory B-Cell Lymphomas: Phase I Dose-Escalation Study. J Clin Oncol. 2021:JCO2100931.
- Hutchings M, Morschhauser F, Iacoboni G, Carlo-Stella C, Offner FC, Sureda A, et al. Glofitamab, a Novel, Bivalent CD20-Targeting T-Cell-Engaging Bispecific Antibody, Induces Durable Complete Remissions in Relapsed or Refractory B-Cell Lymphoma: A Phase I Trial. J Clin Oncol. 2021;39(18):1959-70.
- Sehn LH, Herrera AF, Flowers CR, Kamdar MK, McMillan A, Hertzberg M, et al. Polatuzumab Vedotin in Relapsed or Refractory Diffuse Large B-Cell Lymphoma. J Clin Oncol. 2020;38(2):155-65.
- Van Kampen RJW, Canals C, Schouten HC, Nagler A, Thomson KJ, Vernant J-P, et al. Allogeneic stem-cell transplantation as salvage therapy for patients with diffuse large B-cell non-Hodgkin’s lymphoma relapsing after an autologous stem-cell transplantation: an analysis of the European Group for Blood and Marrow Transplantation Registry. J Clin Oncol. 2011;29(10):1342-8.
- Bacher U, Klyuchnikov E, Le-Rademacher J, Carreras J, Armand P, Bishop MR, et al. Conditioning regimens for allotransplants for diffuse large B-cell lymphoma: myeloablative or reduced intensity? Blood. 2012;120(20):4256-62.
- Rigacci L, Puccini B, Dodero A, Iacopino P, Castagna L, Bramanti S, et al. Allogeneic hematopoietic stem cell transplantation in patients with diffuse large B cell lymphoma relapsed after autologous stem cell transplantation: a GITMO study. Ann Hematol. 2012;91(6):931-9.
- Glass B, Hasenkamp J, Wulf G, Dreger P, Pfreundschuh M, Gramatzki M, et al. Rituximab after lymphoma-directed conditioning and allogeneic stem-cell transplantation for relapsed and refractory aggressive non-Hodgkin lymphoma (DSHNHL R3): an open-label, randomised, phase 2 trial. Lancet Oncol. 2014;15(7):757-66.
- Fenske TS, Ahn KW, Graff TM, DiGilio A, Bashir Q, Kamble RT, et al. Allogeneic transplantation provides durable remission in a subset of DLBCL patients relapsing after autologous transplantation. Br J Haematol. 2016;174(2):235-48.
MAT-ES-2200371 V1 – Febrero 2022
