- Artículo
- Fuente: Campus Sanofi
- 29 abr 2024
Trasplante renal en paciente en riesgo de función retrasada del injerto

La función retrasada del injerto es una de las complicaciones más frecuentes en el trasplante renal, y la Timoglobulina es un instrumento valioso para su manejo. La rATG producido a partir de timocitos humano (rATG) es capaz de frenar la respuesta inflamatoria desencadenada por la isquemia-reperfusión, a la vez que protege a nuestro paciente del incremento de riesgo de rechazo que supone esta situación.
La función retrasada del injerto (FRI) es una de las complicaciones más frecuentes postrasplante renal, con consecuencias sobre paciente e injerto. La FRI incrementa la estancia hospitalaria, el riesgo de rechazo agudo y condiciona la función renal a largo plazo1-3. La FRI persiste como efecto inevitable de las agresiones sufridas por el injerto durante el proceso de trasplante (proceso de fallecimiento del donante y daños de isquemia reperfusión), y también de la expansión tanto de los criterios de aceptación de riñones para el implante, como de las características actuales de los receptores de trasplante renal.
La utilización de rATG ante un riesgo incrementado de FRI puede ser una estrategia útil para la mejora de resultados en este contexto. La inducción con rATG podría reducir la tasa de FRI, aunque la evidencia disponible al respecto no es lo suficientemente concluyente. Por otra parte, rATG reduce el riesgo de rechazo agudo derivado de la introducción retrasada de Tacrolimus4. Este retraso, que tiene periodos variables desde 2 hasta 7 días postrasplante, pretende reducir el efecto aditivo que la toxicidad funcional de los anticalcineurínicos pueda tener en la intensificación de los daños que han conducido a la FRI. Como contrapartida, una exposición reducida y/o retrasada a Tacrolimus conlleva un riesgo aumentado de rechazo agudo, riesgo de por sí ya incrementado por la propia FRI, que induce inflamación en el órgano y con ello, mayor inmunogenicidad del injerto, que conducirá a la activación de la inmunidad innata y adaptativa.
El caso que presentamos ilustra bien esta situación. Se trata de un paciente de 73 años, en hemodiálisis desde hace 32 meses por una nefropatía no filiada, con HTA, dislipemia, obesidad y SAHS. Este paciente recibe un injerto renal procedente de una donante en asistolia controlada de 72 años, con IMC de 30,4 kg/m2, HTA, dislipemia, con antecedentes de ICTUS isquémico, y fallecida por encefalopatía anóxica. La extracción renal se realizó tras 32 minutos de isquemia caliente funcional (ICF), seguida de perfusión regional normotérmica, y posteriormente se procedió al implante, tras 13,3 h de isquemia fría (IF) estática.
En esta situación encontramos varios factores que incrementan el riesgo de FRI, tanto en el donante (edad, obesidad, HTA, ACV), en el proceso de donación (fallecimiento por asistolia controlada, ICF muy prolongada e IF considerable), como en el receptor (edad, obesidad, tiempo en diálisis). La identificación de estos factores permite una selección de los pacientes que se encuentran en riesgo elevado de FRI, como era el caso de este paciente.
Figura 1. Evolución durante las primeras 3 semanas postrasplante.
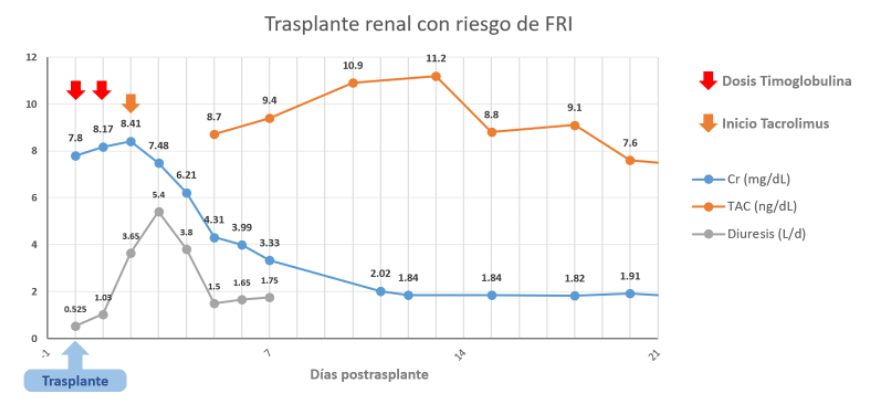
En nuestra Unidad, tras identificar esta situación utilizamos un protocolo de inducción con rATG en dosis variables e introducción retrasada de Tacrolimus. Previamente a la reperfusión se administran 1,5 mg/kg de rATG además del bolo habitual de Metilprednisona. Según la evolución posterior del receptor, esencialmente marcada por la cuantía de diuresis y la necesidad o no de hemodiálisis postrasplante, se adapta el esquema de inmunosupresión. Tacrolimus se introduce en el momento en que se aprecia un incremento significativo de la diuresis, entre el día 1 hasta el día 4 postrasplante. En cuanto a rATG, se administran entre 1 a 3 dosis adicionales hasta que se alcanza ese criterio de diuresis y puede introducirse Tacrolimus. La dosis máxima acumulada en pacientes de edad avanzada (>65 años), frágiles o con comorbilidades asociadas es de 3 mg/kg (2 dosis en total), mientras que en pacientes jóvenes o de riesgo inmunológico más alto la dosis máxima acumulada es de 6 mg/kg (4 dosis en total).
El paciente recibió 2 dosis de rATG, y pese a una fase de oliguria inicial mostró incrementos progresivos de diuresis desde el día 2 postrasplante, introduciéndose Tacrolimus en el día 3 (Figura 1). Se consiguió evitar la HD y la Cr al alta fue de 1,67 mg/dl, aunque la estancia hospitalaria se prolongó por un episodio de retención urinaria aguda tras retirada de sonda y una infección urinaria no complicada en ese contexto. A los 6 meses postrasplante el paciente presenta una excelente situación clínica, Cr 1,45 mg/dl, y cociente de albúmina/Cr en orina de 75 mg/g.
*(El rATG utilizado en este centro fue Timoglobulina)

Dr. Alex Gutiérrez Dalmau
Unidad de Trasplante Renal. Hospital Universitario Miguel Servet. Zaragoza
Contenido mínimo de Timoglobulina®
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
Envase con 1 vial de polvo (CN 800425.6): PVP notificado: 550,91 €. PVP IVA notificado: 572,95 €. Medicamento sujeto a prescripción médica. Uso hospitalario. Financiado por el SNS.

Referencias
- Chen R, Wang H, Song L, Hou J, Peng J, Dai H, et al. Predictors and one-year outcomes of patients with delayed graft function after deceased donor kidney transplantation. BMC Nephrol. 2020;21(1):526.
- Phillips BL, Ibrahim M, Greenhall GHB, Mumford L, Dorling A, Callaghan CJ. Effect of delayed graft function on longer-term outcomes after kidney transplantation from donation after circulatory death donors in the United Kingdom: A national cohort study. Am J Transplant. 2021;21(10):3346-3355.
- Jadlowiec CC, Frasco P, Macdonough E, Wagler J, Das D, Budhiraja P, et al. Association of DGF and Early Readmissions on Outcomes Following Kidney Transplantation. Transpl Int. 2022;35:10849.
- Asderakis A, Sabah TK, Watkins WJ, Khalid U, Szabo L, Stephens MR, et al. Thymoglobulin Versus Alemtuzumab Versus Basiliximab Kidney Transplantation From Donors After Circulatory Death. Kidney Int Rep. 2022;7(4):732-740.
MAT-ES-2400495 V2 Febrero 2026

