- Artículo
- Fuente: Campus Sanofi
- 19 abr 2024
Seguridad de alirocumab
Caso clínico:
Paciente remitido a la Unidad de Lípidos en 2011 por enfermedad cardiovascular (ECV), hipercolesterolemia no controlada e intolerancia a las estatinas. Tenía entonces 55 años y los siguientes antecedentes personales:
- Sin alergias conocidas a fármacos.
- Exfumador desde 2010 (consumo acumulado aproximado de 40 paquetes-año).
- Consumo de alcohol inferior a 30 g/día.
- Tuberculosis pleural en la juventud.
- Artritis reumatoide diagnosticada en 2008. Seguido en consultas de reumatología, recibía tratamiento con rituximab (500 mg cada seis meses) desde 2011, con buen control de la enfermedad.
- Hipertensión arterial conocida y tratada con ramipril (10 mg/24 h) desde 2009.
- Obesidad.
- Prediabetes conocida desde 2011.
- Cardiopatía isquémica: síndrome coronario agudo tipo infarto agudo de miocardio (IAM) anterior con elevación de ST Killip I en 2010. Se le realizó coronariografía urgente, que objetivó coronariopatía de dos vasos (estenosis del 90% en la arteria coronaria descendente anterior y estenosis del 60% en la arteria coronaria derecha), por lo que se procedió a angioplastia primaria e implante de stent sobre arteria coronaria descendente anterior. Asintomático desde entonces, seguía tratamiento con ácido acetilsalicílico (100 mg/24 h) y atenolol (50 mg/24 h).
El paciente refería hipercolesterolemia desde los 32 años, a raíz de una revisión de salud en su empresa. En la última década, su médico de atención primaria le había prescrito estatinas en alguna ocasión, tratamiento que el paciente nunca llegó a iniciar. A raíz del IAM se le prescribió 80 mg de atorvastatina, que el paciente tomó durante unas pocas semanas presentando mialgias persistentes de predominio matutino y localización proximal, que no mejoraban con el ejercicio ni el reposo y que desaparecieron tras la retirada de dicho tratamiento. Posteriormente se le prescribió 20 mg de rosuvastatina, con reaparición de las mialgias, esta vez más leves e intermitentes, pero que se acompañaron de aumento de creatina-fosfocinasa (CPK) (520 UI/ml), por lo que su médico procedió a su retirada, remitiéndolo a la Unidad de Lípidos.
El paciente relataba historia familiar de hipercolesterolemia (uno de sus hermanos y dos de sus tres hijos), pero no de ECV. En la exploración física presentaba una talla de 172 cm, peso de 92 kg, índice de masa corporal de 31,1 kg/m2 y presión arterial de 144/82 mmHg, destacando la presencia de arco corneal completo y bilateral, así como xantomas tendinosos aquíleos y tuberosos en manos (Fig. 1). En el repositorio digital de laboratorio del área sanitaria se objetivaba hipercolesterolemia persistente con cifras máximas de colesterol ligado a lipoproteínas de baja densidad (cLDL) en 337 mg/dl. Durante el seguimiento inicial en la Unidad de Lípidos se le prescribió 10 mg de rosuvastatina (1/24 h) y 10 mg de ezetimiba (1/24 h), que tomó de forma continuada con buena adherencia, presentando mialgias leves y esporádicas con cifras de CPK en torno a 200 UI/ml (rango de normalidad: 10-195 UI/ ml). Se solicitó estudio genético, que mostró mutación patogénica (c.706 T > A) en el gen del receptor de lipoproteínas de baja densidad (gen LDLR).
En marzo de 2013 el paciente mantenía un peso de 92 kg, presión arterial de 141/87 mmHg y los siguientes datos analíticos: glucosa 104 mg/dl; urea 51 mg/dl; creatinina, 1,26 mg/dl; ácido úrico 6,9 mg/ dl; colesterol total 175 mg/dl; colesterol ligado a lipoproteínas de alta densidad (cHDL) 41 mg/dl; colesterol ligado a lipoproteínas de baja densidad (cLDL) 117 mg/dl; triglicéridos 84 mg/dl; bilirrubina total 1,24 mg/dl; fosfatasa alcalina 110 UI/l; láctico deshidrogenasa hepática (LDH) 292 UI/l; aspartato aminotransferasa (AST) 22 UI/l; alanino aminotransferasa (ALT) 28 UI/l; gamma-glutamil transpeptidasa (GGT) 70 UI/l; filtrado glomerular estimado 64 ml/min, y lipoproteína (a) 22 mg/dl.
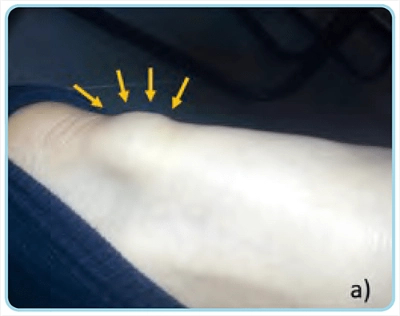
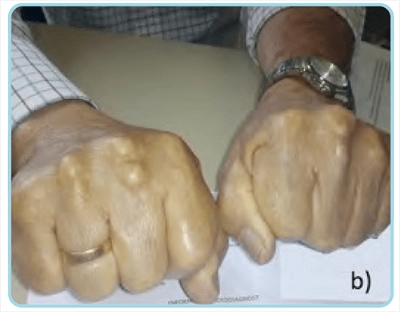
Figura 1. Xantomas. a) xantoma aquíleo. b) xantomas tuberosos.
En esa fecha el paciente aceptó participar en el ensayo clínico ODYSSEY FH I, siendo aleatorizado en abril de 2013 a alirocumab —conocido a posteriori— inicialmente a dosis de 75 mg cada dos semanas, con aumento posterior de dosis a 150 mg cada dos semanas. El paciente mantuvo su participación a lo largo del ensayo, presentando como acontecimientos adversos (AA) dos infecciones de las vías respiratorias superiores, una gastroenteritis aguda probablemente viral y un esguince del tobillo izquierdo. A excepción de mialgias ocasionales, que no aumentaron en intensidad ni frecuencia respecto al periodo previo a su participación en el estudio, el paciente no presentó otros acontecimientos adversos de especial interés (AAEI). Todos los AA fueron categorizados como leves.
En septiembre de 2014 finalizó el ensayo clínico, pero el paciente aceptó participar nuevamente, y sin solución de continuidad, en el estudio ODYSSEY OLE, en el que recibió en abierto alirocumab a la dosis de 150 mg cada dos semanas hasta diciembre de 2016, fecha en la que concluyó su participación en dicho estudio. Durante ese periodo padeció nuevamente dos infecciones respiratorias de las vías superiores, coincidiendo con sendos periodos de gripe estacional, un cuadro de dolor abdominal y vómitos autolimitado en menos de 24 h y por el que no consultó, y un episodio de tendinopatía del supraespinoso del hombro izquierdo, por el que fue atendido en su centro de salud y que se resolvió en ocho días con tratamiento antiinflamatorio y analgesia menor, sin evidencia de acontecimiento adverso serio (AAS). Las mialgias fueron, a criterio del paciente, progresivamente más leves e infrecuentes. En el momento de finalizar su participación en el estudio pesaba 91 kg, tenía una presión arterial de 139/86 mmHg y presentaba los siguientes datos analíticos: glucosa 101 mg/dl; urea 48 mg/dl; creatinina 1,24 mg/dl; ácido úrico 6,6 mg/dl; colesterol tota 104 mg/dl; cHDL 44 mg/dl; cLDL 42 mg/dl; triglicéridos 90 mg/dl; bilirrubina total 1,18 mg/dl; fosfatasa alcalin 133 UI/l; LDH 275 UI/l; AST 28 UI/l; ALT 31 UI/l; GGT 82 UI/l, y filtrado glomerular estimado 63 ml/min.
En marzo de 2017, tras autorización para la prescripción por parte del servicio de salud correspondiente según indicaciones financiadas, el paciente retomó tratamiento con alirocumab a la dosis de 150 mg cada dos semanas, que ha mantenido en condiciones de práctica clínica real con excelente tolerabilidad y adherencia —dos retrasos en la administración sin criterios de sobredosis— hasta la última visita en enero de 2021. En ese momento, el paciente tenía un peso de 91 kg, la presión arterial era de 141/85 mmHg y presentaba los siguientes datos analíticos: glucosa, 100 mg/dl; hemoglobina glucosilada, 5,9%; urea, 46 mg/dl; creatinina, 1,18 mg/dl; ácido úrico, 6,8 mg/dl; colesterol total, 98 mg/dl; cHDL, 43 mg/dl; cLDL, 36 mg/dl; triglicéridos, 96 mg/dl; bilirrubina total, 1,12 mg/dl; fosfatasa alcalina, 117 UI/l; LDH, 234 UI/l; GOT, 23 UI/l; GPT, 33 UI/l; GGT, 91 UI/l, y filtrado glomerular estimado (CKD-EPI), 64 ml/min.
Durante este último periodo el paciente ha sufrido un episodio de gripe A, tres infecciones respiratorias de las vías superiores no filiadas, un ataque de gota, por el que fue atendido en su centro de salud y tratado con antiinflamatorios no esteroideos durante siete días con resolución del mismo, y un cuadro de cefalea de cuatro días de duración, coincidente con la «primera ola» del SARS-CoV-2, por el que no consultó ni recibió tratamiento. Las mialgias fueron anecdóticas, y en uno de los tres controles en los que se solicitó CPK, los niveles fueron ligeramente elevados (327 UI/ml). La evolución del perfil lipídico durante este periodo se recoge en la figura 2.
Finalmente, señalar que durante el seguimiento el paciente ha permanecido estable desde un punto de vista reumatológico y no ha presentado ningún acontecimiento cardiovascular.
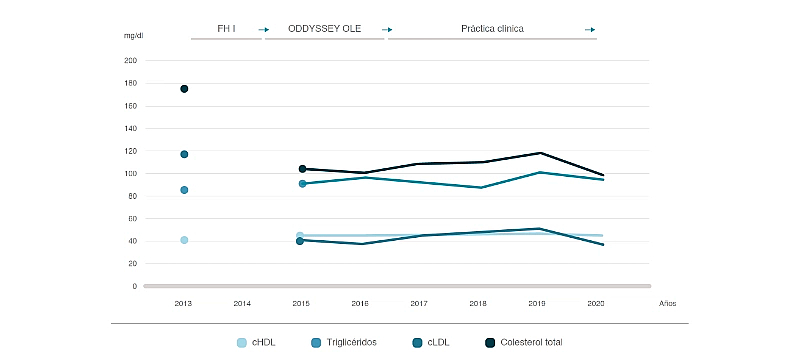
Figura 2. Perfil lipídico del paciente a lo largo del tiempo.
Comentario del caso clínico
Se presenta el caso de un paciente con hipercolesterolemia familiar, ECV ateroesclerótica, intolerancia muscular «parcial» a las estatinas y cLDL lejos del objetivo terapéutico que ha recibido dosis máximas de alirocumab (150 mg cada dos semanas) durante un periodo prácticamente ininterrumpido —tres meses de pausa administrativa—, primero en ensayo clínico (cuatro años) y luego en condiciones de práctica clínica real, alcanzando niveles de cLDL < 50 mg/dl, sostenidos en el tiempo y sin evidencia de AAS ni AAEI. Los AA más frecuentes en este caso (infecciones respiratorias de las vías superiores) coinciden con los de mayor frecuencia en el programa de desarrollo clínico de alirocumab1, donde no hubo diferencias entre grupos y que son congruentes con la historia previa del paciente («todos los años cojo un catarro») y la morbilidad estacional en nuestro entorno. Destacar que el espectro de acontecimientos musculares no empeoró durante ese tiempo, datos que son también congruentes con los del ensayo ALTERNATIVE2.
Además de lo expuesto, cabe destacar dos aspectos finales:
- Primero, el hecho de que el paciente inició tratamiento con alirocumab siendo prediabético y que, a pesar de transcurrir ocho años, continuar con 10 mg de rosuvastatina y no haber bajado de peso, no ha pasado a la condición de diabético, experiencia alineada con el análisis preespecificado del ODYSSEY OUTCOMES3, que sugiere que, en el momento actual, alirocumab no debe ser considerado como diabetogénico.
- Y segundo, la curiosidad de que el tratamiento con alirocumab ha coexistido durante ocho años con rituximab (anticuerpo monoclonal quimérico anti-CD20), un escenario que al inicio planteaba ciertas dudas sobre la eficacia y la seguridad, pero que el transcurso del tiempo se ha encargado de disipar.
Consulta la guía de uso de Praluent mensual
Contenido mínimo de Praluent®
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
Praluent 75 mg pluma precargada, envase de 2 plumas precargadas (CN: 708030.5) P.V.P.: 463,06 €. Medicamento sujeto a prescripción médica.Dispensación hospitalaria.
Praluent 150 mg pluma precargada, envase de 2 plumas precargadas (CN: 708035.0) P.V.P.: 463,06 €. Medicamento sujeto a prescripción médica. Dispensación hospitalaria.
Praluent 300 mg pluma precargada, envase de 1 pluma precargada (CN: 729267.8) P.V.P.: 463,06 €. Medicamento sujeto a prescripción médica. Dispensación hospitalaria.
Ver ficha técnica Praluent 75mg
Ver ficha técnica Praluent 150mg
Ver ficha técnica Praluent 300mg

Referencias
- Jones PH, Bays HE, Chaudhari U, Pordy R, Lorenzato C, Miller K, et al. Safety of Alirocumab (A PCSK9 Monoclonal Antibody) from 14 Randomized Trials. Am J Cardiol. 2016;118(12):1805-11.
- Moriarty PM, Thompson PD, Cannon CP, Guyton JR, Bergeron J, Zieve FJ, et al.; ODYSSEY ALTERNATIVE Investigators. Efficacy and safety of alirocumab vs ezetimibe in statin-intolerant patients, with a statin rechallenge arm: The ODYSSEY ALTERNATIVE randomized trial. J Clin Lipidol. 2015;9(6):758-69.
- Ray KK, Colhoun HM, Szarek M, Baccara-Dinet M, Bhatt DL, Bittner VA, et al.; ODYSSEY OUTCOMES Committees and Investigators. Effects of alirocumab on cardiovascular and metabolic outcomes after acute coronary syndrome in patients with or without diabetes: a prespecified analysis of the ODYSSEY OUTCOMES randomised controlled trial. Lancet Diabetes Endocrinol. 2019;7(8):618-28.
MAT-ES-2101298.V1 Junio 2021