- Artículo
- Fuente: Campus Sanofi
- 28 oct 2025
Definición de los criterios de control y de cambio de la EEo

La EEo es más que solo los síntomas: busca signos ocultos de progresión1-4
La EEo no controlada impulsada por la inflamación de tipo 2 puede conducir a un remodelado tisular progresivo del tejido y fibrosis5
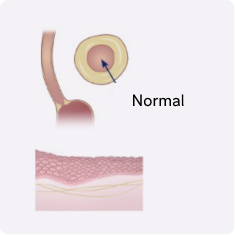
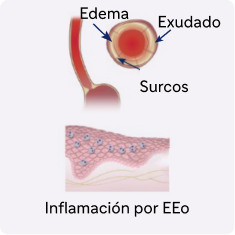
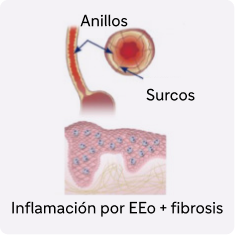
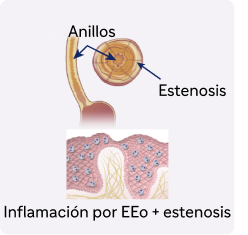

Aproximadamente el 80% de los pacientes con EEo presentaban alteraciones endoscópicas e histológicas tras el tratamiento convencional a pesar de la resolución de los síntomas4,6
La IL-4 y la IL-13 son impulsoras clave y centrales de la inflamación de tipo 2 persistente, lo que lleva a la progresión de la enfermedad y a complicaciones a largo plazo en la EEo1,7

Visita virtual con Eomilio Fagitis
Explora más sobre EEo e IT2 en la visita virtual con Eomilio Fagitis
Sigue las guías para identificar la respuesta incompleta al tratamiento con la lista S.C.O.P.E4,8-12
CONTROL DE SÍNTOMAS: tu paciente presenta disfagia…
- Persistente durante el tratamiento
- Que empeora en gravedad
- Que aumenta en frecuencia
OBSERVACIÓN: observas…
- Conductas adaptativas (I.M.P.A.C.T.S.)
- Impactación alimentaria
- Pérdida de peso o crecimiento deficiente
EVALUACIÓN PATOLÓGICA: la endoscopia y las biopsias revelan…
- Cambios esofágicos visibles
- Puntuación total de EoE-EREFS <2
- Recuento de eosinófilos >15 EOS/HPF
- Aumento de la gravedad y extensión histológica (EoEHSS)
Evalúa con la lista S.C.O.P.E.
- Al inicio del tratamiento
- Evalúa mejoras a los 3 meses
- Seguimientos regulares cada 12 meses
Control de la progresión de la enfermedad evaluando la EEo de manera integral
Las medidas clínicas, endoscópicas e histológicas pueden determinar si el tratamiento actual está abordando completamente la progresión de la enfermedad11
Medidas de mejora

Clínica
>30 % de mejora en síntomas de gravedad y frecuencia según DSQ sin evidencia de conductas adaptativas (I.M.P.A.C.T.S.)

Endoscópica
>30 % de mejora en signos endoscópicos (EoE-EREFS) y EoE-EREFS <2

Histológica
Mejora global en gravedad y extensión histológica (EoEHSS) y objetivo de respuesta de <15 EOS/HPF

Clínica
>30 % de mejora en síntomas de gravedad y frecuencia según DSQ sin evidencia de conductas adaptativas (I.M.P.A.C.T.S.)

Endoscópica
>30 % de mejora en signos endoscópicos (EoE-EREFS) y EoE-EREFS <2

Histológica
Mejora global en gravedad y extensión histológica (EoEHSS) y objetivo de respuesta de <15 EOS/HPF
SI ALGUNO DE ESTOS OBJETIVOS NO SE CUMPLE, CONSIDERA EL CAMBIO DE TRATAMIENTO
Control de múltiples medidas con DUPIXENT13,14
Síntomas clínicosa
Mejora significativa de la disfagia en comparación con placebo ya en la semana 4b

Hasta un 81% de reducción de la disfagia en la semana 5213,c
Para pacientes de 1 a 11 años, hasta 0,47 puntos de mejora en PESQ-C
desde el inicio en la semana 5214,d
Endoscópico
Reducción de los signos endoscópicos de inflamación y fibrosis

Hasta un 85% de mejora de la puntuación total de EoE-EREFS en la semana 5213,e,f
Para pacientes de 1 a 11 años, hasta 4,8 puntos de mejora en EoE-EREFS desde el inicio 5214,g
Histológicoh
Se alcanzó respuesta en el recuento máximo de eosinófilos intraepiteliales esofágicos

Hasta un 100% de los pacients alcanzaon la respuesta histológica (<15 EOS/HPF) en la semana 5213,j
- Hasta un 85 % de los pacientes alcanzaron la remisión histológica (≤6 EOS/HPF) en la semana 5213,j
- Hasta un 86 % de los pacientes de 1 a 11 años alcanzaron respuesta en el recuento máximo de eosinófilos intraepiteliales esofágicos (<15 EOS/HPF) en la semana 5214,k
DUPIXENT® ES EL PRIMER Y ÚNICO BIOLÓGICO QUE REDUCE LA INFLAMACIÓN DE TIPO 2 AL DIRIGIRSE DIRECTAMENTE A LA SEÑALIZACIÓN DE LA IL-4 Y LA IL-131,7,15
Seguridad establecida con DUPIXENT® en niños, adolescentes y adultos
DUPIXENT® es un anticuerpo monoclonal con un perfil de seguridad comparable a placebo15,l
Los AAET más frecuentes en el estudio TREET parte B/C fueron reacciones en el lugar de la inyección (incluye eritema, dolor e hinchazón). Se produjeron AAET graves en 5 pacientes que recibieron DUPIXENT® en la parte B/C. Ningún AAG fue considerado por el investigador como relacionado con el tratamiento de estudio.
Para más información de seguridad, accede al contenido mínimo.
Diseño de estudio
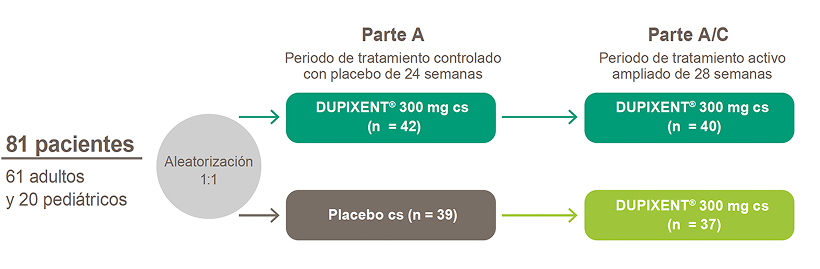
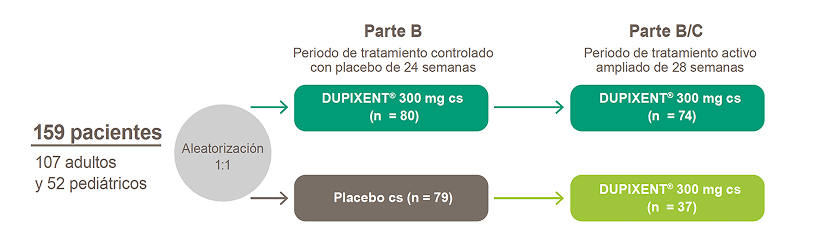
Partes A y B
Dos estudios controlados con placebo, doble ciego de 24 semanas.15 Los pacientes fueron aleatorizados a recibir DUPIXENT® 300 mg cs, DUPIXENT® 300 mg c2s (solo Partes B y B-C) o placebo csm
Parte C
Estudio de tratamiento activo ampliado opcional de 28 semanas, para un total de 52 semanas de tratamiento en pacientes que fueron tratados con DUPIXENT® 300 mg o placebo, completando las partes A o B.
Todos los pacientes incluidos (81 en la Parte A y 159 en la parte B) debían tener:
- EEo no controlada definida como ≥15 EOS/HPF intraepitelial a pesar de un curso de 8 semanas de IBP a altas dosis
- Puntuación en DSQ ≥10
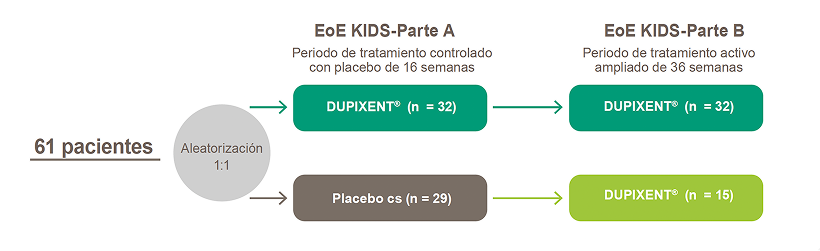
EoE KIDS-Parte A:
Estudio controlado con placebo, doble ciego de 16 semanas. Los pacientes fueron aleatorizados a recibir DUPIXENT® o placebo a dosis basadas en el peso corporal: ≥15 a <30 kg (200 mg c2s) y ≥30 a <60 kg (300 mg c2s)15,16,n
EoE KIDS-Parte B:
Estudio de tratamiento activo ampliado de 36 semanas, para un total de 52 semanas de tratamiento en pacientes que fueron tratados con DUPIXENT® o placebo, completando la parte A. Los pacientes recibieron DUPIXENT® a dosis basadas en el peso corporal: ≥15 a <30 kg (200 mg c2s), ≥30 a <60 kg (300 mg c2s) y ≥60 kg (300 mg cs)15,16,o
Todos los pacientes incluidos debían tener EEo no contralada (≥15 EOS/HPF intraepitelial a pesar de un curso de 8 semanas de IBP a altas dosis) y antecedentes de signos y síntomas de EEo15,16


Partes A y B
Dos estudios controlados con placebo, doble ciego de 24 semanas.15 Los pacientes fueron aleatorizados a recibir DUPIXENT® 300 mg cs, DUPIXENT® 300 mg c2s (solo Partes B y B-C) o placebo csm
Parte C
Estudio de tratamiento activo ampliado opcional de 28 semanas, para un total de 52 semanas de tratamiento en pacientes que fueron tratados con DUPIXENT® 300 mg o placebo, completando las partes A o B.
Todos los pacientes incluidos (81 en la Parte A y 159 en la parte B) debían tener:
- EEo no controlada definida como ≥15 EOS/HPF intraepitelial a pesar de un curso de 8 semanas de IBP a altas dosis
- Puntuación en DSQ ≥10

EoE KIDS-Parte A:
Estudio controlado con placebo, doble ciego de 16 semanas. Los pacientes fueron aleatorizados a recibir DUPIXENT® o placebo a dosis basadas en el peso corporal: ≥15 a <30 kg (200 mg c2s) y ≥30 a <60 kg (300 mg c2s)15,16,n
EoE KIDS-Parte B:
Estudio de tratamiento activo ampliado de 36 semanas, para un total de 52 semanas de tratamiento en pacientes que fueron tratados con DUPIXENT® o placebo, completando la parte A. Los pacientes recibieron DUPIXENT® a dosis basadas en el peso corporal: ≥15 a <30 kg (200 mg c2s), ≥30 a <60 kg (300 mg c2s) y ≥60 kg (300 mg cs)15,16,o
Todos los pacientes incluidos debían tener EEo no contralada (≥15 EOS/HPF intraepitelial a pesar de un curso de 8 semanas de IBP a altas dosis) y antecedentes de signos y síntomas de EEo15,16
DUPIXENT® PROPORCIONA UNA MEJORA RÁPIDA Y MANTENIDA EN MÚLTIPLES MEDIDAS DE CONTROL DE LA ENFERMEDAD13,14

Contenido mínimo de Dupixent
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
Dupixent 300 mg solución inyectable en jeringa precargada – 2 jeringas precargadas de 2 ml con protector de aguja (CN 718735.6)
Dupixent 300 mg solución inyectable en pluma precargada – 2 plumas precargadas de 2 ml (CN 758028.7)
Dupixent 200 mg solución inyectable en jeringa precargada – 2 jeringas precargadas de 1,14 ml (CN 727309.7)
Dupixent 200 mg solución inyectable en pluma precargada – 2 plumas precargadas de 1,14 ml (CN 758027.0)
PVP notificado: 1.267,45 €, PVP IVA notificado: 1.318,15 €.
Medicamento sujeto a prescripción médica. Diagnóstico hospitalario. Financiado por SNS. Dispensación hospitalaria sin cupón precinto.
CONSULTE LA FICHA TÉCNICA COMPLETA ANTES DE PRESCRIBIR ESTE MEDICAMENTO
Ver Ficha Técnica Dupixent 300 mg solución inyectable en jeringa precargada
Ver Ficha Técnica Dupixent 300 mg solución inyectable en pluma precargada
Ver Ficha Técnica Dupixent 200 mg solución inyectable en jeringa precargada
Ver Ficha Técnica Dupixent 200 mg solución inyectable en pluma precargada
Dupixent está financiado en España de acuerdo con los criterios establecidos por el SNS.
Notas
AAG: acontecimiento adverso grave; AAET: acontecimientos adversos emergentes con el tratamiento; cs: cada semana; c2s: cada 2 semanas; DSQ: cuestionario de síntomas de disfagia; EEo: esofagitis eosinofílica; EoEHSS: sistema de puntuación histológica en EEo; EoE-EREFS: puntuación de referencia endoscópica de EEo; EOS/HPF: eosinófilos intraepiteliales por campo de gran aumento; IBP: inhibidor de la bomba de protones; I.M.P.A.C.T.S: ingerir líquidos con las comidas, masticar alimentos excesivamente, prolongar los tiempos de comida, abstenerse de ingerir alimentos con textura, como carne y pan, cortar o triturar alimentos, tener dificultad para tragar comprimidos o píldoras, suspender actividades sociales; RSCcPN: rinosinusitis crónica con poliposis nasal; S.C.O.P.E.: control de síntomas, observación evaluación patológica; SNS: Sistema Nacional de salud.
Referencias
- Gandhi NA, et al. Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov. 2016;15(1):35-50.
- Chehade M, et al. Phenotypic characterization of eosinophilic esophagitis in a large multicenter patient population from the consortium for Food Allergy Research. J Allergy Clin Immunol Pract. 2018;6(5):1534-1544.e5.
- Mukkada V, et al. Health-related quality of life and costs associated with eosinophilic esophagitis: a systematic review. Clin Gastroenterol Hepatol. 2018;16(4):495-503.e8.
- Von Arnim U, et al. Monitoring patients with eosinophilic esophagitis in routine clinical practice - international expert recommendations. Clin Gastroenterol Hepatol. 2023;21(10):2526-2533.
- Schoepfer AM, et al. Delay in diagnosis of eosinophilic esophagitis increases risk for stricture formation in a timedependent manner. Gastroenterology. 2013;145(6):1230-1236.e1-2.
- Safroneeva E, et al. Symptoms have modest accuracy in detecting endoscopic and histologic remission in adults with eosinophilic esophagitis. Gastroenterology. 2016;150:581-590.
- Van Rhijn BD, Bredenoord AJ. Management of eosinophilic esophagitis based on pathophysiological evidence. J Clin Gastroenterol. 2017;51(8):659-668.
- Hirano I, Furuta GT. Approaches and challenges to management of pediatric and adult patients with eosinophilic esophagitis. Gastroenterology. 2020;158(4):840-851.
- de Rooij WE, et al. General well-being and coping strategies in adult eosinophilic esophagitis patients. J Neurogastroenterol Mol. 022;28(3):390-400.
- Wechsler JB, et al. Eosinophilic esophagitis reference score accurately identifies disease activity and treatment effects in children. Clin Gastroenterol Hepatol. 2018;16(7):1056-1063.
- Dellon ES, Gupta SK. A conceptual approach to understanding treatment response in eosinophilic esophagitis. Clin Gastroenterol Hepatol. 2019;17(11):2149-2160.
- Muir AB, et al. Eosinophilic esophagiBs: early diagnosis is the key. Clin Exp Gastroenterol. 2019;12:391-399.
- Rothenberg ME, et al. Efficacy and safety of dupilumab up to 52 weeks in adults and adolescents with eosinophilic oesophagitis (LIBERTY EoE TREET study): a multicentre, double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Gastroenterol Hepatol. 2023;8(11):990-1004.
- Chehade M, et al. Dupilumab for Eosinophilic Esophagitis in Patients 1 to 11 Years of Age. N Engl J Med. 2024 Jun 27;390(24):2239-2251.Suplementary Appendix
- CIMA - Centro de información online de medicamentos de la AEMPS. DUPIXENT® (dupilumab). Ficha técnica.
- Chehade M, et al. Dupilumab for eosinophilic esophagitis in patients 1 to 11 years of age. N Engl J Med. 2024;390(24):2239-2251.
a64 % de reducción en disfagia con DUPIXENT® en la semana 24 (variable coprimaria Parte B) (n = 42) vs. 41 % con placebo (n = 39) (p <0,0001).
b28 % de reducción en disfagia con DUPIXENT® en la semana 4 (Parte B) (n = 42) vs. 10 % con placebo (n = 39) (p <0,05).
c81 % de reducción en pacientes que recibieron DUPIXENT® desde el inicio (n = 40) y 78 % de reducción en pacientes que cambiaron a DUPIXENT® desde placebo en la semana 24 (n = 37) (Parte B/C).
d0,33 puntos de mejora en pacientes que recibieron DUPIXENT® desde el inicio (n = 27) y 0,47 de mejora en pacientes que cambiaron a DUPIXENT® desde placebo en la semana 16 (n = 9). Los resultados fueron nominalmente significativos vs. placebo en la semana 16.
e78 % de reducción en pacientes que recibieron DUPIXENT® desde el inicio (n = 63) y 85 % de reducción en pacientes que cambiaron a DUPIXENT® desde placebo en la semana 24 (n = 37) (Parte B/C).
f Las puntuaciones de las biopsias desde las regiones distales y proximales fueron de 0 a 9.
g4,8 puntos de mejora en pacientes que recibieron DUPIXENT® desde el inicio (n = 30) y 3,64 de mejora en pacientes que cambiaron a DUPIXENT® desde placebo en la semana 16 (n = 14).
h83 % de los pacientes alcanzó la respuesta histológica (<15 EOS/HPF) con DUPIXENT® en la semana 24 (variable coprimaria Parte B) (n = 74) vs. 8 % con placebo (n = 37) (p <0,001).
i100 % de los pacientes que recibieron DUPIXENT® desde el inicio alcanzaron la respuesta histológica (<15 EOS/HPF) (n = 74) y el 78 % de los pacientes que cambiaron a DUPIXENT® desde placebo en la semana 24 alcanzaron la respuesta histológica (n = 37) (Parte B/C).
j85 % de los pacientes que recibieron DUPIXENT® desde el inicio (n = 63) alcanzó la remisión histológica (≤ 6EOS/HPF) en la semana 52 (n = 74) y el 68 % de los pacientes que cambiaron a DUPIXENT® desde placebo en la semana 24 alcanzaron la remisión histológica (n = 47) (Parte B/C).
k86 % de los pacientes que recibieron DUPIXENT® desde el inicio alcanzaron la respuesta histológica (n = 35) y el 65 % de los pacientes que cambiaron a DUPIXENT® desde placebo alcanzaron la remisión histológica (n = 17).
lDUPIXENT® se estudió en 12 estudios aleatorizados controlados con placebo, incluyendo dermatitis atópica, asma, RSCcPN y EEo. Los estudios controlados pivotales incluyeron a 4.206 pacientes que recibieron dupilumab y 2.326 pacientes que recibieron placebo durante el período controlado.
mDUPIXENT® 300 mg c2s se estudió en la Parte B (n = 81) y en la Parte B-C (n = 116), pero no está aprobado para el tratamiento de la EEo.
nEl régimen de dosificación de 300 mg c2s es inferior a la dosis recomendada de DUPIXENT® en pacientes ≥40 kg.14
oSe estudió un brazo de exposición más baja de DUPIXENT® en la Parte A (n = 26) y Parte B (n = 36), pero no está aprobado para el tratamiento de la EEo.16
MAT-ES-2503120- v1- Octubre 2025