- Recurso
- Fuente: Campus Sanofi
- 19 jun 2024
Monografía: ¿Qué lugar ocupa la leflunomida en las guías de práctica clínica de la artritis reumatoide?

Formato PDF, 21 páginas
Introducción
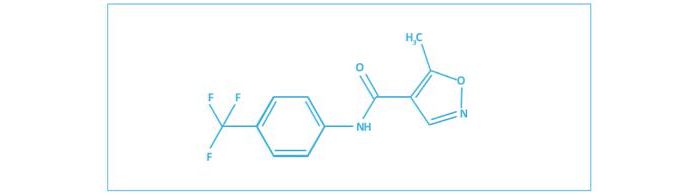
La LEF es un fármaco sintético de bajo peso molecular, pertenece a un grupo de medicamentos denominados FAMEs, cuyo objetivo es disminuir la inflamación y el daño permanente en pacientes con enfermedades reumáticas. La LEF es la N-(4-trifluorometilfenil)-5-metilisoxazol-4-carboxamina (C12H9F3N202), un derivado isoxazólico 5 (Figura 1). Tras su ingesta, se convierte en su metabolito activo, la teriflunomida, que tiene un efecto antiproliferativo, al inhibir la síntesis de novo de las pirimidinas, a través de la inhibición de la enzima dihidroorotato deshidrogenasa (Tabla 1). Con ello, se impide la activación de los linfocitos T, hallazgo patológico habitual en los pacientes con AR1-3. La LEF también tiene una capacidad inhibitoria de las tirosinas-cinasas4.
La LEF fue aprobaba para su comercialización por la Comisión Europea el 2 de septiembre de 1999, y está indicada para el tratamiento de pacientes adultos con AR activa como un FAMEs y artritis psoriásica activa.
Una revisión Cochrane5 concluyó que la LEF parece mejorar todos los resultados clínicos y retrasar la progresión radiológica tanto a los 6 como a los 12 meses de tratamiento en comparación con el placebo. Su eficacia y efectos adversos son comparables a los del MTX, sulfasalacina (SSZ) y ciclosporina A hasta los dos años de tratamiento. La combinación de LEF y MTX fue más eficaz que el MTX solo hasta los tres años de tratamiento, y los acontecimientos adversos no aumentaron. Las diferentes dosis de LEF fueron similares en cuanto a su eficacia y toxicidad. Estos datos han sido confirmados por otras RS6-8.
Figura 1. Chemical structure of leflunomide
.jpg)
Tabla 1. Mecanismos de acción de la leflunomida: efectos subsiguientes a la administración del fármaco.
|
Inhibición de la síntesis de pirimidinas. |
|
Inhibición de la proliferación de células T. |
|
Inhibición de la diapédesis y de la quimiotaxis. |
|
Inhibición del contacto intercelular. |
|
Inhibición de la señalización intracelular. |
|
Inhibición de la adhesión leucocitaria. |
|
Inhibición de las tirosinas-cinasas. |
|
Inhibición de la expresión génica del NFgB. |
|
Inhibición de la expresión de la interleucina-1. |
|
Inhibición de la producción de metaloproteinasas. |
|
Inhibición de la síntesis de monofosfato de desoxiuridina. |
|
Inhibición de la síntesis de pirimidinas. |
Guías de práctica clínica y recomendaciones
Las guías de práctica clínica (GPC), según la definición del Institute of Medicine (IOM) en 2011, son un conjunto de recomendaciones basadas en una RS de la evidencia y en la evaluación de los riesgos y beneficios de las diferentes alternativas con el objetivo de optimizar la atención sanitaria de los pacientes9.
Según Guía Salud10, las GPC tienen como objetivo establecer un conjunto de recomendaciones basadas en la evidencia científica para mejorar y optimizar el cuidado del paciente y promover la racionalidad y la eficiencia en la elección de las diferentes opciones terapéuticas, así como reducir la variabilidad regional entre distintos patrones de asistencia. La implementación de las GPC ayuda a que las decisiones clínicas sean más eficientes y seguras, aumenta la calidad de la atención y favorece el uso adecuado de los recursos de salud11,12.
Las GPC deben basar sus recomendaciones en la mejor evidencia disponible, por lo que es necesario jerarquizarla para decidir si hay que implementar un determinado tratamiento, procedimiento o intervención. Las GPC establecen recomendaciones basadas en RS y MA estableciendo grados de recomendación (GR) y niveles de evidencia (NE)13.
Los NE pueden oscilar entre estudios de máxima calidad y estudios de calidad más débil. Nos ayudan a valorar la calidad y validez de la evidencia disponible para la práctica. Los NE y los GR permiten categorizar los estudios según su mayor o menor riesgo de presentar sesgos dado un determinado diseño. Existen muchos sistemas para clasificar la calidad de la evidencia y la fuerza de las recomendaciones13,14. Uno de los sistemas más utilizados son los NE del Centro Oxford para la Medicina Basada en la Evidencia (OCEBM, Centre for Evidence-Based Medicine, Oxford)15 (Tabla 2).
Los NE de Oxford fueron diseñados para que, además de la valoración crítica tradicional, pudieran utilizarse como una heurística que clínicos y pacientes pudiesen responder a preguntas clínicas. Este sistema, además de efectos terapéuticos y de seguridad, permite valorar la evidencia
Tabla 2. Grados de recomendación y niveles de evidencia del Centre for Evidence-Based Medicine (CEBM).
|
Grado de la recomendación |
Nivel de evidencia |
Tratamiento, prevención, etiología y complicaciones |
Pronóstico |
Diagnóstico |
Análisis económico y análisis de decisiones |
|
A |
1a |
RS de ECA (con homogeneidad). |
RS (con homogeneidad) de estudios de cohortes; CDR validadas en diferentes poblaciones. |
RS (con homogeneidad) de estudios de diagnóstico de nivel 1; CDRT con estudios 1b de diferentes centros clínicos. |
RS (con homogeneidad) de estudios económicos de nivel 1. |
|
1b |
Un ECA (con intervalo de confianza estrecho). |
Un estudio de cohortes con seguimiento >80%; CDR validada en una sola población. |
Estudios de cohortes que validen la calidad de una prueba especifica, con unos buenos estándares de referencia; o CDR probadas en un solo centro clínico. |
Análisis basados en los costes clínicos o en sus alternativas; RS de la evidencia; e inclusión de análisis de sensibilidad de múltiples vías. |
|
Grado de la recomendación |
Nivel de evidencia |
Tratamiento, prevención, etiología y complicaciones |
Pronóstico |
Diagnóstico |
Análisis económico y análisis de decisiones |
|
1c |
Todos o ninguno. |
Series de casos (todos o ninguno). |
Pruebas diagnósticas con especificidad tan alta que un resultado positivo confirma el diagnóstico y con sensibilidad tan alta que un resultado negativo descarta el diagnóstico. |
Análisis en términos absolutos de riesgos y beneficios clínicos: claramente tan buenas o mejores, pero más baratas, claramente tan malas o peores, pero más caras. | |
|
B |
2a |
RS (con homogeneidad) de estudios de cohortes. |
RS (con homogeneidad) de estudios de cohortes retrospectivos o de ECA con grupos control no tratados. |
RS (con homogeneidad) de estudios de diagnóstico de nivel >2. |
RS (con homogeneidad) de estudios económicos de nivel >2. |
|
2b |
Un estudio de cohortes (incluyendo ECA de baja calidad; p.ej. seguimiento <80%). |
Estudio de cohortes retrospectivo o seguimiento de controles no tratados en un ECA; derivación de una CDR o CDR validada solo en una muestra aislada. |
Estudios exploratorios de cohortes con buenos estándares de referencia; CDR tras derivación, o validada solo en una muestra aislada o en bases de datos. |
Análisis basados en costes clínicos o en sus alternativas; revisiones sistemáticas con evidencia limitada; estudios individuales; e inclusión de análisis de sensibilidad de múltiples vías. | |
|
2c |
Investigación de resultados en salud; estudios ecológicos. |
Investigación de resultados en salud. |
Auditoria de resultados en salud. | ||
|
3a |
RS (con homogeneidad) de estudios de casos controles. |
RS (con homogeneidad) de estudios 3b y mejores. |
RS (con homogeneidad) de estudios 3b y mejores. | ||
|
3b |
Un estudio de casos-controles. |
Estudio no consecutivo; o en el que el estándar de referencia no se aplica a todos los pacientes del estudio. |
Análisis sin medidas de coste precisas, pero incluyendo un análisis de sensibilidad que incorpora variaciones clínicamente sensibles en las variables importantes. | ||
|
C |
4 |
Series de casos (y estudios de cohortes y de casos-controles de baja calidad). |
Series de casos (y estudios de cohortes de pronóstico, de baja calidad). |
Estudios de casos- controles con estándares de referencia de poca calidad o no independientes. |
Análisis que no incluye análisis de la sensibilidad. |
|
D |
5 |
Opinión de expertos sin valoración critica explicita, ni basada en fisiología, ni en investigación juiciosa ni en los principios fundamentales. |
Opinión de expertos sin valoración critica explicita, ni basada en fisiología, ni en investigación juiciosa ni en los principios fundamentales. |
Opinión de expertos sin valoración critica explícita, ni basada en fisiología, ni en investigación juiciosa ni en los principios fundamentales. |
Opinión de expertos sin valoración critica explícita, o basada en la teoría económica o en los principios fundamentales. |
|
D |
5 |
Opinión de expertos sin valoración critica explicita, ni basada en fisiología, ni en investigación juiciosa ni en los principios fundamentales. |
Opinión de expertos sin valoración critica explicita, ni basada en fisiología, ni en investigación juiciosa ni en los principios fundamentales. |
Opinión de expertos sin valoración critica explícita, ni basada en fisiología, ni en investigación juiciosa ni en los principios fundamentales. |
Opinión de expertos sin valoración critica explícita, o basada en la teoría económica o en los principios fundamentales. |
CDR: cantidad diaria recomendada; ECA: ensayo clínico aleatorizado; RS: revisión sistemática.
para la prevalencia, la precisión de las pruebas diagnósticas, el pronóstico, los efectos terapéuticos, los daños poco frecuentes, los daños frecuentes y la utilidad del cribado (precoz). Otro sistema de jerarquización fue el utilizado por la Scottish Intercollegiate Guidelines Network (SIGN). Las recomendaciones y NE de SIGN se basaban en RS de la literatura científica y ponen el foco en los tratamientos. El SIGN decidió cambiar en el año 2009 y, desde entonces, aplica el enfoque del sistema GRADE (Grades of Recommendation, Assessment, Development, and Evaluation) en su metodología de elaboración de GPC16.
El sistema GRADE17 ha elaborado y refinado un método para evaluar la calidad de la evidencia y la fuerza de las recomendaciones, que ha sido adoptado por múltiples organizaciones, como la Organización Mundial de la Salud (OMS), el Grupo de Colaboración Cochrane y el National Institute for Health and Clinical Excellence (NICE), entre otros. La metodología GRADE establece criterios unificados y transparentes con el objetivo de graduar la certeza de la evidencia y la fuerza de las recomendaciones. Incluye valoraciones sobre la certeza de la evidencia y la fortaleza de las recomendaciones sobre intervenciones, pruebas diagnósticas y modelos pronósticos. Las principales aportaciones del sistema GRADE respecto a otros sistemas previos son las siguientes:
- La evaluación de la calidad de la evidencia se centra en el análisis de cada desenlace de interés por separado, los cuales habría priorizado previamente el grupo de trabajo en la fase de formulación de preguntas clínicas.
- Se amplía la habitual evaluación del riesgo de sesgo a otros factores, como, por ejemplo, la consistencia de los resultados o su precisión.
- Se separa de forma explícita la definición de la calidad de la evidencia y de la fuerza de las recomendaciones18.
El sistema GRADE se está imponiendo actualmente en la mayoría de las GPC. Elabora recomendaciones de forma sistemática, transparente y reproducible (Tabla 3).
Tabla 3. Clasificación de calidad de evidencia GRADE.
|
Alta |
Confianza alta en que el estimador del efecto disponible en la literatura científica se encuentra muy cercano al efecto real. |
|
Moderada |
Es probable que el estimador del efecto se encuentre cercano al efecto real, aunque pueden existir diferencias sustanciales. |
|
Baja |
El estimador del efecto puede ser sustancialmente diferente al efecto real. |
|
Muy baja |
Es muy probable que el efecto sea sustancialmente diferente al efecto real. |
Las RS y los MA son fundamentales para la elaboración de recomendaciones de los documentos de recomendaciones y de las GPC. El número de RS y MA publicados ha aumentado exponencialmente en las últimas décadas. Esta producción masiva de revisiones es en algunos casos innecesaria, y a veces pueden ser conflictivas; de hecho, en ocasiones, hay RS y/o MA sobre el mismo tema cuyos resultados son diferentes19.
En los últimos años, distintas sociedades científicas tanto nacionales como internacionales han desarrollado múltiples documentos de recomendaciones (GPC y consensos) en relación con enfermedades reumáticas20.
De manera ideal, las recomendaciones deberían basarse en el máximo NE, sin embargo, muchas no lo tienen y, a veces, están basadas únicamente en la “opinión del experto”. Así, muchas recomendaciones con bajo NE siguen presentes en estos documentos durante muchos años, sin que dicho nivel se haya modificado. Un reciente estudio evaluó este aspecto con el objetivo de identificar esas lagunas de conocimiento en la AR, a través de las recomendaciones con bajo NE de las principales GPC y documentos de consenso. En este estudio, se revisaron un total de 14 GPC y consensos publicados entre 2011 y 2019. La revisión de estos consensos y GPC puso de manifiesto que, muchas recomendaciones estaban basadas en NE bajos, siendo las recomendaciones relacionadas con el tratamiento las más numerosas. Asimismo, muchas de las recomendaciones se repetían a lo largo del tiempo sin modificar su NE y, en algunos casos, existían recomendaciones de bajo grado en las que no se habían realizado RS. Los autores indican que las GPC son herramientas importantes para: proporcionar una buena atención sanitaria basada en la evidencia, minimizar la variación y reducir los costes, pero no se debe permitir que se conviertan en una verdad indiscutible, por lo que se deben evaluar de una forma crítica. Este estudio pone de manifiesto que las recomendaciones en AR pueden mejorarse en cuanto a su enfoque o proceso de desarrollo y también con relación a la evidencia en la que se basan20.
Leflunomida en las guías de práctica clínica y recomendaciones
Leflunomida en la Guía de Práctica Clínica para el Manejo de los Pacientes con Artritis Reumatoide de la Sociedad Española de Reumatología
En el año 1998, la Sociedad Española de Reumatología (SER) se propuso elaborar una GPC de AR para ayudar a los médicos en la toma de decisiones en el diagnóstico y tratamiento de la AR. Esta GPC se publicó por primera vez en 200121, y ha sido actualizada posteriormente en 2007, 2011, 2017 y 201822.
En la primera Guía de Práctica Clínica para el Manejo de los Pacientes con Artritis Reumatoide (GUIPCAR) de la SER publicada en 2001, se utilizaron las escalas de Jadad y Hadorn para evaluar las recomendaciones23,24.
En las recomendaciones sobre el tratamiento inicial, se indicaba que: “Todos los pacientes deben ser tratados con un FAMEs tan pronto como se establezca el diagnóstico de la enfermedad”, y también que “el tratamiento inicial recomendado en todos los pacientes que no hubieran sido tratados anteriormente con ningún FAMEs es el MTX, por su perfil de eficacia, no obstante, se considera aceptable el uso de otros fármacos como tratamiento inicial en función de la clasificación clínica de la enfermedad”.
Se indicaba, por otra parte, que la LEF no ha mostrado diferencias en cuanto a eficacia comparada con el MTX y la SSZ (evidencia A1). Asimismo, la LEF se elegía como la principal alternativa terapéutica, tanto en caso de necesidad de suspender el tratamiento por efectos adversos como en caso de fallo de respuesta inadecuada al tratamiento inicial.
Para la actualización de GUIPCAR de 2007, y a diferencia de la primera GUIPCAR de 2001, se realizaron RS que sirvieron para asignar un nivel de recomendación y de graduación de las recomendaciones de la guía. Esta graduación se realizó siguiendo los NE del OCEBM15.
Se llevaron a cabo dos RS en las que se evaluaba el uso de LEF:
- Una RS que valoraba la eficacia comparada de los diferentes FAMEs en monoterapia y en combinación. Se concluía que LEF en monoterapia era tan eficaz como MTX (NE 1b) y ciclosporina A (NE 2b), y que LEF es más eficaz clínicamente que SSZ, aunque sin diferencias a nivel radiológico (NE 1b). En esta actualización, en relación con la persistencia de utilización (no abandono) de los diferentes tratamientos con FAMEs, especialmente en la AR avanzada, se indicaba que la LEF presentaba una elevada persistencia (NE 1b). Se mantenía, aunque con ciertos cambios, el posicionamiento del uso de LEF que se recomendaba en la GUIPCAR inicial: “En caso de respuesta insatisfactoria a MTX, alcanzadas las dosis máximas y asegurada la biodisponibilidad del agente, el panel recomienda utilizar LEF o SSZ o un agente antifactor de necrosis tumoral (anti-TNF) como segundo escalón terapéutico, en terapia de sustitución o en adición al MTX”. En caso de toxicidad relevante al MTX que obligue a su suspensión, el panel recomienda utilizar LEF o SSZ o un agente anti-TNF como segundo escalón terapéutico (NE 5, GR D).
- Otra RS evaluó la eficacia de la combinación de terapias biológicas con FAMEs distintos a MTX. Esta RS concluía que “la combinación de infliximab y otro fármaco modificador de enfermedad distinto a MTX (LEF, azatioprina o ciclosporina A) puede ser de eficacia comparable a la de las combinaciones que incluyen MTX (GR4)”. Estas combinaciones pueden estar limitadas por la presencia de considerables efectos adversos, particularmente con infecciones graves. La combinación con LEF, además de a infecciones, puede asociarse con la aparición de reacciones cutáneas y vasculitis (GR 4).
En la siguiente actualización, en 2011, se utilizaron los mismos criterios para evaluar la evidencia que en la de 2007. Se mantenía como fármaco de primera elección el MTX, pero se establecía una recomendación en la que se indicaba: “No obstante, dada la complejidad clínica de la AR, el panel considera que, en algunas situaciones clínicas, el tratamiento inicial con fármacos modificadores de enfermedad puede consistir en la utilización de otros fármacos que también han demostrado su capacidad de controlar los síntomas y signos de la enfermedad, así como de retrasar la progresión radiológica (NE 5, GR D)”.
Se actualizó la RS que evaluaba la eficacia comparada de los diferentes FAMEs en monoterapia y en combinación, manteniéndose que LEF en monoterapia es tan eficaz como MTX (1b) y que LEF es más eficaz clínicamente que SSZ, aunque sin beneficios a nivel radiológico (1b).
Respecto a los cambios en el tratamiento, se realizó una recomendación que indicaba: “En caso de respuesta insatisfactoria a MTX, alcanzadas las dosis máximas y asegurada la biodisponibilidad del agente, el panel recomienda utilizar LEF o SSZ o un agente anti-TNF como segundo escalón terapéutico, en terapia de sustitución o en adición al MTX. En caso de toxicidad relevante al MTX que obligue a su suspensión, el panel recomienda utilizar LEF o SSZ o un agente anti-TNF como segundo escalón terapéutico (NE 5)”, que permanecía sin cambios respecto a la recomendación de 2007.
Se realizó también una RS para evaluar la eficacia de los agentes biológicos: anti-TNF (infliximab, etanercept, adalimumab), anakinra, abatacept y rituximab. Respecto a LEF, se indicaba que el tratamiento con rituximab parece más eficaz si se combina con MTX y otros fármacos modificadores de enfermedad, especialmente LEF (NE 2b). Se realizó otra RS para evaluar la eficacia de las terapias biológicas con FAMEs distintos a MTX, que concluyó que la combinación de infliximab y LEF (NE 1b) y de adalimumab, etanercept y LEF (NE 1c) puede ser de una eficacia comparable a las combinaciones que incluyen MTX.
En la actualización de 2017, se sigue manteniendo en el algoritmo de tratamiento a la LEF como la primera alternativa de tratamiento en caso de contraindicación a MTX. Por otra parte, se realizó una nueva RS en 2017 que evaluó el NE, empleando la modificación de los NE del SIGN25 para contestar a la siguiente pregunta: “En pacientes con AR, ¿cuál es la eficacia de la combinación de cualquier FAME biológico (FAMEb) con otro FAMEs distinto a MTX?”. La RS llegó a las siguientes conclusiones:
- La combinación de anti-TNF + LEF resulta igual de efectiva que la combinación de antiTNF + MTX valorada por: el índice de actividad de la enfermedad con recuento de 28 articulaciones (DAS28, Disease Activity Score 28), la discapacidad funcional mediante el cuestionario de evaluación de la salud (HAQ, Health Assessment Questionnaire), la respuesta en la escala del American College of Rheumatology (ACR), la respuesta según los criterios de la EULAR (European League Against Rheumatism, Alianza Europea de Asociaciones de Reumatología) y la progresión radiográfica.
- La combinación de rituximab + LEF resulta igual o más efectiva que la combinación de rituximab + MTX valorada por: DAS28: 180; y más efectiva valorada por HAQ y la respuesta EULAR.
- La combinación de tocilizumab + LEF resulta igual de efectiva que la combinación de tocilizumab + MTX en términos de: DAS28, HAQ, ESR y CRP. En esta RS se basa la recomendación realizada en relación con el tratamiento con el primer FAMEb o FAME dirigido (FAMEts) que indica: “En los pacientes con AR e indicación de tratamiento biológico que presentan contraindicación o intolerancia a MTX, se aconseja LEF en combinación con terapia biológica” (GR B).
Leflunomida en las recomendaciones de la EULAR
Las primeras recomendaciones publicadas sobre AR datan del 2007. Dichas recomendaciones versaban sobre el manejo de la artritis precoz, que posteriormente fueron actualizadas en 201726,27.
En la primera recomendación de 2007, se indicaba que: “la LEF tiene eficacia clínica similar al MTX en la AR establecida y la AR de reciente comienzo (categoría Ia) y la LEF es tan eficaz como el MTX para frenar el daño radiográfico”.
En la recomendación número 9, se indicaba que: “entre los FAMEs, el MTX se considera el fármaco de elección, y debe utilizarse en primer lugar en pacientes con riesgo de desarrollar enfermedad persistente”, considerando a la LEF, y en menor medida a la SSZ, como las mejores alternativas.
En la actualización de 2017, la recomendación número 5 dice que: “entre los FAMEs, el MTX se considera el fármaco de referencia y, a menos que esté contraindicado, debe formar parte de la primera estrategia de tratamiento en pacientes con riesgo de enfermedad persistente”. Esta recomendación (antes número 9) se mantiene prácticamente sin cambios.
Por otra parte, en el año 2010, se publicaron las primeras recomendaciones de la EULAR para el tratamiento de la AR28. La categorización de la evidencia y la fuerza de la recomendación se determinaron de acuerdo con las normas del OCEBM15.
La recomendación número 4 indicaba: “Cuando existen contraindicaciones (o intolerancia) al MTX, deben considerarse los siguientes FAMEs como parte de la primera estrategia de tratamiento: LEF, SSZ u oro inyectable” (NE 1a, GR A). Esta recomendación se basaba en una RS y un MA encargados por EULAR para valorar la eficacia y la seguridad de todos los FAMEs en AR29.
En el cuerpo del texto, se indicaba que no existían datos suficientes que indicasen que LEF, SSZ o las sales de oro intramusculares fuesen inferiores al MTX, pero, debido a la gran cantidad de datos sobre eficacia y seguridad disponibles para el MTX, los tres FAMEs mencionados deberían utilizarse en lugar del MTX como primer FAMEs solo si existieran contraindicaciones (o intolerancia) al MTX.
En la recomendación número 7, se indica: “Si no se alcanza el objetivo del tratamiento con la primera estrategia de FAMEs, debe considerarse la adición de un FAMEb cuando existan factores de mal pronóstico; en ausencia de factores de mal pronóstico, debe considerarse el cambio a otra estrategia de FAMEs” (NE5, GR D), por lo tanto, la LEF podría considerarse en caso de fallo a un primer FAMEs si no existen factores de mal pronóstico.
Y por último, la recomendación número 8 decía: “En pacientes que responden insuficientemente al MTX y/o a otros FAMEs con o sin glucocorticoides, deben iniciarse FAMEb (NE 1b, GR A); la práctica actual sería iniciar un inhibidor del TNF (adalimumab, certolizumab, etanercept, golimumab, infliximab) (NE 4, GR B), que debe combinarse con MTX (NE1b, GRA)”, ya que la combinación es más eficaz que la monoterapia con la mayoría de los agentes biológicos.
Posteriormente se han publicado actualizaciones de estas recomendaciones en 2013, 2016, 2019 y 202230-33, y en todas se siguió utilizando la categorización de la evidencia y la fuerza de la recomendación de acuerdo con las normas del OCEBM15. Se realizaron RS de la evidencia para cada una de estas recomendaciones34-37.
En las recomendaciones de 201330, la número 4 pasa a ser la 5, y el texto no cambia esencialmente: “En caso de contraindicación (o intolerancia precoz) al MTX, debe considerarse la SSZ o la LEF como parte de la primera estrategia de tratamiento” (NE 1a, GR A). La recomendación número 8 (en el documento de 2010 era la recomendación 7) permanece sin cambios: “Si no se alcanza el objetivo de tratamiento con la primera estrategia de FAMEs, en ausencia de factores de mal pronóstico, debe considerarse el cambio a otra estrategia de FAMEs; cuando existan factores de mal pronóstico, debe considerarse la adición de un FAMEb” (NE 5, GR D). En la recomendación número 9 (previamente era la 8), con relación a los FAME, se indica que: “los FAMEb deberían utilizarse preferentemente en combinación con MTX u otros FAMEs (NE 1b, GR A)”.
En las recomendaciones de 201631, no hay cambios respecto a la recomendación número 5. Se hace una recomendación única para pacientes que no alcanzan el objetivo en ausencia de factores de mal pronóstico, la recomendación 7: “Si no se alcanza el objetivo de tratamiento con la primera estrategia de FAMEs en ausencia de factores de mal pronóstico, deben considerarse otros FAMEs (NE 5, GR D)”. En la recomendación previa número 8 (que pasa en el actual a la 9), sí existen cambios, ya que se indica: “Los FAMEb y FAMEts deben combinarse con un FAMEs; en pacientes que no pueden utilizar FAMEs como comedicación, los inhibidores de la vía de la IL-6 y los FAMEts pueden tener algunas ventajas en comparación con otros FAMEb (NE FAMEb 1a, GR A/FAMEts NE 1b, GR A)”. En el cuerpo del texto de la recomendación, se indica que la mayoría del grupo de trabajo consideró que los FAMEb y FAMEts deberían ser principalmente combinados con FAMEs, como MTX o LEF, dejando la opción de la monoterapia, con preferencia por determinados fármacos, como excepción en caso de intolerancia o contraindicación a todos los FAMEs NE 1a, 1b; G acuerdo 9.2.
En las recomendaciones de 201932, las recomendaciones 5, 7 y 9 no cambian. En la agenda de estas recomendaciones se plantea la pregunta: “¿Es la LEF equivalente al MTX como tratamiento de primera línea con FAMEs?”. Actualmente hay un protocolo para intentar responderla38.
La última actualización de las recomendaciones EULAR se llevó a cabo en 202233, y no se realiza ningún cambio sobre las recomendaciones de 2019, manteniéndose en la agenda de investigación la misma pregunta sobre la equivalencia de MTX y LEF.
Leflunomida en las guías del Colegio Americano de Reumatología
La primera guía del ACR se publicó en 1996 con actualizaciones posteriores en 2008, 2012, 2025 y 202239-44.
En la primera guía de 1996, no se incorpora la LEF, ya que todavía no había sido comercializada, por lo que no está incluida en las recomendaciones.
En las guías de 200841, se realizaron las recomendaciones utilizando el método modificado de investigación y desarrollo creado por un grupo de investigadores de la RAND Corporation y la Universidad de California en Los Ángeles (RAND/UCLA)45, y se evaluó la calidad de los ECA según la escala de Jadad24 y la escala de Ottawa para los estudios observacionales46.
En relación al uso de LEF, se realiza la siguiente recomendación: “Se recomienda el inicio de monoterapia con MTX o LEF en pacientes con cualquier duración de la enfermedad y cualquier grado de actividad de la enfermedad, independientemente de las características de mal pronóstico (MTX, evidencia de nivel A/B para un mal pronóstico, actividad elevada de la enfermedad, actividad moderada de la enfermedad, corta duración; para la LEF, pruebas de nivel A de mal pronóstico, actividad de la enfermedad, mayor duración de la enfermedad)”.
También se realizó otra recomendación: “MTX más LEF para pacientes con enfermedad de duración intermedia o prolongada (seis meses), independientemente de los factores pronósticos, siempre que la actividad de la enfermedad fuera elevada (NE B para enfermedad de mayor duración, con características de mal pronóstico”.
En esta guía, también se incluyen múltiples recomendaciones para la monitorización del uso de FAMEs, incluida la LEF.
En 201242, se utilizó el mismo sistema para las recomendaciones que en la guía de 2008. Se actualizaron las RS de la guía previa. Respecto a las recomendaciones: en AR temprana (duración de la enfermedad de seis meses), se indicaba: “En pacientes con AR temprana, se recomienda la monoterapia con FAMEs para la actividad baja, moderada o alta de la enfermedad en ausencia de características de mal pronóstico (NE A-C). En pacientes con AR temprana, con actividad moderada o alta de la enfermedad y con factores de mal pronóstico el panel recomienda el uso de terapia combinada con FAMEs (incluyendo terapia doble y triple) (NE A-C). Los FAMEs incluidos son MTX, hidroxicloroquina [HCQ], LEF, SSZ y minociclina. Se puntualiza indicando que monoterapia con FAMEs se refiere al tratamiento en la mayoría de los casos con HCQ, LEF, MTX o SSZ. Cuando se habla de terapia combinada con dos FAMEs, esta suele basarse en MTX, con algunas excepciones (por ejemplo, MTX + HCQ, MTX + LEF, MTX + SSZ y SSZ + HCQ), y terapia triple (MTX + HCQ + SSZ). Con relación al inicio o cambio de tratamiento se realizó la siguiente recomendación: “Si después de 3 meses de monoterapia con FAMEs (en pacientes sin características de mal pronóstico), el paciente pasa de una actividad de la enfermedad baja a moderada/ alta, debe añadirse MTX, HCQ o LEF (nivel de evidencia A y B). En pacientes con baja actividad y factores de mal pronostico o en pacientes con actividad moderada o alta, si tras tres meses de MTX o de una combinación de MTX y FAMEs, el paciente sigue presentando una actividad moderada o alta de la enfermedad, debe añadirse otro FAME o cambiarse a otro FAMEs sin MTX (NE B y C). Cuando se habla de FAMEs, se refiere al tratamiento con HCQ, LEF, MTX o SSZ.
Las recomendaciones de 2015 se realizaron siguiendo el proceso de desarrollo de directrices del ACR47. Este proceso incluye la metodología GRADE48-51. En esta guía, se hacen recomendaciones para el tratamiento de pacientes con AR temprana y para pacientes con AR establecida. En los pacientes con AR temprana, las recomendaciones son las siguientes:
- Recomendación 2: “Si la actividad es baja en pacientes que nunca han usado FAMEs, se recomienda FAMEs en monoterapia (preferentemente MTX) sobre doble terapia (NE bajo), del mismo modo, se recomienda FAMEs en monoterapia (preferentemente MTX) sobre triple terapia (NE bajo); en ambas, GR fuerte”.
- Recomendación 3: “En caso de actividad moderada o alta en pacientes que nunca han recibido terapia con FAMEs, se recomienda FAMEs en monoterapia sobre doble terapia (NE moderado), asimismo se recomienda FAMEs en monoterapia sobre triple terapia (NE alto) (en ambas, GR condicional)”.
- Recomendación 4: En caso de actividad moderada o alta de la enfermedad a pesar del tratamiento con FAMEs (con o sin glucocorticoides), se recomienda FAMEs en combinación con anti-TNF o un fármaco biológico no anti-TNF (con o sin MTX), sin orden de preferencia, en lugar de continuar con FAMEs en monoterapia (NE bajo, GR fuerte). Al hablar de FAMEs, se incluyen MTX, LEF, HCQ y SSZ.
Las recomendaciones de 2015 en el caso de la AR establecida que hacen referencia a LEF son las siguientes:
- Recomendación 2: “En pacientes con actividad baja que nunca han utilizado FAMEs, se recomienda FAMEs en monoterapia (preferentemente MTX) sobre anti-TNF (NE bajo, GR fuerte)”.
- Recomendación 3: “En pacientes con actividad moderada-alta que nunca han utilizado FAMEs, se recomienda FAMEs en monoterapia (preferentemente MTX) sobre tofacitinib (NE alto) o FAMEs en monoterapia (preferentemente MTX) sobre combinación con FAME (NE moderado, recomendación condicional en ambos casos)”.
- Recomendación 4: “Si persiste una actividad moderada/alta a pesar de FAMEs en monoterapia, se debe utilizar FAMEs en combinación, o añadir anti-TNF, o añadir biológico no anti-TNF, o añadir tofacitinib (todas las opciones con o sin MTX) sin orden de preferencia (NE moderado o muy bajo, recomendación fuerte).
- Recomendación 5: “Si la actividad se mantiene moderada/alta a pesar de tratamiento con anti-TNF y los pacientes no están recibiendo FAMEs, se debe añadir uno o dos FAMEs en vez de continuar solo con anti-TNF (NE alto)”.
En 202141, las recomendaciones se realizaron siguiendo la misma metodología que en 2015, con alguna actualización de la metodología GRADE52,53. Las recomendaciones se limitan a los FAMEs aprobados por la Food and Drug Administration (FDA) para el tratamiento de la AR: HCQ, SSZ, MTX y LEF. En el caso de la AR temprana, las recomendaciones son:
- “En pacientes sin tratamiento previo con FAMEs y con baja actividad de la enfermedad, el MTX se recomienda condicionalmente sobre la LEF (NE muy baja). En pacientes sin FAMEs previo y con actividad moderada/alta de la enfermedad, MTX se recomienda condicionalmente sobre la LEF (NE baja).
- En el texto de la recomendación, se indica que, a pesar de las pruebas de eficacia comparable, se prefiere MTX a LEF, debido a la evidencia que apoya su mayor valor en tratamientos combinados, así como por su mayor flexibilidad posológica y su menor coste.
- Otra recomendación hace referencia a la terapia combinada, e indica: “La monoterapia con MTX se recomienda condicionalmente sobre la combinación de MTX más un FAMEs o FAMEts. En el texto, se afirma que la certeza de la evidencia es alta para la combinación de MTX más anti-TNF y moderada para otros FAMEs.
Leflunomida en otras guías
Guía del National Institute for Health and Care Excellence
La guía del NICE53 realiza las siguientes recomendaciones en relación con el uso de LEF:
- En AR de reciente comienzo, se recomienda monoterapia con FAMEs: MTX oral, LEF o SSZ lo antes posible, idealmente en los tres meses siguientes al inicio de los síntomas persistentes.
- Utilizar FAMEs adicionales en combinación (MTX oral, LEF, SSZ o HCQ) en una estrategia escalonada si el objetivo del tratamiento (remisión o baja actividad de la enfermedad) no se ha alcanzado a pesar de la escalada de dosis.
- La evidencia procedente de ECA en personas que nunca habían recibido un FAMEs no mostró diferencias consistentes en la eficacia de MTX, LEF y SSZ. El comité acordó que cualquiera de estos fármacos puede utilizarse como tratamiento de primera línea, ya que los fármacos tenían costes similares.
Agencia Canadiense de Medicamentos y Tecnologías Sanitarias
La Agencia Canadiense de Medicamentos y Tecnologías Sanitarias (CADTH, Canadian Agency for Drugs and Technologies in Health) es una organización independiente sin ánimo de lucro encargada de proporcionar a los responsables sanitarios canadienses pruebas objetivas que les ayuden a tomar decisiones informadas sobre el uso óptimo de medicamentos y productos sanitarios en el sistema de salud. En 2021, reviso nueve guías de tratamiento de AR54. Solo se hará referencia a las recomendaciones de la Sociedad Francesa de Reumatología (SFR, Société Française de Rhumatologie), la Sociedad Brasileña de Reumatología (SBR, Sociedade Brasileira de Reumatologia) y la Liga de Asociaciones de Reumatología de Asia Pacífico (APLAR, Asia Pacific League of Associations for Rheumatology), ya que el resto de las recomendaciones ya han sido comentadas anteriormente.
Respecto a las recomendaciones sobre LEF, en 2019, la SFR55 realiza dos recomendaciones:
- “En pacientes sin FAMEs que presentan contraindicaciones o intolerancia precoz a MTX, LEF y SSZ, son buenas alternativas (NE 1a, GR A)”.
- “En pacientes con una respuesta inadecuada o intolerancia al MTX, debe optimizarse el tratamiento. En pacientes sin factores de mal pronóstico, puede considerarse el cambio a otro FAMEs (LEF o SSZ) o la combinación de varios FAMEs; si esta estrategia fracasa o está contraindicada, debe considerarse la terapia dirigida (con un FAMEb o FAMEts)” (NE 1b, GR A).
La SBR56 propone las siguientes recomendaciones:
- “Puede utilizarse la combinación de dos o más FAMEs, incluido el MTX, como primera línea de tratamiento”. Existe evidencia de alta a moderada que sugiere que la terapia triple con MTX + SSZ + HCQ y MTX + LEF en comparación con la monoterapia con MTX presenta una mejor respuesta. Hay evidencia moderada/baja que sugiere que no hubo diferencias clínicamente significativas con el MTX solo o en combinación en otras actividades de la enfermedad, la progresión radiográfica y la seguridad terapéutica.
- “Tras el fracaso del tratamiento de primera línea con MTX, se pueden utilizar estrategias terapéuticas que incluyan la combinación de MTX con otro FAMEs (LEF), con dos FAMEs (HCQ y SSZ), o el cambio de MTX por otro FAME (LEF o SSZ) en monoterapia”. Hay evidencia moderada/baja que sugiere que las terapias de combinación con MTX pueden proporcionar una mejor respuesta sin diferencias significativas en la progresión radiográfica o en los acontecimientos adversos.
Respecto a las recomendaciones de la APLAR57, se indica:
- “Los pacientes que no toleran MTX pueden recibir otros FAMEs como LEF o SSZ como tratamiento de primera línea”.
- Otra recomendación dice que: “En los pacientes con elevada actividad de la enfermedad, debe considerarse el tratamiento combinado con FAMEs, con un estrecho seguimiento de las toxicidades relacionadas con el tratamiento”. Esta recomendación se basó en ECA de terapia combinada. Cuatro ECA demostraron que la triple terapia era más eficaz que la monoterapia, pero se acompañaba de una mayor hepatotoxicidad. Otros siete ECA que analizaron terapia doble o triple frente a la monoterapia tuvieron resultados similares. Una revisión Cochrane anterior de 2002 también demostró una mayor eficacia del tratamiento combinado en comparación con la monoterapia.
Los principales mensajes del informe de esta agencia de revisiones de tecnologías fueron que la monoterapia con MTX fue el FAMEs más recomendado como tratamiento de primera línea por las guías incluidas. En ocho de las recomendaciones, se recomienda el tratamiento combinado con múltiples FAMEs si la monoterapia no es eficaz.
Conclusiones
- La LEF en monoterapia ha demostrado en ECA y en RS y MA ser segura, eficaz, inhibir la progresión radiográfica y mejorar la calidad de vida en pacientes con AR5-8. También ha demostrado eficacia en combinación con MTX41.
- En las recomendaciones de AR precoz26,27, se afirma que LEF tiene eficacia clínica similar al MTX en la AR establecida y la AR de reciente comienzo. También señala que la LEF es tan eficaz como el MTX para frenar el daño radiográfico.
- En la mayoría de las GPC, se posiciona como la alternativa principal al MTX en caso de contraindicación o intolerancia al mismo. En las dos últimas recomendaciones de la EULAR32,33, se ha planteado en la agenda de investigación la siguiente pregunta: “¿Es la LEF equivalente al MTX como tratamiento de primera línea con FAMEs?”. Y actualmente hay un protocolo en marcha para intentar darle respuesta38.
- En la guía del NICE53, sin embargo, se indica que, en AR de reciente comienzo, se recomienda monoterapia con FAMEs: MTX oral, LEF o SSZ lo antes posible, idealmente en los tres meses siguientes al inicio de los síntomas persistentes, sin posicionar a un fármaco delante de otro. Hace además la puntualización de que no existe evidencia procedente de ECA, en pacientes con AR que no hayan recibido un FAMEs, de que existan diferencias consistentes en la eficacia de MTX. LEF y SSZ, por lo que afirma que cualquiera de estos fármacos puede utilizarse como tratamiento de primera línea, ya que todos tenían costes similares.
- Por otra parte, la combinación de MTX + LEF también ha demostrado eficacia en pacientes con AR, y se posiciona en distintas GPC como alternativa cuando existe un fallo a FAMEs en monoterapia42,44,45,53,55-57.
- Por lo tanto, LEF es una buena alternativa para el tratamiento de pacientes con AR precoz o establecida, tanto en monoterapia como en terapia combinada, fundamentalmente con MTX.

Dr. Jesús Tornero
Servicio de Reumatología. Hospital General Universitario de Guadalajara Departamento de Medicina y Especialidades Médicas. Universidad de Alcalá. Madrid
Contenido mínimo de AravaTM
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
Arava 10 mg comprimidos recubiertos con película. Envase de 30 comprimidos (CN: 848093.7); P.V.P: 25,92€. P.V.P IVA: 26,96€. Medicamento sujeto a prescripción médica. Diagnóstico hospitalario. Financiado por el SNS. Aportación reducida. Con visado de inspección.
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
Arava 20 mg comprimidos recubiertos con película. Envase de 30 comprimidos (CN: 8481354); P.V.P:
51,85€. P.V.P IVA: 53,92€. Envase de 100 comprimidos (CN: 7274797); P.V.P: 161,04€. P.V.P IVA: 167,48€. Medicamento sujeto a prescripción médica. Diagnóstico hospitalario. Financiado por el SNS. Aportación reducida. Con visado de inspección.
Referencias
- Rückermann K, Fairbanks LD, Carrey EA, Hawrylowicz CM, Richards DF, Kirschbaum B, et al. Leflunomide inhibits pyrimidine de novo synthesis in mitogen-stimu-lated T-lymphocytes from healthy humans. J Biol Chem. 1998;273(34):21682-91.
- Cherwinski HM, Cohn RG, Cheung P, Webster DJ, Xu YZ, Caulfield JP, et al. The immunosuppressant leflunomide inhibits lymphocyte proliferation by inhibiting pyrimidine biosynthesis. J Pharmacol Exp Ther. 1995;275(2):1043-9.
- Prakash A, Jarvis B. Leflunomide: a review of its use in active rheumatoid arthritis. Drugs. 1999;58(6):1137-64.
- Xu X, Blinder L, Shen J, Gong H, Finnegan A, Williams JW, et al. In vivo mechanism by which leflunomide controls lymphoproliferative and auto immune disease inMRL/MpJ-Ipr/Ipr mice. J Immunol. 1997;159(1):167-74.
- Osiri M, Shea B, Welch V, Suarez-Almazor ME, Strand V, Tugwell P, et al. Leflunomide for the treatment of rheumatoid arthritis. Cochrane Database Syst Rev. 2003;2002(1):CD002047.
- Alfaro-Lara R, Espinosa-Ortega HF, Arce-Salinas CA; PRECIS study group, all physicians belong to Division of Internal Medicine. Hospital Central Sur de Pemex. Systematic review and meta-analysis of the efficacy and safety of leflunomide and methotrexate in the treatment of rheumatoid arthritis. Reumatol Clin. 2019;15(3):133-9.
- Hewitson PJ, Debroe S, McBride A, Milne R. Leflunomide and rheumatoid arthritis: a systematic review of effectiveness, safety and cost implications. J Clin Pharm Ther. 2000;25(4):295-302.
- Osiri M, Shea B, Robinson V, Suarez-Almazor M, Strand V, Tugwell P, et al. Leflunomide for the treatment of rheumatoid arthritis: a systematic review and metaanalysis. J Rheumatol. 2003;30(6):1182-90.
- Committee on Standards for Developing Trustworthy Clinical Practice Guidelines. Institute of Medicine (U.S.). Clinical practice guidelines we can trust. Washington, D.C.: National Academies Press; 2011.
- es. [Internet]. Instituto Aragonés de Ciencias de la Salud. [Fecha de acceso 5 Dic 2023]. Disponible en: https://portal.guiasalud.es/egpc/manual-elaboracion-justificacion/
- Bahtsevani C, Udén G, Willman A. Outcomes of evidence-based clinical practice guidelines: A systematic review. Int J Technol Assess Health Care. 2004;20(4):427-33.
- So JPP, Wright JG. The use of three strategies to improve quality of care at a national level. Clin Orthop Relat Res. 2012;470(4):1006-16.
- Manterola C, Asenjo-Lobos C, Otzen T. Jerarquización de la evidencia: Niveles de evidencia y grados de recomendación de uso actual. Rev Chilena Infectol. 2014;31(6):705-18.
- Atkins D, Eccles M, Flottorp S, Guyatt GH, Henry D, Hill S, et al. Systems for grading the quality of evidence and the strength of recommendations I: critical appraisal of existing approaches The GRADE Working Group. BMC Health Serv Res. 2004;4(1):38.
- OCEBM Levels of Evidence Working Group. The Oxford Levels of Evidence 2. [Internet]. Oxford Centre for Evidence-Based Medicine, University of Oxford. Disponible en: https://www.cebm.ox.ac.uk/ resources/levels-of-evidence/ocebm-levels-of-evidence
- New developments. [Internet]. En: Sign.ac.uk. [Fecha de acceso 3 Dic 2023]. Disponible en: https:// sign.ac.uk/what-we-do/methodology/new-developments/
- GRADE Working Group. GRADE. [Internet]. En: Gradeworkinggroup.org. [Fecha de acceso 1 Dic 2023]. Disponible en: https://www.gradeworkinggroup.org/
- La evaluación de la calidad de la evidencia y la graduación de la fuerza de las recomendaciones: el sistema GRADE. [Internet]. En: Fisterra.com. [Fecha de acceso 1 Dic 2023]. Disponible en: https:// fisterra.com/guias-clinicas/la-evaluacion-calidad-evidencia-graduacion-fuerza-recomendacionessistema-grade/
- Ioannidis JP. The Mass Production of Redundant, Misleading, and Conflicted Systematic Reviews and Meta-analyses. Milbank Q. 2016;94(3):485-514.
- Ortiz AM, Silva Fernández L, Villaverde V, Abad MÁ, Maneiro JR, Candelas G, et al. Gaps between research and recommendations in rheumatoid arthritis. Rheumatol Int. 2021;41(1):57-66.
- Grupo GUIPCAR. Guía de Práctica Clínica para el Manejo de la Artritis Reumatoide en España. Madrid: Sociedad Española de Reumatología. 2001.
- Sociedad Española de Reumatología. Guía de Práctica Clínica para el Manejo de los Pacientes con Artritis Reumatoide. [Internet]. En: Ser.es. SER. [Actualizado 16 Oct 2020]. [Fecha de acceso 1 Dic 2023]. Disponible en: https://www.ser.es/guipcar/
- Hadorn DC, Baker D, Hodges JS, Hicks N. Rating the quality of evidence for clinical practice guidelines. J Clin Epidemiol. 1996;49(7):749-54.
- Jadad AR, Moore RA, Carroll D, Jenkinson C, Reynolds DJ, Gavaghan DJ, et al. Assessing the quality of reports of randomized clinical trials: is blinding necessary? Control Clin Trials. 1996;17(1):1-12.
- Grupo de trabajo sobre Guías de Práctica Clínica. Elaboración de Guías de Práctica Clínica en el Sistema Nacional de Salud. Manual Metodológico. Plan Nacional para el SNS del MSC. Instituto Aragonés de Ciencias de la Salud-I+CS; 2007.
- Combe B, Landewe R, Lukas C, Bolosiu HD, Breedveld F, Dougados M, et al. EULAR recommendations for the management of early arthritis: report of a task force of the European Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis. 2007;66(1):34-45.
- Combe B, Landewe R, Daien CI, Hua C, Aletaha D, Álvaro-Gracia JM, et al. 2016 update of the EULAR recommendations for the management of early arthritis. Ann Rheum Dis. 2017;76(6):948-59.
- Smolen JS, Landewé R, Breedveld FC, Dougados M, Emery P, Gaujoux-Viala C, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological diseasemodifying antirheumatic drugs. Ann Rheum Dis. 2010;69(6):964-75.
- Gaujoux-Viala C, Smolen JS, Landewé R, Dougados M, Kvien TK, Mola EM, et al. Current evidence for the management of rheumatoid arthritis with synthetic disease-modifying antirheumatic drugs: a systematic literature review informing the EULAR recommendations for the management of rheumatoid arthritis. Ann Rheum Dis. 2010;69(6):1004-9.
- Smolen JS, Landewé R, Breedveld FC, Buch M, Burmester G, Dougados M, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2013 update. Ann Rheum Dis. 2014;73(3):492-509.
- Smolen JS, Landewé R, Bijlsma J, Burmester G, Chatzidionysiou K, Dougados M, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological diseasemodifying antirheumatic drugs: 2016 update. Ann Rheum Dis. 2017;76(6):960-77.
- Smolen JS, Landewé RBM, Bijlsma JWJ, Burmester GR, Dougados M, Kerschbaumer A, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological diseasemodifying antirheumatic drugs: 2019 update. Ann Rheum Dis. 2020;79(6):685-99.
- Smolen JS, Landewé RBM, Bergstra SA, Kerschbaumer A, Sepriano A, Aletaha D, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological diseasemodifying antirheumatic drugs: 2022 update. Ann Rheum Dis. 2023;82(1):3-18.
- Gaujoux-Viala C, Nam J, Ramiro S, Landewé R, Buch MH, Smolen JS, et al. Efficacy of conventional synthetic disease-modifying antirheumatic drugs, glucocorticoids and tofacitinib: a systematic literature review informing the 2013 update of the EULAR recommendations for management of rheumatoid arthritis. Ann Rheum Dis. 2014;73(3):510-5.
- Nam JL, Takase-Minegishi K, Ramiro S, Chatzidionysiou K, Smolen JS, Van der Heijde D, et al. Efficacy of biological disease-modifying antirheumatic drugs: a systematic literature review informing the 2016 update of the EULAR recommendations for the management of rheumatoid arthritis. Ann Rheum Dis. 2017;76(6):1113-36.
- Kerschbaumer A, Sepriano A, Smolen JS, Van der Heijde D, Dougados M, Van Vollenhoven R, et al. Efficacy of pharmacological treatment in rheumatoid arthritis: a systematic literature research informing the 2019 update of the EULAR recommendations for management of rheumatoid arthritis. Ann Rheum Dis. 2020;79(6):744-59.
- Qi W, Xia Y, Li X, Cao J. Clinical efficacy and safety of methotrexate compared with leflunomide in the treatment of rheumatoid arthritis: A protocol for systematic review and meta-analysis. Medicine. 2021;100(51):e28285.
- Guidelines for monitoring drug therapy in rheumatoid arthritis. American College of Rheumatology Ad Hoc Committee on Clinical Guidelines. Arthritis Rheum. 1996;39(5):723-31.
- Guidelines for the management of rheumatoid arthritis. American College of Rheumatology Ad Hoc Committee on Clinical Guidelines. Arthritis Rheum. 1996;39(5):713-22.
- Saag KG, Teng GG, Patkar NM, Anuntiyo J, Finney C, Curtis JR, et al. American College of Rheumatology 2008 recommendations for the use of nonbiologic and biologic disease-modifying antirheumatic drugs in rheumatoid arthritis. Arthritis Rheum. 2008;59(6):762-84.
- Singh JA, Furst DE, Bharat A, Curtis JR, Kavanaugh AF, Kremer JM, et al. 2012 update of the 2008 American College of Rheumatology recommendations for the use of disease-modifying antirheumatic drugs and biologic agents in the treatment of rheumatoid arthritis. Arthritis Care Res. 2012;64(5):625-39.
- Singh JA, Saag KG, Bridges SL, Akl EA, Bannuru RR, Sullivan MC, et al. 2015 American College of Rheumatology Guideline for the Treatment of Rheumatoid Arthritis. Arthritis Rheumatol. 2016;68(1):1-26.
- Fraenkel L, Bathon JM, England BR, St Clair EW, Arayssi T, Carandang K, et al. 2021 American College of Rheumatology Guideline for the Treatment of Rheumatoid Arthritis. Arthritis Care Res. 2021;73(7):924-39.
- Fitch K, Bernstein SJ, Aguilar MD, Burnand B, LaCalle JR, Lazaro P, et al. The RAND/UCLA Appropriateness Method user’s manual. Santa Mónica (CA): RAND Corporation; 2001.
- Wells GA, Shea B, O’Connell D, Peterson J, Welch V, Losos M, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in meta-analyses. Ottawa (ON): Ottawa Health Research Institute; 1999.
- American College of Rheumatology. Clinical Practice Guidelines. [Internet]. En: Rheumatology.org. ACR.[Fecha de acceso 15 Dic 2023]. Disponible en: http://www.rheumatology.org/Practice-Quality/ Clinical-Support/Clinical-Practice-Guidelines
- Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, et al. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. 2008;336(7650):924-6.
- Andrews J, Guyatt G, Oxman AD, Alderson P, Dahm P, Falck-Ytter Y, et al. GRADE guidelines: 14. Going from evide nce to recommendations: the significance and presentation of recommendations. J Clin Epidemiol. 2013;66(7):719-25.
- Andrews JC, Schunemann HJ, Oxman AD, Pottie K, Meerpohl JJ, Coello PA, et al. GRADE guidelines: 15. Going fromevidence to recommendation: determinants of a recommendation’s direction and strength. J Clin Epidemiol. 2013;66(7):726-35.
- Guyatt GH, Oxman AD, Kunz R, Atkins D, Brozek J, Vist G, et al. GRADE guidelines: 2. Framing the question and deciding on important outcomes. J Clin Epidemiol. 2011;64(4):395-400.
- Alexander PE, Gionfriddo MR, Li SA, Bero L, Stoltzfus RJ, Neumann I, et al. A number of factors explain why WHO guideline developers make strong recommendations inconsistent with GRADE guidance. J Clin Epidemiol. 2016;70:111-22.
- National Institute for Health and Care Excellence. Rheumatoid arthritis in adults: management. [Internet]. NICE guideline [NG100]. NICE; 2018. [Actualización 12 Oct 2020]. Disponible en: https://www. org.uk/guidance/ng100
- Hill S, Frey N. Conventional Disease-Modifying Antirheumatic Drugs for the Treatment of Rheumatoid Arthritis. [Internet]. Canadian J Health Technol. 2021;1(5). Disponible en: https://canjhealthtechnol.ca/ php/cjht/article/view/rc1359
- Daien C, Hua C, Gaujoux-Viala C, Cantagrel A, Dubremetz M, Dougados M, et al. Update of French society for rheumatology recommendations for managing rheumatoid arthritis. Joint Bone Spine. 2019;86(2):135-50.
- Daien C, Hua C, Gaujoux-Viala C, Cantragel A, Dubremetz M, Dougados M, et al. Update of French society for rheumatology recommendatios for managing rheumatoid arthritis. Joint Bone Spine. 2019;86(2):135-50.
- Mota LMHD, Kakehasi AM, Gomides APM, Duarte ALBP, Cruz BA, Brenol CV, et al. 2017 recommendatios of the Brazilian Society of Rheumatology for the pharmacological treatment of rheumatoid arthritis. Adv Rheumatol. 2018;58(1):2.
- Lau CS, Chia F, Dans L, Harrison A, Hsieh TY, Jain R,et al. 2018 update of the APLAR recommendations for treatment of rheumatoid arthritis. Int J Rheum Dis. 2029;22(3):357-75.
MAT-ES-2400234 v1.0 Abril 2024
