- Artículo
- Fuente: Campus Sanofi
- 1 nov 2021
La Inflamación Tipo 2 y el Nuevo Paradigma en Asma y RSCcPN: SEAIC-2021
La inflamación T2 está presente en aproximadamente un 50-70% de los pacientes con asma (Tran et al., 2016). La guía GINA establece la presencia de este tipo de inflamación en caso que los eosinófilos en sangre ≥150 cél/μl y/o FeNO ≥20 ppb y/o eosinófilos en esputo ≥2% y/o asma desencadenada por alérgenos y/o la necesidad de mantener los corticoides orales (CO) (GINA 2021).
El fenoendotipado de la inflamación T2 va más allá de las categorías de asma alérgico o eosinofílico (Figura 1). Estas comparten una serie de rasgos clínicos bajo el prisma T2 (Laidlaw et al., 2021).
Perfil del paciente asmático en España
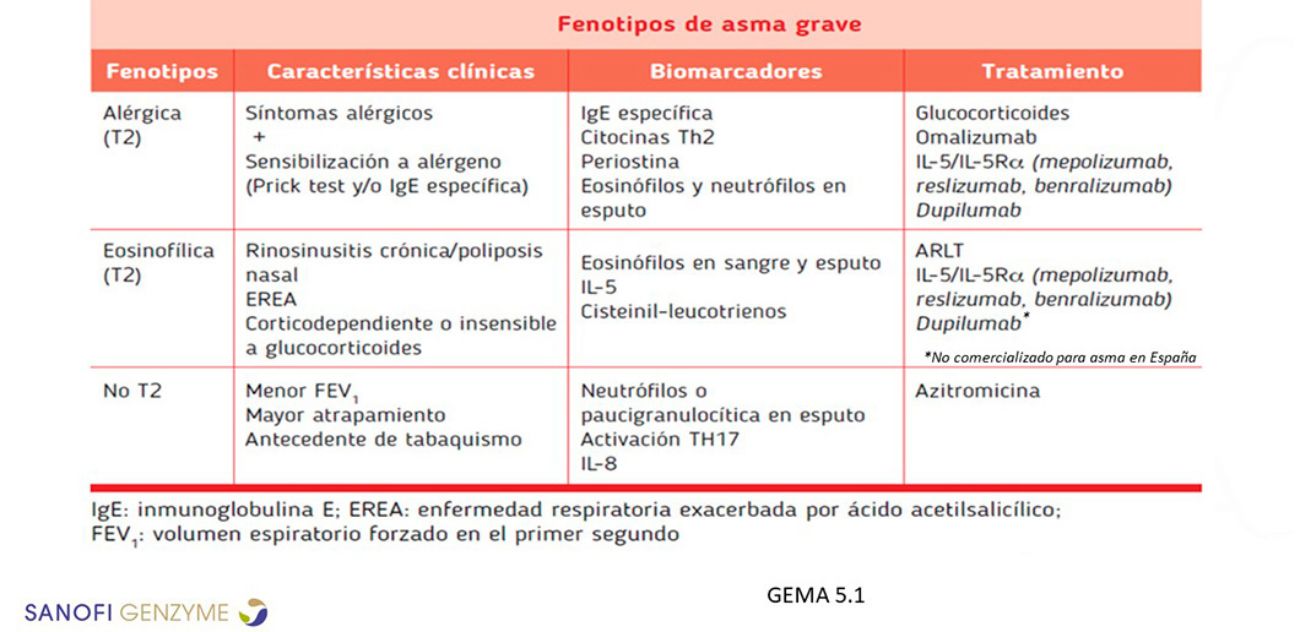
Figura 1. Fenotipos de asma grave según las guías GEMA 5.1
La asociación entre el asma y la rinosinusitis crónica con pólipos nasales (RSCcPN) con perfil T2 engloba manifestaciones diferentes en una misma vía respiratoria. Esta asociación, tiene una repercusión en la función pulmonar, tanto en términos de FEV1 y de obstrucción como, indirectamente, en el aumento del FeNO (Wu et al., 2017).
Es necesario mejorar los criterios de clasificación de los pacientes con asma T2 y comenzar a hablar de T2 o NO-T2, en vez de T2 alto o bajo para evitar confusiones. Debe alcanzarse un consenso en la utilización de términos, y hacer que estos biomarcadores sean accesibles en la consulta (Figura 2). Por otra parte, es frecuente que varios de estos marcadores coexistan (Price et al., 2019).
Perfil del paciente asmático en España
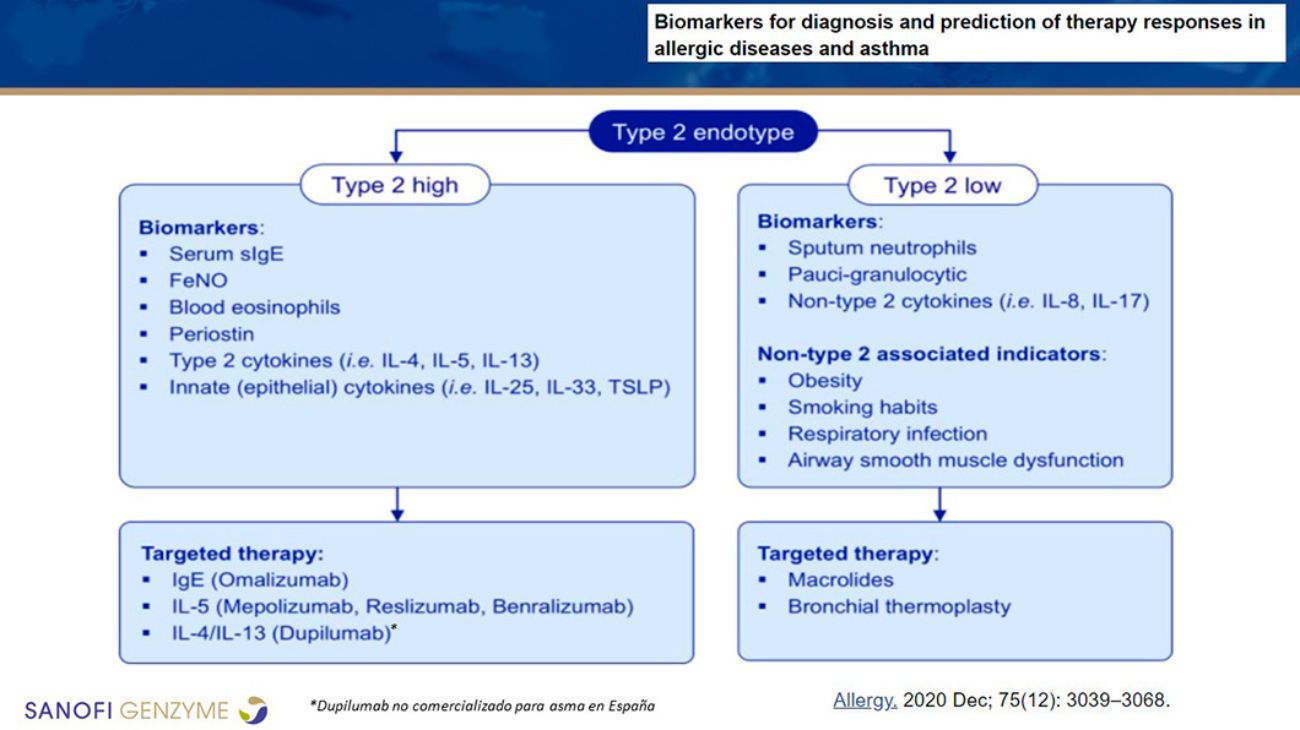
Figura 2. Biomarcadores para el diagnóstico y predicción de la respuesta terapéutica en enfermedades alérgicas y asma T2
En cuanto a la caracterización del asma en la población española, la cohorte MEGA ha permitido analizar las características inflamatorias de pacientes con asma de cualquier gravedad en España (Rial et al., 2021). En aquellos con asma grave, seguidos en Unidades de Asma y con tratamiento optimizado, se detectaron niveles elevados de IgE total, eosinófilos en sangre periférica y esputo, así como de FeNO.
En el estudio BRAVO, un 29,82% de los pacientes con asma grave de tipo 2 no controlada tenían ≥500 eosinófilos/μl en sangre periférica, valor <150 en sólo el 10% (Domingo et al., 2020). De igual modo, en la comunicación de Dávila et al. sólo un 10,3% de los pacientes presentaban valores de FeNO <25 + eosinófilos <150, mientras que un 58,1% presentaban FeNO ≥25 + eosinófilos ≥150 (Dávila et al., SEAIC 2021). Clasificando bien, es muy posible que más pacientes se puedan beneficiar del tratamiento con un biológico.
Por otro lado, la terapia crónica con CO en pacientes con asma grave es habitual en España, llegando al 28% de los pacientes (Entrenas et al., 2019). Es importante tener una visión global, pues es frecuente la coexistencia de distintas enfermedades de tipo 2 en el mismo paciente (Khan et al., 2019; White et al., 2018) y esto conduce a una mayor dosis acumulada de CO. Cuatro ciclos de CO al año equivalen a una dosis anual de 1 g, umbral para que aparezcan efectos adversos (EA) como inmunosupresión (Dalal et al., 2016) (Figura 3). Se ha demostrado que el paciente con asma grave sufre los EA de los CO sea corticodependiente o no.
El uso de CO se asocia a EA graves menos conocidos. La inmunosupresión puede afectar al sistema inmunitario humoral (Posey et al., 1978; Hamilos et al., 1992) o al celular. La insuficiencia adrenal inducida por corticoides, por inhibición del eje hipotálámico-hipofisario-adrenal, es posible en pacientes que reciban CO en dosis de 15-20 mg/día durante 2 años (Menzies-Gow et al., 2019).
Efectos adversos de los CS: La dosis de CS acumulada a largo plazo se asocia con EA
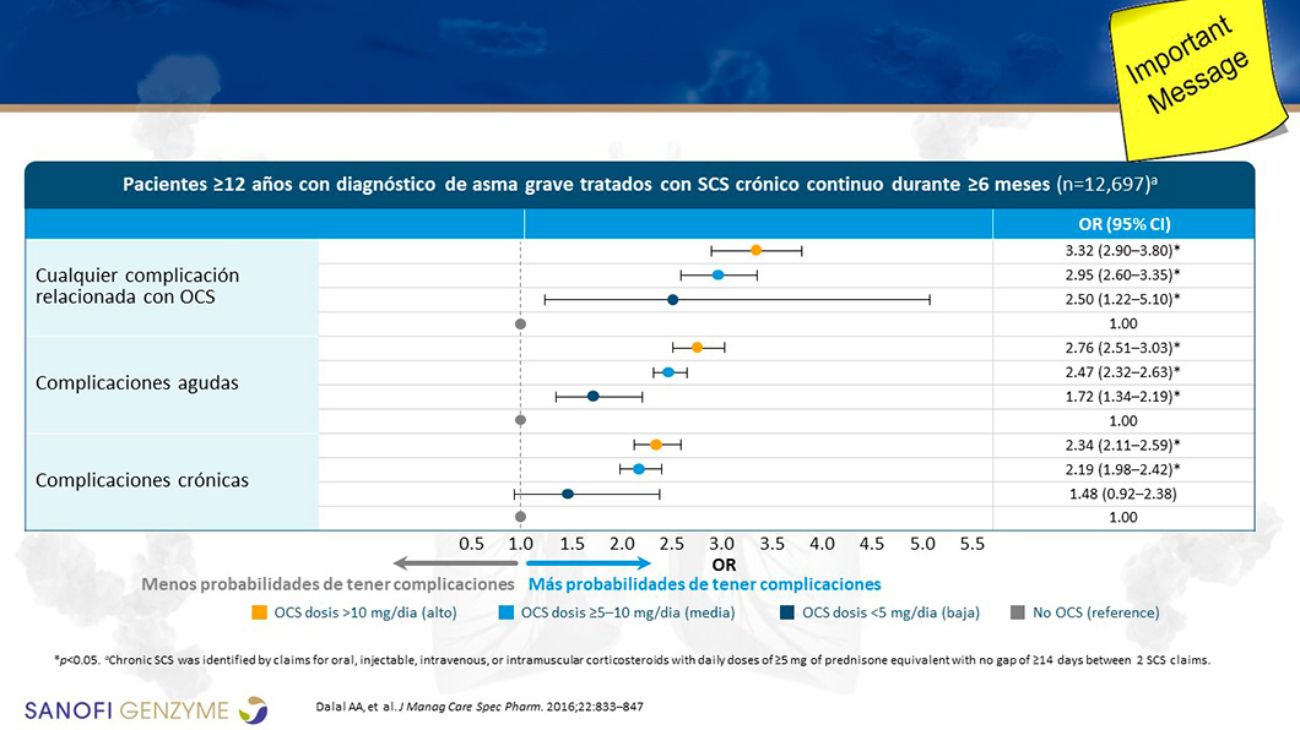
Figura 3. Efectos adversos causados a largo plazo tras dosis acumulada de CO en asma grave
Las guías para el asma y la RSCcPN reconocen la necesidad de minimizar el uso de CO debido al riesgo de EA (GINA 2021; Fokkens et al., 2020; Fokkens et al., 2019; Hox et al., 2020; Rudmik et al., 2015). Cuando se prescriba a un paciente con otras comorbilidades un biológico que tenga varias indicaciones, habrá que exigir, cada vez más, que la reducción sea de los CO recibidos por el paciente en todas las indicaciones.
Los nuevos biológicos disponen de estudios en fase 3 en los que se ha evaluado la reducción del consumo de CO. Dupilumab ha demostrado una reducción media en el uso de CO >70%; el 80% de los pacientes tuvieron una reducción de dosis ≥50%, y el 48% suspendieron totalmente los CO (Rabe at al., 2018) (Figura 4).
DUPILUMAB: Ensayo clínico fase 3
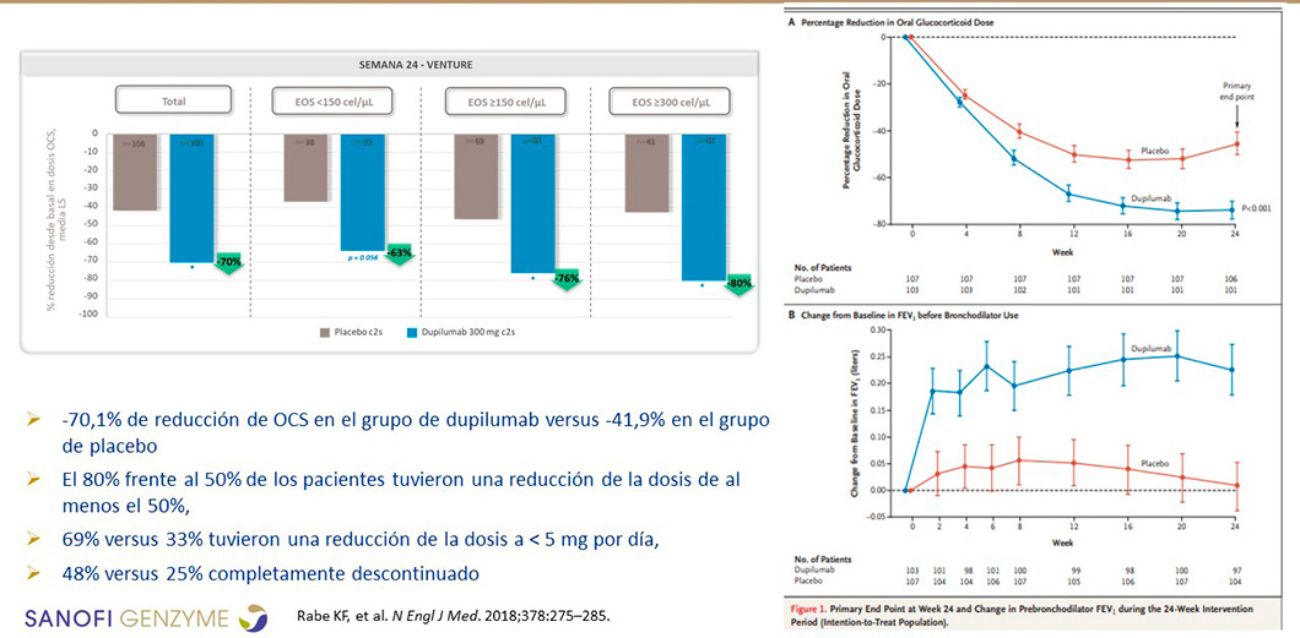
Figura 4. Reducción de la dosis de corticoides orales con dupilumab en asma grave

Referencias
Tran TN, et al. Ann Allergy Asthma Immunol 2016;116(1):37-42. Global Initiative for Asthma (GINA), 2021. Laidlaw TM, et al. J Allergy Clin Immunol Pract 2021;9(3):1133-41. Wu D, et al. Ann Allergy Asthma Immunol 2017;118:318-25. Pérez de Llano, et al. Respiratory Med 2019;151:49-54. Spahn JD, et al. J Allergy Clin Immunol 2016;138(5):1296-8. Malinovschi A, et al. J Allergy Clin Immunol 2016;138(5):1301-8.e2. Price D, et al. Clin Transl Allergy 2019;9:41. Rial MJ, et al. Clin Transl Allergy 2021;11:e12001. Domingo C, et al. Eur Respir J 2020;55(Suppl. 65): 5148. Dávila et al. Póster nº 581. 2021, 33º Congreso de la SEAIC. Entrenas Costa LM, et al. Pharmacoecon Open 2019;3:333-42. Khan A, et al. Rhinology 2019;57(1):32-42. White AA, Stevenson DD. N Engl J Med 2018;379:106 -70. Sullivan PW et al. J Allergy Clin Immunol 2018;141:110-6. Waljee, AK et al. BMJ 2017;357:j1415. Dalal AA, et al. J Manag Care Spec Pharm 2016;22:833-47. Posey WC, et al. J Allergy Clin Immunol 1978;62:340. Hamilos DL, et al. Ann Allergy 1992;68:472. Menzies-Gow A, et al. ERJ Open Research 2019;5:00009-2019. Global Initiative for Asthma (GINA). 2021. https://ginasthma.org/severe-asthma/. Último acceso noviembre 2021. Fokkens WJ, et al. Rhinology 2020;58(Suppl S29):1-464. Fokkens WJ, et al. Allergy 2019;74(12):2312-9. Hox V, et al. Clin Transl Allergy 2020;10:1. Rudmik L, et al. JAMA 2015;314:926-39. Plaza V (Coord). Guía Española para el Manejo del Asma 5.1 (GEMA5.1). Madrid: Luzan 5; 2020. ISBN: 978-84-17372-97-2. Disponible en: https://www.gemasma.com/. Último acceso: noviembre 2021. MacDonald KM, et al. Expert Rev Clin Immunol 2019;15(5):553-69. Andrew Menzies-Gow, et al. ERJ Open Research 2019 5: 00009-2019. Bel EH et al. N Engl J Med 2014;371:1189-97. Nair P, et al. N Engl J Med 2017;376(25):2448-58. Rabe KF, et al. N Engl J Med 2018;378:275-85.
MAT-ES-2103969 V1 Noviembre