- Artículo
- Fuente: Campus Sanofi
- 7 abr 2025
Descifrando la inflamación de tipo 2 en la EPOC: la perspectiva de un experto

¿Qué papel desempeña la inflamación de tipo 2 en la EPOC?
Una mirada más profunda a la fisiopatología subyacente y a los factores que impulsan la inflamación crónica, en particular la inflamación de tipo 2, puede ayudarnos a comprender mejor la EPOC. Las citocinas clave implicadas en la inflamación de tipo 2 se elevan durante las exacerbaciones agudas de la EPOC y pueden desempeñar un papel en la hipersecreción de moco en los pulmones.
Vea el siguiente vídeo para comprender mejor la inflamación de tipo 2 y su papel en la EPOC.

Me llamo Surya Bhatt. Soy profesor de Medicina en la Universidad de Alabama en Birmingham e investigador de la EPOC.
Esta charla está patrocinada por Sanofi y Regeneron y no obtendrá ningún crédito (CME). En respuesta a cualquier tipo de insulto. Por ejemplo, el humo del cigarrillo, las infecciones víricas, las infecciones bacterianas, la contaminación, hay algún elemento de lesión epitelial y daño epitelial. Y la primera respuesta a esto suele ser que una vez que hay suficiente daño epitelial, se liberan patrones moleculares asociados al daño o (DAMPs) que ahora son quizás más popularmente llamados alarminas y estos son IL-33, IL-25 y TSLP o linfopoyetina del estroma tímico. Todos estos pueden ser liberados y tienen funciones específicas en términos de promover la inflamación. Y la IL-33 es quizás la mejor comprendida y algunas personas la consideran el interruptor maestro de la inflamación donde una vez que se activa, permanece activada durante mucho tiempo. Promueve tanto la inflamación de tipo 1 como la de tipo 3, así como la de tipo 2.
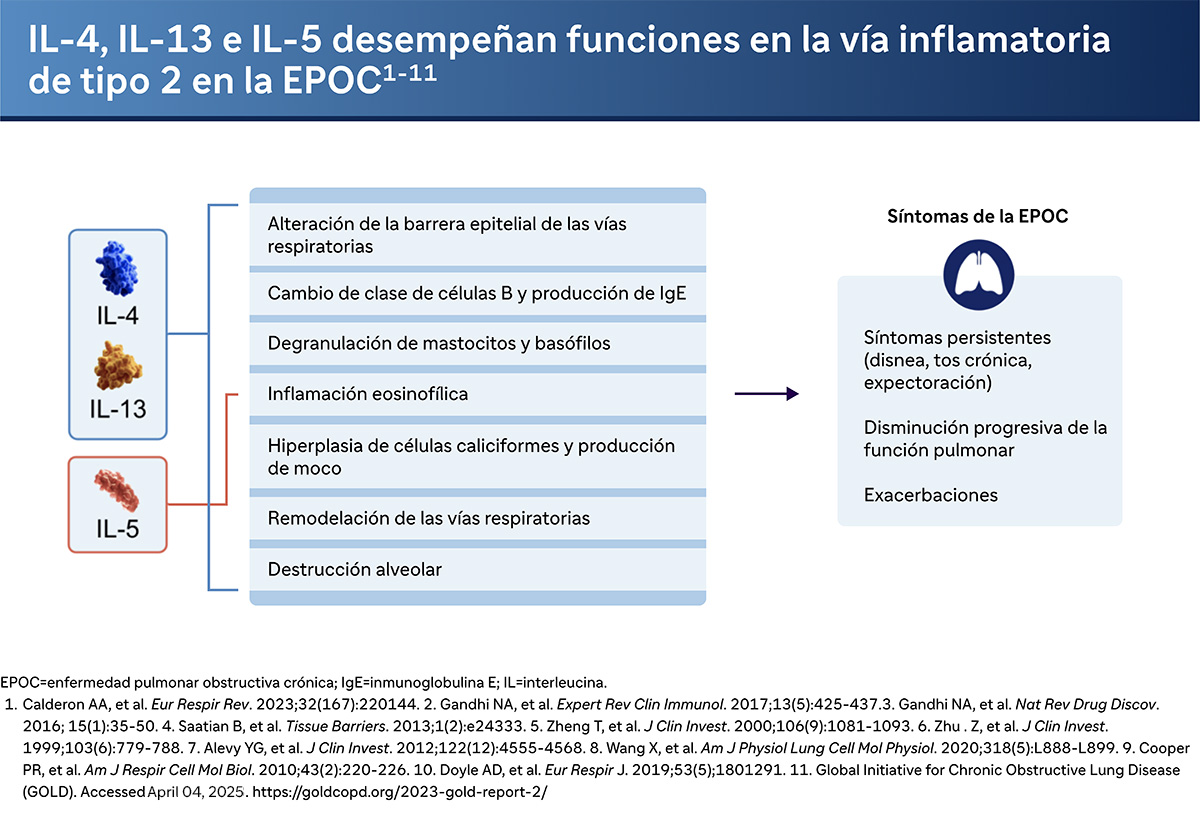
El pensamiento tradicional ha sido que el principal impulsor de la inflamación de tipo 2 es la IL-5, que causa la inflamación eosinofílica. Pero ahora entendemos que tanto la IL-4 como la IL-13 son importantes en la conducción de la inflamación de tipo 2. Y aquí está una lista de todas las cosas que pueden hacer. IL-4 e IL-13:
- Ambas pueden causar la interrupción de la barrera epitelial.
- Pueden causar el cambio de clase de células B y aumentar la producción de IgE.
- Pueden provocar la degranulación de los mastocitos
- Pueden causar degranulación de basófilos
- Y también inflamación eosinofílica al igual que la IL-5.
- También pueden provocar hiperplasia de células caliciformes y producción de moco, especialmente la IL-13.
- Y como consecuencia de todo ello, pueden causar una remodelación significativa de las vías respiratorias, así como destrucción alveolar.
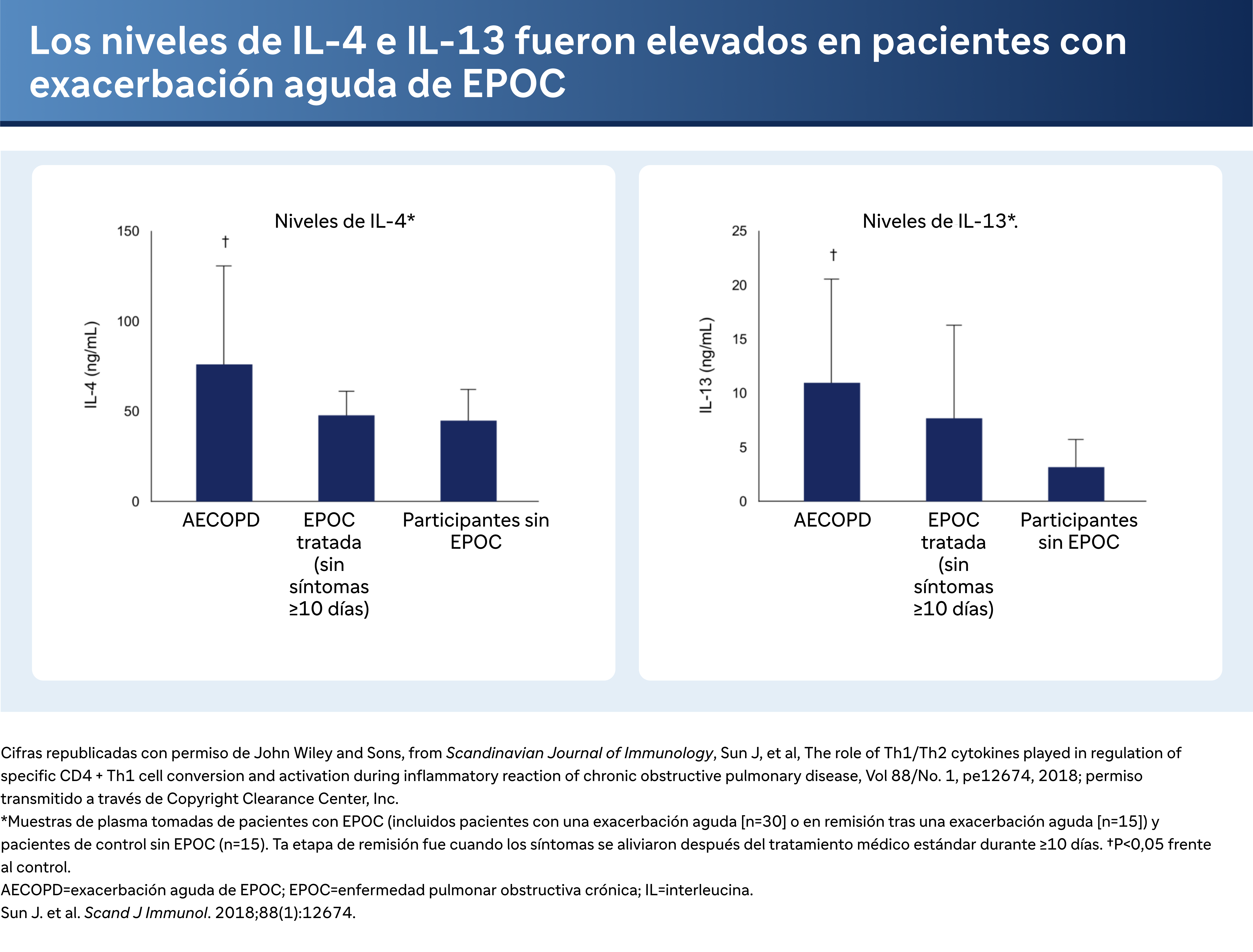
Los niveles de IL-4 e IL-13 también son elevados durante una exacerbación aguda, a diferencia de lo que ocurre en un estado estable o en pacientes sin EPOC. Así que también es importante señalar que estas vías se activan en pacientes con exacerbación aguda de la EPOC y se presentan y son importantes en la EPOC.
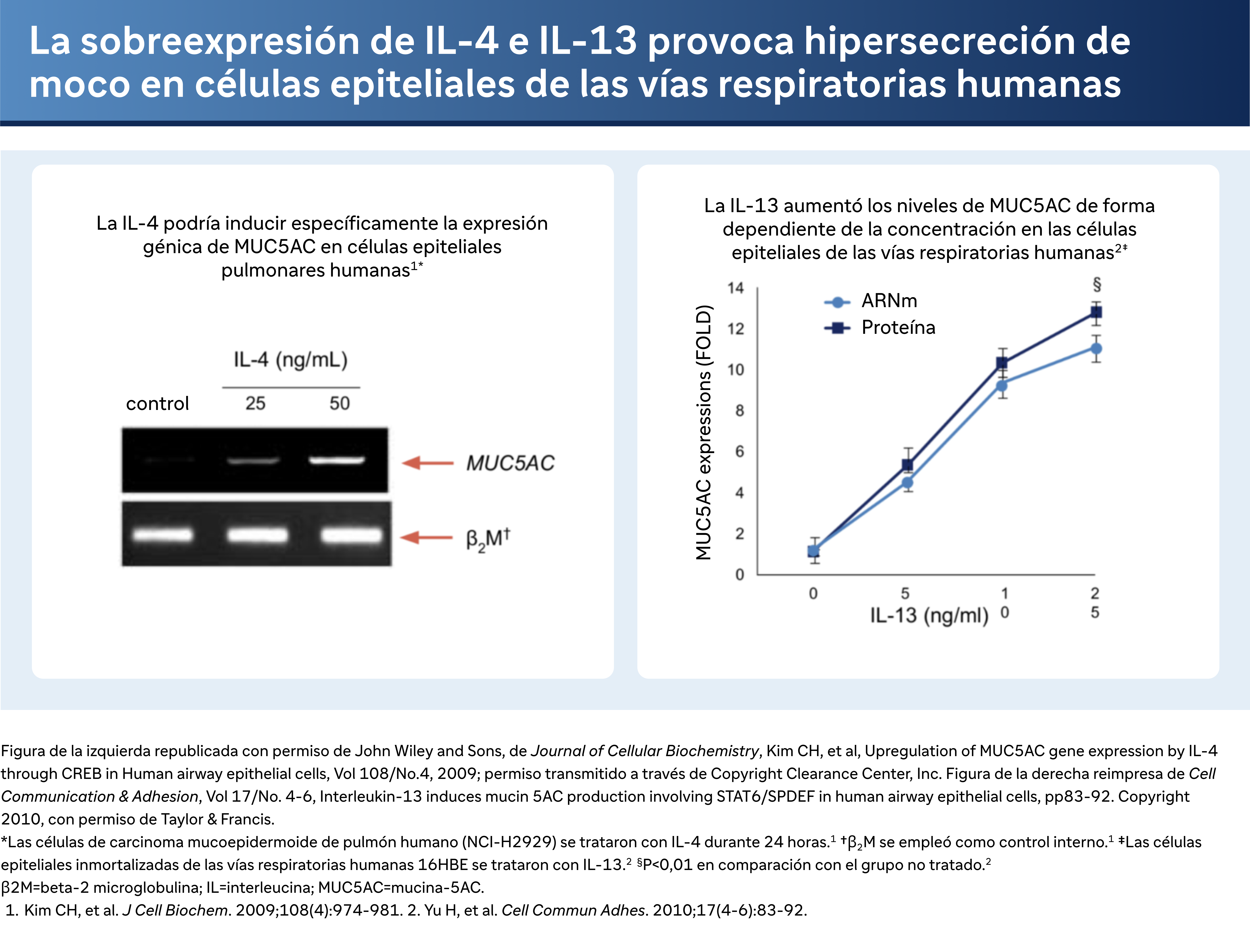
Y luego, ya sabes, todos sabemos que ha habido una gran comprensión de la mucina y la producción de moco en la EPOC. Y uno de los principales impulsores de eso es MUC5A y la IL-4 puede inducir una mayor expresión de MUC5AC en las células epiteliales humanas. Y también hay una respuesta casi dependiente de la dosis de IL-13 en MUC5A, así como un aumento de la producción de moco. Así pues, se ha descubierto que la IL-13 es un factor importante en la producción de moco en pacientes con EPOC.
La génesis de la inflamación en la EPOC
La EPOC se asocia tradicionalmente a la exposición a estímulos nocivos como el humo del tabaco, la contaminación atmosférica y las infecciones respiratorias. El Dr. Bhatt explica que estas agresiones provocan daños epiteliales en las vías respiratorias, que son el primer paso de una cascada de respuestas inflamatorias. "En respuesta a cualquier tipo de insulto, hay algún elemento de lesión y daño epitelial", señala el Dr. Bhatt, que describe la liberación de patrones moleculares asociados a daños (DAMP), también conocidos como alarminas. Entre ellos están la IL-33, la IL-25 y la TSLP (linfopoyetina del estroma tímico), que desempeñan un papel crucial en la amplificación de la inflamación.
Inflamación de tipo 2: Más allá de los eosinófilos
Si bien la inflamación eosinofílica (impulsada por la IL-5) ha sido el foco tradicional de la inflamación de tipo 2, el Dr. Bhatt hace hincapié en el importante papel de la IL-4 y la IL-13. Estas interleucinas contribuyen a diversos procesos inflamatorios. Estas interleucinas contribuyen a diversos procesos patológicos de la EPOC:
-
Alteración de la barrera epitelial: La IL-4 y la IL-13 pueden comprometer la integridad de la barrera epitelial, haciéndola más susceptible a las agresiones ambientales.
-
Cambio de clase de células B y producción de IgE: Estas citocinas facilitan la transformación de las células B y aumentan los niveles de IgE, que son fundamentales en las respuestas alérgicas y pueden exacerbar los síntomas respiratorios.
-
Degranulación de mastocitos y basófilos: Esto conduce a una mayor liberación de mediadores inflamatorios, empeorando la inflamación y la gravedad de los síntomas.
-
Hiperplasia de células caliciformes y sobreproducción de moco: Especialmente impulsada por la IL-13, da lugar a una producción excesiva de moco, una característica distintiva de la EPOC que contribuye a la obstrucción de las vías respiratorias y a la dificultad para eliminar las infecciones.
-
Remodelación alveolar y de las vías respiratorias: La inflamación crónica impulsada por estas citocinas puede provocar cambios estructurales en el pulmón, reduciendo su funcionalidad con el tiempo.
Exacerbaciones agudas y producción de mucosidad en la EPOC
El Dr. Bhatt señala que los niveles de IL-4 e IL-13 son elevados durante las exacerbaciones agudas de la EPOC en comparación con los estados estables, lo que subraya la activación de estas vías durante las reagudizaciones. También aborda el papel de las mucinas en la EPOC, en particular la MUC5AC, que es inducida por la IL-4 en las células epiteliales humanas. La IL-13 también muestra un efecto dependiente de la dosis sobre la MUC5A y aumenta la producción de moco, lo que la convierte en un factor importante en las exacerbaciones de la EPOC.
La conexión MUC5AC
Un aspecto significativo del debate del Dr. Bhatt gira en torno a la producción de mucina, impulsada específicamente por la MUC5AC y su regulación por la IL-4 y la IL-13. "La IL-4 puede inducir un aumento de la expresión de MUC5AC en las células epiteliales humanas", explica, destacando un aumento dependiente de la dosis en la producción de mucina impulsada por la IL-13. Esta vía es especialmente importante, ya que contribuye a la hipersecreción de moco característica de los pacientes con EPOC.
En resumen
Los conocimientos del Dr. Surya Bhatt sobre el papel de la inflamación de tipo 2 en la EPOC ponen de relieve la complejidad de esta enfermedad y la naturaleza polifacética de sus procesos inflamatorios. La comprensión de estos mecanismos no sólo arroja luz sobre la fisiopatología de la EPOC, sino que también abre nuevas vías para tratamientos específicos que podrían modular estas vías inflamatorias, ofreciendo esperanzas para un mejor tratamiento de esta enfermedad debilitante.
A medida que el campo de la investigación de la EPOC sigue evolucionando, está claro que la integración de los conocimientos de expertos como el Dr. Bhatt será crucial para desarrollar estrategias terapéuticas más eficaces que aborden la inflamación subyacente y sus diversas manifestaciones en los pacientes con EPOC.
Referencias
- Gandhi NA, Bennett BL, Graham NMH, et al. Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov. 2016;15(1):35-50.
- Yousuf A, Ibrahim W, Greening NJ, et al. T2 Biologics for Chronic Obstructive Pulmonary Disease. J Allergy Clin Immunol Pract. 2019;7(5):1405-1416.
- Aghapour M, Raee P, Moghaddam SJ, et al. Airway Epithelial Barrier Dysfunction in Chronic Obstructive Pulmonary Disease: Role of Cigarette Smoke Exposure. Am J Respir Cell Mol Biol. 2018;58(2):157-169.
- Barnes JP. Inflammatory endotypes in COPD. Allergy. 2019;74(7):1249-1256.
- Wang Z, Bafadhel M, Haldar K, et al. Lung microbiome dynamics in COPD exacerbations. Eur Respir J. 2016;47(4):1082-1092.
- Smithgall MD, Comeau MR, Yoon BRP, et al. IL-33 amplifies both Th1- and Th2-type responses through its activity on human basophils, allergen-reactive Th2 cells, iNKT and NK cells. Int Immunol. 2008;20(8):1019-1030.
- Senra L, Mylonas A, Kavanagh RD, et al. IL-17E (IL-25) enhances innate immune responses during skin inflammation. J Invest Dermatol. 2019;139(8):1732-1742.
- Linden D, Guo-Parke H, Coyle PV, et al. Respiratory viral infection: a potential “missing link” in the pathogenesis of COPD. Eur Respir Rev. 2019; 28(151):180063.
- Global Initiative for Chronic Obstructive Lung Disease (GOLD). Accessed July 27, 2023. https://goldcopd.org/2023-gold-report-2/.
- Calderon AA, Dimond C, Choy DF, et al. Targeting interleukin-33 and thymic stromal lymphopoietin pathways for novel pulmonary therapeutics in asthma and COPD. Eur Respir Rev. 2023;32(167):220144.
- Kurokawa M, Matsukura S, Kawaguchi M, et al. Interleukin-33-activated dendritic cells induce the production of thymus and activation-regulated chemokine and macrophage-derived chemokine. Int Arch Allergy Immunol. 2013;161(Suppl 2):52-57.
- Griesenauer B, Paczesny S. The ST2/IL-33 axis in immune cells during inflammatory diseases. Front Immunol. 2017;8:475.
- Borowczyk J, Shutova M, Brembilla NC, et al. IL-25 (IL-17E) in epithelial immunology and pathophysiology. J Allergy Clin Immunol. 2021;148(1):40-52.
- Claudio E, Wang H, Kamenyeva O, et al. IL-25 orchestrates activation of Th cells via conventional dendritic cells in tissue to exacerbate chronic house dust mite–induced asthma pathology. J Immunol. 2019;203(8)2319-2327.
- Kotlyarov S. Involvement of the innate immune system in the pathogenesis of chronic obstructive pulmonary disease. Int J Mol Sci. 2022;23(2):985.
- Gandhi NA, Pirozzi G, Graham NMH. Commonality of the IL-4/IL-13 pathway in atopic diseases. Expert Rev Clin Immunol. 2017;13(5):425-437.
- Saatian B, Rezaee F, Desando S, et al. Interleukin-4 and interleukin-13 cause barrier dysfunction in human airway epithelial cells. Tissue Barriers. 2013;1(2):e24333.
- Zheng T, Zhu Z, Wang Z, et al. Inducible targeting of IL-13 to the adult lung causes matrix metalloproteinase- and cathepsin-dependent emphysema. J Clin Invest. 2000;106(9):1081-1093.
- Zhu Z, Homer RJ, Wang Z, et al. Pulmonary expression of interleukin-13 causes inflammation, mucus hypersecretion, subepithelial fibrosis, physiologic abnormalities, and eotaxin production. J Clin Invest. 1999;103(6):779-788.
- Alevy YG, Patel AC, Romero AG, et al. IL-13-induced airway mucus production is attenuated by MAPK13 inhibition. J Clin Invest. 2012;122(12):4555-4568.
- Wang X, Xu C, Ji J, et al. IL-4/IL-13 upregulates Sonic hedgehog expression to induce allergic airway epithelial remodeling. Am J Physiol Lung Cell Mol Physiol. 2020;318(5):L888-L899.
- Cooper PR, Poll CT, Barnes PJ, et al. Involvement of IL-13 in tobacco smoke-induced changes in the structure and function of rat intrapulmonary airways. Am J Respir Cell Mol Biol. 2010;43(2):220-226.
- Doyle AD, Mukherjee M, LeSuer WE, et al. Eosinophil-derived IL-13 promotes emphysema. Eur Respir J. 2019;53(5):1801291.
- Sun J, Liu T, Yan Y, et al. The role of Th1/Th2 cytokines played in regulation of specific CD4+ Th1 cell conversion and activation during inflammatory reaction of chronic obstructive pulmonary disease. Scand J Immunol. 2018;88(1):e12674.
- Kim CH, Kim KE, Yoon JH, et al. Upregulation of MUC5AC gene expression by IL-4 through CREB in Human airway epithelial cells. J Cell Biochem. 2009;108(4):974-981.
- Yu H, Li Q, Kolosov VP, et al. Interleukin-13 induces mucin 5AC production involving STAT6/SPDEF in human airway epithelial cells. Cell Commun Adhes. 2010;17(4-6):83-92.
MAT-ES-2500998- V1- Marzo 2025