- Artículo
- Fuente: Campus Sanofi
- 3 dic 2024
Inflamación de tipo 2 en la EPOC

La inflamación Tipo 2 puede aumentar el riesgo de exacerbaciones y deterioro de la función pulmonar en la EPOC23,24
La EPOC se caracteriza por la producción de moco, la obstrucción de las vías respiratorias y la tos13
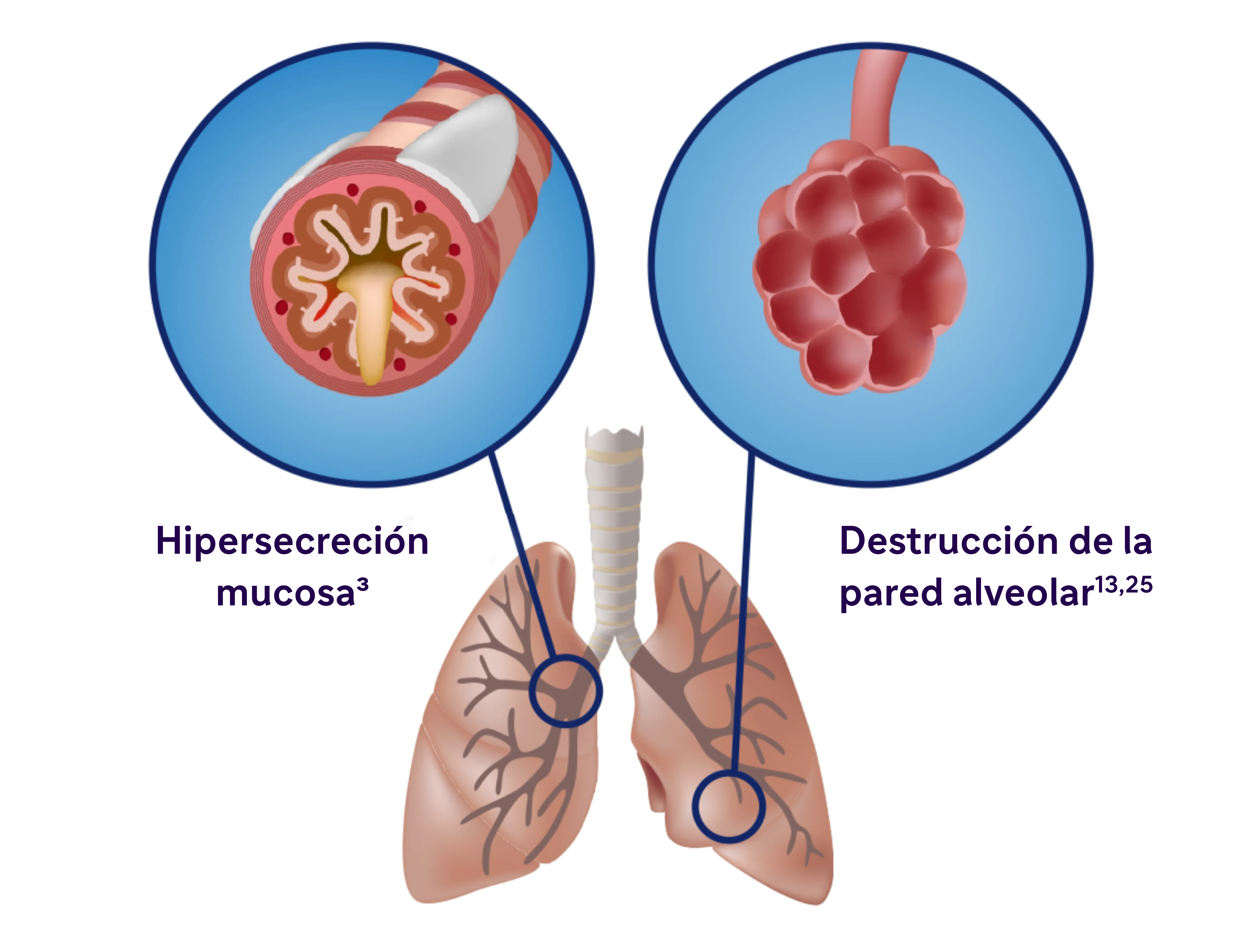
La inflamación se manifiesta sistémica y localmente
- La inflamación crónica provoca cambios estructurales, como el estrechamiento de las vías respiratorias y la disminución de la elasticidad pulmonar13.
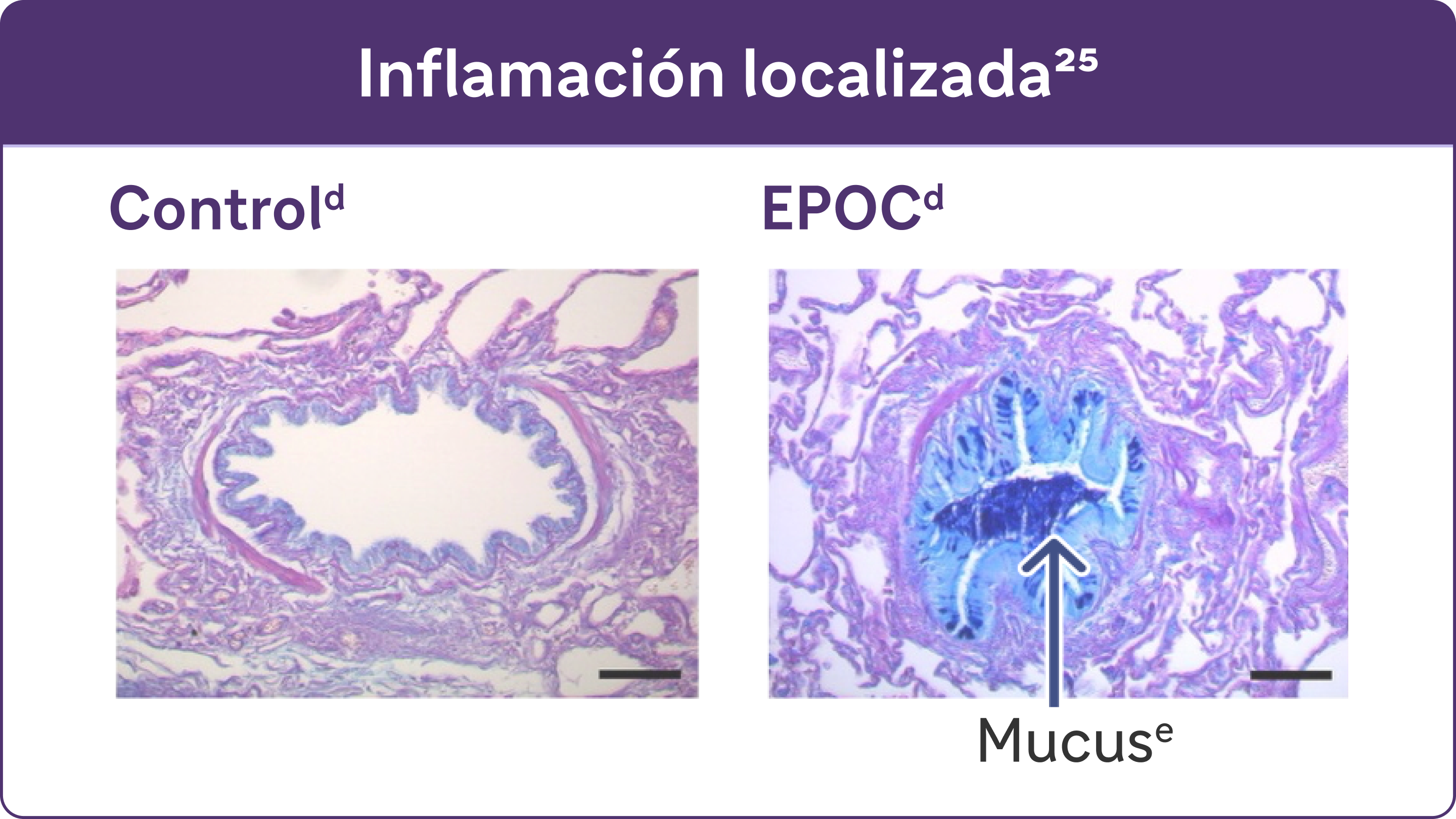
- Los estudios han identificado una relación entre la inflamación y la hipersecreción de moco en afecciones respiratorias como la EPOC25

Escuche a la profesora Nicola Hanania : «Ya no la vemos como una enfermedad de talla única»
1:36 minutos
Nicola Hanania es catedrática de Medicina, jefa de sección de Cuidados Críticos Pulmonares y Medicina del Sueño en el Hospital Ben Taub de Houston (Texas) y director del Centro de Investigación Clínica de las Vías Respiratorias (ACRC) de la Facultad de Medicina de Baylor.
.webp)
Escuche el episodio completo del podcast en el sitio web de EMJ (European medical Journal - Noviembre de 2024)
Patrocinado por Sanofi y Regeneron, en colaboración con EMJ.
Creo que nuestro enfoque de esta enfermedad ha cambiado, sabiendo que tiene múltiples fenotipos, pero no sólo eso, sino que también hemos identificado múltiples mecanismos de la enfermedad, por lo que ya no la vemos como una enfermedad de talla única. Por lo tanto, es muy importante que los médicos profundicen en la historia clínica para identificar estos fenotipos, ya sea un fenotipo de exacerbación frecuente, un fenotipo de bronquitis crónica o un fenotipo de enfisema principalmente, pero ahora utilizamos biomarcadores como los eosinófilos en sangre, y puede que en el futuro haya más, incluidos biomarcadores radiológicos, que nos ayuden a subdividir este grupo de pacientes para poder adoptar un enfoque más personalizado. Y creo que es un momento muy emocionante para la EPOC, así que hemos pasado de este enfoque del tipo «globo azul, globo rosa» a tener ahora múltiples, como he mencionado, subtipos o fenotipos, e incluyendo la identificación de más mecanismos para que tengamos un enfoque más dirigido a esta enfermedad. Y es de esperar que eso ayude a mejorar los resultados en el futuro. Ese es el principal objetivo: reducir el mayor riesgo de mortalidad que hemos observado en la EPOC, mientras que en otras enfermedades hemos conseguido muchos logros. Desgraciadamente, no hemos avanzado mucho en este sentido, por lo que esperamos que con nuevos enfoques podamos mejorar los resultados.
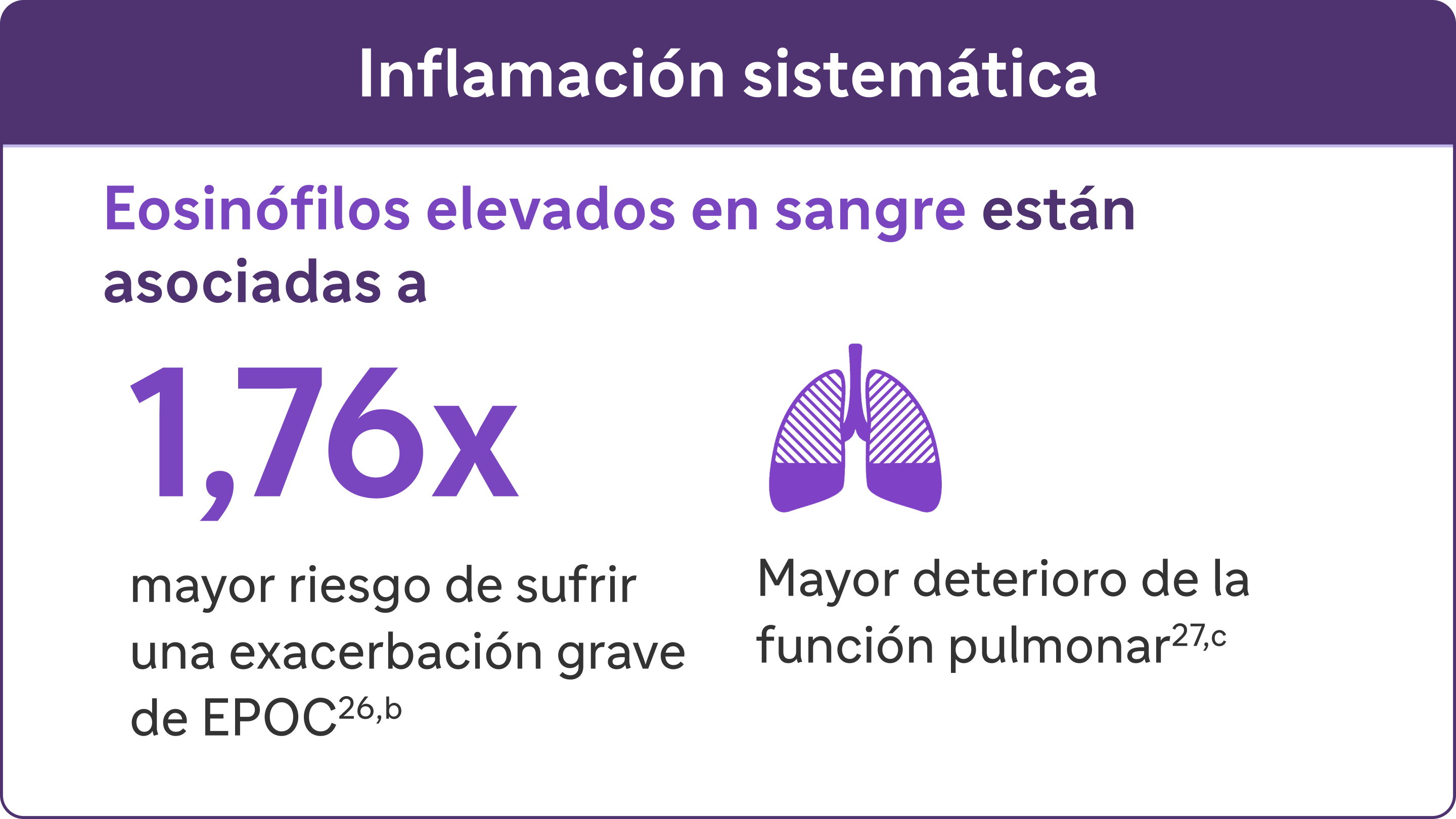
Busque eosinófilos elevados en sangre (>300 Células/μL) - Un Biomarcador de Inflamación Tipo 2 en EPOC13
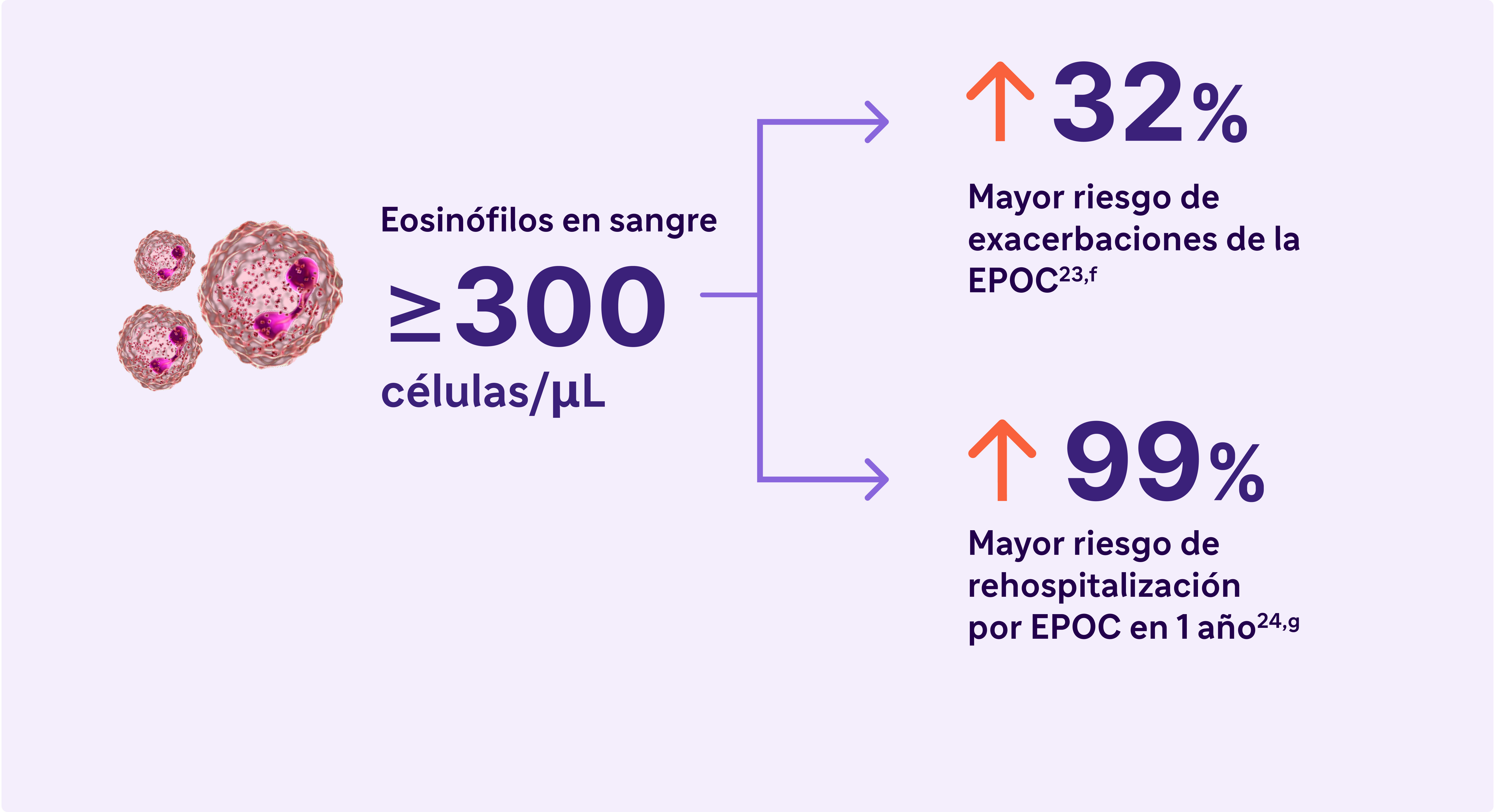
Los eosinófilos elevados en la EPOC son un rasgo tratable y un marcador de inflamación de tipo 213
El Informe GOLD 2024 reconoce los eosinófilos elevados en sangre como un biomarcador clínicamente utilizado para identificar la EPOC con inflamación de tipo 2.
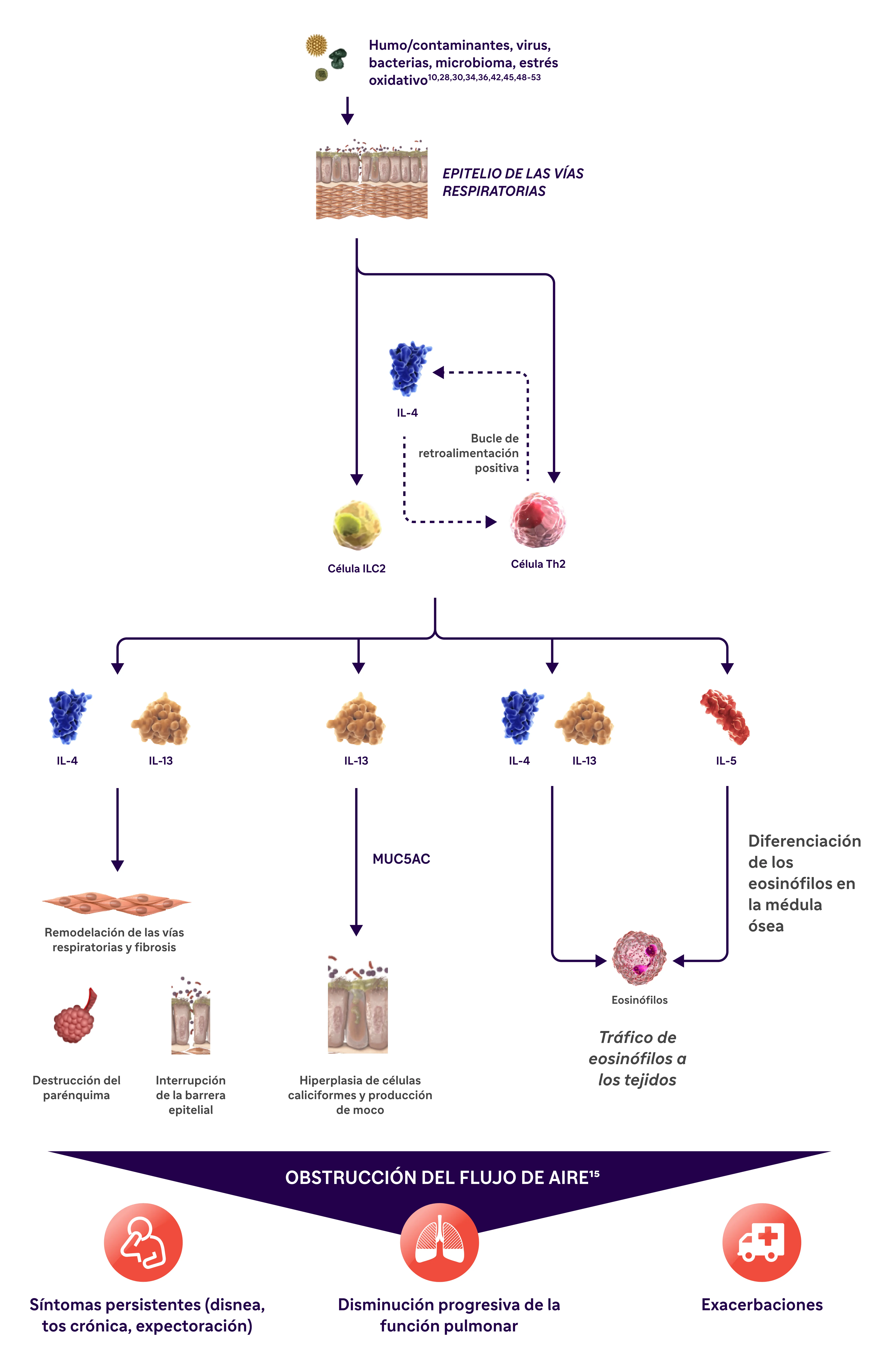
La inflamación de tipo 2 en la EPOC puede implicar múltiples vías, citocinas y células inflamatorias28-33
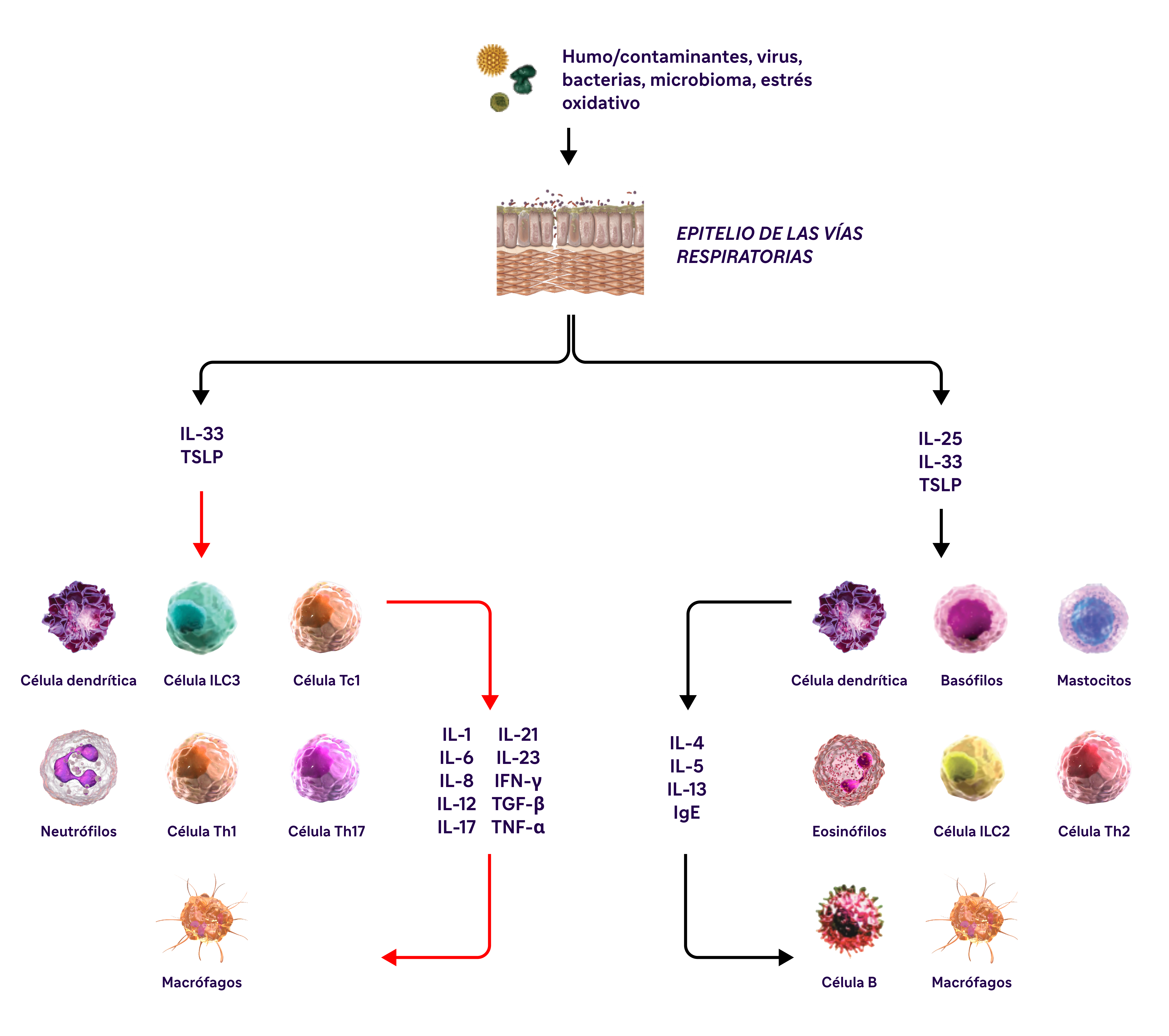
IL-4, IL-13 e IL-5 son citocinas de tipo 2 implicadas en la EPOC.



aBasado en los resultados de 5 estudios en pacientes con EPOC sin asma. Los niveles de eosinófilos utilizados para definir la inflamación de tipo 2 oscilaron entre ≥300 células/μL y ≥340 células/μL (sangre), ≥2% en esputo inducido o 3% en sangre periférica. Los porcentajes de pacientes con inflamación de tipo 2 oscilaron entre el 12,3% y el ~40%23,24
bUna exacerbación grave se definió como una hospitalización debida a EPOC. Las exacerbaciones tenían que estar separadas por un mínimo de 4 semanas para ser consideradas exacerbaciones separadas.27
cEn una cohorte de pacientes con EOS > 200 células/μL.26
dReproducido con autorización de la American Thoracic Society. Fritzsching B et al. Am J Respir Crit Care Med. 2015;191(8):902-91325
eTinción PAS con azul Alcian del moco en células epiteliales de las vías respiratorias.25
fResultados de un estudio observacional de 1553 pacientes con EPOC de grado 2-4 de espirometría GOLD (cociente FEV1/FVC posbroncodilatador <0,7, con FEV, >80% predicho)23.
gResultados de un estudio observacional de 1 año de 479 pacientes con EPOC, 173 de los cuales tenían niveles de eosinófilos en sangre ≥200 células/μL y/o ≥2% del recuento total de leucocitos.24
EPOC, enfermedad pulmonar obstructiva crónica; EOS, eosinófilos; FEV1, volumen espiratorio forzado en 1 segundo; FVC, capacidad vital forzada; GOLD, Iniciativa Global para la Enfermedad Pulmonar Obstructiva Crónica; IFN-y: interferón gamma; ILC2: células linfoides innatas de tipo 2; MUC5AC: mucina 5AC; PAS: ácido peryódico de Schiff; TNF-a: factor de necrosis tumoral alfa; TSLP: linfopoyetina del estroma tímico.
Referencias
1. Halpin DMG, Dransfield MT, Han MK, et al. The effect of exacerbation history on outcomes in the IMPACT trial. Eur Respir J. 2020;55:1901921. doi:10.1183/13993003.01921-2019
2. Suissa S, Dell’Anniello S, Ernst P. Long-term natural history of chronic obstructive pulmonary disease: severe exacerbations and mortality. Thorax. 2012;67(11):957-963.
3. Halpin DMG, Decramer M, Celli BR, Mueller A, Metzdorf N, Tashkin DP. Effect of a single exacerbation on decline in lung function in COPD. Respir Med. 2017;128:85-91.
4. Cosio Piqueras MG, Cosio MG. Disease of the airways in chronic obstructive pulmonary disease. Eur Respir J. 2001;18(suppl 34):41s-49s.
5. Tajti G, Gesztelyi R, Pak K, et al. Positive correlation of airway resistance and serum asymmetric dimethylarginine level in COPD patients with systemic markers of low-grade inflammation. Int J Chron Obstruct Pulmon Dis. 2017;12:873-884.
6. Higham A, Quinn AM, Cançado JED, Singh D. The pathology of small airways disease in COPD: historical aspects and future directions. Respir Res. 2019;20(1):49. doi:10.1186/s12931-019-1017-y
7. O’Donnell DE, Parker CM. COPD exacerbations. 3: Pathophysiology. Thorax. 200661(4):354-361.
8. Calverley PMA. Respiratory failure in chronic obstructive pulmonary disease. Eur Respir J. 2003;22:26s-30s.
9. Roussos C, Koutsoukou A. Respiratory failure. Eur Respir J. 2003;22(suppl 47):3s-14s.
10. Aghapour M, Raee P, Moghaddam SJ, Hiemstra PS, Heijink IH. Airway epithelial barrier dysfunction in chronic obstructive pulmonary disease: role of cigarette smoke exposure. Am J Respir Cell Mol Biol. 2018;58(2):157-169.
11. Brightling CE, Saha S, Hollins F. Interleukin-13: prospects for new treatment. Clin Exp Allergy. 2010;40(1):42-49.
12. Barberà JA, Peinado VI, Santos S. Pulmonary hypertension in chronic obstructive pulmonary disease. Eur Respir J. 2003;21(5):892-905.
13. Global Initiative for Chronic Obstructive Lung Disease. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease (2024 report). Accessed [February 9, 2024]. https://goldcopd.org/2024-gold-report-2/
14. Jones PW. St George’s Respiratory Questionnaire: MCID. COPD. 2005 Mar;2(1):75-79.
15. Jones P. St George’s Respiratory Questionnaire Manual. [Version 2.4, March 2022]. Accessed [February 9, 2024]. https://www.sgul.ac.uk/research/research-operations/research-administration/st-georges-respiratory-questionnaire/docs/SGRQ-Manual-March-2022.pdf
16. Evidera website. EXACT and E-RS:COPD content. Accessed [February 9, 2024]. https://www.evidera.com/what-we-do/patient-centered-research/coa-instrument-management-services/exact-program/ exact-content/
17. Leidy NK, Bushnell DM, Thach C, Hache C, Gutzwiller FS. Interpreting Evaluating Respiratory Symptoms in COPD diary scores in clinical trials: terminology, methods, and recommendations. Chronic Obstr Pulm Dis. 2022;9(4):576-590.
18. Oshagbemi OA, Franssen FME, van Kraaij S, et al. Blood eosinophil counts, withdrawal of inhaled corticosteroids and risk of COPD exacerbations and mortality in the clinical practice research datalink (CPRD). COPD. 2019;16(2):152-159.
19. Casanova C, Celli BR, de-Torres JP, et al. Prevalence of persistent blood eosinophilia: relation to outcomes in patients with COPD. Eur Respir J. 2017;50:1701162. doi:10.1183/13993003.01162-2017
20. Singh D, Kolsum U, Brightling CE, Locantore N, Agusti A, Tal-Singer R; ECLIPSE investigators. Eosinophilic inflammation in COPD: prevalence and clinical characteristics. Eur Respir J. 2014;44(6):1697-1700.
21. Bafadhel M, McKenna S, Terry S, et al. Acute exacerbations of chronic obstructive pulmonary disease: identification of biologic clusters and their biomarkers. Am J Respir Crit Care Med. 2011;184(6):662-671.
22. Oshagbemi OA, Burden AM, Braeken DCW, et al. Stability of blood eosinophils in patients with chronic obstructive pulmonary disease and in control subjects, and the impact of sex, age, smoking, and baseline counts. Am J Respir Crit Care Med. 2017;195(10):1402-1404.
23. Yun JH, Lamb A, Chase R, et al; COPDGene and ECLIPSE Investigators. Blood eosinophil count thresholds and exacerbations in patients with chronic obstructive pulmonary disease. J Allergy Clin Immunol. 2018;141(6):2037-2047.e10. doi:10.1016/j.jaci.2018.04.010
24. Bélanger M, Couillard S, Courteau J, et al. Eosinophil counts in first COPD hospitalizations: a comparison of health service utilization. Int J Chron Obstruct Pulmon Dis. 2018;13:3045-3054.
25. Fritzsching B, Zhou-Suckow Z, Trojanek JB, et al. Hypoxic epithelial necrosis triggers neutrophilic inflammation via IL-1 receptor signaling in cystic fibrosis lung disease. Am J Respir Crit Care Med. 2015;191(8):902-913.
26. Vedel-Krogh S, Nielsen SF, Lange P, Vestbo J, Nordestgaard BG. Blood eosinophils and exacerbations in chronic obstructive pulmonary disease. The Copenhagen General Population Study. Am J Respir Crit Care Med. 2016;193(9):965-974.
27. George L, Taylor AR, Esteve- Codina A, et al; U-BIOPRED and the EvA study teams. Blood eosinophil count and airway epithelial transcriptome relationships in COPD versus asthma. Allergy. 2020;75(2):370-380.
28. Yousuf A, Ibrahim W, Greening NJ, Brightling CE. T2 biologics for chronic obstructive pulmonary disease. J Allergy Clin Immunol Pract. 2019;7(5):1406-1416.
29. Barnes PJ. Inflammatory endotypes in COPD. Allergy. 2019;74(7):1249-1256.
30. Oishi K, Matsunaga K, Shirai T, Hirai K, Gon Y. Role of type 2 inflammatory biomarkers in chronic obstructive pulmonary disease. J Clin Med. 2020;9(8):2670. doi:10.3390/jcm9082670
31. Gabryelska A, Kuna P, Antczak A, Białasiewicz P, Panek M. IL-33 mediated inflammation in chronic respiratory diseases—understanding the role of the member of IL-1 superfamily. Front Immunol. 2019;10:692. doi:10.3389/fimmu.2019.00692
32. Allinne J, Scott G, Lim WK, et al. IL-33 blockade affects mediators of persistence and exacerbation in a model of chronic airway inflammation. J Allergy Clin Immunol. 2019;144(6):1624-1637.e10.
33. Calderon AA, Dimond C, Choy DF, et al. Targeting interleukin-33 and thymic stromal lymphopoietin pathways for novel pulmonary therapeutics in asthma and COPD. Eur Respir Rev. 2023;32(167):220144. doi:10.1183/16000617.0144-2022
34. Gandhi NA, Bennett BL, Graham NMH, Pirozzi G, Stahl N, Yancopoulos D. Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov. 2016;15(1):35-50.
35. Rosenberg HF, Phipps S, Foster PS. Eosinophil trafficking in allergy and asthma. J Allergy Clin Immunol. 2007;119(6):1303-1310.
36. Doyle AD, Mukherjee M, LeSuer WE, et al. Eosinophil-derived IL-13 promotes emphysema. Eur Respir J. 2019;53(5):1801291. doi:10.1183/13993003.01291-2018
37. Barnes PJ. Inflammatory mechanisms in patients with chronic obstructive pulmonary disease. J Allergy Clin Immunol. 2016;138(1):16-27.
38. Defrance T, Carayon P, Billian G, et al. Interleukin 13 is a B cell stimulating factor. J Exp Med. 1994;179(1):135-143.
39. Yanagihara Y, Ikizawa K, Kajiwara K, Koshio T, Basaki Y, Akiyama K. Functional significance of IL-4 receptor on B cells in IL-4– induced human IgE production. J Allergy Clin Immunol. 1995;96(6 pt 2):1145-1151.
40. Gandhi NA, Pirozzi G, Graham NMH. Commonality of the IL-4/IL-13 pathway in atopic diseases. Expert Rev Clin Immunol. 2017;13(5):425-437.
41. Kaur D, Hollins F, Woodman L, et al. Mast cells express IL-13Rα1: IL-13 promotes human lung mast cell proliferation and FcεRI expression. Allergy. 2006;61(9):1047-1053.
42. Saatian B, Rezaee F, Desando S, et al. Interleukin-4 and interleukin-13 cause barrier dysfunction in human epithelial cells. Tissue Barriers. 2013;1(2):e24333. doi:10.4161/tisb.24333
43. Zheng T, Zhu Z, Wang Z, et al. Inducible targeting of IL-13 to the adult lung causes matrix metalloproteinase– and cathepsin-dependent emphysema. J Clin Invest. 2000;106(9):1081-1093.
44. Garudadri S, Woodruff PG. Targeting chronic obstructive pulmonary disease phenotypes, endotypes, and biomarkers. Ann Am Thorac Soc. 2018;15(suppl 4):S234-S238.
45. Alevy YG, Patel AC, Romero AG, et al. IL-13–induced airway mucus production is attenuated by MAPK13 inhibition. J Clin Invest. 2012;122(12):4555-4568.
46. Singanayagam A, Footitt J, Marczynski M, et al. Airway mucins promote immunopathology in virus-exacerbated chronic obstructive pulmonary disease. J Clin Invest. 2022;132(8):e12901. doi:10.1172/JCI120901
47. Zhu Z, Homer RJ, Wang Z, et al. Pulmonary expression of interleukin-13 causes inflammation, mucus hypersecretion, subepithelial fibrosis, physiologic abnormalities, and eotaxin production. J Clin Invest. 1999;103(6):779-788.
48. Cooper PR, Poll CT, Barnes PJ, Sturton RG. Involvement of IL-13 in tobacco smoke-induced changes in the structure and function of rat intrapulmonary airways. Am J Respir Cell Mol Biol. 2010;43(2):220-226.
49. Arora S, Dev K, Agarwal B, Das P, Syed MA. Macrophages: their role, activation, and polarization in pulmonary diseases. Immunobiology. 2018;223(4-5):383-396.
50. He S, Xie L, Lu J, Sun S. Characteristics and potential role of M2 macrophages in COPD. Int J Chron Obstruct Pulmon Dis. 2017;12:3029-3039.
51. Wang X, Xu C, Ji J, et al. IL-4/IL-13 upregulates Sonic hedgehog expression to induce allergic airway epithelial remodeling. Am J Physiol Lung Cell Mol Physiol. 2020;318(5):L888-L899.
52. Linden D, Guo-Parke H, Coyle PV, et al. Respiratory viral infection: a potential “missing link” in the pathogenesis of COPD. Eur Respir Rev. 2019;28(151):180063. doi:10.1183/16000617.0063-2018
53. Wang Z, Bafadhel M, Haldar K, et al. Lung microbiome dynamics in COPD exacerbations. Eur Respir J. 2016;47(4):1082-1092.
MAT-ES-2402661- V1- Noviembre 2024