- Artículo
- Fuente: Campus Sanofi
- 16 may 2024
La carga y el riesgo de exacerbaciones en la EPOC según el Dr. Surya Bhatt

Me llamo Surya Bhatt. Soy profesor de medicina en la Universidad de Alabama en Birmingham e investigador de la EPOC. Esta charla está patrocinada por Sanofi y Regeneron, y no obtendrá ningún crédito CME. Otra cosa muy importante en la EPOC son las exacerbaciones agudas. Y éstas no son sólo un inconveniente, sino que están asociadas a una progresión significativa de la enfermedad. Ahora hay muchos datos que sugieren que estas exacerbaciones están asociadas con el declive de la función pulmonar. Suelen estar causadas por infecciones, como virus e infecciones bacterianas, a veces debidas a la contaminación ambiental y a exposiciones ocupacionales. Independientemente de la causa, la gravedad viene determinada por el lugar donde se tratan, lo cual no es lo ideal. Pero si consiguen ajustar los esteroides y antibióticos en casa, eso se clasifica como una exacerbación moderada. Pero si es lo suficientemente grave como para terminar en el hospital, y luego que causa una exacerbación grave y la gente va a sufrir de exacerbaciones, tienen una tasa más rápida de deterioro de la función pulmonar que los que no tienen exacerbaciones en absoluto. Y aquí a la derecha están los datos del estudio del gen de la EPOC en el que observaron el descenso del FEV uno por exacerbación o la frecuencia de las exacerbaciones.
Y especialmente para exacerbaciones severas y especialmente para aquellos con enfermedad más leve que tienen más función pulmonar que perder, el efecto puede ser bastante dramático. El descenso del FEV puede ser de hasta 87 mm en una exacerbación grave, por ejemplo. Y como puedes imaginar, si tienes 4 o 5 exacerbaciones, puedes perder hasta medio metro de fev1 en los siguientes 4 o 5 años. Las exacerbaciones graves parecen ser acontecimientos centinela en el curso de los pacientes con EPOC. Cuando alguien sufre una primera exacerbación parece que engendra más exacerbaciones. En un estudio retrospectivo realizado por Sammy Sosa de unos 75.000 pacientes en Canadá. Modeló la frecuencia de las exacerbaciones graves y descubrió que el intervalo medio habitual entre una primera y una segunda exacerbación es de unos cinco años y medio, y luego las exacerbaciones se producen a intervalos progresivamente más cortos hasta el punto de que alrededor de la décima exacerbación el intervalo medio es de unos cuatro meses. Así que se puede imaginar a un paciente en unos pocos años estableciendo un patrón de 3 a 4 exacerbaciones que necesitan hospitalización en un solo año.
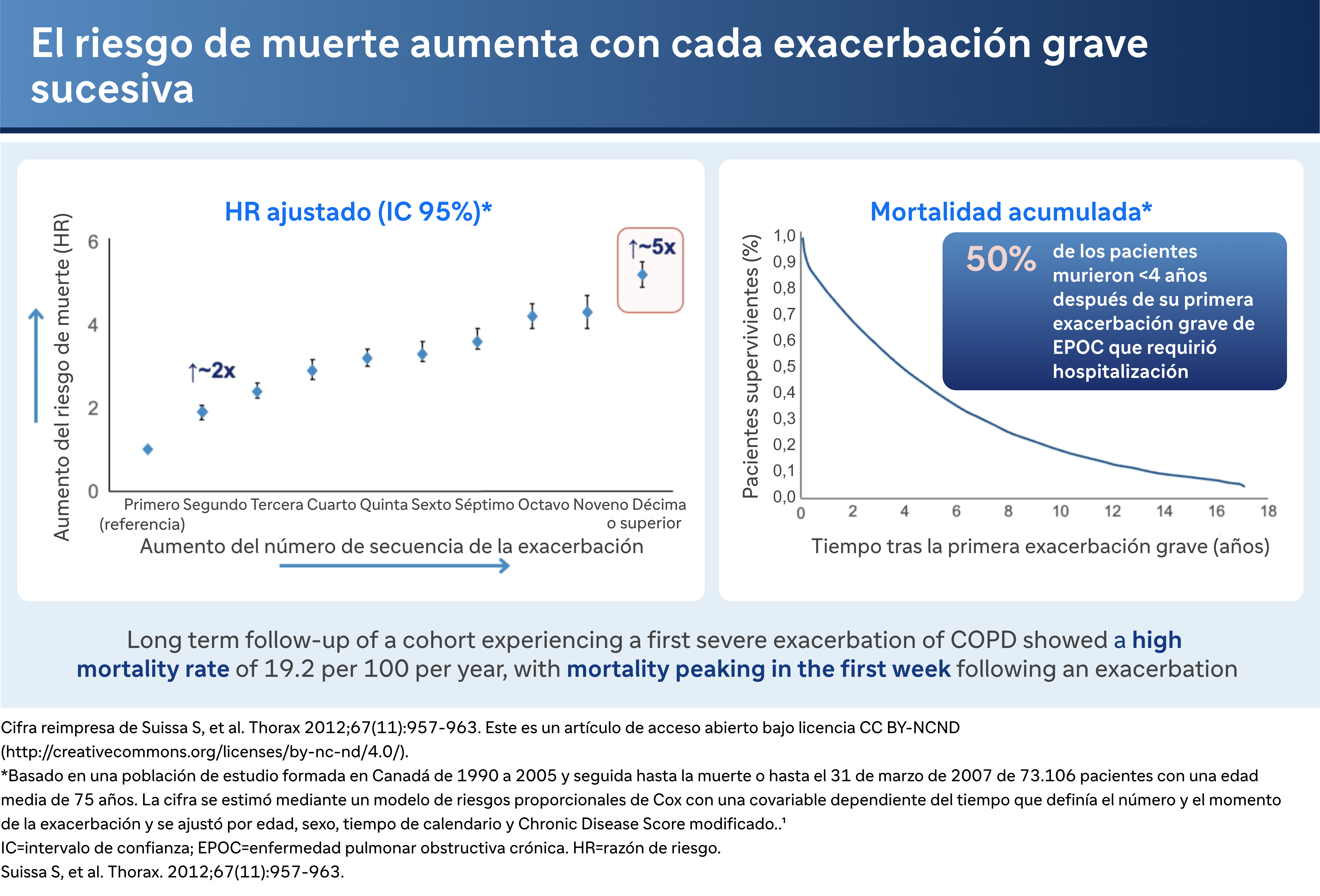
Y esto no deja de tener consecuencias. Este tipo de exacerbaciones pueden repercutir en la mortalidad. El riesgo de mortalidad es aproximadamente el doble. Si usted tiene dos exacerbaciones graves en comparación con una exacerbación grave. Y el riesgo de mortalidad es cinco veces mayor. Si tienes diez exacerbaciones en comparación con una exacerbación severa. Así que hay casi un aumento monotónico en los riesgos con el aumento de la frecuencia de las exacerbaciones graves. Y la curva de la derecha muestra el riesgo de morir tras una única exacerbación grave que requiera hospitalización. La mortalidad en el plazo de un año es del 25%, y la mortalidad en los cuatro años siguientes al alta tras la primera exacerbación grave es del 50%.
¿Qué es la EPOC?
La EPOC es una enfermedad pulmonar inflamatoria crónica que provoca la obstrucción del flujo de aire de los pulmones. Los síntomas incluyen dificultad para respirar, tos, producción de mucosidad (esputo) y sibilancias. Suele estar causada por una exposición prolongada a gases o partículas irritantes, en la mayoría de los casos procedentes del humo del tabaco. Las personas con EPOC corren un mayor riesgo de padecer cardiopatías, cáncer de pulmón y otras afecciones.
El papel crítico de las exacerbaciones en la progresión de la EPOC
El Dr. Bhatt subraya que las exacerbaciones agudas de la EPOC no son meros inconvenientes, sino que son acontecimientos fundamentales que influyen significativamente en la evolución de la enfermedad. "Otra cosa muy importante en la EPOC son las exacerbaciones agudas. Y éstas no son sólo un inconveniente, sino que se asocian a una progresión significativa de la enfermedad", afirma. Las exacerbaciones suelen estar desencadenadas por infecciones, como virus e infecciones bacterianas, o por la contaminación ambiental y las exposiciones ocupacionales.
Impacto en la función pulmonar
Las exacerbaciones tienen un profundo impacto en la función pulmonar, y hay datos que sugieren una relación entre las exacerbaciones y el deterioro acelerado de la función pulmonar. El Dr. Bhatt señala: "Hay muchos datos que sugieren que estas exacerbaciones se asocian a un deterioro de la función pulmonar". Este declive es más grave en el caso de las exacerbaciones frecuentes. Por ejemplo, cita el estudio COPD Gene, que muestra cómo la frecuencia de las exacerbaciones se correlaciona con la tasa de disminución del FEV1, una medida de la función pulmonar.
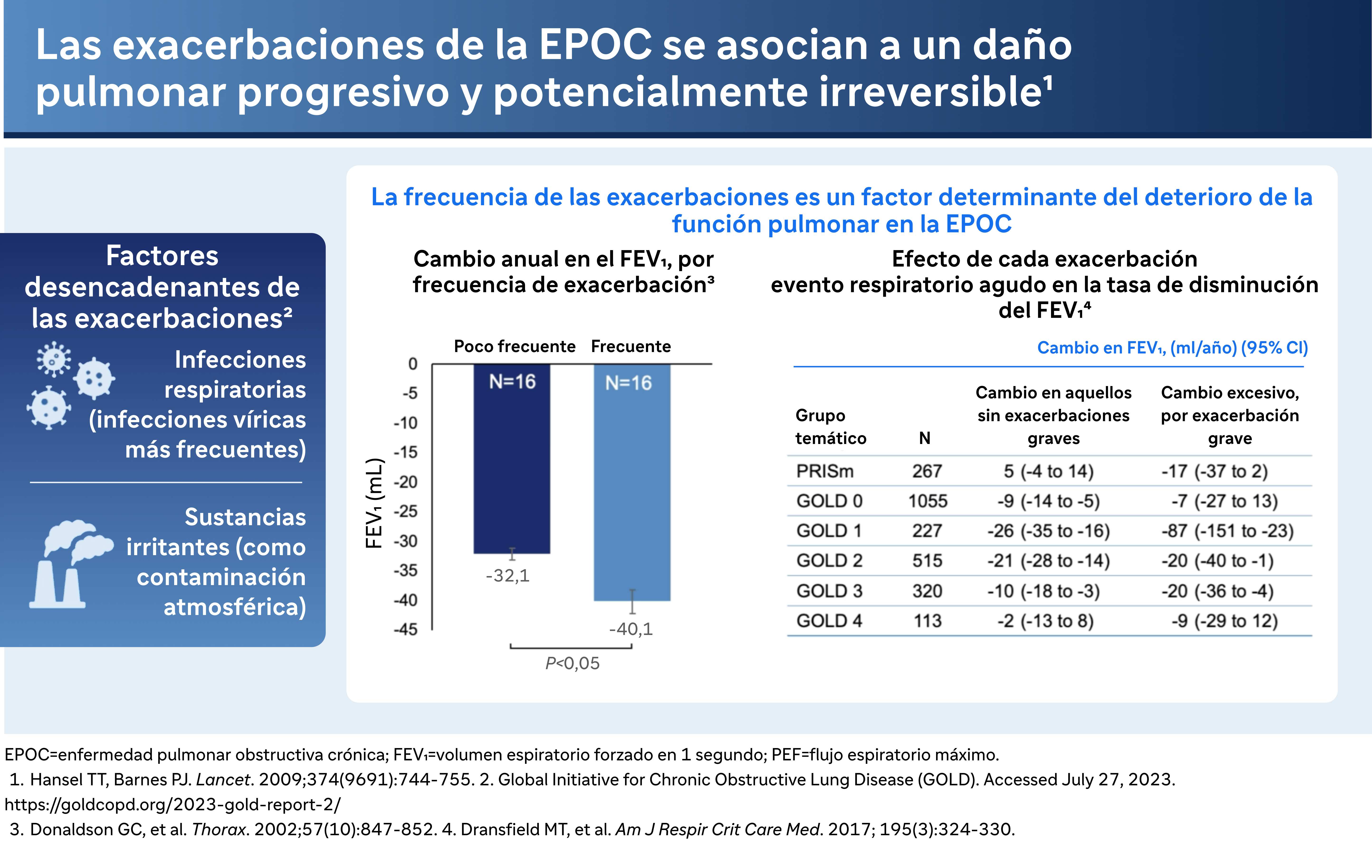
Gravedad y tratamiento
La gravedad de las exacerbaciones puede variar, lo que afecta significativamente a los enfoques de tratamiento y a los resultados. "Si consiguen ajustar los corticoides y los antibióticos en casa, eso se clasifica como una exacerbación moderada. Pero si es lo bastante grave como para acabar en el hospital, entonces se trata de una exacerbación grave", explica el Dr. Bhatt. La distinción entre exacerbaciones moderadas y graves es crucial, pues determina el protocolo de tratamiento inmediato y la estrategia de gestión a largo plazo.
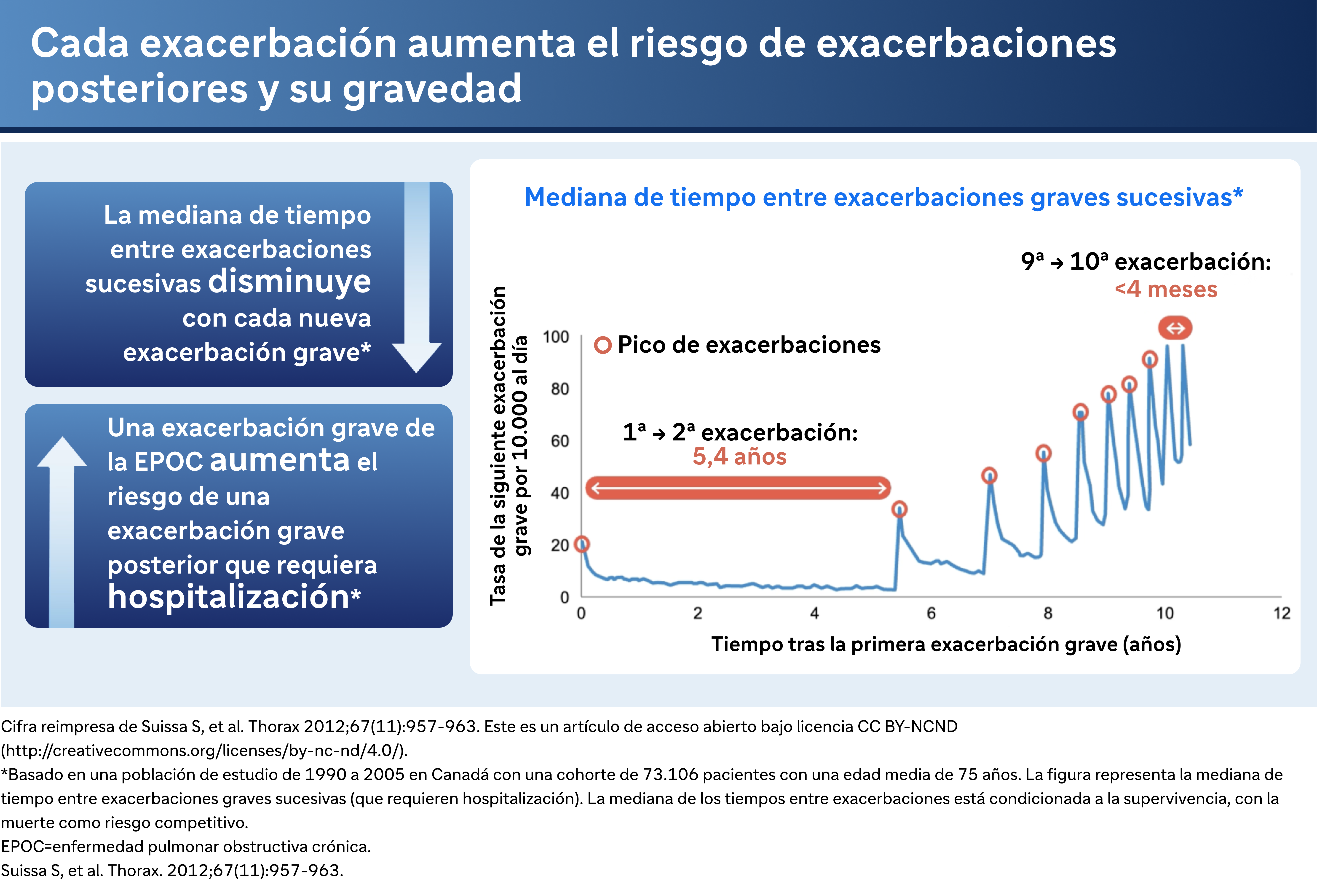
Efectos en cascada de las exacerbaciones graves
Las exacerbaciones graves son especialmente preocupantes por sus efectos en cascada sobre la salud. El Dr. Bhatt comenta un estudio de Sammy Sosa, que modelizó la frecuencia de las exacerbaciones graves entre unos 75.000 pacientes de Canadá. El estudio descubrió que el intervalo entre exacerbaciones tiende a disminuir con el tiempo, lo que indica un patrón de empeoramiento de la enfermedad. "Cuando alguien sufre una primera exacerbación, parece que presenta más exacerbaciones", explica.
Riesgos de mortalidad
Los riesgos de mortalidad asociados a las exacerbaciones graves son evidentes. El Dr. Bhatt subraya: "El riesgo de mortalidad es aproximadamente el doble si se sufren dos exacerbaciones graves que si se sufre una. Y el riesgo de mortalidad se quintuplica si se sufren diez exacerbaciones frente a una exacerbación grave". Además, el riesgo de morir en el plazo de un año tras una exacerbación grave que requiera hospitalización es de aproximadamente el 25%, que aumenta al 50% en los cuatro años siguientes al alta.
En resumen
Las ideas aportadas por el Dr. Surya Bhatt ilustran las graves implicaciones de las exacerbaciones de la EPOC. Comprender los factores desencadenantes, la frecuencia y la gravedad de estas exacerbaciones es crucial para tratar la EPOC con eficacia. A medida que la investigación sigue evolucionando, es esencial que los profesionales sanitarios se mantengan informados sobre las mejores prácticas para tratar y controlar las exacerbaciones con el fin de mejorar la calidad de vida de los pacientes con EPOC. Además, las estrategias preventivas, como dejar de fumar y reducir la exposición a contaminantes, siguen siendo componentes clave del tratamiento de la EPOC. Mediante un enfoque integral que incluya tanto la prevención como el tratamiento eficaz de las exacerbaciones, el impacto de la EPOC puede mitigarse significativamente.
Referencias
- Gandhi NA, Bennett BL, Graham NMH, et al. Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov. 2016;15(1):35-50.
- Yousuf A, Ibrahim W, Greening NJ, et al. T2 Biologics for Chronic Obstructive Pulmonary Disease. J Allergy Clin Immunol Pract. 2019;7(5):1405-1416.
- Aghapour M, Raee P, Moghaddam SJ, et al. Airway Epithelial Barrier Dysfunction in Chronic Obstructive Pulmonary Disease: Role of Cigarette Smoke Exposure. Am J Respir Cell Mol Biol. 2018;58(2):157-169.
- Barnes JP. Inflammatory endotypes in COPD. Allergy. 2019;74(7):1249-1256.
- Wang Z, Bafadhel M, Haldar K, et al. Lung microbiome dynamics in COPD exacerbations. Eur Respir J. 2016;47(4):1082-1092.
- Smithgall MD, Comeau MR, Yoon BRP, et al. IL-33 amplifies both Th1- and Th2-type responses through its activity on human basophils, allergen-reactive Th2 cells, iNKT and NK cells. Int Immunol. 2008;20(8):1019-1030.
- Senra L, Mylonas A, Kavanagh RD, et al. IL-17E (IL-25) enhances innate immune responses during skin inflammation. J Invest Dermatol. 2019;139(8):1732-1742.
- Linden D, Guo-Parke H, Coyle PV, et al. Respiratory viral infection: a potential “missing link” in the pathogenesis of COPD. Eur Respir Rev. 2019; 28(151):180063.
- Global Initiative for Chronic Obstructive Lung Disease (GOLD). Accessed April 04, 2025. https://goldcopd.org/2023-gold-report-2/.
- Calderon AA, Dimond C, Choy DF, et al. Targeting interleukin-33 and thymic stromal lymphopoietin pathways for novel pulmonary therapeutics in asthma and COPD. Eur Respir Rev. 2023;32(167):220144.
- Kurokawa M, Matsukura S, Kawaguchi M, et al. Interleukin-33-activated dendritic cells induce the production of thymus and activation-regulated chemokine and macrophage-derived chemokine. Int Arch Allergy Immunol. 2013;161(Suppl 2):52-57.
- Griesenauer B, Paczesny S. The ST2/IL-33 axis in immune cells during inflammatory diseases. Front Immunol. 2017;8:475.
- Borowczyk J, Shutova M, Brembilla NC, et al. IL-25 (IL-17E) in epithelial immunology and pathophysiology. J Allergy Clin Immunol. 2021;148(1):40-52.
- Claudio E, Wang H, Kamenyeva O, et al. IL-25 orchestrates activation of Th cells via conventional dendritic cells in tissue to exacerbate chronic house dust mite–induced asthma pathology. J Immunol. 2019;203(8)2319-2327.
- Kotlyarov S. Involvement of the innate immune system in the pathogenesis of chronic obstructive pulmonary disease. Int J Mol Sci. 2022;23(2):985.
- Gandhi NA, Pirozzi G, Graham NMH. Commonality of the IL-4/IL-13 pathway in atopic diseases. Expert Rev Clin Immunol. 2017;13(5):425-437.
- Saatian B, Rezaee F, Desando S, et al. Interleukin-4 and interleukin-13 cause barrier dysfunction in human airway epithelial cells. Tissue Barriers. 2013;1(2):e24333.
- Zheng T, Zhu Z, Wang Z, et al. Inducible targeting of IL-13 to the adult lung causes matrix metalloproteinase- and cathepsin-dependent emphysema. J Clin Invest. 2000;106(9):1081-1093.
- Zhu Z, Homer RJ, Wang Z, et al. Pulmonary expression of interleukin-13 causes inflammation, mucus hypersecretion, subepithelial fibrosis, physiologic abnormalities, and eotaxin production. J Clin Invest. 1999;103(6):779-788.
- Alevy YG, Patel AC, Romero AG, et al. IL-13-induced airway mucus production is attenuated by MAPK13 inhibition. J Clin Invest. 2012;122(12):4555-4568.
- Wang X, Xu C, Ji J, et al. IL-4/IL-13 upregulates Sonic hedgehog expression to induce allergic airway epithelial remodeling. Am J Physiol Lung Cell Mol Physiol. 2020;318(5):L888-L899.
- Cooper PR, Poll CT, Barnes PJ, et al. Involvement of IL-13 in tobacco smoke-induced changes in the structure and function of rat intrapulmonary airways. Am J Respir Cell Mol Biol. 2010;43(2):220-226.
- Doyle AD, Mukherjee M, LeSuer WE, et al. Eosinophil-derived IL-13 promotes emphysema. Eur Respir J. 2019;53(5):1801291.
- Sun J, Liu T, Yan Y, et al. The role of Th1/Th2 cytokines played in regulation of specific CD4+ Th1 cell conversion and activation during inflammatory reaction of chronic obstructive pulmonary disease. Scand J Immunol. 2018;88(1):e12674.
- Kim CH, Kim KE, Yoon JH, et al. Upregulation of MUC5AC gene expression by IL-4 through CREB in Human airway epithelial cells. J Cell Biochem. 2009;108(4):974-981.
- Yu H, Li Q, Kolosov VP, et al. Interleukin-13 induces mucin 5AC production involving STAT6/SPDEF in human airway epithelial cells. Cell Commun Adhes. 2010;17(4-6):83-92.
MAT-ES-2501000- V1- Marzo 2025