- Artículo
- Fuente: Campus Sanofi
- 7 abr 2025
Revisión de las implicaciones clínicas de la estabilidad y capacidad predictiva de los eosinófilos en la EPOC
¿Influyen los eosinófilos en la EPOC?
En la EPOC, el aumento de los niveles de eosinófilos (EOS) en sangre se asocia con la inflamación de tipo 21 y se ha relacionado con un mayor riesgo de exacerbaciones.2 Comprender el papel de los niveles de EOS y su evolución a lo largo del tiempo puede ser importante para que los médicos fenotipen a sus pacientes y evalúen el riesgo potencial de exacerbación.3 Sin embargo, se justifica un periodo de retrospectiva al evaluar los niveles de EOS en pacientes porque los niveles de EOS pueden fluctuar como resultado del tratamiento.4
Más información sobre el papel de la inflamación de tipo 2 en la EPOC
Endotipo de inflamación eosinofílica
La inflamación eosinofílica es un endotipo estable. El estudio AERIS investigó la estabilidad de este fenotipo a lo largo del tiempo. Los resultados del estudio demostraron que la inflamación eosinofílica (recuento de EOS en sangre ≥2%) es frecuente en el momento de la exacerbación en pacientes con EOS predominantemente elevada durante el estado estable.5 La probabilidad de que una exacerbación fuera eosinofílica era nueve veces mayor en pacientes con EOS en sangre ≥2% que en aquellos con EOS en sangre <2% en el momento de la inclusión (OR = 9,16; IC del 95%: 4,10-20,47; p <0 ,001).5
¿Qué se sabe sobre la estabilidad de los niveles de EOS?
Estabilidad temporal de los niveles de EOS
El concepto de estabilidad temporal se refiere a la consistencia de un biomarcador a lo largo del tiempo.6 En un estudio de Landis et al., los recuentos de EOS en sangre tomados durante la EPOC estable fueron razonablemente reproducibles.7
Un estudio de Long et al. proporciona datos sólidos sobre la estabilidad temporal de los niveles de EOS en pacientes con EPOC.En su análisis de 225 pacientes de la cohorte COPDMAP, Long y sus colegas investigaron la estabilidad de la EOS a lo largo de 1 año utilizando los umbrales de EPOC de la GOLD 2019 (<100,100-<300 y ≥300 EOS/μL).8 Descubrieron que el 69,3% de los pacientes tenían una buena estabilidad de los niveles de EOS desde el inicio hasta 1 año (mediciones tomadas durante el estado estable) dentro de los mismos umbrales de EPOC de la GOLD 2019.8 Esta estabilidad temporal indica que los niveles de EOS medidos durante la fase estable de la EPOC no son fluctuaciones aleatorias, sino que reflejan un fenotipo inflamatorio subyacente y consistente. Además, el estudio demostró que los pacientes (sin exacerbación, 66,7% pacientes; ≥1 exacerbación, 72,7% pacientes; ≥2 exacerbaciones, 74,3% pacientes) tenían niveles estables de EOS en sangre durante 1 año cuando se estratificaban en subgrupos según el número de exacerbaciones en un año.8
Asociación entre los niveles de EOS y el riesgo de exacerbaciones futuras9,10
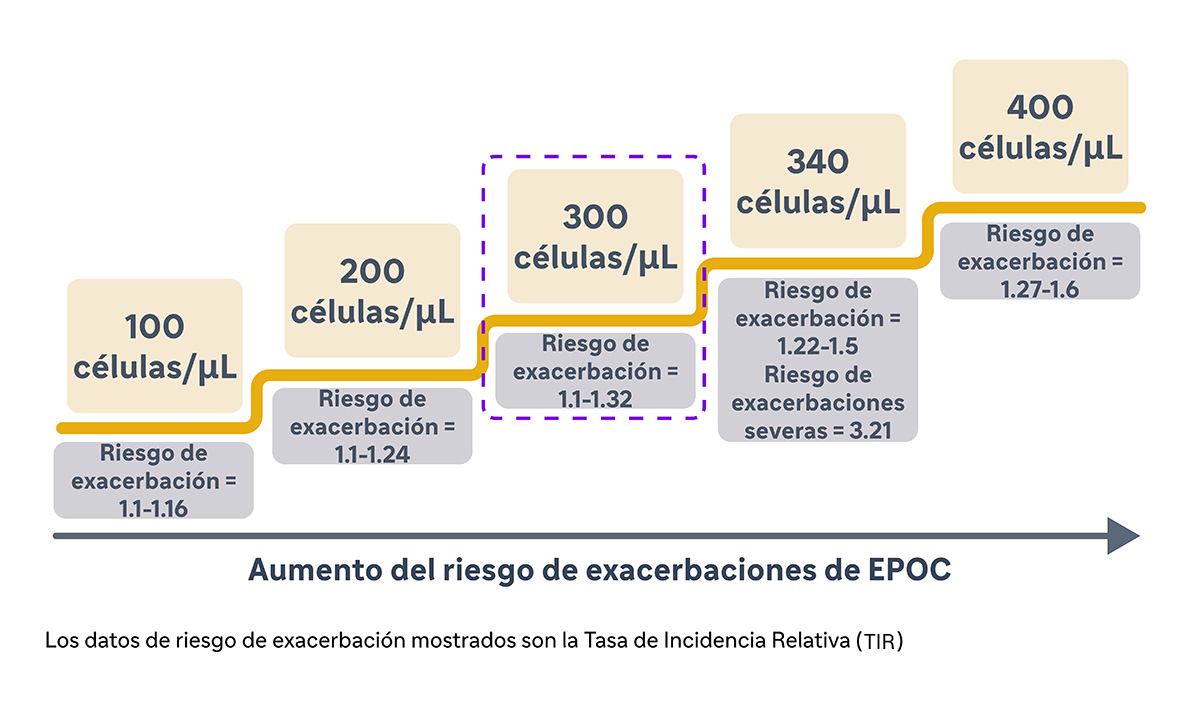
Yun et al. validaron de forma prospectiva la asociación del aumento de los niveles de EOS con las exacerbaciones en la EPOC en el estudio ECLIPSE.9 En este estudio, los investigadores midieron los niveles de EOS durante la fase estable y realizaron un seguimiento de la aparición de exacerbaciones durante un periodo de 3 años.9 Descubrieron que un nivel elevado de EOS (≥300 células/μL) al inicio del estudio durante la fase estable era un factor predictivo constante del riesgo de exacerbaciones en el año siguiente (TIR = 1,20; IC del 95%: 1,05-1,36 a 1 año).9 En concreto, el riesgo de exacerbación era mayor en pacientes con niveles de EOS persistentemente elevados (frente a bajos), lo que indicaba que dichos pacientes presentaban el mayor riesgo. Además, el estudio reveló que la capacidad predictiva de los niveles de EOS se extendía más allá de un año (TIR = 1,22; IC del 95%: 1,06-1,42 para todo el periodo de estudio).9 Los pacientes con niveles elevados de EOS tenían sistemáticamente más probabilidades de sufrir una exacerbación a lo largo de 3 años. Esta capacidad de predicción ampliada subraya la utilidad del nivel de EOS como predictor a largo plazo del riesgo de exacerbación, lo que permite estrategias de tratamiento tempranas y proactivas.9

Impacto del uso de corticosteroides orales en los niveles de EOS en sangre en pacientes con EPOC
Prazma et al. observaron una relación lineal inversa entre los niveles de EOS en sangre y la dosis de corticosteroides orales (CSO) en pacientes con asma grave, con un aumento de los niveles de EOS en sangre del 41% por cada disminución de 5 mg/día en la dosis de CSO.11 Hasta donde sabemos, el impacto del uso de CSO en los niveles de EOS en sangre no se ha estudiado en pacientes con EPOC. Sin embargo, se sabe que el uso de OCS suprime los niveles de EOS en pacientes con EPOC.12 Un estudio informó de una reducción significativa de seis veces en los recuentos de EOS en esputo, tras el uso diario de OCS durante 2 semanas.13 La medición de los niveles de EOS en pacientes cuyos niveles están suprimidos debido a la administración de OCS podría proporcionar una evaluación inexacta de los niveles de EOS.12
Más información sobre los eosinófilos en sangre como biomarcador en pacientes con EPOC
¿Cuáles son las implicaciones clínicas de la estabilidad y la capacidad predictiva de la EOS?
Las pruebas que respaldan la estabilidad8 y la capacidad predictiva a largo plazo9 de los niveles de EOS en la EPOC tienen importantes implicaciones clínicas. Al identificar a los pacientes con niveles de EOS elevados de forma constante, los profesionales sanitarios pueden estratificar a los pacientes en función de su riesgo de exacerbaciones futuras. Esta estratificación puede guiar las decisiones de tratamiento, en particular el uso de ACO,14 inhalados (CSI)15 o biológicos16 dirigidos contra la inflamación de tipo 2. Por ejemplo, un paciente con EPOC con niveles sistemáticamente elevados de EOS (>300 células/μL) durante la fase estable puede ser un candidato ideal para una intervención precoz con CSI,15 que ha demostrado reducir la frecuencia y gravedad de las exacerbaciones en la EPOC eosinofílica.17,18 Por el contrario, la ausencia de niveles elevados de EOS en sangre de >2% puede ayudar a identificar un subgrupo con un impacto adverso de los CSO en su recuperación.14 La estabilidad de los niveles de EOS a lo largo del tiempo permite a los clínicos monitorizar estos niveles como parte de la atención rutinaria, lo que facilita la identificación de cambios en el perfil inflamatorio del paciente y el ajuste del tratamiento en consecuencia.
Si desea más información sobre cómo tratar a los pacientes con EPOC, consulte las Recomendaciones GOLD para el tratamiento y manejo de la EPOC.

La capacidad de predicción a largo plazo de los niveles de EOS en sangre9 es especialmente útil, ya que permite a los profesionales sanitarios anticipar y mitigar el riesgo de exacerbaciones, que son una de las principales causas de morbilidad y costes sanitarios en la EPOC.14,19,20
¿Cómo pueden incorporarse las mediciones de la EOS a la práctica clínica?
La incorporación de las mediciones de EOS a la gestión rutinaria de la EPOC requiere una cuidadosa consideración de los umbrales de datos y del contexto clínico específico. El umbral de ≥300 células/μL se utiliza habitualmente para definir los niveles elevados de EOS,9 basándose en la evidencia de múltiples estudios, incluido el de Yun et al.9 Sin embargo, existe cierta variabilidad en el umbral óptimo en función de la población de pacientes y los resultados específicos que se predicen.21
En la práctica, la medición de los niveles de EOS durante la fase estable de la EPOC puede integrarse fácilmente en los análisis de sangre rutinarios.22 Dada la evidencia de estabilidad temporal, una sola medición puede proporcionar una evaluación fiable del fenotipo eosinofílico del paciente.7 Los pacientes con niveles elevados de EOS deben ser monitorizados estrechamente para detectar signos de exacerbación,23 y debe considerarse el inicio temprano de los CSI.1 Actualmente se están llevando a cabo varios ensayos clínicos para evaluar el papel de las terapias dirigidas a la inflamación de tipo 2 en la EPOC con niveles elevados de EOS.24
Además, la capacidad predictiva de los niveles de EOS significa que estas mediciones pueden informar sobre las estrategias de tratamiento a largo plazo. Por ejemplo, los pacientes con niveles basales elevados de EOS pueden requerir un seguimiento más intensivo y un umbral más bajo para intensificar el tratamiento en caso de signos tempranos de exacerbación. Este enfoque proactivo puede ayudar a reducir la frecuencia y gravedad de las exacerbaciones, mejorando en última instancia los resultados de los pacientes y reduciendo la carga de los sistemas sanitarios.22
Retos y orientaciones futuras
Aunque las pruebas que apoyan el uso de los niveles de EOS como biomarcador en la EPOC son convincentes, aún quedan varios retos. Uno de ellos es la variabilidad de los niveles de EOS debida a factores externos como infecciones,25 medicaciones,21 y exposiciones ambientales.26 Estos factores pueden influir en los niveles de EOS y confundir potencialmente su valor predictivo. Por lo tanto, es esencial en los medicamentos que los médicos interpreten las mediciones de EOS en el contexto del cuadro clínico general del paciente y consideren la posibilidad de repetir las mediciones si es necesario.
Otro reto es la necesidad de seguir investigando para refinar los umbrales de los niveles de EOS en diferentes escenarios clínicos. Si bien el umbral de ≥300 células/μL se utiliza ampliamente, se necesitan más datos para establecer los puntos de corte óptimos para diferentes poblaciones de pacientes y para validar estos umbrales en diversos escenarios clínicos.23
La investigación futura también debe explorar el potencial de combinar los niveles de EOS con otros biomarcadores y características clínicas para mejorar la precisión predictiva. Por ejemplo, la integración de las mediciones de EOS con marcadores de inflamación de las vías respiratorias27 o con características clínicas como el historial de exacerbaciones,28 podría proporcionar una herramienta de evaluación del riesgo más completa para los pacientes con EPOC.
Referencias
- Singh D. Blood eosinophil counts in chronic obstructive pulmonary disease: a biomarker of inhaled corticosteroid effects. Tuber Respir Dis (Seoul). 2020;83(3):185–194. Doi: 10.4046/trd.2020.0026. PMID: 32578413.
- Komura M, Sato T, Suzuki Y, Yoshikawa H, Nitta NA, Hayashi M, Kawasaki E, Horikoshi K, Nishioki T, Mori M, Kodama Y, Sasaki S, Takahashi K. Blood Eosinophil Count as a Predictive Biomarker of Chronic Obstructive Pulmonary Disease Exacerbation in a Real-World Setting. Can Respir J. 2023 May 25;2023:3302405. doi: 10.1155/2023/3302405. PMID: 37275320; PMCID: PMC10234729.
- David B, Bafadhel M, Koenderman L, De Soyza A. Eosinophilic inflammation in COPD: from an inflammatory marker to a treatable trait. Thorax. 2021 Feb;76(2):188-195. doi: 10.1136/thoraxjnl-2020-215167. Epub 2020 Oct 29. PMID: 33122447; PMCID: PMC7815887.
- Sivapalan P, Bikov A, Jensen JU. Using Blood Eosinophil Count as a Biomarker to Guide Corticosteroid Treatment for Chronic Obstructive Pulmonary Disease. Diagnostics (Basel). 2021 Feb 3;11(2):236. doi: 10.3390/diagnostics11020236. PMID: 33546498; PMCID: PMC7913607.
- Kim VL, Coombs NA, Staples KJ, Ostridge KK, Williams NP, Wootton SA, Devaster JM, Aris E, Clarke SC, Tuck AC, Bourne SC. Impact and associations of eosinophilic inflammation in COPD: analysis of the AERIS cohort. Eur Respir. 2017;50(4). doi: 10.1183/13993003.00853-2017. PMID: 29025891.
- Walsh CP, Lindsay EK, Grosse P, Natale BN, Fairlie S, Bwint A, Schaffer L, McMahon K, Del Duke C, Forse J, Lamonja-Vicente N. A systematic review and meta-analysis of the stability of peripheral immune markers in healthy adults. Brain Behav Immun.2023;107:32–46. doi: 10.1016/j.bbi.2022.09.011. PMID: 36152782.
- Landis SH, Suruki R, Hilton E, Compton C, Galwey NW. Stability of blood eosinophil count in patients with COPD in the UK clinical practice research datalink. COPD. 2017;14(4):382–388. doi: 10.1080/15412555.2017.1313827. PMID: 28569614.
- Long GH, Southworth T, Kolsum U, Donaldson GC, Wedzicha JA, Brightling CE, Singh D. The stability of blood Eosinophils in chronic obstructive pulmonary disease. Respir Res.2020;21:1–4. doi: 10.1186/s12931-020-1279-4. PMID: 31924207.
- Yun JH, Lamb A, Chase R, Singh D, Parker MM, Saferali A, Vestbo J, Tal-Singer R, Castaldi PJ, Silverman EK, Hersh CP. Blood eosinophil count thresholds and exacerbations in patients with chronic obstructive pulmonary disease. J Allergy Clin Immunol.2018;141(6):2037–2047. doi: 10.1016/j.jaci.2018.04.010. PMID: 29709670.
- Vedel-Krogh S, Nielsen SF, Lange P, Vestbo J, Nordestgaard BG. Blood eosinophils and exacerbations in chronic obstructive pulmonary disease. The Copenhagen General Population Study. Am J Respir Crit Care Med.2016 May 1;193(9):965–74. doi: 10.1164/rccm.201509-1869OC. PMID: 26641631.
- Prazma CM, Bel EH, Price RG, Bradford ES, Albers FC, Yancey SW. Oral corticosteroid dose changes and impact on peripheral blood eosinophil counts in patients with severe eosinophilic asthma: a post hoc analysis. Respir Res. 2019 May 3;20(1):83. doi: 10.1186/s12931-019-1056-4. PMID: 31053134; PMCID: PMC6499981.
- Mathioudakis AG, Bikov A, Foden P, Lahousse L, Brusselle G, Singh D, Vestbo J. Change in blood eosinophils following treatment with inhaled corticosteroids may predict long-term clinical response in COPD. Eur Respir J. 2020 May 27;55(5):1902119. doi: 10.1183/13993003.02119-2019. PMID: 32108044.
- Brightling CE, Monteiro W, Ward R, Parker D, Morgan MD, Wardlaw AJ, Pavord ID. Sputum eosinophilia and short-term response to prednisolone in chronic obstructive pulmonary disease: a randomised controlled trial. Lancet. 2000 Oct 28;356(9240):1480-5. doi: 10.1016/S0140-6736(00)02872-5. PMID: 11081531.
- Bafadhel M, McKenna S, Terry S, Mistry V, Pancholi M, Venge P, Lomas DA, Barer MR, Johnston SL, Pavord ID, Brightling CE. Blood eosinophils to direct corticosteroid treatment of exacerbations of chronic obstructive pulmonary disease: a randomized placebo-controlled trial. Am J Respir Crit Care Med.2012;186(1):48–55. doi: 0.1164/rccm.201108-1553OC. PMID: 22447964.
- Lea S, Higham A, Beech A, Singh D. How inhaled corticosteroids target inflammation in COPD. Eur Respir Rev.2023;32(170). doi: 10.1183/16000617.0084–2023. PMID: 37852657.
- Ohnishi H, Eitoku M, Yokoyama A. A systematic review and integrated analysis of biologics that target Type 2 inflammation to treat COPD with increased peripheral blood eosinophils. Heliyon. 2022;8(6). doi: 10.1016/j.heliyon.2022.e09736. PMID: 35756113.
- Quint JK, Ariel A, Barnes PJ. Rational use of inhaled corticosteroids for the treatment of COPD. NPJ Prim Care Respir Med. 2023;33(1):27. doi: 10.1038/s41533-023-00347-6. PMID: 37488104.
- Mkorombindo T, Dransfield MT. Inhaled corticosteroids in chronic obstructive pulmonary disease: benefits and risks. Clin Chest Med. 2020;41(3):475–484. doi: 10.1016/j.ccm.2020.05.006. PMID: 32800200.
- Ritchie AI, Wedzicha JA. Definition, causes, pathogenesis, and consequences of chronic obstructive pulmonary disease exacerbations. Clin Chest Med.2020;41(3):421–438. doi: 10.1016/j.ccm.2020.06.007. PMID: 32800196.
- Bafadhel M, Davies L, Calverley PM, Aaron SD, Brightling CE, Pavord ID. Blood eosinophil guided prednisolone therapy for exacerbations of COPD: a further analysis. Eur Respir. 2014;44(3):789–91. doi: 10.1183/09031936.00062614. PMID: 24925917.
- Benson VS, Hartl S, Barnes N, Galwey N, Van Dyke MK, Kwon N. Blood eosinophil counts in the general population and airways disease: a comprehensive review and meta-analysis. Eur Respir J. 2022;59(1). doi: 10.1183/09031936.00062614. PMID: 24925917.
- Bartziokas K, Gogali A, Kostikas K. The role of blood eosinophils in the management of COPD: an attempt to answer the important clinical questions. COPD. 2021;18(6):690–699. doi: 10.1080/15412555.2021.1985989. PMID: 34657541.
- Oliver B, Tonga K, Darley D, Rutting S, Zhang X, Chen H, Wang G. COPD treatment choices based on blood eosinophils: are we there yet?. Breathe (Sheff). 2019;15(4):318–323. doi: 10.1183/20734735.0254-2019. PMID: 31803266.
- Rabe KF, Rennard S, Martinez FJ, Celli BR, Singh D, Papi A, Bafadhel M, Heble J, Radwan A, Soler X, Jacob Nara JA. Targeting type 2 inflammation and epithelial alarmins in chronic obstructive pulmonary disease: a biologics outlook. Am J Respir Crit Care Me. 2023 Aug 15;208(4):395–405. doi: 10.1164/rccm.202303-0455CI. PMID: 37348121.
- Roufosse F, Weller PF. Practical approach to the patient with hypereosinophilia. Allergy Clin Immunol.2010 Jul 1;126(1):39–44. doi: 10.1016/j.jaci.2010.04.011. PMID: 20538328.
- Chipps BE, Jarjour N, Calhoun WJ, Iqbal A, Haselkorn T, Yang M, Brumm J, Corren J, Holweg CT, Bafadhel M. A comprehensive analysis of the stability of blood eosinophil levels. Ann Am Thorac Soc. 2021;18(12):1978–1987. doi: 10.1513/AnnalsATS.202010-1249OC. PMID: 33891831.
- Oishi K, Matsunaga K, Shirai T, Hirai K, Gon Y. Role of Type2 Inflammatory Biomarkers in Chronic Obstructive Pulmonary Disease. J Clin Med. 2020 Aug 18;9(8):2670. doi:10.3390/jcm9082670. PMID: 32824775; PMCID: PMC7464674.
- Haughney J, Lee AJ, Nath M, Müllerová H, Holmgren U, Nigris ED, Ding B. The long-term clinical impact of COPD exacerbations: a 3-year observational study (SHERLOCK). Ther Adv Respir Dis.2022;16:17534666211070139. doi: 10.1177/17534666211070139. PMID: 35156488.
MAT-ES-2501006- V1- Marzo 2025