- Artículo
- Fuente: Campus Sanofi
- 30 abr 2024
Una visión general del impacto de la inflamación de tipo 2 en la EPOC: ideas del Dr. Surya Bhatt

Me llamo Surya Bhatt. Soy profesora de Medicina en la Universidad de Alabama en Birmingham e investigadora de la EPOC.
Esta charla está patrocinada por Sanofi y Regeneron y no obtendrá ningún crédito (CME). En respuesta a cualquier tipo de insulto. Por ejemplo, el humo del cigarrillo, las infecciones víricas, las infecciones bacterianas, la contaminación, hay algún elemento de lesión epitelial y daño epitelial. Y la primera respuesta a esto suele ser que una vez que hay suficiente daño epitelial, se liberan patrones moleculares asociados al daño o (DAMPs) que ahora son quizás más popularmente llamados alarminas y estos son IL-33, IL-25 y TSLP o linfopoyetina del estroma tímico. Todos estos pueden ser liberados y tienen funciones específicas en términos de promover la inflamación. Y la IL-33 es quizás la mejor comprendida y algunas personas la consideran el interruptor maestro de la inflamación donde una vez que se activa, permanece activada durante mucho tiempo. Promueve tanto la inflamación de tipo 1 como la de tipo 3, así como la de tipo 2.
El pensamiento tradicional ha sido que el principal impulsor de la inflamación de tipo 2 es la IL-5, que causa la inflamación eosinofílica. Pero ahora entendemos que tanto la IL-4 como la IL-13 son importantes en la conducción de la inflamación de tipo 2. Y aquí está una lista de todas las cosas que pueden hacer. IL-4 e IL-13:
Ambas pueden causar la interrupción de la barrera epitelial.
Pueden causar el cambio de clase de células B y aumentar la producción de IgE.
Pueden provocar la degranulación de los mastocitos
Pueden causar degranulación de basófilos
Y también inflamación eosinofílica al igual que la IL-5.
También pueden provocar hiperplasia de células caliciformes y producción de moco, especialmente la IL-13.
Y como consecuencia de todo ello, pueden causar una remodelación significativa de las vías respiratorias, así como destrucción alveolar.
Los niveles de IL-4 e IL-13 también son elevados durante una exacerbación aguda, a diferencia de lo que ocurre en un estado estable o en pacientes sin EPOC. Así que también es importante señalar que estas vías se activan en pacientes con exacerbación aguda de la EPOC y se presentan y son importantes en la EPOC.
Y luego, ya sabes, todos sabemos que ha habido una gran comprensión de la mucina y la producción de moco en la EPOC. Y uno de los principales impulsores de eso es MUC5A y la IL-4 puede inducir una mayor expresión de MUC5AC en las células epiteliales humanas. Y también hay una respuesta casi dependiente de la dosis de IL-13 en MUC5A, así como un aumento de la producción de moco. Así pues, se ha descubierto que la IL-13 es un factor importante en la producción de moco en pacientes con EPOC.
Comprensión de la EPOC y las vías de inflamación
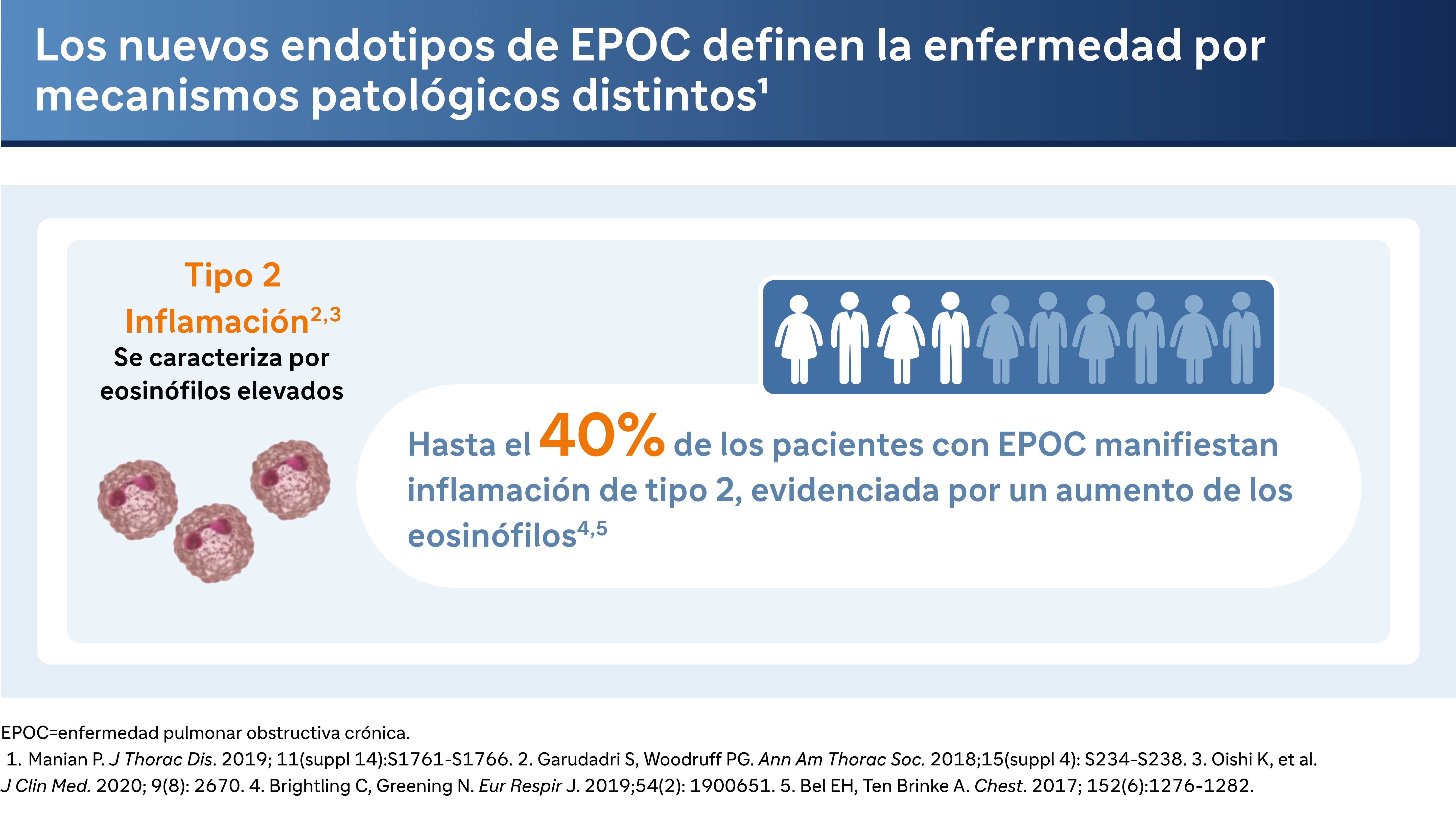
Históricamente, la EPOC se ha considerado desde el punto de vista de la inflamación neutrofílica, impulsada principalmente por las vías DH1 y DH17. Sin embargo, el Dr. Bhatt destaca un cambio en la comprensión, señalando que "cada vez se reconoce más que la inflamación de tipo 2 puede desempeñar realmente un papel en la EPOC". Esta inflamación no es tan fácil de detectar, con diversos grados de presencia en la población de pacientes. "Entre el 20 y el 40 por ciento de los pacientes parecen tener indicios de inflamación de tipo 2", explica el Dr. Bhatt.
Marcadores diagnósticos de la inflamación de tipo 2
Uno de los marcadores clave para detectar la inflamación de tipo 2 es el recuento de eosinófilos en sangre. El Dr. Bhatt señala el valor diagnóstico de este marcador: "Se correlaciona relativamente bien con la inflamación eosinofílica en los pulmones y es más probable que sea específico que sensible". Esto significa que un recuento elevado de eosinófilos puede ser un indicador fiable de actividad inflamatoria de tipo 2 en los pulmones. Sin embargo, también advierte de que la fluctuación de los niveles de eosinófilos puede complicar el diagnóstico, afirmando que "si no lo encuentras, eso no significa que no tengan inflamación de tipo 2."

Implicaciones clínicas de la inflamación de tipo 2 en la EPOC
El Dr. Bhatt se refiere a los datos de estudios significativos como COPD Gene y Eclipse, que muestran una clara correlación entre el recuento de eosinófilos y la frecuencia de exacerbaciones en pacientes con EPOC. "Hay un aumento casi monotónico de la frecuencia de las exacerbaciones con el aumento del recuento de eosinófilos", señala, subrayando la relevancia clínica de estos hallazgos. En particular, en torno a 300 células por microlitro se produce un aumento significativo de la frecuencia de las exacerbaciones, que sigue aumentando con recuentos más elevados.
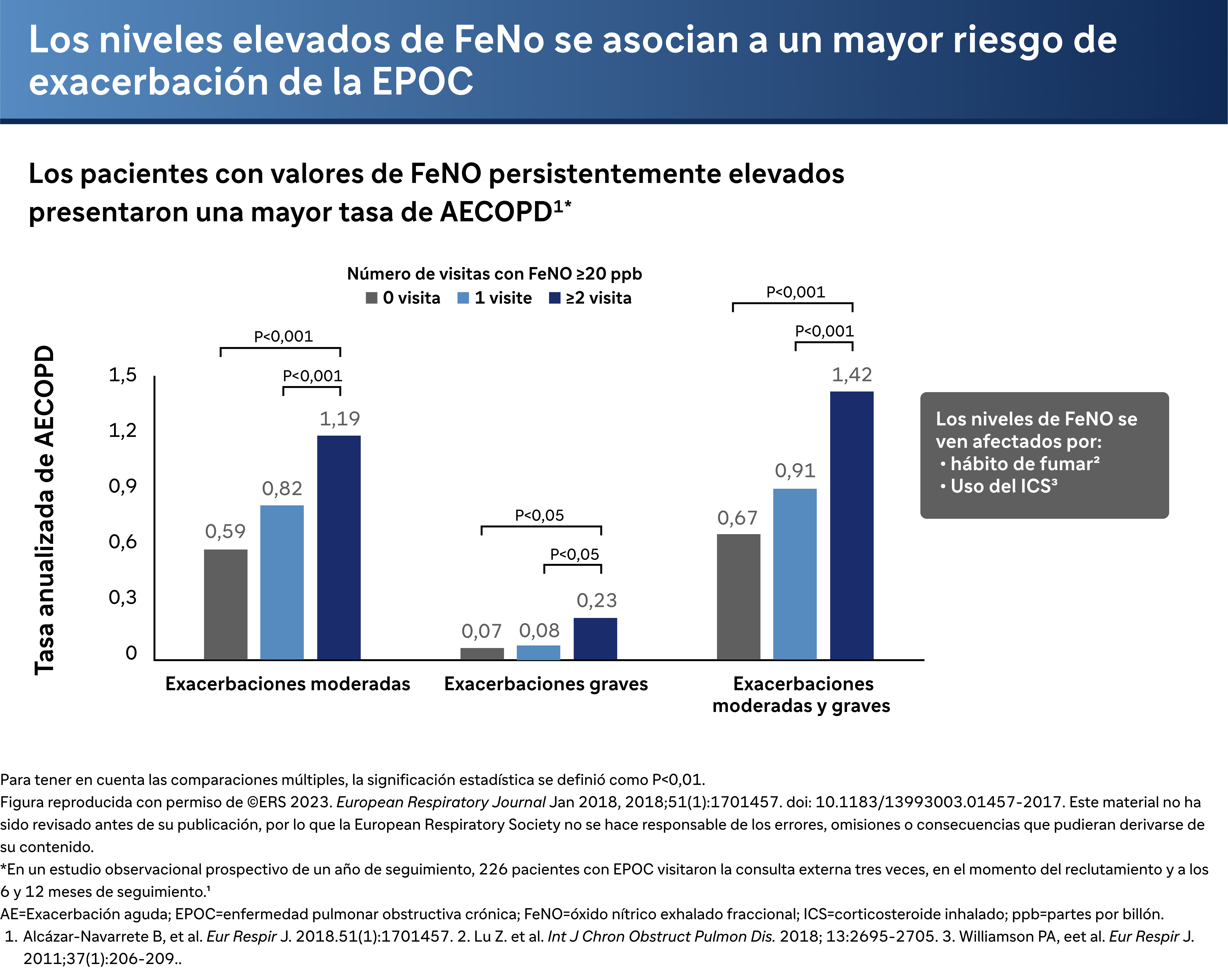
Además, otras herramientas diagnósticas como la fracción exhalada de óxido nítrico (FeNO) pueden ofrecer información sobre la inflamación de tipo 2. El Dr. Bhatt comenta un estudio en el que participaron 220 pacientes y en el que se observó que los distintos niveles de FeNO se asociaban a diferentes frecuencias de exacerbación. Aquellos con niveles de FeNO persistentemente elevados mostraron un aumento continuo de las exacerbaciones, lo que sugiere una inflamación de tipo 2 en curso.
Valor pronóstico de la inflamación de tipo 2
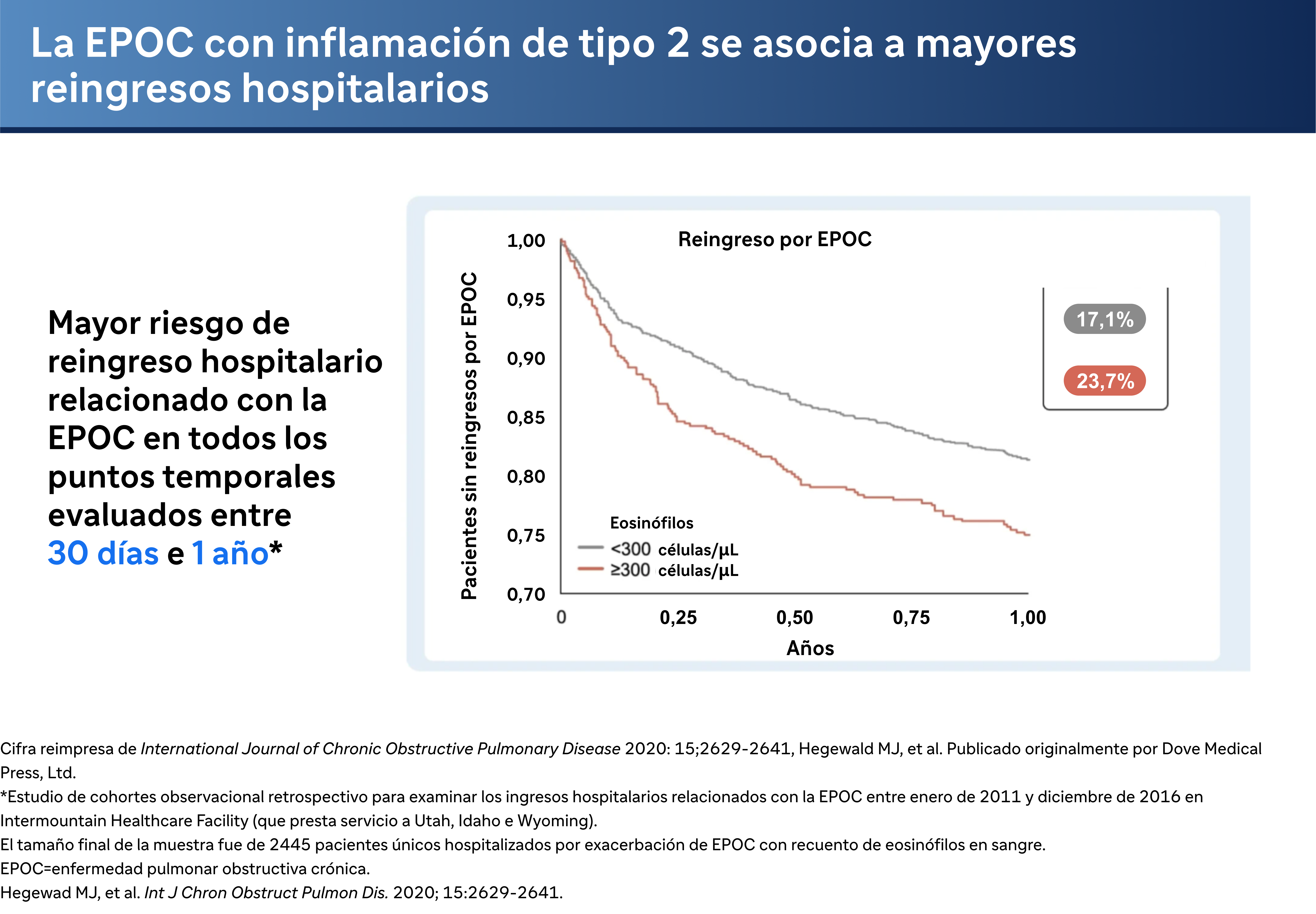
La inflamación de tipo 2 no sólo se correlaciona con la frecuencia de las exacerbaciones, sino que también tiene implicaciones para los reingresos hospitalarios. El Dr. Bhatt cita un estudio retrospectivo de casi 2.500 pacientes de una base de datos administrativa, que reveló que "unos niveles elevados de eosinófilos, definidos como superiores a 300 células por microlitro, se asociaban a un mayor reingreso relacionado con la EPOC a los 30 días, así como a las 52 semanas". Este hallazgo subraya la importancia de vigilar los niveles de eosinófilos para predecir las exacerbaciones moderadas y graves, y potencialmente adaptar las estrategias de tratamiento para reducir los reingresos hospitalarios.
En resumen
Los conocimientos del Dr. Surya Bhatt sobre la inflamación de tipo 2 en la EPOC ponen de relieve un cambio significativo en la comprensión y el tratamiento de esta compleja enfermedad. Reconocer el papel de la inflamación de tipo 2 podría conducir a enfoques de tratamiento más personalizados, mejorando potencialmente los resultados para un subconjunto sustancial de pacientes con EPOC. A medida que la investigación sigue evolucionando, los neumólogos y otros profesionales sanitarios deben mantenerse informados sobre estos avances para optimizar la atención a sus pacientes con EPOC.
Al resumir la repercusión de estos hallazgos, el Dr. Bhatt subraya la necesidad de seguir investigando y concienciando: "Creo que tenemos que seguir buscando", afirma, apuntando a un futuro en el que el tratamiento de la EPOC podría ser más específico y eficaz en función de los perfiles inflamatorios individuales. Este enfoque podría revolucionar el tratamiento de la EPOC, haciendo que no se trate sólo de controlar los síntomas, sino de alterar potencialmente el curso de la enfermedad en muchos pacientes.
Referencias
- Gandhi NA, Bennett BL, Graham NMH, et al. Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov. 2016;15(1):35-50.
- Yousuf A, Ibrahim W, Greening NJ, et al. T2 Biologics for Chronic Obstructive Pulmonary Disease. J Allergy Clin Immunol Pract. 2019;7(5):1405-1416.
- Aghapour M, Raee P, Moghaddam SJ, et al. Airway Epithelial Barrier Dysfunction in Chronic Obstructive Pulmonary Disease: Role of Cigarette Smoke Exposure. Am J Respir Cell Mol Biol. 2018;58(2):157-169.
- Barnes JP. Inflammatory endotypes in COPD. Allergy. 2019;74(7):1249-1256.
- Wang Z, Bafadhel M, Haldar K, et al. Lung microbiome dynamics in COPD exacerbations. Eur Respir J. 2016;47(4):1082-1092.
- Smithgall MD, Comeau MR, Yoon BRP, et al. IL-33 amplifies both Th1- and Th2-type responses through its activity on human basophils, allergen-reactive Th2 cells, iNKT and NK cells. Int Immunol. 2008;20(8):1019-1030.
- Senra L, Mylonas A, Kavanagh RD, et al. IL-17E (IL-25) enhances innate immune responses during skin inflammation. J Invest Dermatol. 2019;139(8):1732-1742.
- Linden D, Guo-Parke H, Coyle PV, et al. Respiratory viral infection: a potential “missing link” in the pathogenesis of COPD. Eur Respir Rev. 2019; 28(151):180063.
- Global Initiative for Chronic Obstructive Lung Disease (GOLD). Accessed April 15, 2025, 2025. https://goldcopd.org/2025-gold-report/.
- Calderon AA, Dimond C, Choy DF, et al. Targeting interleukin-33 and thymic stromal lymphopoietin pathways for novel pulmonary therapeutics in asthma and COPD. Eur Respir Rev. 2023;32(167):220144.
- Kurokawa M, Matsukura S, Kawaguchi M, et al. Interleukin-33-activated dendritic cells induce the production of thymus and activation-regulated chemokine and macrophage-derived chemokine. Int Arch Allergy Immunol. 2013;161(Suppl 2):52-57.
- Griesenauer B, Paczesny S. The ST2/IL-33 axis in immune cells during inflammatory diseases. Front Immunol. 2017;8:475.
- Borowczyk J, Shutova M, Brembilla NC, et al. IL-25 (IL-17E) in epithelial immunology and pathophysiology. J Allergy Clin Immunol. 2021;148(1):40-52.
- Claudio E, Wang H, Kamenyeva O, et al. IL-25 orchestrates activation of Th cells via conventional dendritic cells in tissue to exacerbate chronic house dust mite–induced asthma pathology. J Immunol. 2019;203(8)2319-2327.
- Kotlyarov S. Involvement of the innate immune system in the pathogenesis of chronic obstructive pulmonary disease. Int J Mol Sci. 2022;23(2):985.
- Gandhi NA, Pirozzi G, Graham NMH. Commonality of the IL-4/IL-13 pathway in atopic diseases. Expert Rev Clin Immunol. 2017;13(5):425-437.
- Saatian B, Rezaee F, Desando S, et al. Interleukin-4 and interleukin-13 cause barrier dysfunction in human airway epithelial cells. Tissue Barriers. 2013;1(2):e24333.
- Zheng T, Zhu Z, Wang Z, et al. Inducible targeting of IL-13 to the adult lung causes matrix metalloproteinase- and cathepsin-dependent emphysema. J Clin Invest. 2000;106(9):1081-1093.
- Zhu Z, Homer RJ, Wang Z, et al. Pulmonary expression of interleukin-13 causes inflammation, mucus hypersecretion, subepithelial fibrosis, physiologic abnormalities, and eotaxin production. J Clin Invest. 1999;103(6):779-788.
- Alevy YG, Patel AC, Romero AG, et al. IL-13-induced airway mucus production is attenuated by MAPK13 inhibition. J Clin Invest. 2012;122(12):4555-4568.
- Wang X, Xu C, Ji J, et al. IL-4/IL-13 upregulates Sonic hedgehog expression to induce allergic airway epithelial remodeling. Am J Physiol Lung Cell Mol Physiol. 2020;318(5):L888-L899.
- Cooper PR, Poll CT, Barnes PJ, et al. Involvement of IL-13 in tobacco smoke-induced changes in the structure and function of rat intrapulmonary airways. Am J Respir Cell Mol Biol. 2010;43(2):220-226.
- Doyle AD, Mukherjee M, LeSuer WE, et al. Eosinophil-derived IL-13 promotes emphysema. Eur Respir J. 2019;53(5):1801291.
- Sun J, Liu T, Yan Y, et al. The role of Th1/Th2 cytokines played in regulation of specific CD4+ Th1 cell conversion and activation during inflammatory reaction of chronic obstructive pulmonary disease. Scand J Immunol. 2018;88(1):e12674.
- Kim CH, Kim KE, Yoon JH, et al. Upregulation of MUC5AC gene expression by IL-4 through CREB in Human airway epithelial cells. J Cell Biochem. 2009;108(4):974-981.
- Yu H, Li Q, Kolosov VP, et al. Interleukin-13 induces mucin 5AC production involving STAT6/SPDEF in human airway epithelial cells. Cell Commun Adhes. 2010;17(4-6):83-92.
MAT-ES-2501002- V1- Marzo 2025