- Artículo
- Fuente: Campus Sanofi
- 27 oct 2023
Klotho y enfermedad vascular en la enfermedad renal crónica

La enfermedad renal crónica (ERC), una patología reconocida como un modelo clínico de envejecimiento prematuro1, se asocia a un elevadísimo incremento del riesgo de morbimortalidad de origen cardiovascular, donde el sustrato subyacente, en un importante número de estos eventos, es la enfermedad vascular aterosclerótica, un proceso grabe de aparición precoz y curso acelerado en el paciente renal2.
Durante décadas, la aterosclerosis fue considerada como una enfermedad producida de forma pasiva por el depósito y almacenamiento de lípidos en la pared arterial. Sin embargo, hoy sabemos que se trata de un proceso dinámico y complejo, en el que la inflamación juega un papel fundamental en todo el proceso evolutivo de la placa aterosclerótica3.
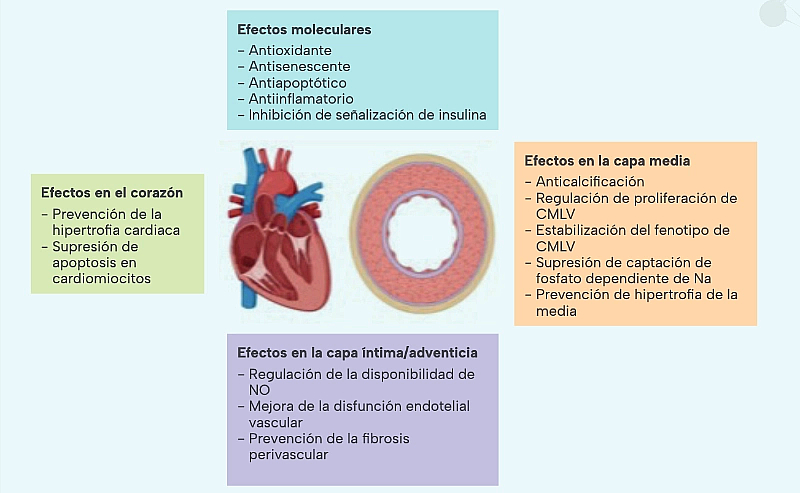
Klotho (KL) es una proteína con propiedades antienvejecimiento descubierta en 1997 por un defecto en la expresión de su gen en ratones, que conducía al desarrollo de un fenotipo con amplios efectos sistémicos, que se asemeja al envejecimiento humano: acortamiento del periodo de vida, infertilidad, retraso en el crecimiento, osteoporosis, enfisema, daño cognitivo y, también, calcificación vascular y aterosclerosis4.
En humanos, el gen KL se localiza en el cromosoma 13q12 y codifica para una glicoproteína transmembrana que se constituye por una secuencia señal N-terminal, dos regiones internas homólogas (KL1 y KL2) en el dominio extracelular, un dominio transmembrana, y un corto dominio intracelular C-terminal. A partir de esta forma, se genera un factor soluble mediante la proteólisis del dominio extracelular completo que es liberado a la circulación, aunque también puede darse el corte entre las regiones KL1 y KL2, generándose dos proteínas solubles más pequeñas5 (Figura 1).
El papel fisiológico de KL mejor caracterizado es su participación en el metabolismo mineral. La forma transmembrana de KL se expresa principalmente en los túbulos renales, actuando como correceptor del factor de crecimiento fibroblástico 23. Esta hormona actúa en los riñones, uniéndose a un complejo de alta afinidad compuesto por KL y por receptores cognados para los factores de crecimiento fibroblástico, lo que genera una señal intracelular que resulta en la inhibición de la expresión de los cotransportadores de fósforo PiT1 y PiT2, reduciéndose la reabsorción de fósforo y estimulando la fosfaturia6. Sin embargo, es de especial interés el papel de la forma soluble de KL, que se relaciona con nuevas funciones para esta proteína, incluyendo su papel protector sobre la pared vascular7,8.
Klotho ha cobrado especial protagonismo en el ámbito de la nefrología, donde se ha demostrado que el descenso en sus niveles se asocia con un declive en la función renal, observándose una reducción en su concentración sérica y su expresión en el riñón conforme avanza la enfermedad renal9. Es de señalar en este contexto el papel de la inflamación, un fenómeno que caracteriza de forma universal a la ERC, como factor responsable de la inhibición de la expresión de KL10.
Finalmente, es de gran interés destacar la demostración de la presencia del ácido ribonucleico mensajero de KL10 y de su proteína11,12 en muestras clínicas de pared vascular, y la constatación de que, durante la ERC, ocurre una disminución en los niveles de expresión vascular de KL11,13.
Desde una perspectiva clínica, un reciente estudio ha constatado que, en pacientes con deterioro de función renal, los niveles séricos de KL, así como su expresión génica en células mononucleares circulantes, elementos celulares con un papel crítico en la fisiopatología del proceso aterogénico, se relacionan con marcadores de aterosclerosis subclínica (índice tobillo-brazo y grosor íntima-media carotídeo) independientemente de factores de riesgo cardiovascular clásicos o emergentes. De esta forma, Klotho podría ser un nuevo biomarcador de enfermedad cardiovascular subclínica de naturaleza aterosclerótica en la ERC14.
Figura 1. Cambio porcentual en los niveles de parámetros séricos después de tres meses de tratamiento con sevelámero.
Autor

Dr. Juan F. Navarro González
Unidad de Investigación y Servicio de Nefrología. Hospital Universitario Nuestra Señora de Candelaria. Santa Cruz de Tenerife

Referencias
- Stenvinkel P, Larsson TE. Chronic kidney disease: A clinical model of premature aging. Am J Kidney Dis. 2013;62(2):339-51.
- Valdivielso JM, Rodríguez-Puypl D, Pascual J, Barrios C, Bermúdez-López M, Sánchez-Niño MD, et al. Atherosclerosis in chronic kidney disease. More, less or just different? Arterioscler Thromb Vasc Biol. 2019;39:1938-66.
- Libby P. Inflammation during the life cycle of the atherosclerotic plaque. Cardiovasc Res. 2021;117(13):2525-36.
- Kuro-o M, Matsumura Y, Aizawa H, Kawaguchi H, Suga T, Utsugi T, et al. Mutation of the mouse klotho gene leads to a syndrome resembling ageing. Nature. 1997;390(6655):45-51.
- Matsumura Y, Aizawa H, Shiraki-Iida T, Nagai R, Kuro-o M, Nabeshima Y. Identification of the human klotho gene and its two transcripts encoding membrane and secreted klotho protein. Biochem Biophys Res Commun. 1998;242(3):626-30.
- Kurosu H, Ogawa Y, Miyoshi M, Yamamoto M, Nandi A, Rosenblatt KP, et al. Regulation of fibroblast growth factor-23 signaling by klotho. J Biol Chem. 2006:281(10):6120-3.
- Kusaba T, Okigaki M, Matui A, Murakami M, Ishikawa K, Kimura T, et al. Klotho is associated with VEGF receptor-2 and the transient receptorpotential canonical-1 Ca2+ channel to maintain endothelial integrity. Proc Natl Acad Sci U S A. 2010;107(45):19308-13.
- Lindberg K, Amin R, Moe OW, Hu MC, Erben RG, Ostman Wernerson A, et al. The kidney is the principal organ mediating klotho effects. J Am Soc Nephrol. 2014;25(10):2169-75.
- Wang Q, Su W, Shen Z, Wang R. Correlation between Soluble alpha-Klotho and Renal Function in Patients with Chronic Kidney Disease: A Review and Meta-Analysis. Biomed Res Int. 2018;2018:9481475.
- Ruiz-Andrés O, Sánchez-Niño MD, Moreno JA, Ruiz-Ortega M, Ramos AM, Sanz AB, et al. Downregulation of kidney protective factors by inflammation: role of transcription factors and epigenetic mechanisms. Am J Physiol Renal Physiol. 2016;311(16):F1329-40.
- Donate Correa J, Mora Fernández C, Martínez-Sanz R, Muros de Fuentes M, Pérez H, Meneses Pérez B, et al. Expression of FGF23/KLOTHO system in human vascular tissue. Int J Cardiol. 2013;165(1):179-83.
- Lim K, Lu TS, Molostvov G, Lee C, Lam FT, Zehnder D, et al. Vascular Klotho deficiency potentiates the development of human artery calcification and mediates resistance to fibroblast growth factor 23. Circulation. 2012;125(18):2243-55.
- Donate-Correa J, Martín-Núñez E, Ferri C, Hernández-Carballo C, Tagua VG, Delgado-Molinos A, et al. FGF23 and Klotho Levels are Independently Associated with Diabetic Foot Syndrome in Type 2 Diabetes Mellitus. J Clin Med. 2019;8(4):448.
- Fang Y, Ginsberg C, Seifert M, Agapova O, Sugatani T, Register TC, et al. CKD-induced wingless/integration1 inhibitors and phosphorus cause the CKD-mineral and bone disorder. J Am Soc Nephrol. 2014;25(8):1760-73.
- Donate-Correa J, Ferri CM, Martín-Núñez E, Pérez-Delgado N, González-Luis A, Mora-Fernández C, et al. Klotho as a biomarker of subclinical atherosclerosis in patients with moderate to severe chronic kidney disease. Sci Rep. 2021;11(1):15877.
MAT-ES-2301867-V.1-Octubre 2023